2. 农业农村部大洋渔业开发重点实验室, 上海 201306;
3. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
4. 国家远洋渔业工程技术研究中心, 上海 201306;
5. 青岛国家海洋科学技术实验室 海洋渔业科学与食物产出过程功能实验室, 山东 青岛 266237
柔鱼(Ommastrephes bartramii)广泛分布于全球热带与亚热带海域,资源量丰富[1-2]。柔鱼的生长速度快,基本为1年生,因此其生长和资源量极易受到海洋环境的影响。已有大量的研究[3]表明,海洋环境的大幅度变化会对柔鱼的资源量和生长等造成很大的影响,相关学者[4-5]已经就海洋环境变化(包括极端气候变化)与柔鱼资源量的关系进行了研究,认为海表面温度和叶绿素a浓度的变化是导致柔鱼资源量变化的主要原因。角质颚是头足类的重要摄食器官,是一种具有稳定形态和丰富生态信息的硬组织[6],已经广泛应用于年龄鉴定、种群划分和资源丰度等研究[7-9]。角质颚的生长特征也是各国研究者关注的焦点之一,了解角质颚的生长特征既能体现其食物丰度,也能推断出某一时期资源量的大体状况,已有学者对剑尖枪乌贼(Uroteuthis edulis)[10]、太平洋褶柔鱼(Todarodes pacificus)[11]和火枪乌贼(Loliolus beka)[12]等角质颚的形态和生长特征进行了研究,并对寒海乌贼(Psychroteuthis glacialis)的资源量进行了评估[13]。目前对柔鱼角质颚的研究主要集中于种群划分等方面[14-16],针对角质颚年度生长特性变化及其影响因子等研究仍未见报道。因此本研究根据我国鱿钓船2010、2015和2016年7—11月在西北太平洋海域生产期间采集的柔鱼样本,测定其角质颚的形态值,分析不同年份间角质颚的月生长率情况,并讨论环境因子可能对角质颚生长造成的影响,为柔鱼年度生长状况和资源情况的分析提供参考依据。
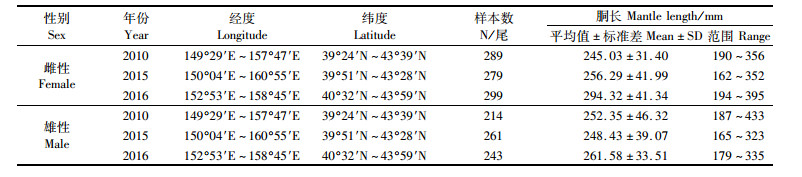
1 材料与方法 1.1 采集时间和范围选取2010、2015和2016年的柔鱼样本(表 1)来进行分析,分别代表不同环境条件下的年份(2010年为拉尼娜年,2015年为厄尔尼诺年,2016年为正常年份)。样本主要采集于西北太平洋海域,采集时间均集中于7—11月。为保证每月样本的代表性,研究月份中每月随机采集样本不少于40尾,最终共采集样本1 585尾(雌性867尾,雄性718尾,表 1)。采集的柔鱼样本直接在鱿钓船上冷冻,后续随运输船运回实验室进行后续分析。
|
表 1 不同年份北太平洋柔鱼样本基本信息 Tab.1 Basic information of Ommastrephes bartramii samples in different years |
柔鱼样品解冻后进行基础生物学测定,包括胴长(mantel length,ML)、性别、性腺成熟度等。用卷尺测量胴长,精确至1 mm。性成熟度的划分根据LIPINSKI等[17]的方法,根据性腺的特征变化划分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ五期,其中Ⅰ和Ⅱ为未成熟,Ⅲ期以上为成熟个体。用镊子从柔鱼口球中取出角质颚,并存放于盛有75%乙醇溶液的20 mL离心管中。以上所有样本均为采集完整的角质颚样本。
1.3 角质颚外形测量利用游标卡尺对柔鱼角质颚进行形态测量,首先对游标卡尺进行校准, 然后测量上头盖长(upper hood length,UHL)、上脊突长(upper crest length,UCL)、上喙长(upper rostrum length,URL)、上喙宽(upper rostrum width, URW)、上侧壁长(upper lateral wall length,ULWL)、上翼长(upper wing length,UWL)、下头盖长(lower hood length,LHL)、下脊突长(lower crest length,LCL)、下喙长(lower rostrum length,LRL)、下喙宽(lower rostrum width, LRW)、下侧壁长(lower lateral wall length,LLWL)、下翼长(lower wing length,LWL)12项形态参数(图 1)[18], 测量结果精确至0.01 mm。

|
图 1 柔鱼角质颚外部形态测量示意图 Fig. 1 Scheme of morphometric measurements of Ommastrephes bartramii beak |
柔鱼角质颚的生长在很大程度上受到温度和摄食的影响[19]。因此对西北太平洋柔鱼的主要索饵场(150°E~160°E,40°N~45°N)7—11月的海表面温度(sea surface temperature,SST)和叶绿素a浓度(chlorophyll-a,Chl.a)进行了统计。以上环境数据均来自美国国家航空航天局(national aeronautics and space administration,NASA)地球观测站(earth observation)卫星数据(https://neo.sci.gsfc.nasa.gov/)。
1.5 数据处理方法(1) 采用频度分析法分雌雄分析渔获物胴长组成,并对不同年间角质颚形态参数进行统计。
(2) 不同性别和不同年间角质颚差异。为了消除个体差异对角质颚形态的影响,首先对角质颚形态进行标准化,具体参考文献[20]。然后对标准化后的角质颚数据进行正态性检验,不满足正态分布的则进行平方根转化的标准化处理[21],最后利用方差分析(ANOVA)对不同年份角质颚形态参数进行差异性分析。
(3) 根据上述差异分析,利用不同的生长模型(线性、幂函数、指数函数、对数函数)拟合角质颚形态参数与胴长之间的关系。利用赤池信息量准则(akaike information criterion,AIC)[22],选取值最小的为最适生长模型,计算公式为
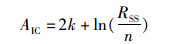 (1)
(1)
式中:k为方程中参数常数的数量;n为样本量;RSS为剩余平方和。
利用协方差分析(analysis of covariance, ANCOVA),以各角质颚形态参数为协变量,分析不同环境条件下角质颚生长的差异。
(4) 为了研究各月间角质颚的生长率情况,采用长度变化较为明显的上头盖长(UHL)、上脊突长(UCL)、上侧壁长(ULWL)和下头盖长(LHL)、下脊突长(LCL)、下侧壁长(LLWL)分别表征上颚和下颚形态的变化规律。采用瞬时相对生长率(instantaneous relative growth rate,G)和绝对生长率(absolute growth rate,AGR)来分析角质颚形态变化,其计算公式[23]分别为
 (2)
(2)
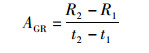 (3)
(3)
式中:R2为t2月角质颚形态参数;R1为t1月的角质颚形态参数;AGR为绝对生长率,mm/m。
(5) 为了找出环境因素对柔鱼角质颚形态和生长的影响,将分析不同年份各月索饵场(150°E~160°E,40°N~45°N)的SST和Chl.a值进行频率分布统计,对各月间的变化规律进行分析,并与角质颚生长进行关联讨论。
所有统计分析采用MS excel和SPSS statistics 17.0软件进行。
2 结果 2.1 胴长组成统计表明:2010年雌性个体胴长范围为190~356 mm,优势胴长组为220~280 mm,占总数的78.54%;雄性范围为187~433 mm,优势胴长组为220~280 mm,占总数的71.49%。2015年雌性个体胴长范围为162~352 mm,优势胴长组为240~320 mm,占总数的75.98%;雄性范围为165~323 mm,优势胴长组为220~300 mm,占总数的78.93%。2016年雌性个体胴长范围为194~395 mm,优势胴长组为260~340 mm,占总数的72.91%;雄性范围为179~335 mm,优势胴长组为240~300 mm,占总数的74.90%。以上3年个体的胴长(ANOVA,♀:F=132.30,P < 0.01;♂:F=7.19,P < 0.01)存在显著差异。见图 2。

|
图 2 不同年份柔鱼胴长组成分布图 Fig. 2 Distribution of mantle length of Ommastrephes bartramii in different years |
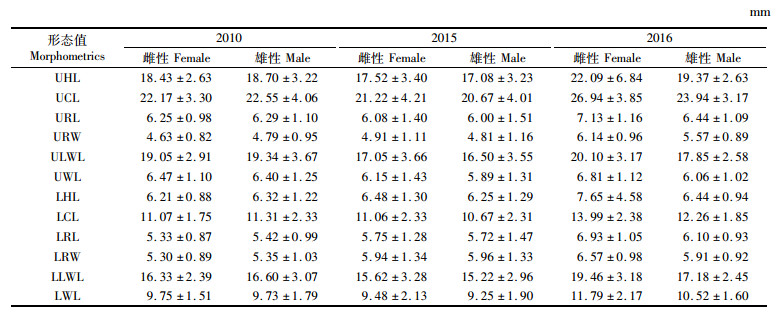
由表 2可知,不同年份间、不同性别角质颚形态各有其特征。其中2010年样本雌性个体的角质颚形态的各项参数略小于雄性个体,2015年样本雌性个体角质颚形态参数略大于雄性个体,而2016年样本雌性个体角质颚参数明显大于雄性个体。
|
表 2 不同年份柔鱼角质颚形态均值和标准差 Tab.2 Mean value and standard deviation of beak morphometrics of Ommastrephes bartramii in different years |
将不同角质颚参数进行标准化后(各值均以下标“s”表示)进行方差分析,结果认为雌性个体在不同年间角质颚形态均存在显著差异(P < 0.01),雄性个体在不同年间除了下头盖长(LHLS)外,其他角质颚参数也均存在显著差异(P < 0.01)。利用多重比较(Tukey-HSD)分析发现,雌性个体仅在2010和2015年个体的上喙长(URLS)、下脊突长(LCLS)和下翼长(LWLS)不存在差异(P>0.05), 雄性个体在2010和2015年的上喙宽(URWS)、下喙长(LHLS)和下翼长(LWLS)、2010和2016年的上喙长(URLS)、下喙长(LHLS)和下侧壁长(LLWLS)、2015和2016年的上翼长(UWLS)、下喙长(LHLS)和下喙宽(LRWS)不存在差异(P>0.05)。见表 3。

|
表 3 不同年份不同性别柔鱼角质颚形态值方差分析 Tab.3 Beak morphometrics variation of Ommastrephes bartramii in different sexes and years |
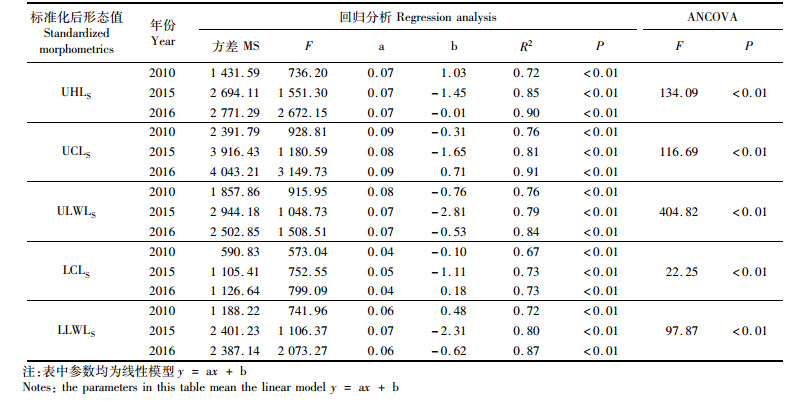
结合上述差异分析,综合长度变化明显的角质颚参数,选取标准化后的上头盖长(UHLS)、上脊突长(UCLS)、上侧壁长(ULWLS)、下脊突长(LCLS)和下侧壁长(LLWLS)分别与胴长建立关系。根据AIC准则,上述雄性角质颚形态值与胴长的关系符合线性模型,各项参数与胴长的关系均有较高的相关性,具体回归分析情况见表 4。从协方差分析(ANCOVA)结果中可以发现,上述5项标准化雄性角质颚参数与胴长的关系,在不同的年间均存在显著差异(P < 0.01)。2010年的b值相对较高,2015年则为最低。

|
表 4 不同年份雄性柔鱼角质颚与胴长回归分析和协方差分析 Tab.4 Regression analysis and ANCOVA of beak morphometrics and mantle length for male Ommastrephes bartramii in different years |
根据AIC准则,上述雌性角质颚形态值与胴长的关系符合线性模型,具体回归分析情况见表 5,各项参数与胴长的关系均有较高的相关性。从协方差分析(ANCOVA)结果中可以发现,上述5项标准化雌性角质颚参数与胴长的关系在不同的年间均存在显著差异(P < 0.01)。与雌性相似,2010年的b值最大,2015年最小。
|
表 5 不同年份雌性柔鱼角质颚与胴长回归分析和协方差分析 Tab.5 Regression analysis and ANCOVA of beak morphometrics and mantle length for female Ommastrephes bartramii in different years |
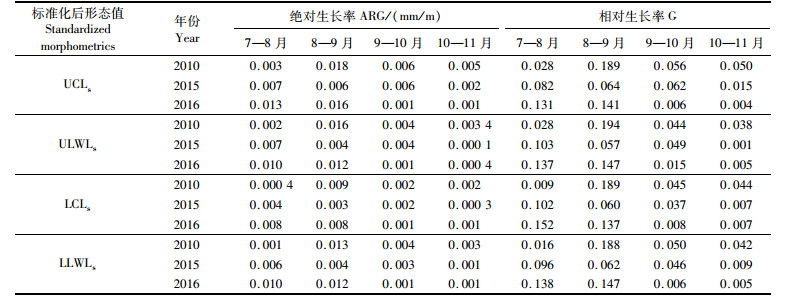
将不同性别区分开,按月分析角质颚的生长模式。从表 6可看出:在同一年份中,2010年个体在8—9月的角质颚绝对生长率最高,其他月份间绝对生长率相对较低,这一点在相对生长率中有着更为明显的体现; 2015年的个体中,7—8月和9—10月表现除了相似的绝对生长率,而8—9月的生长率则最低;2016年,角质颚绝对生长率最高时期发生在7—8月,随后的月份绝对生长率大幅下降。在同一月份中,2016年个体在7—8月的绝对生长率最高,2010年个体在8—9月绝对生长率最高,2015年个体则在9—10月的绝对生长率表现出最高, 2016年10—11月的绝对生长率均较低。相对生长率也表现出类似的情况。

|
表 6 不同年份雄性柔鱼月间角质颚生长率变化 Tab.6 Monthly beak growth rate of male Ommastrephes bartramii in different years |
由表 7可以看出,雌性个体与雄性个体相似:2010年个体在8—9月的角质颚绝对生长率最高,其他月份间绝对生长率相对较低,这一点在相对生长率中有着更为明显的体现; 2015年的个体中,7—8月的绝对生长率最高,随后月份生长率则较低,且保持稳定;2016年,角质颚绝对生长率最高时期发生在8—9月,其他的月份绝对生长率稍低。在同一月份中,与雄性相似,2016年雌性个体的绝对生长率在7—8月份为各年最高,2010年雌性个体在8—9月绝对生长率最高,2015年雌性个体的绝对生长率在9—10月为最高。相对生长率也表现出类似的情况(表 7)。
|
表 7 不同年份雌性柔鱼月间角质颚生长率变化 Tab.7 Monthly beak growth rate of female Ommastrephes bartramii in different years |
由于鱿钓船主要捕捞海域分布于柔鱼索饵场(150°E~160°E,40°N ~45°N)范围内,因此本研究对该范围内的主要捕捞月份(7—11月)的海表温(SST)和叶绿素a浓度进行统计分析。由图 3可看出,在同一年份中,7月的SST较低,8—9月份开始逐渐升温,到10月份下降明显,11月份基本上SST均在18 ℃以下。在同一月份中,不同年份间差异最大的为8月和9月。其中2010、2016年8月SST主要分布于20~23 ℃,而2015年8月SST主要分布于16~19 ℃,2010、2016年9月SST主要分布于18~22 ℃,而2015年9月SST主要分布于15~18 ℃。另外,2010、2015年7月SST主要分布于18~20 ℃,而2016年7月SST主要分布于16~18 ℃。

|
图 3 不同年份柔鱼索饵场海表面温度(SST)月分布图 Fig. 3 Distribution of monthly sea surface temperature (SST) of Ommastrephes bartramii feeding ground in different years |
根据柔鱼索饵场叶绿素a浓度的变化可看出,在同一年份中,Chl.a主要分布于0.2~1.2 mg/m3之间,其中7—9月主要集中在0.2~0.6 mg/m3之间,10—11月主要集中在0.5~1.2 mg/m3之间。2010年所有月份在0.2~1.6 mg/m3均有分布,而2015、2016年7—9月的Chl.a的主要分布均在0.7 mg/m3。同一月份来看,2010年7—9月Chl.a主要集中于0.2~0.5 mg/m3,2015、2016年7—9月Chl.a主要集中于0.4~0.6 mg/m3(图 4)。历年分布均存在一定的差异。
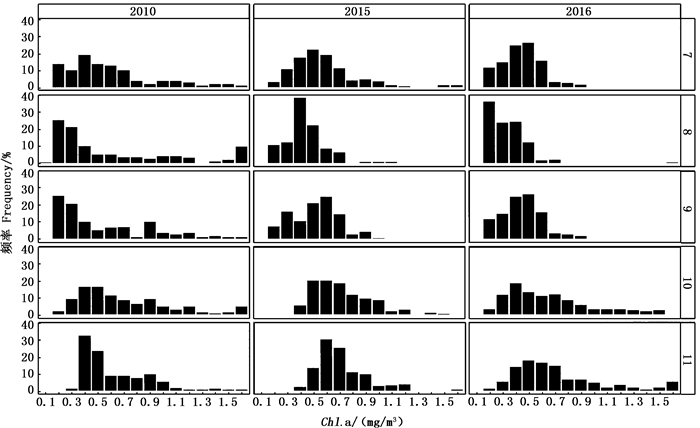
|
图 4 不同年份柔鱼索饵场叶绿素a浓度(Chl.a)月分布图 Fig. 4 Distribution of monthly Chlorophyll-a (Chl.a) of Ommastrephes bartramii feeding ground in different years |
不同年份的柔鱼胴长和体质量均存在显著差异。从胴长体质量分布来看,2010年的个体最小(220~280 mm),2015年次之(240~320 mm),2016年个体最大(260~340 mm)。根据以往研究资料,在西部传统渔场(即本研究所选取的海域)优势胴长组最大为1999年的190~360 mm[24],其余2007年个体优势胴长为230~320 mm[25],2010年为200~260 mm[26],历年均存在一定的差异。杨铭霞等[27]分析高产年份和低产年份个体大小及生长率差异发现,高产年份的优势胴长组明显大于低产年份,同时优势体质量组方面也有类似的情况。造成这种差异的主要原因在于受黑潮弯曲的影响,渔场的水温偏低,这也直接对柔鱼个体的生长率造成影响[28]。总体而言,年间个体差异主要是由海洋环境的剧烈变化(主要是海表面温度)所造成的,这在其他的种类也有所发现[29]。
3.2 不同性别角质颚形态及生长差异角质颚是主要的摄食器官,其生长与头足类个体生长保持一致,因此分析角质颚形态差异可以研究个体的摄食和生长情况,不同性别间角质颚形态存在显著差异(表 3和表 4)。大洋性柔鱼类在其生长阶段,食性往往会根据生长发育的需求而改变,此时角质颚的形态也会产生较大的变化[30]。同时角质颚的这种形态变化在不同性别中也存在一定的差异[31-32]。ROCHA等[33]介绍了不同头足类的生殖策略,其中多数大洋性经济头足类(如柔鱼,茎柔鱼,鸢乌贼)均属于单循环产卵(monocyclic spawning)中的多次产卵(multiple spawning)模式,个体在不同的产卵季节间仍旧保持生长[33]。正是因为上述原因,直接造成了雌雄个体在相似的情况下性成熟程度不相同,也影响了角质颚的形态。不同性别间角质颚形态的差异主要是由于:(1)雌雄柔鱼在同一时期不同阶段的栖息环境不同,因此其摄食对象和周围环境的不同也会对角质颚的形态造成直接的影响;(2)在同一环境中,雌性个体比雄性更早成熟,因为雌性相较于雄性需要更多的能量来维持其性腺的发育,而性成熟时间的不同,也导致了角质颚形态产生差异。
3.3 不同年份角质颚形态及生长差异研究还发现:角质颚的各项形态值与胴长的关系均符合线性模型,2010年角质颚生长速度最快,且与其他年份个体在生长过程中存在显著差异(表 5);角质颚的线性生长模式在头足类中较为常见[10-12, 18];雌性个体角质颚的生长明显快于雄性,应该与其生殖策略有关。柔鱼在不同年份中角质颚月生长率存在很大不同(表 6和表 7),这也与其摄食有着密切关联。在头足类个体发育阶段,个体的摄食情况是影响角质颚生长的重要因素之一,SST和Chl.a的变化会直接影响浮游动植物和小型鱼类的生长,也间接影响了以浮游生物和小型鱼类为食的头足类的摄食情况,最终导致其角质颚形态存在年间差异。
3.4 环境对角质颚生长的影响大洋性头足类作为一种机会主义物种,极易受到周围海洋环境变化的影响。已有研究[34-35]证明,栖息环境(SST为主要表征指标)和饵料丰度(Chl.a为主要表征指标)是影响柔鱼资源量及补充量的重要环境因子。已有研究[36]认为,柔鱼索饵场SST适宜范围为17~22 ℃,而Chl.a适宜范围为0.2~0.5 mg/m3。研究结果可以发现,2015年柔鱼个体在8—9月间角质颚生长率最为缓慢,其他年份8—9月生长率则较高,在研究对应的索饵场SST的分布规律可以发现,2015年8—9月的SST峰值明显比2010、2016年对应月份要低约3 ℃左右,而其他月份的SST分布规律则较为相似。较低SST对应较低的生长率,可以认为SST的变化会对角质颚的生长产生影响。同样针对8—9月,2015和2016年索饵场Chl.a浓度则集中于0.4~0.7 mg/m3的高浓度范围内,而在同时期的2010年索饵场海域的Chl.a浓度分布相对分散,主要均集中在低浓度(0.2~0.4 mg/m3),但有较多高浓度区域存在(>0.7 mg/m3)。这也可以认为是2010年8—9月柔鱼角质颚生长率保持较高的原因之一。较为适宜的SST和较高的Chl.a,使得2016年个体的角质颚明显大于其他年份(表 2)。综上所述,SST和Chl.a的变化对角质颚的形态会产生很大的影响,8—9月的环境因素是影响本年度柔鱼角质颚形态和生长的关键。
本研究分析了不同年份柔鱼角质颚形态及其生长特征的差异,结合不同年份月间SST和Chl.a的变化,提出了差异产生的可能原因。柔鱼作为我国重要的远洋捕捞种类,资源量的变化与海洋环境息息相关,而通过研究角质颚的形态变化,可以更好地了解柔鱼在某一时期的摄食和生长状况,为资源量的变化找出对应的原因。本文主要定性分析了相关环境对角质颚形态和生长的影响,也得出了适宜的SST和Chl.a更有利于角质颚生长的结论。今后的研究需要更为细化地定量分析角质颚与SST以及Chl.a的关系,建立起不同因素间的模型,为研究柔鱼对于环境变化的响应找出更多影响因素。
| [1] |
ANDERSON C I H, RODHOUSE P G. Life cycles, oceanography and variability:ommastrephid squid in variable oceanographic environments[J]. Fisheries Research, 2001, 54(1): 133-143. |
| [2] |
JEREB P, ROPER C F E. Cephalopods of the world. An annotated and illustrated catalogue of cephalopod species known to date. vol.2. Myopsid and Oegopsid Squids. FAO Species Catalogue for Fishery Purposes 4[R]. Rome: FAO, 2010: 1-605.
|
| [3] |
RODHOUSE P G. Managing and forecasting squid fisheries in variable environments[J]. Fisheries Research, 2001, 54(1): 3-8. |
| [4] |
YU W, CHEN X J, YI Q, et al. Variability of suitable habitat of western winter-spring cohort for neon flying squid in the northwest Pacific under anomalous environments[J]. PLoS One, 2015, 10(4): e0122997. DOI:10.1371/journal.pone.0122997 |
| [5] |
YU W, CHEN X J, CHEN Y, et al. Effects of environmental variations on the abundance of western winter-spring cohort of neon flying squid (Ommastrephes bartramii) in the northwest Pacific Ocean[J]. Acta Oceanologica Sinica, 2015, 34(8): 43-51. DOI:10.1007/s13131-015-0707-7 |
| [6] |
XAVIER J C, ALLCOCK A L, CHEREL Y, et al. Future challenges in cephalopod research[J]. Journal of the Marine Biological Association of the United Kingdom, 2015, 95(5): 999-1015. DOI:10.1017/S0025315414000782 |
| [7] |
FANG Z, LI J H, KATHERINE THOMPSON, et al. Age, growth and population structure of neon flying squid (Ommastrephes bartramii) in the north Pacific Ocean based on beak microstructure[J]. Fish Bull, 2016, 114: 34-44. DOI:10.7755/FB.114.1.3 |
| [8] |
FANG Z, THOMPSON K, JIN Y, et al. Preliminary analysis of beak stable isotopes (δ13C and δ15N) stock variation of neon flying squid, Ommastrephes bartramii, in the north Pacific Ocean[J]. Fisheries Research, 2016, 177: 153-163. DOI:10.1016/j.fishres.2016.01.011 |
| [9] |
JACKSON G D. The use of beaks as tools for biomass estimation in the deepwater squid Moroteuthis ingens (Cephalopoda:Onychoteuthidae) in New Zealand waters[J]. Polar Biology, 1995, 15(1): 9-14. |
| [10] |
徐杰, 刘尊雷, 李圣法, 等. 东海剑尖枪乌贼角质颚的外部形态及生长特性[J]. 海洋渔业, 2016, 38(3): 245-253. XU J, LIU Z L, LI S F, et al. Morphology and growth characteristics of Uroteuthis edulis beak in the East China Sea[J]. Marine Fisheries, 2016, 38(3): 245-253. DOI:10.3969/j.issn.1004-2490.2016.03.003 |
| [11] |
杨林林, 姜亚洲, 刘尊雷, 等. 东海太平洋褶柔鱼角质颚的形态学分析[J]. 中国海洋大学学报, 2012, 42(10): 51-57. YANG L L, JIANG Y Z, LIU Z L, et al. Variation analysis on partial morphometric measurements of beak of Todarodes pacificus inhabiting East China Sea[J]. Periodical of Ocean University of China, 2012, 42(10): 51-57. |
| [12] |
杨林林, 姜亚洲, 刘尊雷, 等. 东海火枪乌贼角质颚的形态特征[J]. 中国水产科学, 2012, 19(4): 586-593. YANG L L, JIANG Y Z, LIU Z L, et al. Analysis of beak morphology of Loligo beka in the East China Sea[J]. Journal of Fishery Sciences of China, 2012, 19(4): 586-593. |
| [13] |
GRÖGER J, PIATKOWSKI U, HEINEMANN H. Beak length analysis of the southern ocean squid Psychroteuthis glacialis, (Cephalopoda:Psychroteuthidae) and its use for size and biomass estimation[J]. Polar Biology, 2000, 23(1): 70-74. DOI:10.1007/s003000050009 |
| [14] |
WOLFF G A. Identification and estimation of size from the beaks of 18 species of cephalopods from the Pacific Ocean[R]. NOAA Technical Report NMFS 17. U.S. Department of Commerce, National Oceanic and Atmospheric Administration, National Marine Fisheries Service, 1984: 50.
|
| [15] |
FANG Z, LIU B L, LI J H, et al. Stock identification of neon flying squid (Ommastrephes bartramii) in the north Pacific Ocean on the basis of beak and statolith morphology[J]. Scientia Marina, 2014, 78(2): 239-248. DOI:10.3989/scimar.03991.06A |
| [16] |
陈芃, 方舟, 陈新军. 基于角质颚外部形态学的柔鱼种群判别[J]. 海洋渔业, 2015, 37(1): 1-9. CHEN P, FANG Z, CHEN X J. Population identification of Ommastrephes bartramii based on beak's external morphological characters[J]. Marine Fisheries, 2015, 37(1): 1-9. DOI:10.3969/j.issn.1004-2490.2015.01.001 |
| [17] |
LIPIN'SKI M R, UNDERHILL L G. Sexual maturation in squid:quantum or continuum[J]. South Africa Journal of Marine Science, 1995, 15(1): 207-223. DOI:10.2989/02577619509504844 |
| [18] |
方舟, 陈新军, 陆化杰, 等. 北太平洋两个柔鱼群体角质颚形态及生长特征[J]. 生态学报, 2014, 34(19): 5405-5415. FANG Z, CHEN X J, LU H J, et al. Morphology and growth of beaks in two cohorts for neon flying squid (Ommastrephes bartramii) in the north Pacific Ocean[J]. Acta Ecologica Sinica, 2014, 34(19): 5405-5415. |
| [19] |
UCHIKAWA K, SAKAI M, WAKABAYASHI T, et al. The relationship between paralarval feeding and morphological changes in the proboscis and beaks of the neon flying squid Ommastrephes bartramii[J]. Fisheries Science, 2009, 75(2): 317-323. DOI:10.1007/s12562-008-0036-2 |
| [20] |
LLEONART J, SALAT J, TORRES G J. Removing allometric effects of body size in morphological analysis[J]. Journal of Theoretical Biology, 2000, 205(1): 85-93. |
| [21] |
管于华. 统计学[M]. 北京: 高等教育出版社, 2005: 178-182. GUAN Y H. Statistics[M]. Beijing: Higher Education Press, 2005: 178-182. |
| [22] |
韩青鹏, 陆化杰, 陈新军, 等. 南海北部海域中国枪乌贼角质颚的形态学分析[J]. 南方水产科学, 2017, 13(4): 122-130. HAN Q P, LU H J, CHEN X J, et al. Morphological analysis of beaks of Uroteuthis chinensis in the northern South China Sea[J]. South China Fisheries Science, 2017, 13(4): 122-130. DOI:10.3969/j.issn.2095-0780.2017.04.015 |
| [23] |
CHEN X J, LI J H, LIU B L, et al. Age, growth and population structure of jumbo flying squid, Dosidicus gigas, off the Costa Rica Dome[J]. Journal of the Marine Biological Association of the United Kingdom, 2013, 93(2): 567-573. DOI:10.1017/S0025315412000422 |
| [24] |
黄洪亮, 郑元甲, 程家骅. 北太平洋海区柔鱼生物学特征研究[J]. 海洋渔业, 2003, 25(3): 126-129, 135. HUANG H L, ZHENG Y J, CHENG J H. Study on the biological characteristics of Ommastrephes bartramii in the north Pacific[J]. Marine Fisheries, 2003, 25(3): 126-129, 135. DOI:10.3969/j.issn.1004-2490.2003.03.006 |
| [25] |
李建华, 陈新军, 刘必林, 等. 夏秋季西北太平洋柔鱼渔业生物学的初步研究[J]. 上海海洋大学学报, 2011, 20(6): 890-894. LI J H, CHEN X J, LIU B L, et al. Biological characteristics of Ommastrephes bartramii in northwest Pacific Ocean[J]. Journal of Shanghai Ocean University, 2011, 20(6): 890-894. |
| [26] |
唐峰华, 伍玉梅, 樊伟. 2010年北太平洋海区巴特柔鱼(Ommastrephe bartramii)的生物学特征[J]. 海洋科学进展, 2012, 30(2): 257-265. TANG F H, WU Y M, FAN W. Biological characters of neon flying squid (Ommastrephe bartramii) in the north Pacific Ocean[J]. Advances in Marine Science, 2012, 30(2): 257-265. DOI:10.3969/j.issn.1671-6647.2012.02.013 |
| [27] |
杨铭霞, 陈新军, 刘必林, 等. 西北太平洋柔鱼渔获群体组成及生长率的年间比较[J]. 上海海洋大学学报, 2012, 21(5): 872-877. YANG M X, CHEN X J, LIU B L, et al. Comparison of catch composition and growth rate for Ommastrephes bartramii between different years in the northwest Pacific[J]. Journal of Shanghai Ocean University, 2012, 21(5): 872-877. |
| [28] |
范江涛, 陈新军, 曹杰, 等. 西北太平洋柔鱼渔场变化与黑潮的关系[J]. 上海海洋大学学报, 2010, 19(3): 378-384. FAN J T, CHEN X J, CAO J, et al. The variation of fishing ground of Ommastrephes bartramii in the northwest Pacific concerning with Kuroshio current[J]. Journal of Shanghai Ocean University, 2010, 19(3): 378-384. |
| [29] |
ARKHIPKIN A, ARGÜELLES J, SHCHERBICH Z, et al. Ambient temperature influences adult size and life span in jumbo squid (Dosidicus gigas)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2015, 72(3): 400-409. DOI:10.1139/cjfas-2014-0386 |
| [30] |
WATANABE H, KUBODERA T, ICHⅡ T, et al. Feeding habits of neon flying squid Ommastrephes bartramii in the transitional region of the central north Pacific[J]. Marine Ecology Progress Series, 2004, 266: 173-184. DOI:10.3354/meps266173 |
| [31] |
MERCER M C, MISRA R K, HURLEY G V. Sex determination of the ommastrephid squid Illex illecebrosus using beak morphometries[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(2): 283-286. DOI:10.1139/f80-035 |
| [32] |
BOLSTAD K S. Sexual dimorphism in the beaks of Moroteuthis ingens Smith, 1881(Cephalopoda:Oegopsida:Onychoteuthidae)[J]. New Zealand Journal of Zoology, 2006, 33(4): 317-327. DOI:10.1080/03014223.2006.9518459 |
| [33] |
ROCHA F, GUERRA Á, GONZÁLEZ Á F. A review of reproductive strategies in cephalopods[J]. Biological Reviews, 2001, 76(3): 291-304. DOI:10.1017/S1464793101005681 |
| [34] |
ALABIA I D, SAITOH S I, MUGO R, et al. Seasonal potential fishing ground prediction of neon flying squid (Ommastrephes bartramii) in the western and central north Pacific[J]. Fisheries Oceanography, 2015, 24(2): 190-203. DOI:10.1111/fog.12102 |
| [35] |
ALABIA I D, SAITOH S I, MUGO R, et al. Identifying pelagic habitat hotspots of neon flying squid in the temperate waters of the central north Pacific[J]. PLoS One, 2015, 10(11): e0142885. DOI:10.1371/journal.pone.0142885 |
| [36] |
WANG J T, YU W, CHEN X J, et al. Detection of potential fishing zones for neon flying squid based on remote-sensing data in the northwest Pacific Ocean using an artificial neural network[J]. International Journal of Remote Sensing, 2015, 36(13): 3317-3330. DOI:10.1080/01431161.2015.1042121 |
2. Key Laboratory of Oceanic Fisheries Exploitation, Ministry of Agriculture, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
5. Laboratory of Marine Fisheries Science and Food Production Processes, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, Shandong, China
 2020,
Vol. 29
2020,
Vol. 29


