2. 大洋渔业资源可持续开发教育部重点实验室, 上海 201306;
3. 国家远洋渔业工程技术研究中心, 上海 201306;
4. 农业农村部大洋渔业开发重点实验室, 上海 201306
大洋性鱿鱼Ommastrephidae(也称柔鱼类)是头足类的重要种类[1],主要以钓捕作业为主。我国远洋鱿钓渔业始于1989年,经过近30年的发展,远洋鱿钓渔业已经成为我国远洋渔业的重要组成[2]。据统计,2017年我国远洋鱿钓的作业渔船为706艘,产量为43.68万t(2015年最高达到78.86万t),作业海域主要分布在北太平洋、东南太平洋、东太平洋赤道海域、西南大西洋、印度洋西北部和日本海等,我国已经成为世界鱿钓渔业规模和产量最大的国家。我国远洋鱿钓渔业能够得到稳定持续的发展,其中一个重要的原因就是:通过产学研合作,政府与协会支持,企业与高校强强联合,持续10多年对三大洋的大洋性鱿鱼资源进行探捕调查,一批新资源、新渔场被不断开发,初步摸清了其基础生物学特性以及资源渔场分布与水温等的关系,并得到商业化捕捞。为此,根据2003—2017年三大洋公海大洋性鱿鱼资源调查资料,对资源调查取得的成果进行系统总结,对捕捞对象的基础生物学、资源渔场分布及其与水温等因子的关系进行分析,为世界大洋性鱿鱼资源的可持续开发和利用提供基础资料。
1 材料与方法 1.1 调查船、调查海域和时间调查船、调查海域、站点和调查时间具体见表 1。调查分别由不同企业的鱿钓生产船承担,其参数见表 1。调查海域空间分布示意图见图 1。

|
表 1 2003—2017年三大洋经济鱿鱼类资源调查汇总表 Tab.1 Summary of the productive survey of the economic squids in the three oceans from 2003 to 2017 |

|
图 1 2003—2017年大洋性鱿鱼类资源生产性调查分布示意图 Fig. 1 Investigation distribution of oceanic squid resources from 2003 to 2017 |
调查区域分为重点调查海域和一般调查海域,重点调查海域为每30′×30′为一站点,一般调查海域每1°×1°为一站点。利用CTD(SEABIRD-58)测定0~300 m水层的水温与盐度。
1.2.2 渔业基础生物学测定测定渔获群体组成, 包括胴长、体质量、性别、性腺成熟度、摄食等级等,其测定的依据参考《渔业资源生物学》[3]。
1.2.3 资源丰度(CPUE)计算柔鱼资源丰度CPUE[尾/(线·h)]的计算公式[4]为
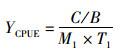 (1)
(1)
式中:C为当次作业的总产量,kg;B为当次作业所获柔鱼的平均体质量,kg;M1为每天钓机的总钓线数,线;T1为每天钓机的作业时数, h。
1.2.4 CPUE与海洋环境因子的关系分析CPUE与海表温以及各水层温度、盐度的关系,获得中心渔场的最适环境范围,同时探讨分析海面高度(代表冷暖水团)与中心渔场的关系。
2 结果 2.1 胴长范围及胴长与体质量的关系 2.1.1 印度洋西北部鸢乌贼2003年9—11月调查期间共测定2 766尾鸢乌贼样本,胴长(LML, cm)范围为10.6~54.0 cm,优势胴长组为22~36 cm,占总数的70.5%,其中,雌性个体胴长范围为10.6~54.0 cm,平均胴长为29.2 cm;雄性个体胴长范围为14.2~31.0 cm,平均胴长为22.0 cm。雌性个体胴长与体质量(W,kg)关系式为W = 0.000 3×LML2.597 3(R2=0.95,P<0.01),雄性个体的关系式为W=0.002 3×LML2.207 6(R2=0.940 0,P<0.01)。
2004年9月—2005年2月调查期间共采集649尾鸢乌贼样本,其胴长范围为16.3~56.0 cm,优势胴长组为28.0~44.0 cm,占总数的70.51%,其中:雄性个体胴长范围为23.0~36.4 cm,平均胴长为27.6 cm;体质量范围为0.32~1.43 kg,平均体质量为0.59 kg。雌性个体胴长范围为16.3~56.0 cm,平均胴长为36.8 cm;体质量范围为0.08~6.02 kg,平均体质量为1.64 kg。雌性个体的胴长与体质量关系式为W=0.000 05×LML3.170 8(R2=0.970 0,P<0.01),雄性个体的关系式为W=0.000 1×LML2.743 1(R2=0.910 0,P<0.01)。
2005年3—5月调查期间共采集208尾鸢乌贼样本,其胴长范围为17.8~59.0 cm,平均胴长为41.2 cm,优势胴长组为28.0~54.0 cm,占总数的85.81%;体质量范围为0.25~7.15 kg,平均体质量为2.55 kg,优势体质量组为0.25~4.50 kg,占总数的87.84%。雌性个体胴长与体质量的关系式为W=0.000 04×LML2.977 8(R2=0.96,P<0.01),雄性个体的关系式为W=0.009 1×LML1.957 9(R2=0.930 0,P<0.01)。
2.1.2 智利外海茎柔鱼2006年4—6月调查期间共采集茎柔鱼580尾,渔获个体胴长范围为24.0~55.0 cm,优势胴长为31.0~43.0 cm,占总数的82.1%。体质量范围为0.50~5.80 kg,优势体质量为1.00~2.00 kg,占总数的66.0%。胴长与体质量关系式为:W=0.046 693×LML2.877(R2=0.971 5,P<0.01)。
2006年12月—2007年1月、2007年5—7月探捕期间共采集茎柔鱼样本430尾,其胴长范围为28.7~70.2 cm,平均胴长为40.4 cm,优势胴长组为35.0~45.0 cm,占总数的71.6%。体质量范围为0.63~11.30 kg,平均体质量为2.00 kg,优势体质量为1.00~2.50 kg,占总数的75.6%。雌性、雄性个体的胴长与体质量关系式分别为:W=6.208 2×10-5LML3.361 6(R2=0.971 3,P<0.01),W=1.082 5×10-4LML3.235 1(R2=0.977 5,P<0.01)。
2008年1—5月共采集茎柔鱼样本550尾,渔获物胴长为21.1~83.7 cm,平均胴长为36.0 cm,优势胴长组为30.0~40.0 cm,占总数的66.2%。体质量范围为0.17~10.20 kg,平均体质量为0.78 kg,优势体质量为0.50~1.50 kg,占总数的91.5%。雌性和雄性个体的胴长与体质量关系式分别为W=7.969 7×10-5LML3.102 1(R2=0.951 7,P<0.01),W=2.963 3×10-5LML2.301 4(R2=0.934 1,P<0.01)。
2.1.3 哥斯达黎加外海茎柔鱼2009年8—9月的调查认为,茎柔鱼样本的胴长范围为20.0~44.0 cm,平均胴长为30.5 cm,优势胴长为26.0~36.0 cm,占总数的74.9%。体质量范围为0.20~2.20 kg,平均体质量为0.69 kg,优势体质量为0.40~1.20 kg,占总数的77.2%。胴长与体质量关系式为W=0.000 1×LML2.578 5(R2= 0.787 4,P<0.01)。
2010年2—3月、8—9月的调查认为,调查海域茎柔鱼胴长范围为20.4~42.9 cm,平均胴长为30.6 cm,优势胴长为25.0~35.0 cm,占总数的80.4%;体质量范围为0.17~2.12 kg,平均体质量为0.70 kg,优势体质量为0~1.00 kg,占总数的87.2%。雌性个体胴长与体质量关系式为W=2.703 5×10-4LML2.574 7(R2=0.868 7,P<0.01),雄性为W=1.788 2×10-4LML2.629 4(R2=0.886 8,P<0.01)。
2.1.4 北太平洋中东部柔鱼2011年5—6月调查共采集柔鱼样本1 424尾,胴长范围为19.8~49.9 cm,平均胴长为31.2 cm,优势胴长为33.0~41.0 cm,占总数的70.6%。体质量范围为0.28~3.15 kg,平均体质量为1.43 kg,优势体质量为1.0~2.0 kg,占总数的72.1%。柔鱼胴长与体质量关系式为W=1.6×10-5LML3.175 3(R2=0.949 2,P<0.01)。
2012年5—7月调查共采集柔鱼样本1 940尾,胴长范围为21.8~49.0 cm,平均胴长为35.8 cm,优势胴长为33.0~43.0 cm,占总数的76.96%。体质量范围为0.125~3.4 kg,平均体质量为1.46 kg,优势体质量为1.0~2.5 kg,占总数的87.48%。柔鱼胴长与体质量关系式为W=1.0×10-5LML3.267 5(R2=0.943 8,P<0.01)。
2.1.5 东太平洋公海赤道茎柔鱼和鸢乌贼2013年4—6月调查共采集茎柔鱼1 115尾,分析表明,不同性别、不同月份的胴长和体质量组成不同。4—6月各月雌性个体胴长范围分别为18.4~39.8 cm、23.8~46.9 cm和9.3~49.5 cm,优势胴长组分别为24.0~32.0 cm、26.0~34.0 cm和28.0~36.0 cm;体质量范围分别为0.22~1.80 kg、0.37~3.31 kg和0.02~3.90 kg,优势体质量组分别为0.20~0.80 kg、0.40~1.20 kg和0.60~1.20 kg。4—6月雄性个体胴长范围分别为21.8~39.8 cm、19.3~40.8 cm和9.4~40.6 cm,优势胴长组分别为22.0~30.0 cm、24.0~34.0 cm和28.0~32.0 cm;体质量范围分别为0.25~2.17 kg、0.35~1.78 kg和0.03~1.78 kg,优势体质量组分别为0.20~0.80 kg、0.40~1.20 kg和0.40~0.80 kg。雌、雄茎柔鱼的胴长与体质量关系分别为:W =1.64×10-5LML3.092 6(R2=0.943 4,P<0.01),W=2.32×10-5LML3.022 9(R2= 0.942 6,P<0.01)。
鸢乌贼在调查海域也有分布。调查期间,鸢乌贼渔获物的胴长范围为13.7~33.8 cm,优势胴长组为16.0~22.0 cm,占总数的81.45%;体质量范围为0.09~1.30 kg,优势体质量组为0.15~0.45 kg,占总数的80.67%。不同月份的鸢乌贼胴长与体质量组成不同,4—6月胴长范围分别为18.3~26.4 cm、13.7~29.7 cm和14.2~33.8 cm,体质量范围分别为0.24~0.67 kg、0.09~1.17 kg和0.11~1.30 kg。其胴长与体质量关系式为W =4.58×10-5LML2.971 3(R2=0.968 6,P<0.01)。
2014年4—6月调查共采集茎柔鱼样本584尾,其胴长范围为22.0~47.6 cm,平均胴长为31.9 cm,优势胴长为26.0~35.0 cm,占总数的83.0%。体质量范围为0.28~3.33 kg,平均体质量为0.91 kg,优势体质量为0.30~1.20 kg,占总数的87.2%。胴长与体质量关系式为W=1.0×10-5LML3.124 7(R2=0.901 9,P<0.01)。
共采集鸢乌贼220尾,其雌性个体胴长范围为13.2~35.1 cm,平均胴长为19.6 cm,优势胴长为14.0~22.0 cm,占总数的81.8%;体质量范围为0.06~1.98 kg,平均体质量为0.32 kg,优势体质量为0.10~0.40 kg,占总数的78.4%。雄性个体胴长范围为11.9~25.4 cm,平均胴长为17.5 cm,优势胴长为12.0~22.0 cm,占总数的75.0%,体质量范围为0.04~0.67 kg,平均体质量为0.24 kg。其胴长与体质量关系式为W=2.0×10-5LML3.120 4(R2=0.933 8,P<0.01)。
2.1.6 北太平洋西经海域柔鱼2015年6—8月调查期间共采集柔鱼样本565尾,雌、雄个体胴长范围分别为16.5~51.6 cm和16.6~51.2 cm,优势胴长组分别为30.0~45.0 cm和25.0~45.0 cm,分别占总数的78.88%和86.42%。雌、雄性个体体质量范围分别为0.10~3.88 kg和0.10~4.50 kg,优势体质量组分别为1.00~2.50 kg和0.50~2.50 kg,分别占总数的73.60%和78.19%。胴长与体质量关系式为W =5.0×10-6LML3.296 9(R2= 0.918 0,P<0.01)。
2016年4—6月调查期间共采集柔鱼539尾,分析认为,不同性别渔获物中柔鱼的胴长和体质量组成不同,不同月份的也不同。4月、5月和6月雌性个体胴长范围分别为29.3~38.6 cm、27.2~45.0 cm和19.8~45.1 cm,优势胴长组分别为30.0~35.0 cm、30.0~35.0 cm和35.0~40.0 cm;体质量范围分别为0.73~1.62 kg、0.62~2.90 kg和0.22~3.48 kg,优势体质量组分别为0.50~1.00 kg、0.50~1.00 kg和1.00~1.50 kg。雄性样本只在6月出现,其胴长范围为19.7~26.4 cm,优势胴长组为20.0~25.0 cm;体质量范围为19.0~58.0 cm,优势体质量组为0~0.50 kg。胴长与体质量关系式为W=1.0×10-5LML3.186 0(R2=0.897 4,P<0.01)。
2.1.7 大西洋中西部公海柔鱼2017年5—6月探捕期间,共采集柔鱼样本322尾。雌、雄性个体的胴长范围分别为14.7~43.5 cm和13.7~36.6 cm,优势胴长组分别为20.0~40.0 cm和20.0~30.0 cm,分别占总数的85.94%和84.62%。雌、雄个体体质量范围分别为0.06~2.66 kg和0.06~1.49 kg,优势体质量组分别为0~0.50 kg和0~1.00 kg,分别占总数的59.84%和68.72%。
分析表明,不同性别、不同月份柔鱼的胴长和体质量组成不同。雌性个体,5月柔鱼胴长范围为14.7~43.2 cm,无明显优势胴长组;体质量范围为0.06~2.06 kg,优势体质量组为0~0.5 kg,占总数的42.03%。6月柔鱼胴长范围为15.4~43.5 cm,优势胴长组为25.0~30.0 cm,占总数的43.86%;体质量范围为0.10~2.66 kg,优势体质量组为0.50~1.00 kg,占总数的45.61%。雄性个体,5月柔鱼胴长范围为13.7~36.6 cm,优势胴长组为25.0~30.0 cm,占总数的47.95%;体质量范围为0.06~1.49 kg,优势体质量组为0~0.50 kg,占总数的54.79%。6月柔鱼胴长范围为17.7~35.6 cm,优势胴长组为25.0~30.0 cm,占总数的51.85%;体质量范围为0.18~0.47 kg,优势体质量组为0.50~1.00 kg,占总数的66.67%。胴长与体质量关系式为W =2.0×10-5LML3.072 3(R2= 0.920 2,P<0.01)。
2.2 渔获物性比组成与摄食 2.2.1 印度洋西北部鸢乌贼2003年9—11月调查发现,渔获物中鸢乌贼雌雄比为93: 7。尽管雄性鸢乌贼数量极少,但分布范围很大,整个调查海域均有雄性个体分布。分析发现,10°N以南海域,雌性个体性成熟以Ⅳ期为主,10°N以北海域则以Ⅰ期为主; 雄性个体,在不同海域的性成熟均以Ⅳ期为主,均占总数的80%。调查发现,鸢乌贼摄食等级较低,以0~2级为主,占总数的63%。在残留的胃含物中,以鱿鱼为主。
2004年9月—2005年2月调查认为,渔获物中鸢乌贼雌雄比为96: 4。雄性个体的性成熟度以Ⅱ~Ⅳ期为主,占总数的88%;雌性个体以Ⅰ、Ⅱ期为主,占总数的69.9%。分析发现,摄食等级以1级和2级为主,分别占30%和32%。残留的胃含物以鱿鱼块和飞鱼为主,自食现象极为严重。
2005年3—5月调查认为,渔获物中鸢乌贼雌雄比为100: 4。不同纬度的雌性个体的性腺成熟度具有明显的差异。在15°N附近海域,各期性腺成熟度差异不大,以Ⅰ~Ⅲ期为主;在17°N附近海域,性腺成熟度以Ⅲ、Ⅳ期为主。其摄食等级主要以3、4级为主,占总数的63%。调查发现,一般在凌晨时,鸢乌贼的摄食程度开始下降。
2.2.2 智利外海茎柔鱼2006年4—6月调查认为,渔获物中茎柔鱼雌雄比为91: 9。4—6月期间,雌性个体的性腺成熟度以Ⅰ~Ⅱ级为主,占总数的91.21%。摄食等级以1~3级为主,占总数的72.0%。
2007年1月、5—7月调查认为,渔获物中茎柔鱼雌雄比为3: 1。总体上,渔获物中性腺成熟度以Ⅰ期为主,占总数的92%,未发现Ⅴ期个体。渔获物中的摄食等级以0级和1级为主,分别占总数的35%和20%。调查发现,当地时间24:00前空胃率较高,摄食率低;24:00后满胃率较高,摄食量明显增加。同时,茎柔鱼的自我残食现象严重。
2008年1—5月调查认为,渔获物中茎柔鱼雌雄比为3.7: 1,其中1月雌雄比为4.8: 1,2月雌雄比为3.2: 1, 3月雌雄比为3: 1。渔获物中性腺成熟度以Ⅰ期为主,占总数的75%,未发现Ⅴ期个体。其摄食等级以1级和2级为主,分别占总数的27%和43%。
2.2.3 哥斯达黎加外海茎柔鱼2009年8—9月调查认为,渔获物中以雌性茎柔鱼为主,占总数的80.9%,雄性仅占19.1%,雌雄比例为4.24: 1。雄性个体的性腺成熟度以Ⅳ期为主,占总数的75.6%,雌性以Ⅱ~Ⅳ为主,分别占总数的28.2%、46.0%、21.3%。摄食等级以0级为主,占总数的70%。
2010年2—3月、8—9月调查认为,渔获物中雌雄比为3.75: 1。雌性个体性腺成熟度以Ⅱ和Ⅲ期为主体,累计占总数的63%以上;雄性个体则以Ⅲ、Ⅳ期为主,累计占总数的88%以上。其间,调查海域发现了数量很多的幼体,该海域有可能是茎柔鱼的肥育场。渔获物的摄食等级各月有所差异,8月以0级为主,所占比重达89.8%;9月则以0~1级为主,其所占比重达87.8%。
2.2.4 北太平洋中东部柔鱼2011年5—6月调查发现,渔获物中柔鱼雌雄性比为70.4: 1。性腺成熟度集中在Ⅱ期和Ⅲ期,分别占总数的28.4%和56.7%,未发现Ⅳ期以上个体。摄食等级主要为1级和2级,分别占总数的56.7%和22.0%。
2012年5—7月调查发现,渔获物中柔鱼雌雄比为40.6: 1。性腺成熟度主要集中在Ⅰ期和Ⅱ期,分别占总数的36.1%和42.8%。柔鱼摄食等级主要集中在0级和1级,分别占总数的26.9%和41.8%。
2.2.5 东太平洋公海赤道茎柔鱼和鸢乌贼2013年4—6月调查发现,不同月茎柔鱼性比例构成不同,4—6月雌雄性比分别为1.87: 1、1.61: 1和1.17: 1。分析认为:雌性个体以未成熟为主(Ⅲ期以下),占总数的88.95%;雄性个体则以性成熟(Ⅲ期及其以上)为主,占总数的59.58%。分析表明,不同性别、不同月间茎柔鱼摄食等级组成不同。4—6月雌性个体,各月0~2级所占的比例分别为77.96%、62.28%和49.58%,雄性个体分别为80.66%、75.94%和61.90%。许多大型茎柔鱼胃里包含残碎的茎柔鱼个体,自相残食现象普遍。
调查也表明,渔获物中鸢乌贼雌雄比达76: 1。渔获物中以成熟个体(Ⅲ期及其以上)为主,占总数的68.83%。摄食等级以0~2级为主,占89.42%。初步分析表明,鸢乌贼主要以甲壳类和仔鱼为食,同时包含很多残碎的鱿鱼个体。
2014年4—6月调查发现,渔获物中茎柔鱼雌雄性比为2.06: 1。雌性个体的性成熟度主要分布在Ⅰ和Ⅱ期,分别占总数的33.8%、48.5%,雄性个体则分布比较均匀,Ⅰ~Ⅴ期分别占总数的15.2%、30.2%、15.2%、21.2%和18.2%。雌性个体摄食等级主要集中在0~2级,分别占总数的26.5%、35.3%和29.4%,雄性个体也主要集中在0~2级,分别占总数的15.2%、33.3%和33.3%。
渔获物中鸢乌贼雌雄性比为12.75: 1。雌性个体性成熟分布比较均匀,Ⅰ~Ⅴ期分别占总数的23.0%、13.7%、27.0%、21.6%和14.7%。雄性个体主要集中在Ⅳ期和Ⅴ期,分别占总数的25.0%和50.0%。雌性个体摄食等级主要集中在0级和1级,分别占总数的38.7%和46.6%;雄性个体也主要集中在0级和1级,分别占总数的50.0%和43.8%。
2.2.6 北太平洋西经海域柔鱼2015年6—8月调查认为,渔获物中6—8月柔鱼各月雌雄比分别为1.67: 1、1.27: 1和0.63: 1,总体雌雄比为1.33: 1。不同月份,雌雄个体的性腺成熟度组成不同。6月份,雌、雄性个体性成熟度均以Ⅱ期为主,分别占总数的54.21%、50.00%;7月份,分别以Ⅱ、Ⅲ期为主,分别占总数的37.84%、43.21%;8月份性成熟度均以Ⅰ期为主,分别占总数的73.3%和52.08%。分析也表明:6—8月雌性个体摄食等级均以0级为主,分别占总数的55.79%、51.46%、41.38%;6—8月雄性个体的摄食等级也以0级为主,分别占总数的56.14%、51.85%、56.25%。
2016年4—6月调查表明,渔获物中柔鱼雌雄性比为32.69: 1,其性成熟度以Ⅱ期为主,占总数的90%。分析表明:4—6月雌性个体各月0~1级所占的累计比重分别为35.00%、53.19%和62.07%;6月雄性个体摄食等级0~1级所占比重为56.25%。
2.2.7 大西洋中西部公海柔鱼2017年5—6月调查认为,渔获物中柔鱼雌雄性比为1.54: 1,其中5月和6月雌雄性比分别为1.89: 1和1.06: 1。不同月份,柔鱼性腺成熟度组成不同。5月和6月,雌性个体性成熟度均以Ⅱ期为主,分别占总数的60.87%和70.18%。同样,5—6月雄性个体性成熟度也以Ⅱ期为主,分别占总数的42.47%和48.15%。分析表明,不同性别、不同月份间柔鱼摄食等级组成不同。雌性个体,5月摄食等级以1级和2级为主,分别占总数的30.43%和31.16%;6月份则以2级为主,占总数的35.09%。雄性个体,5月摄食等级以1级和2级为主,分别占总数的30.14%和27.40%;6月也以1级和2级为主,分别占总数的38.89%、31.48%。
2.3 资源密度分布及其与水温的关系 2.3.1 印度洋西北部鸢乌贼2003年9—11月调查表明,整个调查海域的CPUE一般为0.01~5.69尾/(线·h),平均为1.061尾/(线·h)。在12°N以南海域,CPUE一般在1.0尾/(线·h)以下,其中心渔场的适宜表温为26.4~27.0 ℃;在12°N~14°N、58°E~61°E海域,其CPUE在2.0~2.5尾/(线·h),其中心渔场的适宜表温为26.7~29.0 ℃。在15°N~16°N、61°E附近海域,CPUE值为最高,达到5.5尾/(线·h)以上,平均日产均在5 t以上,其表温在27~29 ℃。从海面高度来看,中心作业渔场处在冷水涡的边缘海域。
2014年9月—2015年2月调查表明,调查海域的CPUE多数在1.0~4.0尾/(线·h),占总数的63.1%。高CPUE[>2尾/(线·h)]主要分布在12°N、14°N~16°N和59°E~61°E海域,以及18°30′N~20°N、62°30′E~64°E海域。调查表明,中心渔场主要集中在3个区域:(1)62°E~64°E、12°N~13°N海域,其表温为27.1~28.3 ℃;(2)59°E~62°E、15°N~18°N海域,其表温为27.30~28.20 ℃;(3)62°E~64°E,18°N~20°N海域,其表温为26.90~29.00 ℃。中心作业渔场基本上在冷水与暖水交汇边缘处,并处于冷水涡边缘一侧。
2005年3—5月调查表明,中心渔场主要分布在17°00′N、61°00′E附近海域,其表温范围为27.7~28.5 ℃,同样处在冷水与暖水交汇边缘处。
2.3.2 智利外海茎柔鱼2006年4—6月调查表明,茎柔鱼在智利外海广泛分布,且其资源密度较高,南部区域(37°S以南)平均CPUE为2.8尾/(线·h),北部区域(30°S以北)平均CPUE为3.1尾/(线·h)。南部区域较高CPUE[>2尾/(线·h)]主要分布在40°00′S~41°00′S、79°00′W~84°00′W,以及37°30′S、78°30′W海域;CPUE最高[>5尾/(线·h)]的区域分布在40°00′S~40°30′S、79°00′W~79°30′W海域。北部区域较高CPUE[>2尾/(线·h)]分布在28°00′S~30°00′S、76°30′W~77°00′W海域,CPUE最高[>5尾/(线·h)]区域分布在28°30′S、77°00′W附近海域。
分析发现:南部区域中心渔场(日产8 t以上)的适宜表温为14.2~15.3 ℃,盐度为33.58~34.23;50 m水层适宜温度为13.6~14.4 ℃,盐度为33.14~34.29;100 m水层适宜温度为10.4~11.6 ℃,盐度为33.82~34.11;200 m水层适宜温度为8.6~9.5 ℃,盐度为33.95~34.18;300 m水层适宜温度为6.4~7.1 ℃,盐度为33.13~34.32。分析表明,茎柔鱼中心渔场主要分布在冷水涡周围,以及冷暖水团的交界处附近,而在暖水团中部其渔获产量一般较低。
2007年1月、5—7月调查表明:在南部(37°S以南),较高CPUE[>2尾/(线·h)]主要分布在37°30′S~39°30′S、78°30′W~79°30′W,以及39°00′S~39°30S、80°W~81°W海域,CPUE最高[>5尾/(线·h)]的区域分布在39°30′S、78°30′W附近,其适宜表温为13.9~14.1 ℃;在北部(30°S以北),较高CPUE[>2尾/(线·h)]主要分布在23°30′S~28°00′S、75°30′W附近海域,CPUE最高[>5尾/(线·h)]区域主要分布在27°00′S、75°30′W附近,其适宜表温为17.39~20.84 ℃。
2008年1—5月探捕表明:CPUE较高区域在23°00′S~24°30′S、75°30′W~77°30′W海域,CPUE最高区域则在24°00′S、75°30′W附近海域;中心渔场适宜表温为17.3~20.9 ℃,盐度为34.17~34.71。
2.3.3 哥斯达黎加外海茎柔鱼和鸢乌贼2009年7—8月调查表明,茎柔鱼分布在6°30′N~10°00′N、97°00′W~91°00′W海域,但其资源密度分布不均匀,渔获量及CPUE差异很大,CPUE为0~5尾/(线·h)的最多,占总作业次数的56.25%,其中7°30′N~8°00′N、91°00′W~92°00′W以及8°30′N~9°00′N、94°30′W~95°00′W海域CPUE最高,最高超过20尾/(线·h)。作业渔场的表温为27.5~29.0 ℃,盐度为32.85~33.91,其高产的中心渔场表温为27.5~29.0 ℃,盐度为33.48~33.91,50 m水层最适水温为14~15 ℃。
2010年2—3月、8—9月调查表明,茎柔鱼分布在整个调查海域,各月空间分布不均匀。2月CPUE在5尾/(线·h)、日产量在1 t以上的海域主要分布在95°W~97°W、5°30~9°N,3月分布在90°W~96°W、8°N~9°N海域,8月分布在91°W~96°W、6°N~7°30′N海域,9月分布在96°W~97°W、7°~7°30′N海域。2~3月作业渔场的适宜表温为28~29 ℃,10 m、50 m、100 m、200 m水层的温度分别为27~28 ℃、24.5~25 ℃、15~17 ℃、13~14 ℃。8~9月作业渔场的适宜表温约为28 ℃,10 m、50 m、100 m、200 m水层的温度分别为27 ℃、21~22 ℃、14~15 ℃、13~14 ℃。
2.3.4 北太平洋中东部柔鱼2011年调查表明,5月至6月中旬柔鱼主要集中在38°40′N~39°30′N、172°E~175°E和38°40′N~39°20′N、179°E~177°30′W海域,其中心渔场最适温度为13.7~15.0 ℃,平均CPUE为2.1尾/(线·h),最高CPUE为8.2尾/(线·h)。
2012年5—7月调查表明,其CPUE在1.1~11.7尾/(线·h),平均CPUE达到3.6尾/(线·h)。作业渔场主要分布在39°30′N~40°N、174°E~177°E,39°30′N~40°N、179°00′E~179°00′W和39°30′N~40°N、177°00′W~175°00′W海域,中心渔场集中在39°30′N~40°N、174°E~177°E和39°30′N~40°N、177°00′W ~175°00′W海域。5月中心渔场的适宜表温为13.4~16.6 ℃,6月为13.9~15.3 ℃,7月为14.4~16.1 ℃。分析还发现,中心渔场与海面高度距平均值分布关系密切,基本上分布在冷水涡的边缘海域。
2.3.5 东太平洋公海赤道茎柔鱼2013年4—6月调查显示,4月高CPUE[>30尾/(线·h)]主要集中在0°30′N~1°18′N、116°W~119°W海域,最高CPUE[36.44尾/(线·h),对应产量为8.29 t]的作业海域分布在1°18′N、116°W附近,其表温为25.5~26.5 ℃。5月份高CPUE[>30尾/(线·h)]主要分布在0°36′N~1°12′N、115°56′W~116°10′W海域,最高CPUE[41.27尾/(线·h),对应日产量11 t]的作业海域分布在1°03′N、116°05′W附近,其表温为24.0~25.5 ℃。6月份高CPUE[>30尾/(线·h)]主要集中在0°35′N~1°N、114°53′W~115°40′W海域,最高CPUE[42.09尾/(线·h),对应日产量9.9 t]的作业海域分布在0°33′N、115°40′W附近,其表温为23.0~24.0 ℃。
2014年4—6月调查显示,在整个调查海域中,CPUE为1~5尾/(线·h)的站点为最多,占总数的60%。中心渔场主要分布在0°N~0°30′N、117°W~118°W海域,其他作业渔场还有0°S~0°30′S、109°W~110°W等海域。研究表明,不同月份中心渔场的最适水温存在差异,4月适宜表温为26~27 ℃,5月为25~27 ℃。
2.3.6 北太平洋西经海域柔鱼2015年6—8月调查显示,6月高CPUE[>2尾/(线·h)]主要集中在38°30′N~40°N、173°25′W~179°59′W海域,最高CPUE[4.48尾/(线·h),日产量1.0 t]的海域分布在40°N、174°W附近,其表温为13 ℃。7月高CPUE[>2尾/(线·h)]主要集中在40°44′N~41°12′N、175°W~177°50′W海域,最高CPUE[4.39尾/(线·h)]分布在177°50′W、40°46′N附近,其表温为14 ℃;8月作业渔场分布在37°23′N~41°37′N,171°09′W~175°58′ W海域,CPUE为0.50~1.17尾/(线·h),其表温为14~15 ℃。
2016年调查显示,5月份高CPUE[>8尾/(线·h)]主要集中在37°20′N~37°30′N、172°40′W~175°00′W海域,中心渔场主要分布在37°24′N~38°19′N、172°30′W~174°30′W海域,其表温为13.3~13.9 ℃。6月高CPUE[>8尾/(线·h)]主要集中在38°20′N~39°10′N、172°20′W~175°10′W海域,中心渔场主要分布在38°21′N~40°51′N、170°40′W~174°40′W海域,其表温为13.7~16.3 ℃。7月中心渔场主要分布在40°30′N~42°12′N、152°09′W~154°49′W,其表温为13.7~16.3 ℃。
2.3.7 大西洋中西部公海柔鱼2017年5—6月调查显示,整个调查海域均有柔鱼分布,但资源密度较低,平均日产量为136.5 kg/d,最高日产量为1 310 kg/d。作业渔场主要分布在37°30′S~39°30′S、50°30′W~52°00′W海域,中心渔场主要集中在37°30′S~38°10′S、51°00′W~51°40′W海域,其适宜表温为14 ℃左右。分析发现,其中心渔场形成与海表面温度、海面高度距平均值关系密切。
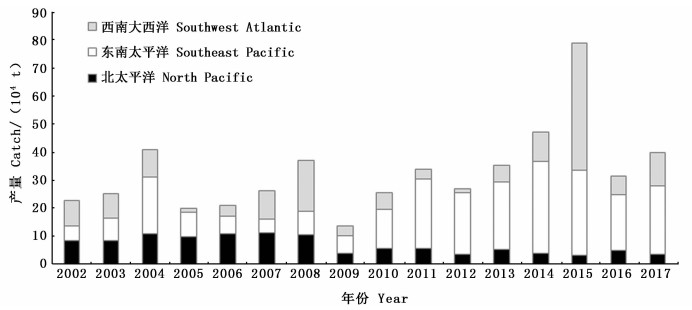
3 讨论与分析 3.1 我国远洋鱿钓渔业发展分析2003—2017年在农业部公海渔业资源调查项目的支持下,对印度洋、太平洋、大西洋等三大洋7个渔场的大洋性鱿鱼资源进行了生产性调查,在国际上首次发现了4个鱿鱼新渔场(智利外海、东太平洋赤道、印度洋西北和西南大西洋公海),新增作业海域1 000多万km2,相当于我国管辖海域的3倍,估计新增渔场的资源蕴藏量在500万t以上,绝大多数渔场都实现了商业化生产。通过10多年的生产性调查,我国远洋鱿钓渔业的生产规模和产量也不断增长,其捕捞年产量从2002年调查前的22.1万t,增加到2015年的78.9万t,增加了2倍多(图 2);作业渔船数量从2002年的502艘增加到2017年706艘(部分作业渔船可能存在西南大西洋和东南太平洋兼作的可能),增长了40%以上(图 3)。生产期间,由于厄尔尼诺现象、北太平洋涛动、产卵场环境变化等影响,鱿鱼捕捞年产量出现了剧烈的变化[5-6],如2009年达到历史最低值,2016年也出现了大幅度下降(图 2)。总体上分析,由于10多年来对全球三大洋的大洋性鱿鱼资源进行持续性生产性调查,开发了一批新渔场,增加了一些新种类,为我国远洋鱿钓渔业持续稳定发展,并成为世界上第一大远洋鱿钓渔业国家作出了重要的贡献,同时也为鱿钓船实行全年性生产以及作业渔场互补、降低因资源补充量不稳定而造成生产风险提供了保障。
|
图 2 2002—2017年中国远洋鱿钓渔业产量分布图 Fig. 2 Annual catch of Chinese squid jigging fisheries from 2002 to 2017 |

|
图 3 2002—2017年中国远洋鱿钓渔船数量分布图 Fig. 3 Annual number of fishing vessels for Chinese squid jigging fisheries from 2002 to 2017 |
在10多年的生产性调查中,通过对每一个海域2~3年的调查与样本采集,对其渔获物的胴长和体质量组成,以及性成熟度、摄食等级等有了初步的了解[7-8]。研究发现:不同捕捞对象个体大小及其优势群体、性成熟等存在明显的差异,在所有捕捞群体中,以智利外海茎柔鱼平均个体为最大,东太平洋公海海域的鸢乌贼平均个体为最小,但总体上胴长处在20~50 cm的范围内;渔获物基本上以雄性为主;摄食等级以0~2级的低摄食为主;同时,基本上存在自我残食的现象。
但是,由于调查时间有限,分布范围极广,目前对其群体组成、洄游过程、产卵场分布、繁殖习性以及生活史过程等基础特性尚不清楚。种群是渔业资源开发和管理的基本单元,大洋性鱿鱼具有群体结构复杂、分布范围广[9]、空间区域交叉重叠等特点,为此,需要利用多种手段和方法,通过国际合作持续大范围收集鱿鱼样本,开展种群结构的研究工作。大洋性鱿鱼是一种典型的生态机会主义者,大量的亲体在产完卵后就死亡,其资源补充量大小完全取决于补充群体[10],繁殖能力决定了其后代的数量和质量,但目前对新开发的大洋性鱿鱼的繁殖策略与行为知之甚少,尤其是产卵至孵化、孵化后至仔鱼的生物学过程;大洋性鱿鱼的年龄与生长已被广泛研究与应用[11],但其样本多来自索饵场,产卵场及产卵后个体的样本极少。因此,对新开发的渔场和大洋性鱿鱼资源要通过国际合作,基于科学调查和生产调查相结合,长序列全年采集产卵场和索饵场的样本,基于鱿鱼硬组织结构、微化学和稳定同位素等手段[12],系统开展大洋性鱿鱼的基础生物学研究,为合理开发和科学管理鱿鱼资源提供基础。
3.3 资源渔场分布及其与环境关系分析对每一个海域的鱿鱼资源渔场,通过2~3年的生产性调查,初步掌握了渔汛的时间以及资源空间分布、中心渔场分布及其与表温、盐度和海面高度等因子的关系[4, 13],也获得了其最适的环境因子范围。研究发现,不同作业渔场其最适水温是不一致的,并存在较大的差异。例如,智利南部区域中心渔场的适宜表温为14.2~15.3 ℃,而印度洋西北部海域中心渔场的表温在26~29 ℃。
由于短短的几年资源调查无法全面了解其资源渔场分布以及渔场形成的机制,更无法有效开展精准的渔情预报工作(例如资源补充量的预测),为此,在后续的研究中,要通过生产和调查系统收集统计数据,结合卫星遥感资料和气候指标,结合栖息地指数理论、人工智能等方法[14-19],建立中心渔场预报模型以及资源补充量预测模型,为科学安排生产和合理开发鱿鱼资源提供技术手段。
3.4 可持续开发和利用经济柔鱼类资源的建议已开发的三大洋鱿鱼资源具有分布广、资源蕴藏量大但年间变化剧烈的特点,气候变化对大洋性鱿鱼生活史过程的影响极其复杂[5-6],它们不仅可直接影响其资源补充量,同时还可通过栖息环境如水温等来间接影响资源量和渔场分布。总体上看,目前对新开发几个海域的大洋性鱿鱼的研究,对其生活史过程的了解甚少甚至没有,无法正确解释大洋性鱿鱼在其产卵场、洄游过程、索饵场受到环境变化时是如何产生相应变化的。因此,在未来的研究中,除了采用水温指标外,还应该将叶绿素、海面高度、海流等影响大洋性鱿鱼资源渔场的重要环境指标综合考虑,并提出一些科学的假设理论,以便诠释大洋性鱿鱼资源变化的原因和机制。
为此,在以后的研究中应做好以下几个方面的工作:(1)开展国际合作,对几个大洋性鱿鱼资源进行系统科学的调查,重点是产卵场的调查;(2)开展基于硬组织的大洋性鱿鱼年龄与生长、群体结构和生活史过程以及洄游分布的研究,了解产卵场和索饵场环境与大洋性鱿鱼生长的内在关系;(3)开展高精度的渔情预报研究,结合海洋遥感、物理海洋学、地理信息系统、人工智能等多学科,开发出一套基于大洋性鱿鱼的生活史特性的中心渔场预报系统,以及大洋性鱿鱼资源补充量预测技术,掌握其动态变化趋势;(4)建立大洋性鱿鱼资源评估模型,并开展管理策略的研究。目前世界上对短生命周期种类资源评估和管理正处于探索与发展阶段,在实践中应用较为成功仅有DeLury衰减模型,但在使用DeLury衰减模型时也存在一些问题[20],如没有考虑环境因子的影响,自然死亡率等不确定性因素太多。为此,应从减少大洋性鱿鱼资源评估参数的不确定性上入手,选择影响资源补充显著的气候和环境因子[21],采用贝叶斯统计理论,发展一种较为科学的大洋性鱿鱼资源评估和管理方法,实现对资源的合理开发利用,维持其可持续发展。
| [1] |
陈新军, 韩保平, 刘必林, 等. 世界头足类资源及其渔业[M]. 北京: 科学出版社, 2013. CHEN X J, HAN B P, LIU B L, et al. Fisheries and resources of world cephalopod[M]. Beijing: Science Press, 2013. |
| [2] |
陈新军, 陆化杰, 刘必林, 等. 大洋性柔鱼类资源开发现状及可持续利用的科学问题[J]. 上海海洋大学学报, 2012, 21(5): 831-840. CHEN X J, LU H J, LIU B L, et al. Current exploitation and some scientific issues in the sustainable utilization of Ommastrephidae[J]. Journal of Shanghai Ocean University, 2012, 21(5): 831-840. |
| [3] |
陈新军, 刘必林. 渔业资源生物学[M]. 北京: 科学出版社, 2017. CHEN X J, LIU B L. Fishery resources biology[M]. Beijing: Science Press, 2017. |
| [4] |
钱卫国, 陈新军, 郑波, 等. 智利外海茎柔鱼资源密度分布与渔场环境的关系[J]. 上海水产大学学报, 2008, 17(1): 98-103. QIAN W G, CHEN X J, ZHENG B, et al. Study on the resource density distribution of Dosidicus gigas and marine environment in the high sea waters off Chile[J]. Journal of Shanghai Fisheries University, 2008, 17(1): 98-103. |
| [5] |
曹杰, 陈新军, 刘必林, 等. 鱿鱼类资源量变化与海洋环境关系的研究进展[J]. 上海海洋大学学报, 2010, 19(2): 232-239. CAO J, CHEN X J, LIU B L, et al. Review on the relationship between stock recruitment of squid and oceanographic environment[J]. Journal of Shanghai Ocean University, 2010, 19(2): 232-239. |
| [6] |
余为, 陈新军, 易倩. 不同气候模态下西北太平洋柔鱼渔场环境特征分析[J]. 水产学报, 2017, 41(4): 525-534. YU W, CHEN X J, YI Q. Analysis of variations in the environmental conditions onthe fishing ground of neon flying squid (Ommastrephes bartramii) inthe Northwestern Pacific Ocean under different climate modes[J]. Journal of Fisheries of China, 2017, 41(4): 525-534. |
| [7] |
叶旭昌, 陈新军. 印度洋西北海域鸢乌贼生物学特性初步研究[J]. 上海水产大学学报, 2004, 13(4): 316-322. YE X C, CHEN X J. Study of biological characteristics of Symlectoteuthis oualaniensis in the northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 2004, 13(4): 316-322. |
| [8] |
刘必林, 陈新军, 钱卫国. 智利外海茎柔鱼生物学特性的初步研究[J]. 广东海洋大学学报, 2009, 29(1): 1-5. LIU B L, CHEN X J, QIAN W G. Biological characteristic of Dosidicus gigas off chile waters[J]. Journal of Guandong Ocean University, 2009, 29(1): 1-5. DOI:10.3969/j.issn.1673-9159.2009.01.001 |
| [9] |
陈新军, 刘必林, 王尧耕. 世界头足类[M]. 北京: 海洋出版社, 2009. CHEN X J, LIU B L, WANG Y G. World cepholopod[M]. Beijing: Ocean Press, 2009. |
| [10] |
陈新军, 曹杰, 田思泉, 等. 鱿鱼类资源评估与管理研究现状[J]. 上海海洋大学学报, 2009, 18(4): 495-501. CHEN X J, CAO J, TIAN S Q, et al. Review on stock assessment and management of the squids[J]. Journal of Shanghai Ocean University, 2009, 18(4): 495-501. |
| [11] |
陈新军, 刘必林, 钟俊生. 头足类年龄与生长特性的研究方法进展[J]. 大连水产学院学报, 2006, 21(4): 371-377. CHEN X J, LIU B L, ZHONG J S. Advances in determination of age and growth of cephalopods[J]. Journal of Dalian Fisheries University, 2006, 21(4): 371-377. DOI:10.3969/j.issn.1000-9957.2006.04.016 |
| [12] |
李建华, 李云凯, 陈新军, 等. 头足类硬组织的稳定同位素研究进展[J]. 上海海洋大学学报, 2014, 23(1): 154-160. LI J H, LI Y K, CHEN X J, et al. Review on stable isotope in hard issues of cephalopods[J]. Journal of Shanghai Ocean University, 2014, 23(1): 154-160. |
| [13] |
陈新军, 叶旭昌. 印度洋西北部海域鸢乌贼渔场与海洋环境因子关系的初步分析[J]. 上海水产大学学报, 2005, 14(1): 55-60. CHEN X J, YE X C. Preliminary study on the relationship between fishing ground of Symlectoteuthis oualaniensis and environmental factors in northwestern Indian Ocean[J]. Journal of Shanghai Fisheries University, 2005, 14(1): 55-60. |
| [14] |
龚彩霞, 陈新军, 高峰, 等. 栖息地适宜性指数在渔业科学中的应用进展[J]. 上海海洋大学学报, 2011, 20(2): 260-269. GONG C X, CHEN X J, GAO F, et al. Review on habitat suitability index in fishery science[J]. Journal of Shanghai Ocean University, 2011, 20(2): 260-269. |
| [15] |
陈新军, 高峰, 官文江, 等. 渔情预报技术及模型研究进展[J]. 水产学报, 2013, 37(8): 1270-1280. CHEN X J, GAO F, GUAN W J, et al. Review of fishery forecasting technology and its models[J]. Journal of Fisheries of China, 2013, 37(8): 1270-1280. |
| [16] |
易倩, 陈新军, 余为, 等. 基于信息增益技术比较分析智利和秘鲁外海茎柔鱼渔场环境[J]. 上海海洋大学学报, 2014, 23(2): 272-278. YI Q, CHEN X J, YU W, et al. A comparison of habitats of Dosidicus gigas in the fishing ground off Chile and Peru based on information gain technique[J]. Journal of Shanghai Ocean University, 2014, 23(2): 272-278. |
| [17] |
官文江, 高峰, 陈新军. 卫星遥感在海洋渔业资源开发、管理与保护中的应用[J]. 上海海洋大学学报, 2017, 26(3): 440-449. GUAN W J, GAO F, CHEN X J. Review of the applications of satellite remote sensing in the exploitation, management and protection of marine fisheries resources[J]. Journal of Shanghai Ocean University, 2017, 26(3): 440-449. |
| [18] |
陈洋洋, 陈新军, 郭立新, 等. 基于BP神经网络的中西太平洋鲣鱼渔场预报模型构建与比较[J]. 广东海洋大学学报, 2017, 37(6): 65-73. CHEN Y Y, CHEN X J, GUO L X, et al. Comparison of fishing ground of skipjack based on BP neural networkin the western and central Pacific Ocean[J]. Journal of Guangdong Ocean University, 2017, 37(6): 65-73. DOI:10.3969/j.issn.1673-9159.2017.06.011 |
| [19] |
WANG J T, CHEN X J, CHEN Y. Projecting distributions of Argentine shortfin squid (Illex argentinus) in the Southwest Atlantic using a complex integrated model[J]. Acta Oceanologica Sinica, 2018, 37(8): 31-37. DOI:10.1007/s13131-018-1231-3 |
| [20] |
徐洁, 陈新军, 官文江. 适用于短生命周期种类资源评估模型的研究现状与展望[J]. 海洋湖沼通报, 2015(3): 113-124. XU J, CHEN X J, GUAN W J. Review on stock assessment models and methods of short-lived species[J]. Transactions of Oceanology and Limnology, 2015(3): 113-124. |
| [21] |
WANG J T, CHEN X J, STAPLES K W, et al. A stock assessment for Illex argentinus in Southwest Atlantic using an environmentally dependent surplus production model[J]. Acta Oceanologica Sinica, 2018, 37(2): 94-101. DOI:10.1007/s13131-017-1131-y |
2. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
3. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28

