2. 中国水产科学研究院黄海水产研究所 农业农村部海洋渔业可持续发展重点实验室, 山东 青岛 266071;
3. 青岛市鱼类种子工程与生物技术重点实验室, 山东 青岛 266071;
4. 内江师范学院, 四川 内江 641100;
5. 江苏中洋集团股份有限公司, 江苏 海安 226600
暗纹东方鲀(Takifugu obscurus)又名河鲀,是我国长江中下游地区重要淡水养殖种类,其营养价值丰富、肉质鲜美,蛋白质和维生素以及硒、锌等微量元素含量丰富,且脂肪含量低,被称为“鱼中极品”[1-2],过去因受国内市场禁止销售的限制,养殖产量多年以来一直在1万~2万t范围内波动[3]。2016年9月农业部办公厅和国家食品药品监督管理总局联合发布《关于有条件放开养殖红鳍东方鲀和养殖暗纹东方鲀加工经营的通知》[4],解除了暗纹东方鲀不准市场流通的禁令,为暗纹东方鲀产业的二次创业和可持续发展提供了新的契机。暗纹东方鲀在2.5龄前雄鱼体质量生长速度大于雌鱼[5],且雄鱼组织的毒素量很低,精巢营养价值高,富含脱氧核糖核酸、鱼精蛋白和微量元素Se和Zn[6],被认为是难得的珍贵食材,有“西施乳”的美誉。一对精巢的价值甚至超过雄鱼本身,养殖全雄苗种的利润是养殖普通苗种的1.5倍以上。因此,生产和养殖全雄暗纹东方鲀,可以大幅度提高我国暗纹东方鲀的养殖经济效益。但遗憾的是,目前有关暗纹东方鲀的性别调控机制及其性控技术的研究还较少。雄性哺乳动物的性别决定区域(sex-determining region of Y chromosome,SRY)[7]编码的蛋白质包含一个高度保守的区域,称为高泳动组盒基序(high mobility group box motif,HMG box motif),属于高速泳动族类非组蛋白,并且通过与DNA特异性结合来调控下游基因的表达[7-8]。sox基因是指与性别决定基因SRY相关的HMG box序列相似性大于60%的一系列基因[9-10],而sox9是sox基因家族E亚族的一员,主要参与骨骼、神经系统和胰腺的发育以及肿瘤的形成等过程,特别是在性别决定和分化过程中起着重要的调控作用[11-15],在大鼠中,若sox9基因缺失会导致个体发生从雄性到雌性的性别逆转,同时sox9基因过表达则会导制XX雌性个体向雄性方向发育[16-18]。sox9基因分为sox9a和sox9b两种类型,据报道,已经在斑马鱼(Danio rerio)[19]、虹鳟(Oncorhynchus mykiss)[20]、黄颡鱼(Pelteobagrus fulvidraco)[21]、黄鳝(Monopterus albus)[22]、鲤(Cyprinus carpio)[23]、半滑舌鳎(Cynoglossus semilaevis)[24]和孔雀花鳉(Poecilia reticulata)[25]等鱼类中成功分离并克隆到sox9a或sox9b基因。证实了sox9基因在性别分化和性腺发育过程中发挥着重要的作用。在此基础上,本实验以暗纹东方鲀为研究对象,克隆sox9基因的cDNA全长序列,分析该基因的序列结构、相关生物信息学特征以及不同组织中的表达情况,为暗纹东方鲀sox9基因的遗传特性及相关生理功能的研究奠定了基础。
1 材料与方法 1.1 实验材料暗纹东方鲀样本购自江苏省南通市中洋集团股份有限公司,选取雌鱼和雄鱼各3尾,体长为14.2~15.5 cm,体质量为150~200 g,分别剖取下丘脑、脑、垂体、性腺、心脏、肝脏、胆、胃、肠、肌肉、眼等组织,置于RNA Store保存液中,-20 ℃冷冻保存。
1.2 sox9a和sox9b基因全长序列的克隆采用MiniBEST Universal RNA Extraction Kit(TaKaRa,大连)提取精巢组织总RNA,通过1%的琼脂糖凝胶电泳检测总RNA完整性,超微量分光光度计测定总RNA浓度。按照SMARTerⓇRACE5'/3'Kit User Manual(Clontech,美国)说明书合成cDNA第一链。
根据已知河豚属鱼类的保守序列,利用DNAMAN软件设计扩增引物sox9a -F1/R1和sox9b -F1/R1(表 1),以合成的cDNA第一链为模板进行sox9a和sox9b基因保守片断的扩增,PCR反应程序:95 ℃预变性5 min;94 ℃ 30 s,58 ℃ 40 s,72 ℃ 40 s,35个循环;72 ℃延伸10 min;4 ℃保存。PCR产物经1%的琼脂糖凝胶电泳检测后,送至上海生工生物工程有限公司测序。

|
表 1 暗纹东方鲀sox9a和sox9b基因克隆和相对表达定量引物 Tab.1 Cloning and relative expression quantitative primers of sox9a and sox9b genes in T. obscurus |
根据获得的保守片段序列设计特异性引物sox9a -F2、sox9a -F3、sox9b -F2、sox9b -F3(3'-RACE)和sox9a -R2、sox9a -R3、sox9b -R2、sox9b -R3(5'-RACE,表 1),用于RACE扩增sox9a和sox9b基因cDNA全长序列。使用SMART RACE试剂盒(TaKaRa)进行5'-RACE和3'-RACE的半巢式PCR扩增。PCR产物经琼脂糖凝胶电泳检测后,对目的条带切胶后进行纯化回收。切胶回收的PCR产物与pEASY-T3载体(全式金生物,北京)连接,采用热激法将5 μL连接产物转化至20 μL Trans1-T1感受态细胞(全式金生物,北京),37 ℃过夜培养,挑取单一克隆菌落。经PCR鉴定后,送至上海生工生物工程有限公司测序。
采用DNAstar软件将5'-RACE、保守片段和3'-RACE的测序结果进行拼接,获得暗纹东方鲀sox9a和sox9b基因的cDNA全长序列。同时将克隆的基因cDNA全长序列与暗纹东方鲀不同发育期性腺组织转录组测序的序列比较后发现一致,证明克隆获得的sox9基因cDNA全长序列准确可靠。
1.3 sox9a和sox9b基因的表达分析取适量暗纹东方鲀雌鱼和雄鱼各组织,提取总RNA,1%的琼脂糖凝胶电泳检测总RNA完整性,NanoDrop 2000测定总RNA浓度。以暗纹东方鲀雌鱼和雄鱼提取的不同组织总RNA为模板,按照PrimeScriptTM RT reagent Kit with gDNA Eraser(TaKaRa,大连)说明书合成cDNA第一链。
根据已获得的sox9a和sox9b基因序列,采用DNAMAN设计特异性引物sox9a -F/R和sox9b -F/R(表 1),以暗纹东方鲀雌鱼和雄鱼不同组织的cDNA第一链为模板,以β-actin为内参基因,采用Real-Time PCR方法在Line Gene 9600型实时荧光定量PCR仪(博日,杭州)上检测sox9a和sox9b基因在暗纹东方鲀不同组织中的相对表达量。反应程序:94 ℃ 30 s;94 ℃ 5 s,55 ℃ 34 s,40个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s。每个实验样品设置3个重复,实验步骤参考SYBRⓇPremix Ex TaqTM试剂盒(TaKaRa,大连)操作说明。
实时荧光定量PCR获得一系列Ct值,数据分析采用2-ΔΔCt法,用SPSS 16.0软件进行数据的统计分析,分析方法为单因素方差,即当P < 0.05时为差异显著,结果表示为平均值±标准误。
1.4 生物信息学分析将拼接的暗纹东方鲀sox9a和sox9b基因的全长序列在NCBI数据库中进行BLAST比对,推断其开放阅读框序列并进行同源性分析;使用DNAMAN软件进行编码蛋白质的氨基酸多重序列比对分析;利用MEGA 5.1软件构建基于邻位相接法(NJ法)的系统进化树,并采用1 000次自举检验分析(bootstrap analysis)评估进化树分支节点的置信度。
借助ExPASy ProtParam工具推断两个Sox9蛋白质的基本理化性质,包括蛋白质的相对分子质量、等电点、氨基酸组成和总平均亲水性等;使用NetPhos 3.1 Server程序预测磷酸化位点;使用NetNGlyc 1.0程序预测糖基化位点;利用SMART和PROSITE工具分别分析氨基酸序列的保守结构域及其功能域位点;借助SOPMA工具分别预测Sox9a和Sox9b蛋白质的二级结构;使用ExPASy ProtScale程序分析两个Sox9蛋白质的疏水性;采用SignalIP 4.1预测信号肽剪切位点;采用PSORT Ⅱ Prediction工具定位蛋白质的亚细胞;利用TMHMM Server 2.0程序分析跨膜区;借助SWISS-MODEL工具分别预测Sox9a和Sox9b蛋白质的三级结构。
2 结果与分析 2.1 暗纹东方鲀sox9a和sox9b基因克隆与序列特征暗纹东方鲀sox9a基因cDNA序列全长1 248 bp(不含多聚腺苷酸尾),包括5'非编码区297 bp,3'非编码区267 bp(不含多聚腺苷酸尾),开放阅读框684 bp,编码227个氨基酸。sox9b基因cDNA序列全长为1 941 bp(不含多聚腺苷酸尾),包括5'非编码区306 bp,3'非编码区165 bp(不含多聚腺苷酸尾),开放阅读框1 470 bp,编码489个氨基酸。
Sox9a蛋白相对分子量为25.66 ku,等电点为6.56,蛋白分子式为C1 112H1 747N331O351S9;成熟蛋白质中含有34个带负电荷的酸性氨基酸(Asp+Glu)和32个带正电荷的碱性氨基酸(Arg+Lys)。推导出的氨基酸序列包括16个丝氨酸(Ser)、4个苏氨酸(Thr)和3个酪氨酸(Tyr)等蛋白激酶磷酸化位点,1个N-糖基化位点,1个Pfam结构域(11~93位),1个HMG盒结构域(103~173位),见图 1a。二级结构中α-螺旋(h)占36.56%,β-折叠(e)占3.52%,β-转角(t)占6.17%,无规卷曲(c)占53.74%。而Sox9b蛋白相对分子量为53.74 ku,等电点为5.90,蛋白分子式为C2331H3599N675O767S12,成熟蛋白质中含有带负电荷的酸性氨基酸(Asp+Glu)和带正电荷的碱性氨基酸(Arg+Lys)分别为56和45个。推导出的氨基酸序列包括49个丝氨酸、13个苏氨酸和9个酪氨酸等蛋白激酶磷酸化位点,3个N-糖基化位点,1个Pfam结构域(22~93位),1个HMG盒结构域(103~173位)和1个低复杂度区保守结构域(231~243位,见图 1b)。二级结构中α-螺旋(h)占19.43%,β-折叠(e)占6.54%,β-转角(t)占1.43%,无规卷曲(c)占72.60%,这种二级结构组成可使得Sox9b蛋白质构象多样化,从而决定了Sox9b蛋白质功能的多样性。

|
起始密码子.ATG;终止密码子.TGA(*);潜在的N糖基化位点.●;磷酸化位点.○;单下划线为Pfam保守结构域;灰色阴影区为HMG盒结构域;双下划线为低复杂度保守结构域 Initiation codon is ATG; Termination codon is TGA(*); Potential N-glycosilation sites are indicated by closed black circle; Phosphorylation sites are represented by hollow circles; Pfam conservative domain is indicated by single underscore; grey shadows are respectively the HMG-box domain region; Conservative domains with low complexity is indicated by double underscores 图 1 暗纹东方鲀sox9a基因(a)和sox9b基因(b)cDNA及其编码的氨基酸序列 Fig. 1 The cDNA sequence and deduced amino acid sequence of sox9a gene (a) and sox9b gene (b) in T. obscurus |
Sox9a和Sox9b蛋白质均属于不稳定的亲水性蛋白,存在信号肽剪切位点的概率分别仅为0.1和0.101,因此推断两个Sox9蛋白质均不存在信号肽结构。亚细胞定位分析结果发现,Sox9a和Sox9b蛋白质定位于细胞核、细胞质、线粒体和内质网的概率为60.9%、26.1%、8.7%和4.3%,由此可推测两个Sox9蛋白质最有可能定位于细胞核,其次为细胞质。跨膜区分析结果显示,Sox9a蛋白和Sox9b蛋白均没有跨膜结构域,而且氨基酸均位于胞外,由此可推断暗纹东方鲀两个Sox9蛋白质可能是一种非跨膜蛋白,不发生跨膜运动。以上分析结果说明Sox9a和Sox9b蛋白均可能是一种非分泌性蛋白。除此之外,对2个Sox9蛋白进行三级结构同源建模。结果显示,Sox9a蛋白三级结构的构型(图 2a)与Sox9b蛋白三级结构的构型(图 2b)相似,均包括3个α螺旋,以L形聚集在一起,其中螺旋1和2形成短臂,螺旋3和N末端链形成长臂。
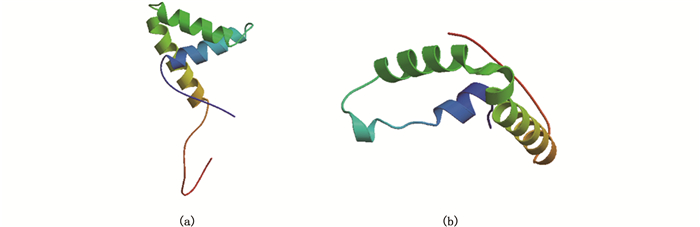
|
图 2 暗纹东方鲀Sox9a(a)和Sox9b(b)蛋白质的三级结构 Fig. 2 Tertiary structure of Sox9a (a) and Sox9b (b) protein in T. obscurus |
同源性分析结果显示:暗纹东方鲀sox9a与红鳍东方鲀(Takifugu rubripes,AY277964.1)、银鲫(Carassius gibelio,NM_131643.1)、斑马鱼(Danio rerio,DQ098685.1)、金鱼(Carassius auratus,KP255974.1)和银鳕鱼(Anoplopoma fimbria,KC112918.1)等5种sox9a核苷酸序列的相似性分别为99%、83%、83%、83%和82%;暗纹东方鲀sox9b与红鳍东方鲀(Takifugu rubripes,AY277965.1) sox9b、半滑舌鳎(Cynoglossus semilaevis,EU070762.1) sox9、军曹鱼(Rachycentron canadum,KX154794.1) sox9、银鳕鱼(Anoplopoma fimbria,KC112918.1) sox9a、黄鳝(Monopterus albus,AF378151.1) sox9b,青鳉(Oryzias latipes,NM_001105085.1) sox9、和虹鳟(Oncorhynchus mykiss,NM_001124270.1) sox9等核苷酸序列的相似性分别为98%、86%、85%83%、83%、81%和76%,同源性分析结果说明克隆得到的序列属于Sox家族,且与红鳍东方鲀同源性最高。氨基酸多重序列比对分析结果显示,哺乳动物或鱼类Sox9a和Sox9b氨基酸的HMG盒结构域均高度保守,除148位氨基酸残基处发生变异外其他序列完全相同,此外近N-末端的氨基酸序列也高度保守(图 3~4),表明这些保守区域可能与sox9a和sox9b基因生理功能的发挥有关。

|
序列中相同氨基酸残基用黑色背景表示,同源性超过75%用粉红色背景表示,同源性超过50%用浅蓝色背景表示 序列号:金鱼(CA)ABA41588, 半滑舌鳎(CS)GQ402461,斑马鱼(DR) AAH93134,三刺鱼(GA) AAQ62978,稀有 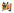 鲫(GR) AID21700,人(HS)AAP36231,猕猴(MM) AAK01651,鼠(M)AAH24958,青鳉(OL)AAX62152 Position with >50% similarity are shaded in light blue, Position with >75% similarity are shaded in pink, while completely conserved positions are shaded in black 鲫(GR) AID21700,人(HS)AAP36231,猕猴(MM) AAK01651,鼠(M)AAH24958,青鳉(OL)AAX62152 Position with >50% similarity are shaded in light blue, Position with >75% similarity are shaded in pink, while completely conserved positions are shaded in black Accession number: Carassius auratus (CA) ABA41588, Cynoglossus semilaevis (CS) GQ402461, Danio rerio (DR) AAH93134, Gasterosteus aculeatus(GA) AAQ62978, Gobiocyp risrarus(GR) AID21700, Homo sapiens(HS)AAP36231, Macaca mulatta(MM) AAK01651, Mus musculus (M)AAH24958, Oryzias latipes (OL) AAX62152 图 3 暗纹东方鲀Sox9a与其他物种氨基酸序列比对图 Fig. 3 Multiple alignment of the deduced amino acid sequence of T. obscurus Sox9a with the corresponding sequences from other species |
|
序列中相同氨基酸残基用黑色背景表示,同源性超过75%用粉红色背景表示,同源性超过50%用浅蓝色背景表示 序列号:单丽鱼(CM) ANG60855,斑马鱼(DR) AAH67133,三刺鱼(GA) AAQ62979,人(HS) AAP36231,猕猴(MM) AAK01651,鼠(M) AAH24958,非洲齿鲤(NF)XP_015801041,银大马哈鱼(OK)XP_020309628,青鳉(OL)AAX62151 Position with >50% similarity are shaded in light blue, Position with >75% similarity are shaded in pink, while completely conserved positions are shaded in black Accession number: Cichla monoculus (CM) ANG60855, Danio rerio (DR) AAH67133, Gasterosteus aculeatus (GA) AAQ62979, Homo sapiens(HS)AAP36231, Macaca mulatta (MM) AAK01651, Mus musculus (M)AAH24958, Nothobranchius furzeri (NF) XP_015801041, Oncorhynchus kisutch (OK) XP_020309628, Oryzias latipes (OL) AAX62151 图 4 暗纹东方鲀Sox9b与其他物种氨基酸序列比对图 Fig. 4 Multiple alignment of the deduced amino acid sequence of T. obscurus Sox9b with the corresponding sequences from other species |
基于邻位相接法(neighbour-jopning,NJ法)构建sox9基因编码氨基酸序列的系统进化树,结果表明,暗纹东方鲀Sox9的系统进化树可分为两个大支:哺乳类和两栖类聚为一大支,所有鱼类聚为另一大支,其中鱼类这一大支又分为两个分支,暗纹东方鲀Sox9a和Sox9b的进化树分别位于不同的鱼类分支中,且均与同属的红鳍东方鲀紧密聚为一个小分支,亲缘关系最近,而与非洲爪蟾、鼠和人等较高等脊椎动物的亲缘关系最远。这表明暗纹东方鲀sox9基因的系统进化关系与传统的物种进化地位基本一致(图 5)。

|
图 5 不同物种Sox9氨基酸序列的系统进化树 Fig. 5 Phylogenetic tree of Sox9 amino acid sequence from different species |
荧光定量PCR结果显示,sox9a基因普遍存在于雌鱼和雄鱼的各个组织中(图 6)。比较sox9a基因在雌鱼不同组织中的表达水平,可以发现:sox9a基因在雌鱼下丘脑中的表达量最高,与其他组织均有显著性差异(P < 0.05);除此之外,sox9a基因在雌鱼脑、垂体、肝、胆、肠、肌肉、眼和胃等组织中表达水平较高。比较sox9a基因在雄鱼不同组织中的表达水平,可以发现sox9a基因在雄鱼肌肉中表达水平最高,与其他组织均有显著性差异(P < 0.05)。比较sox9a基因在雌雄个体相同组织中的表达水平,可以发现sox9a基因在雌鱼下丘脑、肝、胆、肠、眼和胃组织中的表达量明显高于雄鱼,仅在雌鱼性腺和肌肉组织中的表达量明显低于雄鱼。

|
Hy.下丘脑; B.脑; P.垂体; G.性腺; L.肝; Ga.胆; I.肠; M.肌肉; E.眼; H.心脏; S.胃 雌鱼不同组织的显著性差异用大写字母表示,雄鱼不同组织的显著性差异用小写字母表示 Hy.hypothalamus; B.brain; P.pituitary; G.gonad; L.liver; Ga.gallbladder; I.intestine; M.muscle; E.eye; H.heart; S.stomach The significant differences of female tissues are shown in capital letters, and the significant differences in male tissues are shown in lower-case letters 图 6 暗纹东方鲀sox9a mRNA的组织表达 Fig. 6 Expression of sox9a mRNA in various tissues of T. obscurus |
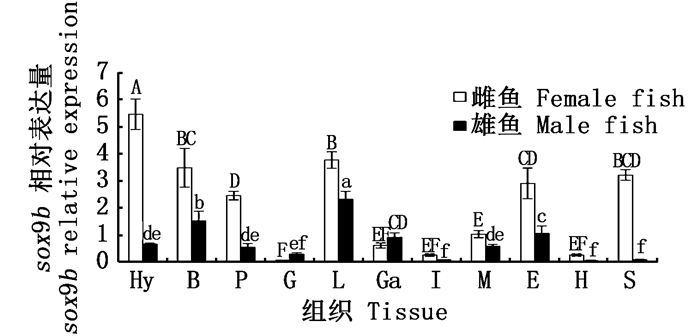
荧光定量PCR结果显示,sox9b基因普遍存在于雌鱼和雄鱼的各个组织中(图 7)。比较sox9b基因在雌鱼不同组织中的表达水平,可以发现:sox9b基因在雌鱼的下丘脑中表达量最高,与其他组织均有显著性差异(P < 0.05);除此之外,sox9b基因在雌鱼脑、垂体、肝、眼和胃等组织中表达水平较高。比较sox9b基因在雄鱼不同组织中的表达水平,可以发现:sox9b基因在雄鱼肝中表达水平最高,与其他组织均有显著性差异(P < 0.05);除此之外,sox9b基因在雄鱼下丘脑、脑、垂体、胆、肌肉和眼等组织中表达水平较高。比较sox9b基因在雌雄鱼个体相同组织中的表达水平,可以发现:sox9b基因在下丘脑、脑、垂体、肝、眼和胃等组织中的表达具有明显的性别差异性,除性腺和肌肉以外的组织中,雌鱼sox9b基因的表达水平要明显高于雄鱼。
|
Hy.下丘脑; B.脑; P.垂体; G.性腺; L.肝; Ga.胆; I.肠; M.肌肉; E.眼; H.心脏; S.胃 雌鱼不同组织的显著性差异用大写字母表示,雄鱼不同组织的显著性差异用小写字母表示 Hy.hypothalamus; B.brain; P.pituitary; G.gonad; L.liver; Ga.gallbladder; I.intestine; M.muscle; E.eye; H.heart; S.stomach The significant differences of female tissues are shown in capital letters, and the significant differences in male tissues are shown in lower-case letters 图 7 暗纹东方鲀sox9b mRNA的组织表达 Fig. 7 Expression of sox9b mRNA in various tissues of T. obscurus |
sox9是一种含有高泳动组合基序的转录调节因子,同时也是一种与哺乳动物决定雄性性别直接相关的基因。研究表明,在鱼类基因组的进化过程中由于基因组的复制导致sox9基因内含子的剪切方式不同,从而产生多种亚型。到目前为止已报道的sox9转录形式分为两种,分别为sox9a (也称为sox9a 1)和sox9b (也称为sox9a 2)。大多数鱼类主要存在sox9a和sox9b这两种亚型,如红鳍东方鲀[26]、斑马鱼[19]和青鳉[20]等。TAKASE等[27]从成年皱皮蛙(Rana rugosa)睾丸中分离出sox9基因的两种异构体亚型sox9a和sox9b,并发现sox9a含有完整HMG盒结构域,具有转录激活子功能,而sox9b不含HMG盒结构域及近N-端氨基酸序列,其编码的氨基酸仅为sox9a编码氨基酸序列的55%,不具有转录因子活性,因此推测sox9b基因可能是sox9a基因剪切包括HMG盒结构域在内的第一个外显子后的产物[27]。暗纹东方鲀克隆获得的sox9a基因大小与皱皮蛙sox9b基因的大小一致,但结构不同,区别在于暗纹东方鲀sox9a基因编码的氨基酸序列含有完整的HMG盒但缺失C-末端序列;而暗纹东方鲀克隆获得的sox9b基因大小及结构与皱皮蛙的sox9a基因相同。由此可以看出sox9基因转录的形式及其结构具有物种的差异性。
3.2 暗纹东方鲀Sox9蛋白功能域分析Sox家族具有转录因子典型的结构特征:HMG盒DNA结合结构域和转录激活结构域。HMG盒结构域由1个特征性基序、1个核定位信号(NLS1)和1个核输出信号(NES)等3部分组成,此外sox9基因在近C-末端也存在1个核定位信号NLS2 [28],其中特征性基序的序列为AQAARRKL,核定位信号NLS1和NLS2序列分别为VKRPMNAFMVWAQAARRK和RRRK,核输出信号序列为LSKTLGKLWRLL[29]。有一种蛋白并非是一直位于核内,而是需要经常往返于核质和细胞质之间,这类穿梭蛋白既含有核定位信号,同时又含有核输出信号,由此可知Sox9蛋白是一种同时含有NLS和NES的穿梭蛋白。
暗纹东方鲀克隆获得的sox9a和sox9b基因作为sox基因家族的一员,具有家族典型的HMG盒结构域、1个特征性基序、2个核定位信号(NLS1和NLS2)和1个核输出信号(NES)等结构,其中特征性基序、核定位信号NLS1和核输出信号NES位于HMG盒结构域内,核定位信号NLS2位于HMG盒结构域外,且这些结构域的位置与金钱鱼(Scatophagus orgus)和泰国斗鱼(Betta splendens)的位置完全相同[29-30],这说明HMG盒在不同物种中均十分保守。除了这些结构以外,sox9基因在近C-末端1/3处存在1个反式转录激活结构域(transactivation activation domain,TA域),据报道人Sox9蛋白在C末端有2个富含脯氨酸-谷氨酸-丙氨酸(Pro-Glu-Ala,PQA)和脯氨酸-谷氨酸-丝氨酸(Pro-Glu-Ser,PQS)转录激活域,这两个结构域在进化上相当保守,因此推测Sox9蛋白因为含有HMG盒DNA结合结构域和反式转录激活结构域才具有转录因子活性[31],若Sox9蛋白缺少TA域,可能会导致丢失转录激活能力[19]、无法发育为雄性个体[32]或性别逆转[33],然而TA域在哺乳动物中较为保守但是在大多数鱼类的C-末端是不保守的,因此鱼类sox9基因转录激活的机制可能与哺乳动物有所不同,需要其他保守域与TA域一起参与转录激活过程[33]。暗纹东方鲀sox9a基因编码的氨基酸序列具有完整的HMG结构域却丢失了C-末端的转录激活结构域,而sox9b基因编码的氨基酸序列虽然不存在PQA区但具有完整的HMG结构域和PQS区,且在近C-末端还存在几个高度保守的区域,可能代替PQA区的作用并与PQS区一起参与转录因子活性的激活过程,故此推测暗纹东方鲀Sox9a蛋白可能不具有转录因子活性,而Sox9b蛋白具有转录因子活性。
3.3 暗纹东方鲀sox9a和sox9b基因的组织表达分析在通常情况下,目的基因的组织表达模式能够在一定程度上反映该基因的生物学功能。荧光定量结果显示暗纹东方鲀sox9a和sox9b基因的mRNA均在雌鱼下丘脑中表达量最高,这说明暗纹东方鲀sox9a和sox9b基因在神经系统调控方面可能发挥十分重要的作用;在精巢中有少量表达,但在卵巢中不表达,这种表达情况与半滑舌鳎[24]、斑马鱼[19]、青鳉[20]、三倍体鲫鱼[34]和胡子鲶[35]的表达情况基本一致,这说明暗纹东方鲀sox9a和sox9b基因可能通过神经系统调控间接参与精巢的发育过程,除此之外sox9a基因在其他组织如脑、垂体、肝、胆、肠、肌肉、眼和胃中也有低等水平的表达;sox9b基因在下丘脑、脑、垂体、肝、眼和胃等组织中的表达具有明显的性别差异性,雌鱼中sox9b基因的表达水平要明显高于雄鱼,由此可知暗纹东方鲀sox9a和sox9b基因的功能比较复杂,参与了多种组织的发育和功能发挥,但具体的作用机制目前为止还尚未有文献报道过,其基因功能有待于进一步的研究和探索。sox9a和sox9b基因的表达模式除上述特点外,还有另外两种情况:一种是既在精巢中表达又在卵巢中表达,如红鳍东方鲀[26]和黄鳝[22]中sox9a基因既在精巢中表达又在卵巢中表达,鲤鱼[23]、孔雀花鳉[25]和黄鳝[22]中sox9b基因既在精巢中表达又在卵巢中表达;另一种是sox9b基因仅在卵巢中表达,如红鳍东方鲀[26]和斑马鱼[19]等。这说明sox9a和sox9b基因不仅与精巢发育有关,还有可能参与卵巢的发育,这种性腺表达的差异可能与鱼的种类和发育时期有关。由暗纹东方鲀的组织表达谱可知sox9a和sox9b基因在雌鱼和雄鱼中的作用具有很大的区别,主要表现在神经调控、性腺及其他组织发育这3个方面,但具体的作用机制还有待于进一步地研究。
4 结论本实验首次克隆得到了暗纹东方鲀sox9a和sox9b基因的cDNA全长序列,并利用生物信息学方法分析了其序列结构、蛋白质的结构特点、相关的生物信息学特征以及基因的组织表达水平,为深入探索sox9a和sox9b基因在暗纹东方鲀性腺发育和性别分化过程中的生物学功能奠定了重要基础,也为今后实现河豚属鱼类良种人工繁育中的性别控制提供重要参考。
| [1] |
华元渝, 顾志峰, 邹宏海, 等. 暗纹东方鲀生殖洄游期体内毒素分布规律[J]. 水利渔业, 2002, 22(2): 12-14. HUA Y Y, GU Z F, ZOU H H, et al. Distribution of toxins in Takifugu obscurus during reproductive migration[J]. Water Conservancy Fishery, 2002, 22(2): 12-14. DOI:10.3969/j.issn.1003-1278.2002.02.007 |
| [2] |
张娜, 韦芬, 鲍宝龙.星点东方鲀及共生细菌河豚毒素的提取与检测[J]. 2017, 26(6): 801-807. ZHANG N, WEI F, BAO B L. Extraction and detection of tetrodotoxin in Takifugu niphobles and it's symbiotic bacterial[J]. Journal of Shanghai Ocean University, 2017, 26(6):801-807. |
| [3] |
张迪, 杨正勇, 张英丽. 中国河鲀养殖产业发展现状与发展对策[J]. 科学养鱼, 2017(12): 1-3. ZHANG D, YANG Z Y, ZHANG Y L. Current situation and development strategy of puffer fish culture industry in China[J]. Science Fish Farming, 2017(12): 1-3. |
| [4] |
刘延正, 徐承旭. 河鲀"解禁"规模化养殖将成主流[J]. 水产科技情报, 2017, 44(5): 284-285. LIU Y Z, XU C X. Large-scale cultivation of puffer fish will become the mainstream[J]. Fisheries Science & Technology Information, 2017, 44(5): 284-285. |
| [5] |
华元渝, 李廷友, 邹宏海. 养殖型暗纹东方鲀生长与发育特性[J]. 水产学报, 2004, 28(1): 8-14. HUA Y Y, LI T Y, ZOU H H. Growth and development characteristics of captive Takifugu obscurus[J]. Journal of Fisheries of China, 2004, 28(1): 8-14. |
| [6] |
王丽雅, 陶宁萍. 养殖的雄性暗纹东方鲀精巢营养分析及评价[J]. 营养学报, 2012, 34(4): 406-408. WANG L Y, TAO N P. Analysis and evaluation of the nutritional composition of the testes of farmed male pufferfish (Takifugu obscurus)[J]. Acta Nutrimenta Sinica, 2012, 34(4): 406-408. |
| [7] |
崔子龙, 常卫华, 王娟红. 反刍动物性控基因SRY最新研究进展[J]. 中国草食动物科学, 2018, 38(1): 53-56. CUI Z L, CHANG W H, WANG J H. Current advances in sex control SRY gene of ruminant[J]. China Herbivore Science, 2018, 38(1): 53-56. DOI:10.3969/j.issn.2095-3887.2018.01.013 |
| [8] |
张秀华, 井长勤. 哺乳动物性别决定基因的研究进展[J]. 新乡医学院学报, 2006, 23(6): 638-640. ZHANG X H, JING C Q. Progress of study on sex-determining gene of the mammal[J]. Journal of Xinxiang Medical College, 2006, 23(6): 638-640. DOI:10.3969/j.issn.1004-7239.2006.06.040 |
| [9] |
冯爽, 隋晓栋, 李丹, 等. sox9在临床常见疾病中的研究进展[J]. 中华临床医师杂志(电子版), 2016, 24(10): 3808-3812. FENG S, SUI X D, LI D, et al. Research development of sox9 in clinical common diseases[J]. Chinese Journal of Clinicians (Electronic Edition), 2016, 24(10): 3808-3812. |
| [10] |
王正江, 杨鸿梅. 结直肠癌中sox9的表达及临床意义[J]. 实用临床医药杂志, 2017, 21(1): 198-199. WANG Z J, YANG H M. Expression of sox9 in colorectal cancer and its clinical significance[J]. Journal of Clinical Medicine in Practice, 2017, 21(1): 198-199. |
| [11] |
陈维, 王昌留, 王磊. sox9基因的结构、功能及进化[J]. 生命的化学, 2012, 32(4): 310-315. CHEN W, WANG C L, WANG L. sox9 gene:structure, function and evolution[J]. Chemistry of Life, 2012, 32(4): 310-315. |
| [12] |
SEYMOUR P A, FREUDE K K, DUBOIS C L, et al. A dosage-dependent requirement for sox9 in pancreatic endocrine cell formation[J]. Developmental Biology, 2008, 323(1): 19-30. DOI:10.1016/j.ydbio.2008.07.034 |
| [13] |
唐君仪, 周冠楠, 谢志芳. 转录因子sox9调控软骨发育的研究进展[J]. 医学研究杂志, 2013, 42(9): 19-20, 164. TANG J Y, ZHOU G N, XIE Z F. Advances in the regulation of cartilage development by transcription factor sox9[J]. Journal of Medical Research, 2013, 42(9): 19-20, 164. DOI:10.3969/j.issn.1673-548X.2013.09.007 |
| [14] |
秦宏敏, 韩会峰, 沙广钊, 等. 软骨肉瘤相关基因sox9 (siRNA)表达质粒的构建鉴定以及对肿瘤细胞生长和凋亡的影响[J]. 中国肿瘤临床, 2008, 35(3): 158-161. QIN H M, HAN H F, SHA G Z, et al. Construction and identification of a siRNA expression plasmid targeting sox9 and its effect on the growth and apoptosis of human chondrosarcoma cells[J]. Chinese Journal of Clinical Oncology, 2008, 35(3): 158-161. DOI:10.3969/j.issn.1000-8179.2008.03.012 |
| [15] |
董琬如, 余莉莉, 陈明会, 等. sox9基因变异引起的性别发育异常研究进展[J]. 中国计划生育学杂志, 2016, 24(4): 270-273. DONG W R, YU L L, CHEN M H, et al. Advances in sex dysplasia caused by sox9 gene variation[J]. Chinese Journal of Family Planning, 2016, 24(4): 270-273. |
| [16] |
BARRIONUEVO F, BAGHERI-FAM S, KLATTIG J, et al. Homozygous inactivation of sox9 causes complete XY sex reversal in mice[J]. Biology of Reproduction, 2006, 74(1): 195-201. DOI:10.1095/biolreprod.105.045930 |
| [17] |
BISHOP C E, WHITWORTH D J, QIN Y J, et al. A transgenic insertion upstream of sox9 is associated with dominant XX sex reversal in the mouse[J]. Nature Genetics, 2000, 26(4): 490-494. DOI:10.1038/82652 |
| [18] |
VIDAL V P I, CHABOISSIER M C, DE ROOIJ D G, et al. sox9 induces testis development in XX transgenic mice[J]. Nature Genetics, 2001, 28(3): 216-217. DOI:10.1038/90046 |
| [19] |
CHIANG E F L, PAI C I, WYATT M, et al. Two sox9 genes on duplicated zebrafish chromosomes:expression of similar transcription activators in distinct sites[J]. Developmental Biology, 2001, 231(1): 149-163. DOI:10.1006/dbio.2000.0129 |
| [20] |
KLÜVER N, KONDO M, HERPIN A, et al. Divergent expression patterns of sox9 duplicates in teleosts indicate a lineage specific subfunctionalization[J]. Development Genes and Evolution, 2005, 215(6): 297-305. DOI:10.1007/s00427-005-0477-x |
| [21] |
俞菊华, 李建林, 曹丽萍, 等. 黄颡鱼sox9基因的分离及分析[J]. 农业生物技术学报, 2005, 13(5): 620-623. YU J H, LI J L, CAO L P, et al. Isolation and analysis of sox9 derived from yellow catfish (Pelteobagrus fulvidraco)[J]. Journal of Agricultural Biotechnology, 2005, 13(5): 620-623. DOI:10.3969/j.issn.1674-7968.2005.05.016 |
| [22] |
ZHOU R J, LIU L, GUO Y Q, et al. Similar gene structure of two sox9a genes and their expression patterns during gonadal differentiation in a teleost fish, rice field eel (Monopterus albus)[J]. Molecular Reproduction and Development, 2003, 66(3): 211-217. DOI:10.1002/mrd.10271 |
| [23] |
杜启艳, 常重杰, 王凤羽, 等. 鲤鱼中sox9b基因的克隆和表达[J]. 实验生物学报, 2005, 38(5): 397-403. DU Q Y, CHANG Z J, WANG F Y, et al. The cloning and expression analysis of sox9b in Cyprinus carpio[J]. Acta Biologiae Experimentalis Sinica, 2005, 38(5): 397-403. DOI:10.3321/j.issn:1673-520X.2005.05.004 |
| [24] |
DONG X L, CHEN S L, JI X S, et al. Molecular cloning, characterization and expression analysis of sox9a and Foxl2 genes in half-smooth tongue sole (Cynoglossus semilaevis)[J]. Acta Oceanologica Sinica, 2011, 30(1): 68-77. DOI:10.1007/s13131-011-0092-9 |
| [25] |
SHEN X Y, CUI J Z, GONG Q L, et al. Cloning of the full-length coding sequence and expression analysis of sox9b in guppy (Poecilia reticulata)[J]. Fish Physiology and Biochemistry, 2007, 33(3): 195-202. DOI:10.1007/s10695-007-9131-z |
| [26] |
SHEN X Y, CUI J Z, YANG G P, et al. Expression detection of Dmrts and two sox9 genes in Takifugu rubripes (Tetraodontidae, Vertebrata)[J]. Journal of Ocean University of China, 2007, 6(2): 182-186. DOI:10.1007/s11802-007-0182-7 |
| [27] |
TAKASE M, NOGUCHI S, NAKAMURA M. Two sox9 messenger RNA isoforms:isolation of cDNAs and their expression during gonadal development in the frog Rana rugosa[J]. FEBS Letters, 2000, 466(2/3): 249-254. |
| [28] |
SEKIDO R, LOVELL-BADGE R. Sex determination involves synergistic action of SRY and SF1 on a specific sox9 enhancer[J]. Nature, 2008, 453(7197): 930-934. DOI:10.1038/nature06944 |
| [29] |
陈建华, 何毛贤, 牟幸江, 等. 金钱鱼sox9 cDNA克隆及其表达分析[J]. 动物学杂志, 2015, 50(1): 93-102. CHEN J H, HE M X, MOU X J, et al. cDNA cloning and mRNA expression analysis of sox9 in Scatophagus argus[J]. Chinese Journal of Zoology, 2015, 50(1): 93-102. |
| [30] |
贺超, 洪广, 吴静娴, 等. 泰国斗鱼sox9基因的克隆及组织表达研究[J]. 安徽农业科学, 2017, 45(8): 151-155, 179. HE C, HONG G, WU J X, et al. Study on cloning and tissue expression of sox9 in Betta splendens[J]. Journal of Anhui Agricultural Sciences, 2017, 45(8): 151-155, 179. DOI:10.3969/j.issn.0517-6611.2017.08.051 |
| [31] |
QIN Y J, KONG L K, POIRIER C, et al. Long-range activation of sox9 in Odd Sex (Ods) mice[J]. Human Molecular Genetics, 2004, 13(12): 1213-1218. DOI:10.1093/hmg/ddh141 |
| [32] |
裴开颜, 王介东. Y染色体性别决定区(Sry):性别决定关键开关[J]. 生殖医学杂志, 2012, 21(4): 400-405. PEI K Y, WANG J D. Sex-determining region of Y-chromosome (Sry):master switch of sex determination[J]. Journal of Reproductive Medicine, 2012, 21(4): 400-405. DOI:10.3969/j.issn.1004-3845.2012.04.023 |
| [33] |
SÜDBECK P, SCHMITZ M L, BAEUERLE P A, et al. Sex reversal by loss of the C-terminal transactivation domain of human sox9[J]. Nature Genetics, 1996, 13(2): 230-232. DOI:10.1038/ng0696-230 |
| [34] |
GUO X H, YAN J P, LIU S J, et al. Isolation and expression analyses of the sox9a gene in triploid Crucian carp[J]. Fish Physiology and Biochemistry, 2010, 36(2): 125-133. DOI:10.1007/s10695-008-9209-2 |
| [35] |
RATHER M A, BHAT I A, GIREESH-BABU P, et al. Molecular characterization of kisspeptin gene and effect of nano-encapsulted kisspeptin-10 on reproductive maturation in Catla catla[J]. Domestic Animal Endocrinology, 2016, 56: 36-47. DOI:10.1016/j.domaniend.2016.01.005 |
2. Key Laboratory for Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, Shandong, China;
3. Qingdao Key Laboratory of Fish Seed Engineering and Biotechnology, Qingdao 266071, Shandong, China;
4. Neijiang Normal University, Neijiang 641100, Sichuan, China;
5. Jiangsu Zhongyang Group Company Limited, Hai'an 226600, Jiangsu, China
 2019,
Vol. 28
2019,
Vol. 28


