2. 中国科学院水生生物研究所 淡水生态与生物技术国家重点实验室, 湖北 武汉 430072;
3. 广东海大集团股份有限公司昇龙生物科技有限公司, 越南 隆安 850000
蛋白质是水产饲料最主要的营养成分,是水产养殖动物细胞结构构成物质来源、生物活性物质组成成分,更是决定饲料成本高低的关键因素[1]。不同种类的海水鱼对饲料蛋白的需求差异很大。大菱鲆(Scophthalmus maximus L.)的饲料蛋白质最适需求量(质量分数)为57%[3]、许氏平鲉(Sebastes schlegelii)为50%[4]、牙鲆(Paralichthys olivaceus)为45%~50%[5-6]、
卵形鲳鲹(Trachinotus ovatus),俗称金鲳,其生长速度快、抗病力强、肉质细嫩、风味鲜美、营养价值高,已经成为我国华南地区最重要的海水养殖经济鱼类。在卵形鲳鲹实际养殖生产操作中,中成鱼阶段(体质量>100 g/只的个体)是饲料使用的主体阶段,且一般而言,动物在不同生长阶段下对饲料中蛋白质和脂肪的需要量存在差异。因此,以中成鱼阶段卵形鲳鲹为研究对象的蛋白质和脂肪需求研究具有非常重要的经济意义和研究意义。目前为止,关于卵形鲳鲹的饲料蛋白质和脂肪需求量研究比较匮乏,主要集中在幼鱼研究中,研究结果差异较大,蛋白质需求在40%~49%之间波动,难以统一[2, 15, 17-18]。尽管有研究比较了饲料中不同脂肪水平对卵形鲳鲹幼鱼生长性能和饲料利用情况的影响[15],但缺乏脂肪需求量系统性研究。中成鱼阶段卵形鲳鲹对饲料中蛋白质和脂肪的需求量研究仍处于空白状态,亟待开展系统地研究。
本文首先通过配置蛋白质梯度实验饲料,饱食饲喂卵形鲳鲹,开展中成鱼阶段卵形鲳鲹对饲料中蛋白质的需求量研究;在获得蛋白质需求量的基础上,再通过配置脂肪梯度实验饲料,开展中成鱼阶段卵形鲳鲹对饲料中脂肪的需求量研究,为卵形鲳鲹营养参数的完善提供理论基础和依据。
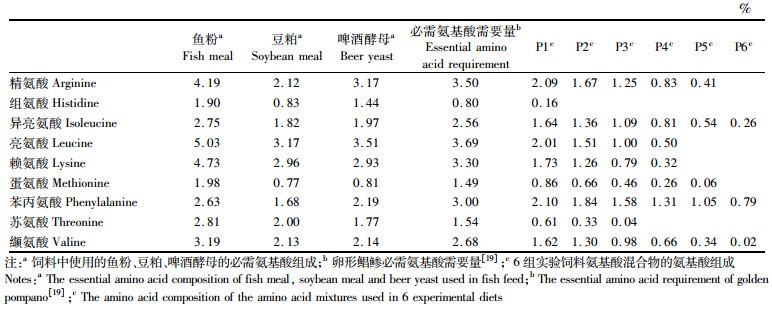
1 材料与方法 1.1 配方设计与饲料制作蛋白质需求研究:在以鱼粉、豆粕、啤酒酵母为主要蛋白源,以鱼油和大豆卵磷脂为脂肪源的基础饲料(表 1)中,添加不同水平的鱼粉,设计6组等脂等能的蛋白梯度实验饲料,并分别命名为P1、P2、P3、P4、P5和P6处理组,同时补充晶体氨基酸以满足卵形鲳鲹对必需氨基酸的需求(表 2)[19]。

|
表 1 实验饲料配方及营养成分组成 Tab.1 Formulation and proximate composition of experimental diets |
|
表 2 饲料原料及氨基酸混合物的必需氨基酸组成 Tab.2 Essential amino acid composition of feed ingredients and amino acid mixtures |
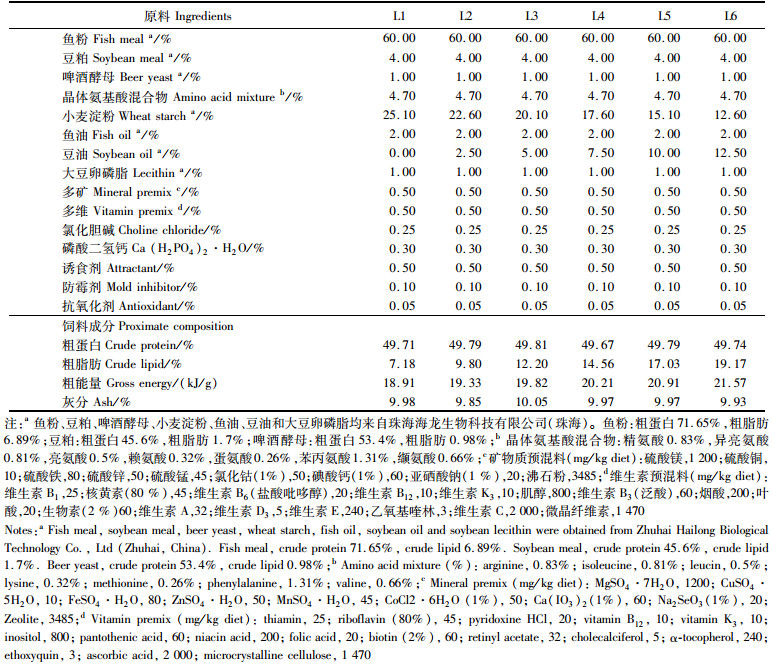
脂肪需求研究:在以鱼粉、豆粕、啤酒酵母为主要蛋白源,以鱼油、豆油和大豆卵磷脂为脂肪源的基础饲料(表 3)中,补充晶体氨基酸以满足卵形鲳鲹对必需氨基酸的需求[19],添加不同水平的豆油,设计6组等氮脂肪梯度实验饲料,分别命名为L1、L2、L3、L4、L5和L6处理组。
|
表 3 实验饲料配方及营养成分组成 Tab.3 Formulation and proximate composition of experimental diets |
实验饲料制作之前,用粉碎机将所有的原料超微粉碎并过80目筛。按照实验配方表,除鱼油和大豆卵磷脂之外,将其他原料按照逐级放大的原则混合均匀,然后将大豆卵磷脂溶解到鱼油中,并用手将油脂颗粒搓散进入饲料原料中,最终加入混合机中混合均匀。向混合均匀的饲料原料中加入蒸馏水,和成饲料面团,将面团放入牧羊双螺杆挤压机(MY56×2A)制成挤压浮性膨化饲料。将饲料颗粒放置在风热烘干机中,用50 ℃恒温下热风干8 h,将风干后的饲料置于双层塑料袋中,并保存在-20 ℃冰箱中。
1.2 实验样本实验鱼苗购自海南三亚的卵形鲳鲹育苗场,为当年该育苗场人工培育的同一批卵形鲳鲹苗种。饲喂养殖实验在广东阳江大沟养殖基地高位池网箱(长×宽×深=2 m×2 m×2 m)中进行。实验开始之前,用商业饲料(广州容川金鲳料4#料)暂养卵形鲳鲹一段时间,以使实验鱼适应养殖环境。
蛋白质需求研究和脂肪需求研究的每个养殖实验正式开始之前,将实验鱼禁食24 h。每个实验,各自从暂养网箱中随机挑选1 920尾大小匀称、体格健壮的实验鱼[蛋白质需求研究用实验鱼的初始平均体质量为(121.45±0.22)g;脂肪需求研究用实验鱼的初始平均体质量为(121.33±0.23)g],并随机分配于两个实验各自的养殖网箱,每个网箱实验鱼数目相同,为80尾。两个实验分别将实验网箱随机分组,并分别投喂两个实验的6种不同实验饲料,每个处理4个重复。
1.3 养殖实验管理饲喂养殖实验持续12周。每天分别在6:30和17:30进行投喂,达到表观饱食后,捞取残饵并称量。每天统计每个网箱的摄食量、残饵量、死鱼数目和质量、水温等。养殖期间保持水温28~34 ℃,盐度20~25,溶氧>7 mg/L,pH 7.5~8.0,氨氮质量浓度 < 0.4 mg/L,亚硝酸盐质量浓度 < 0.1 mg/L。
1.4 实验取样实验结束后,卵形鲳鲹禁食24 h,用丁香酚(体积比为1:10 000,99%纯度,国药集团上海化学试剂有限公司公司)麻醉,对每个网箱中的鱼进行计数、称量,计算生长数据。每个网箱随机取3尾鱼,保存于-20 ℃冰箱中,用于分析体组成。每个网箱随机选择3尾鱼,分别测量其体质量、体长用以计算肥满度,然后在冰上解剖,取出内脏团和肝脏并称量,分别计算脏体比和肝体比。
1.5 体常规检测鱼体和饲料常规成分分析均采用AOAC法。其中,105 ℃烘干恒重法(72 h)测定水分含量;采用FOSS公司2300型蛋白质自动分析仪(瑞典),用凯氏定氮法测定粗蛋白含量;采用BUCHI公司36680型脂肪抽提仪(瑞士),用索氏抽提法分析粗脂肪含量;箱式电阻炉550 ℃灼烧法(16 h)测定粗灰分含量;采用氧弹测热仪(Parr 1281,美国)测定总能。
1.6 计算公式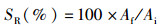 (1)
(1)
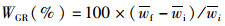 (2)
(2)
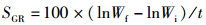 (3)
(3)
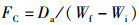 (4)
(4)
 (5)
(5)
 (6)
(6)
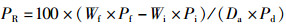 (7)
(7)
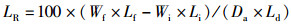 (8)
(8)
 (9)
(9)
式中:SR为存活率,%;WGR为增重率,%;SGR为特定生长率(specific growth rate),%/d;FC为饲料系数(料比);FI为摄食率,%/d;PER为蛋白质效率,%;PR为蛋白质沉积,%;LR为脂肪沉积,%;ER为能量沉积,%;Ai和Af分别是初始和终末的鱼体数量;wi和wf分别是初始和终末的平均鱼体体质量,g;Wi和Wf分别是初始和终末的鱼体总量,g;t是终末养殖天数,d;Da是总摄入饲料量,g(干物质);Pi、Pf和Pd分别是初始鱼体、终末鱼体和饲料(干物质)的蛋白质质量分数,%;Li、Lf和Ld分别是初始鱼体、终末鱼体和饲料(干物质)的脂肪质量分数,%;Ei、Ef和Ed分别是初始鱼体、终末鱼体和饲料(干物质)的能量,kJ/g。
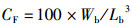 (10)
(10)
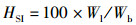 (11)
(11)
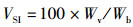 (12)
(12)
式中:CF为肥满度,%;HSI为肝体比,%;VSI为脏体比,%;Wb代表鱼体质量,g;Wl和Wv分别代表肝脏和内脏重量,g;Lb代表鱼体长,cm。
1.7 数据分析采用Shapiro-Wilk W非参数检验的拟合优度检验和Bartlett检验,分别检验卵形鲳鲹生长数据、体组成和形体指数数据的正态分布和方差齐性。当数据符合近似正态分布时,采用SPSS 16.0软件,通过单因素方差分析对实验数据进行检验,当处理之间差异显著时(P<0.05),用Tukey进行多重比较分析,所有数据以平均值±标准误的形式表示。
采用二次曲线模型和折线模型分别估计基于SGR和FC的饲料蛋白质最适需求量和脂肪最适需求量,比较拟合模型的拟合系数(R2):蛋白质最适需求量实验使用折线模型获得最大R2值(P<0.01),脂肪最适需求量实验使用折线模型获得最大R2值(P<0.01)。因此,采用折线模型估计饲料蛋白质和脂肪的最适需求量。
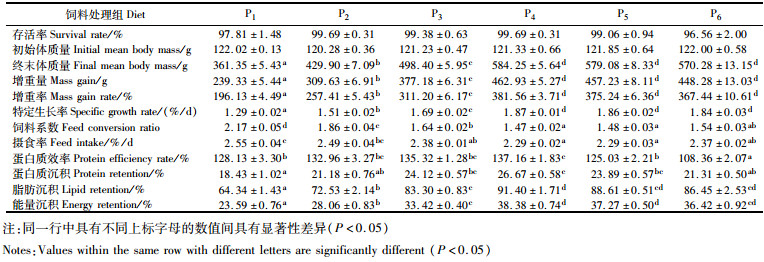
2 结果 2.1 蛋白质需求研究 2.1.1 生长性能饲料中添加不同浓度的蛋白质对卵形鲳鲹的存活率有显著的影响(表 4,P>0.05)。随着饲料中蛋白质含量的升高,卵形鲳鲹的终末体质量、增重率、特定生长率呈现先显著升高(P<0.05)而后逐渐平稳的趋势(P>0.05),其中P4、P5和P6处理组的生长性能均显著高于P1、P2和P3处理组(P<0.05)。饲料系数和摄食率随着饲料中蛋白质浓度的升高呈现先显著降低(P<0.05)而后略微升高的趋势(P>0.05),其中P4和P5处理组的卵形鲳鲹的饲料系数和摄食率显著低于(P<0.05)或低于(P>0.05)P1、P2和P3处理组。随着饲料中蛋白质添加量的升高,卵形鲳鲹的蛋白质效率、蛋白质沉积、脂肪沉积和能量沉积呈现先升高后降低的趋势,其中P4处理组的蛋白质效率和营养沉积率显著高于(P<0.05)或高于(P>0.05)其他5个处理组。
|
表 4 饲料中添加不同质量分数的蛋白质对卵形鲳鲹存活、生长性能和饲料利用的影响 Tab.4 Effects of dietary protein mass fraction on the survival, growth performance and feed utilization of golden pompano |
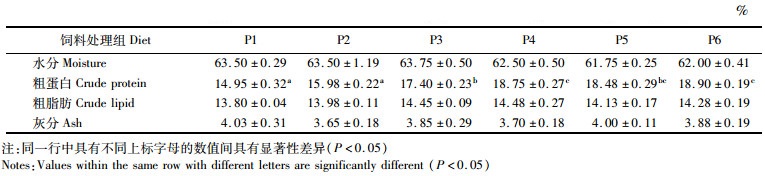
折线回归模型拟合生长性能(图 1和图 2),根据特定生长率和增重率计算得知,卵形鲳鲹对饲料中蛋白质的最适需求量(质量分数)分别为48.559%和49.75%。

|
图 1 饲料中蛋白质含量与卵形鲳鲹特定生长率拟合关系分析 Fig. 1 Regression analysis between SGR and dietary protein levels in golden pompano |
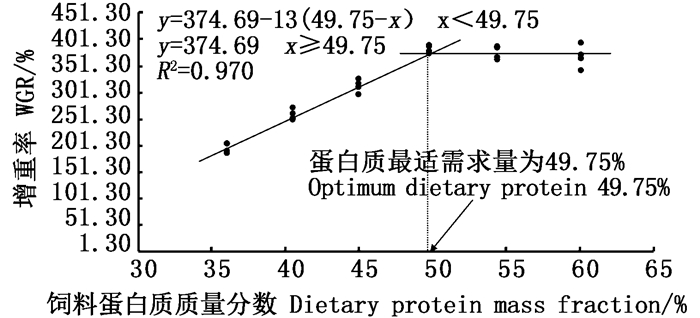
|
图 2 饲料中蛋白质含量与卵形鲳鲹增重率拟合关系分析 Fig. 2 Regression analysis between WGR and dietary protein levels in golden pompano |
随着饲料中蛋白质的提高,卵形鲳鲹全鱼的粗蛋白含量呈现先显著升高(P<0.05)后逐渐稳定(P>0.05)的趋势,其中P4和P6处理组卵形鲳鲹全鱼的粗蛋白含量显著高于P1、P2和P3处理组(表 5,P<0.05)。卵形鲳鲹全鱼粗脂肪含量随着饲料中蛋白质浓度的提升呈现先升高后降低的趋势,差异不显著(P>0.05)。不同处理组之间,卵形鲳鲹全鱼的水分和灰分含量没有显著差异(P>0.05)。
|
表 5 饲料中添加不同浓度的蛋白质对卵形鲳鲹体组成的影响 Tab.5 Effects of dietary protein levels on the whole body proximate composition of golden pompano |
随着饲料中蛋白质含量的升高,卵形鲳鲹的肥满度呈现先升高后降低的趋势,而肝体比和脏体比则呈现先降低后升高的趋势,差异不显著(表 6,P>0.05)。
|
表 6 饲料中添加不同浓度的蛋白质对卵形鲳鲹形体指标的影响 Tab.6 Effects of dietary protein levels on the body index of golden pompano |
饲料中添加不同含量的脂肪,不影响卵形鲳鲹的存活率(表 7,P>0.05)。随着饲料中脂肪含量的提高,卵形鲳鲹的生长性能,包括终末体质量、体增重、增重率、特定生长率和蛋白质效率,呈现先升高后稳定的趋势,其中L3、L4、L5和L6处理组的生长性能显著高于L1和L2处理组(P<0.05)。饲料系数和摄食率随着饲料中脂肪水平的提高而呈现逐渐降低的趋势(P<0.05),当饲料脂肪质量分数≥12.20%时,饲料系数和摄食率呈现稳定的趋势(P>0.05)。蛋白质沉积、脂肪沉积和能量沉积随脂肪梯度的升高均呈现先升高后降低的趋势,其中,当饲料中脂肪质量分数为12.20%时,蛋白质沉积、脂肪沉积和能量沉积有最大值并显著高于(P<0.05)或高于(P>0.05)其他处理组。
|
表 7 饲料中添加不同质量分数的脂肪对卵形鲳鲹存活、生长性能和饲料利用的影响 Tab.7 Effects of dietary lipid mass fraction on survival, growth performance and feed utilization of golden pompano |
折线回归模型拟合生长性能(图 3和4),分别根据特定生长率和蛋白质效率计算得知,卵形鲳鲹对饲料中脂肪的最适需求量(质量分数)分别为12.20%和12.27%。

|
图 3 饲料中脂肪添加水平与卵形鲳鲹特定生长率拟合分析 Fig. 3 Regression analysis between SGR and dietary lipid levels in golden pompano |

|
图 4 饲料中脂肪添加水平与卵形鲳鲹蛋白质效率拟合分析 Fig. 4 Regression analysis between PER and dietary lipid levels in golden pompano |
随着饲料中脂肪添加量的升高,卵形鲳鲹机体的粗蛋白和粗脂肪含量呈现先升高后稳定的趋势(表 8),其中L3、L4、L5和L6处理组的粗蛋白和粗脂肪水平显著高于L1和L2处理组(P<0.05)。不同处理组卵形鲳鲹的水分、灰分含量没有显著差异(P>0.05)。
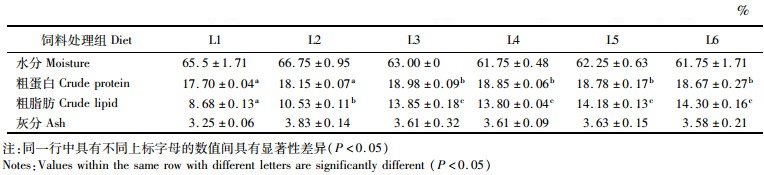
|
表 8 饲料中添加不同质量分数的脂肪对卵形鲳鲹体组成的影响 Tab.8 Effects of dietary lipid mass fraction on whole-body proximate composition of golden pompano |
L5和L6处理组卵形鲳鲹的肥满度显著高于L3处理组卵形鲳鲹(表 9,P<0.05),而与L1、L2和L4处理组相比差异不显著(P>0.05)。L6处理组肝体比显著高于其他5个处理组(P<0.05)。不同处理组卵形鲳鲹的脏体比没有显著差异(P>0.05)。
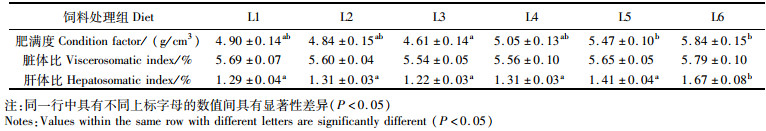
|
表 9 饲料中添加不同质量分数的脂肪对卵形鲳鲹形体指标的影响 Tab.9 Effects of dietary lipid mass fraction on body indices of golden pompano |
蛋白质和脂肪是动物的两大必需营养素之一,能够显著影响动物的生长性能。首先进行了中成鱼阶段卵形鲳鲹对饲料中蛋白质的最适需求量研究。实验结果显示,当饲料中粗脂肪为12%时,折线回归模型拟合生长曲线显示,中成鱼阶段卵形鲳鲹对饲料中蛋白质的最适需求量为48.56%~49.75%。这与早期研究报道[15]的卵形鲳鲹幼鱼饲料蛋白质最适需求量(质量分数)相近(45%~49%)。本结果与其他研究[2, 18]的推测结果差异较大。刘兴旺等[2]以鱼粉和豆粕为蛋白源,通过折线模型拟合生长曲线,发现幼鱼阶段卵形鲳鲹对蛋白质的最适需求量(质量分数)分别为45.75%(脂肪8.9%~9.4%)。这些实验结果的不同,可能主要是实验所用卵形鲳鲹的发育阶段和基础饲料配方的差异导致的。中成鱼阶段卵形鲳鲹饲料蛋白质最适需求量与许氏平鲉(48%~50%)[4]、牙鲆(45%~50%)[5-6]、赤点石斑鱼(Epinephelus akaara,48%~50%)[34]相近,低于大菱鲆(57%)和半滑舌鳎(55%)[3],但高于大黄鱼(42.7%~48.3%)[14]、
中成鱼阶段卵形鲳鲹的生长性能随着饲料中蛋白质含量的变化而变化,当饲料中蛋白质含量(质量分数)从36.11%升高到49.75%时,卵形鲳鲹的生长性能、饲料利用效率、营养沉积、全鱼粗蛋白含量呈现显著升高的趋势。这与大多数鱼类的蛋白质需求量实验结果相类似:饲料中补充适宜的蛋白质,能够显著改善动物的生长性能,提高其生长速度,改善营养沉积[13-15, 32-34, 36]。在本实验中,当饲料中蛋白质含量(质量分数)从49.75%升高到60.03%时,中成鱼阶段卵形鲳鲹的生长性能和鱼体粗蛋白含量呈现逐渐稳定的趋势,但蛋白质效率和营养沉积效率呈现降低的趋势,这与早期在卵形鲳鲹幼鱼上的研究结果[2, 15]相一致。这说明,尽管高蛋白饲料不影响卵形鲳鲹的生长性能,但在一定程度上降低了动物对营养物质的消化、吸收、利用能力。此外,随着饲料中蛋白质含量的升高,中成鱼阶段卵形鲳鲹的摄食量呈现先显著降低而后稳定的趋势,这与早期在卵形鲳鲹幼鱼上的研究结果[2, 15]类似,可能与鱼类摄食不同蛋白水平饲料时的摄食补偿调节机制有关:鱼类摄食蛋白质含量较低的饲料时,会提高摄食量,以提高日蛋白摄入量;当摄食蛋白质含量较高的饲料时,鱼类摄食量会相应降低并稳定。
在获得蛋白质最适需求量的基础上,进一步设计实验配方,以质量分数50%蛋白质为基础配方的粗蛋白质设计值,通过设计不同的脂肪梯度,研究中成鱼阶段卵形鲳鲹对饲料中脂肪的最适需求量。实验结果表明,使用折线回归模型拟合生长曲线计算得到中成鱼阶段卵形鲳鲹对饲料中脂肪的最适需求量(质量分数)为12.2%~12.27%。这与其他肉食性鱼类如七星鲈鱼(Lateolabrax japonicus)[11]、大黄鱼[20]、大菱鲆[21]和佛罗里达鲳鲹(Trachinotus carolinus)[22]的脂肪最适需求量(质量分数)相近(分别为12%、10.7%、9.34%~16.5%和18%),但高于草食性鱼类和杂食性鱼类的脂肪最适需求量(质量分数),如青鱼(Mylopharyngodon piceus)(4.5%~6.5%)[23]、草鱼(Ctenopharyngodon idellus)(3.6%~8%)[24]、尼罗罗非鱼(Sarotherodon mossambicus)(6%~8%)[25]。这可能主要是鱼种的不同而导致的:草食性和杂食性鱼类对饲料脂肪的需求量较低,是因为它们能够在一定程度上利用饲料中的碳水化合物作为能量来源,肉食性鱼类较难利用饲料中的碳水化合物,因此对饲料中脂肪的需求量较高。
当饲料中脂肪质量分数从7.18%升高到12.20%时,中成鱼阶段卵形鲳鲹的生长性能、饲料利用效率、营养沉积等均呈现显著升高的趋势。这与大多数鱼类如大菱鲆[21]、军曹鱼[26, 31]、团头鲂(Megalobrama amblycephala)[27]和白鲈(Atractoscion nobilis)[28]的脂肪实验研究结果类似:向饲料中补充适宜的脂肪以满足鱼类对脂肪的需求之后,能够显著提高鱼类的生长性能、饲料转化率,改善动物营养沉积效率。同时,本实验发现,当饲料中的脂肪含量(质量分数)超过12.20%之后,卵形鲳鲹的生长性能和饲料利用率呈现逐渐平稳的趋势,而营养物质沉积率则呈现降低趋势。这说明,中成鱼阶段卵形鲳鲹对饲料中脂肪具有较高的耐受能力,高脂肪饲料没有影响卵形鲳鲹的生长,但却降低了脂肪等营养物质的沉积效率。这与大菱鲆[21]、大西洋鳕鱼(Gadus morhua)[29]和欧洲鲈(Sparus aurata L.)[30]的研究结果相似。此外,本实验发现,高脂肪饲料处理组卵形鲳鲹的摄食率显著低于低脂肪处理组,这与早期研究结果类似:饲料中添加高质量浓度脂肪,在一定程度上影响动物摄食[21, 29-30],这可能是随着饲料中脂肪含量的提高,满足了动物对饲料中的脂肪需求量,且高能饲料存在蛋白质节约效应,动物摄食高浓度脂肪处理组饲料,能够在较低摄食量的条件下,摄取足够的能量以提供其生长和生活所需。
卵形鲳鲹机体的粗蛋白和粗脂肪含量、肥满度和肝体比指数,随着饲料中脂肪含量的提高而呈现显著升高的趋势,这与大菱鲆[21]、大西洋鳕鱼[29]、军曹鱼[26]、欧洲鲈[30]、黄颡鱼[35]的研究结果类似:饲料脂肪含量的升高,会造成机体脂肪过度沉积,提高鱼体机体粗脂肪含量,提高肝体比以及肥满度等形体指标[31]。同时,脂肪的蛋白质节约效应能够降低机体用于供能的蛋白质比例,使更多蛋白质参与机体组织构建和生长需要,从而提高了机体粗蛋白的含量[31]。
| [1] |
OLSEN R L, HASAN M R. A limited supply of fishmeal:Impact on future increases in global aquaculture production[J]. Trends in Food Science & Technology, 2012, 27(2): 120-128. |
| [2] |
刘兴旺, 许丹, 张海涛, 等. 卵形鲳鲹幼鱼蛋白质需要量的研究[J]. 南方水产科学, 2011, 7(1): 45-49. LIU X W, XU D, ZHANG H T, et al. Optimal dietary protein requirement for juvenile Trachinotus ovatus[J]. South China Fisheries Science, 2011, 7(1): 45-49. DOI:10.3969/j.issn.2095-0780.2011.01.007 |
| [3] |
刘兴旺.大菱鲆及半滑舌鳎蛋白质营养生理研究[D].青岛: 中国海洋大学, 2010: 1-30. LIU X W. The study on protein nutrition physiology of turbot, scophthalmus maximus linnaeus and half-smooth tongue-sole, Cynoglossus semilaevis Gunther[D]. Qingdao: Ocean University of China, 2010: 1-30. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030172.htm |
| [4] |
KIM K W, WANG X J, HAN K, et al. Optimum dietary protein level and protein-to-energy ratio for growth of juvenile Korean rockfish Sebastes schlegeli[J]. Journal of the World Aquaculture Society, 2004, 35(3): 305-314. DOI:10.1111/jwas.2004.35.issue-3 |
| [5] |
LEE S M, KIM K D. Effect of various levels of lipid exchanged with dextrin at different protein level in diet on growth and body composition of juvenile flounder Paralichthys olivaceus[J]. Aquaculture Nutrition, 2005, 11(6): 435-442. DOI:10.1111/anu.2005.11.issue-6 |
| [6] |
KIM K W, KANG Y J, CHOI S M, et al. Optimum dietary protein levels and protein to energy ratios in olive flounder Paralichthys olivaceus[J]. Journal of the World Aquaculture Society, 2005, 36(2): 165-178. |
| [7] |
WANG Y, GUO J L, LI K, et al. Effects of dietary protein and energy levels on growth, feed utilization and body composition of cuneate drum (Nibea miichthioides)[J]. Aquaculture, 2006, 252(2/4): 421-428. |
| [8] |
ALVAREZ-GONZÁLEZ C A, CIVERA-CERECEDO R, ORTIZ-GALINDO J L, et al. Effect of dietary protein level on growth and body composition of juvenile spotted sand bass, Paralabrax maculatofasciatus, fed practical diets[J]. Aquaculture, 2001, 194(1/2): 151-159. |
| [9] |
CHOU R L, SU M S, CHEN H Y. Optimal dietary protein and lipid levels for juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2001, 193(1/2): 81-89. |
| [10] |
KIM L O, LEE S M. Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish, Pseudobagrus fulvidraco[J]. Aquaculture, 2005, 243(1/4): 323-329. |
| [11] |
AI Q H, MAI K S, LI H T, et al. Effects of dietary protein to energy ratios on growth and body composition of juvenile Japanese seabass, Lateolabrax japonicus[J]. Aquaculture, 2004, 230(1/4): 507-516. |
| [12] |
SILVA P, ANDRADE C A P, TIMÓTEO V M F A, et al. Dietary protein, growth, nutrient utilization and body composition of juvenile blackspot seabream, Pagellus bogaraveo (Brunnich)[J]. Aquaculture Research, 2006, 37(10): 1007-1014. DOI:10.1111/are.2006.37.issue-10 |
| [13] |
LEE S M, KIM D J, CHO S H. Effects of dietary protein and lipid level on growth and body composition of juvenile ayu (Plecoglossus altivelis) reared in seawater[J]. Aquaculture Nutrition, 2002, 8(1): 53-58. DOI:10.1046/j.1365-2095.2002.00195.x |
| [14] |
林淑琴.不同生长阶段大黄鱼的蛋白质和蛋/能比营养研究[D].青岛.中国海洋大学, 2013: 1-32. LIN S Q. Effects of dietary protein and its ratio to energy on growth performances and metabolic responses of large yellow croaker at different stages[D]. Qingdao: Ocean University of China, 2013: 1-32. http://cdmd.cnki.com.cn/Article/CDMD-10423-1013368578.htm |
| [15] |
WANG F Y, HAN H, WANG Y, et al. Growth, feed utilization and body composition of juvenile golden pompano Trachinotus ovatus fed at different dietary protein and lipid levels[J]. Aquaculture Nutrition, 2013, 19(3): 360-367. DOI:10.1111/anu.2013.19.issue-3 |
| [16] |
GAO W, LIU Y J, TIAN L X, et al. Effect of dietary carbohydrate-to-lipid ratios on growth performance, body composition, nutrient utilization and hepatic enzymes activities of herbivorous grass carp (Ctenopharyngodon idella)[J]. Aquaculture Nutrition, 2010, 16(3): 327-333. |
| [17] |
张伟涛.卵形鲳鲹(Trachinotus ovatus)对饲料脂肪利用的研究[D].苏州.苏州大学, 2009: 1-25. ZHANG W T. Studies on the utilization of dietary lipid in innovate pompano (Trachinotus ovatus)[D]. Suzhou: Soochow University, 2009: 1-25. http://cdmd.cnki.com.cn/Article/CDMD-10285-2009119011.htm |
| [18] |
TUTMAN P, GLAVIC' N, KOŽUL V, et al. Preliminary information on feeding and growth of pompano, Trachinotus ovatus (Linnaeus, 1758) (Pisces; Carangidae) in captivity[J]. Aquaculture International, 2004, 12(4/5): 387-393. DOI:10.1023/B:AQUI.0000042135.88381.f4 |
| [19] |
NIU J, DU Q, LIN H Z, et al. Quantitative dietary meth-ionine requirement of juvenile golden pompano Trachinotus ovatus at a constant dietary cystine level[J]. Aquaculture Nutrition, 2013, 19(5): 677-686. DOI:10.1111/anu.2013.19.issue-5 |
| [20] |
DUAN Q Y, MAI K S, ZHONG H Y, et al. Studies on the nutrition of the large yellow croaker, Pseudosciaena crocea R. I:growth response to graded levels of dietary protein and lipid[J]. Aquaculture Research, 2001, 32(S1): 46-52. |
| [21] |
彭墨.饲料脂肪水平和脂肪酸组成对大菱鲆幼鱼脂沉积的影响[D].青岛: 中国海洋大学, 2014: 1-54. PENG M. The effects of dietary lipid level and fatty acids composition on lipid deposition in turbot (Scophthalmus maximus L.)[D]. Qingdao: Ocean University of China, 2014: 1-54. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369138.htm |
| [22] |
RICHE M. Evaluation of digestible energy and protein for growth and nitrogen retention in juvenile Florida pompano, Trachinotus carolinus[J]. Journal of the World Aquaculture Society, 2009, 40(1): 45-57. DOI:10.1111/jwas.2009.40.issue-1 |
| [23] |
王道尊, 龚希章, 刘玉芳. 饲料中脂肪的含量对青鱼鱼种生长的影响[J]. 水产学报, 1987, 11(1): 23-28. WANG D Z, GONG X Z, LIU Y F. The effects fat content in feeds on the growth of black carp fingerlings[J]. Journal of Fisheries of China, 1987, 11(1): 23-28. |
| [24] |
毛永庆, 蔡发盛, 林鼎. 鲮鱼最适生长的营养素需要量研究[J]. 水生生物学报, 1985, 9(3): 213-223. MAO Y Q, CAI F S, LIN D. Studies on the nutritional requirements for optimum growth of mud carp Cirrhinus molitorella (C. et V.)[J]. Acta Hydrobiologica Sinica, 1985, 9(3): 213-223. |
| [25] |
JAUNCEY K. The effects of varying dietary protein level on the growth, food conversion, protein utilization and body composition of juvenile tilapias (Sarotherodon mossambicus)[J]. Aquaculture, 1982, 27(1): 43-54. DOI:10.1016/0044-8486(82)90108-9 |
| [26] |
WANG Z, MAI K S, XU W, et al. Dietary methionine level influences growth and lipid metabolism via GCN2 pathway in cobia (Rachycentron canadum)[J]. Aquaculture, 2016, 454: 148-156. DOI:10.1016/j.aquaculture.2015.12.019 |
| [27] |
LI X F, LIU W B, LU K L, et al. Dietary carbohydrate/lipid ratios affect stress, oxidative status and non-specific immune responses of fingerling blunt snout bream, Megalobrama amblycephala[J]. Fish & Shellfish Immunology, 2012, 33(2): 316-323. |
| [28] |
LÓPEZ L M, DURAZO E, VIANA M T, et al. Effect of dietary lipid levels on performance, body composition and fatty acid profile of juvenile white seabass, Atractoscion nobilis[J]. Aquaculture, 2009, 289(1/2): 101-105. |
| [29] |
HANSEN A C, KARLSEN Ø, ROSENLUND G, et al. Dietary plant protein utilization in Atlantic cod, Gadus morhua L.[J]. Aquaculture Nutrition, 2007, 13(3): 200-215. DOI:10.1111/anu.2007.13.issue-3 |
| [30] |
PEREIRA T G, OLIVA-TELES A. Evaluation of corn gluten meal as a protein source in diets for gilthead sea bream (Sparus aurata L.) juveniles[J]. Aquaculture Research, 1999, 34(13): 1111-1117. |
| [31] |
WANG J T, LIU Y J, TIAN L X, et al. Effect of dietary lipid level on growth performance, lipid deposition, hepatic lipogenesis in juvenile cobia (Rachycentron canadum)[J]. Aquaculture, 2005, 249(1/4): 439-447. |
| [32] |
黄岩, 李建, 王学习, 等. 饲料中不同蛋白质和淀粉水平对斜带石斑鱼生长性能和肝脏相关代谢酶活性的影响[J]. 水产学报, 2017, 41(5): 746-756. HUANG Y, LI J, WANG X X, et al. Effects of different dietary protein and starch levels on the growth and liver metabolism of grouper (Epinephelus coioides)[J]. Journal of Fisheries of China, 2017, 41(5): 746-756. |
| [33] |
胡毅, 陈云飞, 张德洪, 等. 不同碳水化合物和蛋白质水平膨化饲料对大规格草鱼生长、肠道消化酶及血清指标的影响[J]. 水产学报, 2018, 42(5): 777-786. HU Y, CHEN Y F, ZHANG D H, et al. Effects of different dietary carbohydrate and protein levels on growth, intestinal digestive enzymes and serum indexes in large-size grass carp (Ctenopharyngodon idella)[J]. Journal of Fisheries of China, 2018, 42(5): 777-786. |
| [34] |
蔡云川, 赵书燕, 林黑着, 等. 不同蛋白水平下添加抗菌肽对赤点石斑鱼影响的研究[J]. 上海海洋大学学报, 2017, 26(3): 383-391. CAI Y C, ZHAO S Y, LIN H Z, et al. Effect of antibacterial peptides supplementation in different protein level diets on grouper (Epinephelus akaara)[J]. Journal of Shanghai Ocean University, 2017, 26(3): 383-391. |
| [35] |
陆游, 周飘萍, 袁野, 等. 不同小麦淀粉和脂肪水平对大黄鱼的生长性能、饲料利用及糖代谢关键酶活力的影响[J]. 水产学报, 2017, 41(2): 297-310. LU Y, ZHOU P P, YUAN Y, et al. Effects of different wheat starch and lipid levels on growth performance, feed utilization and hepatic carbohydrate metabolism key enzymes activities in large yellow croaker (Larimichthys crocea)[J]. Journal of Fisheries of China, 2017, 41(2): 297-310. |
| [36] |
秦钦, 陈校辉, 潘建林, 等. 日粮蛋白含量及家系对黄颡鱼幼鱼生长性能和肝脏IGF-I mRNA表达水平的影响[J]. 上海海洋大学学报, 2018, 27(2): 190-195. QIN Q, CHEN X H, PAN J L, et al. Effects of families and feed protein contents on growth performance and hepatic expression of IGF-I mRNA of juvenile yellow catfish[J]. Journal of Shanghai Ocean University, 2018, 27(2): 190-195. |
2. State Key Laboratory for Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, Hubei, China;
3. Sheng Long Bio-Tech International Co., Ltd of Haid Group Co., Ltd., Long An 850000, Vietnam
 2019,
Vol. 28
2019,
Vol. 28

