2. 三亚热带水产研究院, 海南 三亚 572018;
3. 海南大学 海洋学院, 海南 海口 570228
合浦珠母贝(Pinctada fucata)又称马氏珠母贝(P. martensii)自然分布于热带和亚热带的太平洋和印度洋海域[1],是培育海水珍珠的重要母贝[2-3],与其他3种大型珍珠贝的大珠母贝(P. maxima)[4]、珠母贝(P. margaritifera)[5]和企鹅珍珠贝(Pteria penguin)[6]同为世界性重要的水产养殖经济品种,是中国、日本、印度和越南等国用来培育海水有核珍珠的主要种类[1, 7-8]。合浦珠母贝的珍珠养殖曾一度成为广东、广西和海南等部分沿海地区支柱性产业之一,由合浦珠母贝所生产的珍珠也占到海水珍珠总产量的95 %以上[9-10]。为进一步推动产业发展,以高校和科研院所为主导的选育具有优良生产性能的合浦珠母贝新品种和新品系也得到有效推进,新品种“海优1号”“海选1号”“南科1号”“南珍1号”及其他新品系便应运而生[11],从而满足合浦珠母贝的不同养殖条件和功能需求。合浦珠母贝作为热带和亚热带区域包含中国南方在内的不可或缺的重要海洋养殖经济贝类,不论是在进行出苗海区养殖、新品种推广、出售交易、增殖放流、异地引种及活体取样等过程中都不可避免的要涉及到运输。目前,活体贝的运输也是行业内的软肋,由于缺少科学的运输方法和运输时间的把握而导致的合浦珠母贝失活甚至死亡的事故时有发生[12]。动物在运输过程中由于缺氧、饥饿、环境变化、颠簸等因素的综合影响,常会产生适应性和防御性应急反应,常常表现为抗病能力下降等现象,是影响动物存活的至关重要的外在因素[13]。目前,有关活体贝的运输报道较少,缺少参考和借鉴的依据,在其他水生动物的运输过程中包括有水运输和无水运输,有水运输通过增加水中的溶氧量、适当降低温度辅助麻醉等方式可有效提高水生动物的存活率[14]。为减少合浦珠母贝运输过程中的死亡,提高运输成功率,为合浦珠母贝的运输寻找一个适宜的运输方式和环境温度,该实验运用合浦珠母贝稚贝为实验材料,分别以无水干露、加水淹没和包装充氧等3种运输方式,分别在5、13、21和29 ℃的4种环境温度下模拟运输,通过比较合浦珠母贝在不同运输方式和温度条件下的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1),寻找适宜合浦珠母贝运输的方式及最佳环境温度,把握运输时间,从而为合浦珠母贝实际运输操作提供参考和借鉴。
1 材料与方法 1.1 实验材料实验准备的25 000只合浦珠母贝稚贝[壳长:(23.53 ± 4.38) mm, n=30]为该课题组繁育并于海南省陵水县新村港贝架养殖的3月龄贝,稚贝暂养及实验期间投喂的饵料藻为浓度1010个/mL级的浓缩小球藻(Chlorella vulgaris)。
1.2 实验方法合浦珠母贝稚贝从海区运回后,清除其表面附着物并清洗干净,在室内水泥池中流水暂养2 d使之恢复稳定,暂养期间水体投喂浓缩小球藻浓度为103个/mL级,暂养及实验期间海水温度为(31.25 ± 0.78) ℃、pH 8.05 ± 0.02、盐度34。合浦珠母贝稚贝随机以100只为一份分成228份,其中:第1个72组放入到规格为1 L的烧杯中,然后在上面铺一层厚度为1 cm经海水浸湿的海棉保持潮湿(干露运输);第2个72组放入到规格为1 L的烧杯中加入海水使稚贝刚好淹没(贝与水的总体积大概为350 mL,加水运输);第3个72组放入到规格为口径10 cm、长度36 cm的透明运输袋中加入海水使稚贝刚好淹没再充入氧气(贝与水的体积大概为350 mL,充氧后总体积为1 200 mL左右,充氧运输);剩下的12份留作对照组。在2台冰箱中分别调节好气温为5 ℃和13 ℃,在2间空调房中分别调节好气温为21 ℃和29 ℃。在每台冰箱和空调房中分别放入3个体积为160 L带盖的储物箱,每个储物箱中加水60 L,用冰袋使水降温,以达到水温和气温均达到设定好的5、13、21和29 ℃的4个温度环境。每种运输方式(干露运输、加水运输和充氧运输)平均分成4批(每批18份)分别放置在调节好温度的水中,在水中放入气石充气使水体水温均衡。每隔一段时间观察水温变化并做相应调节,每隔3 h分别从4种温度下取出3种运输方式的其中各1份,以水浴法使之恢复到正常水温状态。温度恢复到正常水温后,把稚贝转移到长为30 cm、宽为20 cm和高为12 cm的塑料筐中,再把塑料筐每次的12份放入2.5 m×2.5 m×1 m的水泥池中进行流水暂养正常投喂,48 h后统计各组贝的存活率,每种温度及运输方式下的实验数据均取到稚贝全部死亡(双壳张开不闭合)为止。未经任何处理的12份,未经任何处理留作对照,暂养在水池中正常投喂,48 h后统计其存活率。
1.3 数据处理与分析用Origin 9.1对运输时间及存活率间数据进行回归参数曲线拟合及作图,稚贝运输时间x与存活率y的函数用y=A2+(A1-A2)/[1+e(x-x0)/dx]表示,稚贝致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)用公式x=x0 + dx ln [(A1-A2)/(y-A2)-1]计算。数据采用SPSS 21进行双因素方差分析(Two-Way ANOVA),所得实验数据以“平均值±标准差”(X ±SD)表示,用Duncan氏方法比较其均值间的差异显著性(P < 0.05)。
2 结果合浦珠母贝稚贝在4种环境温度下以3种不同运输方式模拟运输,其运输时间与稚贝存活率之间结合拟合优度和残差图形分析选择最优的非线性参数拟合方程,结果见图 1的12条拟合曲线,其决定系数R2均大于0.95,接近于1,表明曲线拟合效果较好。从图 1中观察拟合曲线趋势,稚贝在运输的短时间内其存活率几乎不随着时间的增加而有明显的降低,而在经过一段时间后,其存活率出现急剧降低,这基本符合生物在受到胁迫状态下的死亡变化规律。

|
(a) 5 ℃干露;(b) 5 ℃水运;(c) 5 ℃充氧;(d) 13 ℃干露;(e) 13 ℃水运;(f)13 ℃充氧;(g)21 ℃干露;(h)21 ℃水运;(i) 21 ℃充氧;(j)29 ℃干露;(k)29 ℃水运;(l) 29 ℃充氧 (a) 5 ℃ dry transport; (b) 5 ℃ water transport; (c) 5 ℃ oxygen transport; (d) 13 ℃ dry transport; (e) 13 ℃ water transport; (f) 13 ℃ oxygen transport; (g)21 ℃ dry transport; (h)21 ℃ water transport; (i) 21 ℃ oxygen transport; (j) 29 ℃ dry transport; (k) 29 ℃ water transport; (l) 29 ℃ oxygen transport 图 1 合浦珠母贝稚贝运输时间与存活率的曲线拟合 Fig. 1 Fitting curve of transportation time and survival rates of P. fucata juvenile |
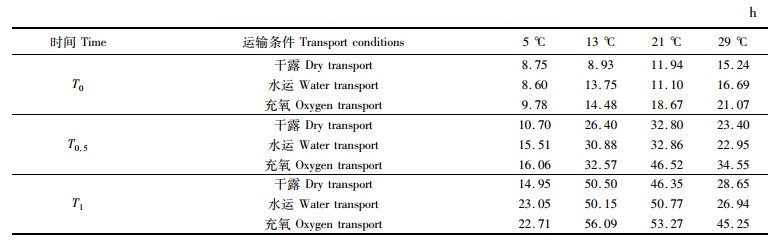
12份合浦珠母贝稚贝对照组在未经任何处理,经过48 h的暂养后其存活率为98.42%±1.38%(n= 12),在95 %的置信区间内其存活率的下限为97.666 66%,故以存活率为此下限时的时间表示稚贝开始致死出现死亡,所经过的时间为致死时间(T0),以存活率为50 %表示半致死量所经过的时间为半致死时间(T0.5),以存活率为0 %为全致死量所经过的时间为全致死时间(T1)。根据公式计算得到稚贝在不同环境温度及运输方式下的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)结果见表 1。
|
表 1 合浦珠母贝稚贝不同运输条件下的致死时间(T0)半致死时间(T0.5)和全致死时间(T1) Tab.1 Lethal time (T0) semi-lethal time (T0.5) and total lethal time (T1) of different transport conditions of P. fucata juvenile |
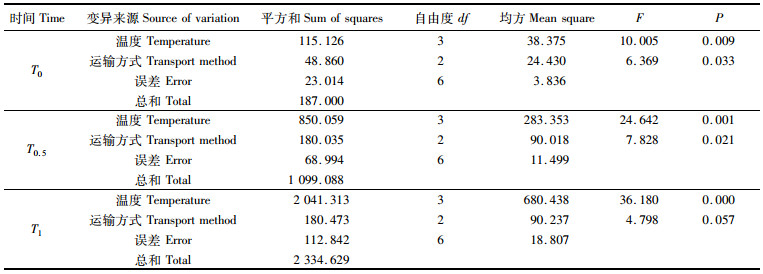
对稚贝在4种环境温度3种运输方式间计算得到的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)进行温度和运输方式间的双因素方差分析,分析结果见表 2。其中,温度和运输方式间对稚贝的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1),除运输方式对全致死时间(T1)产生的差异不显著(P> 0.05)外,其他均产生显著(P < 0.05)差异。
|
表 2 双因素间的方差分析 Tab.2 Two-way analysis of variance |
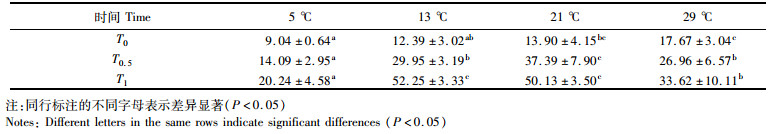
用Duncan氏方法比较4种温度间和3种运输方式间均值的差异显著性。4种温度间对稚贝的致死时间(T0)、半致死时间(T0.5)及全致死时间(T1)的比较结果见表 3,其中,29 ℃时对稚贝的致死时间(T0)显著(P < 0.05)大于5 ℃和13 ℃时的致死时间(T0),21 ℃时的致死时间(T0)又显著(P < 0.05)大于5 ℃,基本表现为随着温度的升高其致死时间(T0)越大。对于半致死时间(T0.5),在21 ℃时显著(P < 0.05)大于13 ℃和29 ℃,而在13 ℃和29 ℃时又显著(P < 0.05)大于5 ℃。对于全致死时间(T1),13 ℃和21 ℃时显著(P < 0.05)大于29 ℃和5 ℃,而在29 ℃时又显著(P < 0.05)大于5 ℃。
|
表 3 不同温度对合浦珠母贝的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)均值比较 Tab.3 Comparison of lethal time, semi-lethal time and total lethal time of P. fucata at different temperature |
3种运输方式间对稚贝的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)的均值比较结果见表 4,其中,充氧运输的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)均显著(P < 0.05)大于其他两种运输方式,而干露运输和加水运输的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)间均表现差异不显著(P>0.05)。

|
表 4 不同运输方式对合浦珠母贝稚贝致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)的均值比较 Tab.4 Comparison of lethal time, semi-lethal time and total lethal time of P. fucata juvenile by different transport modes |
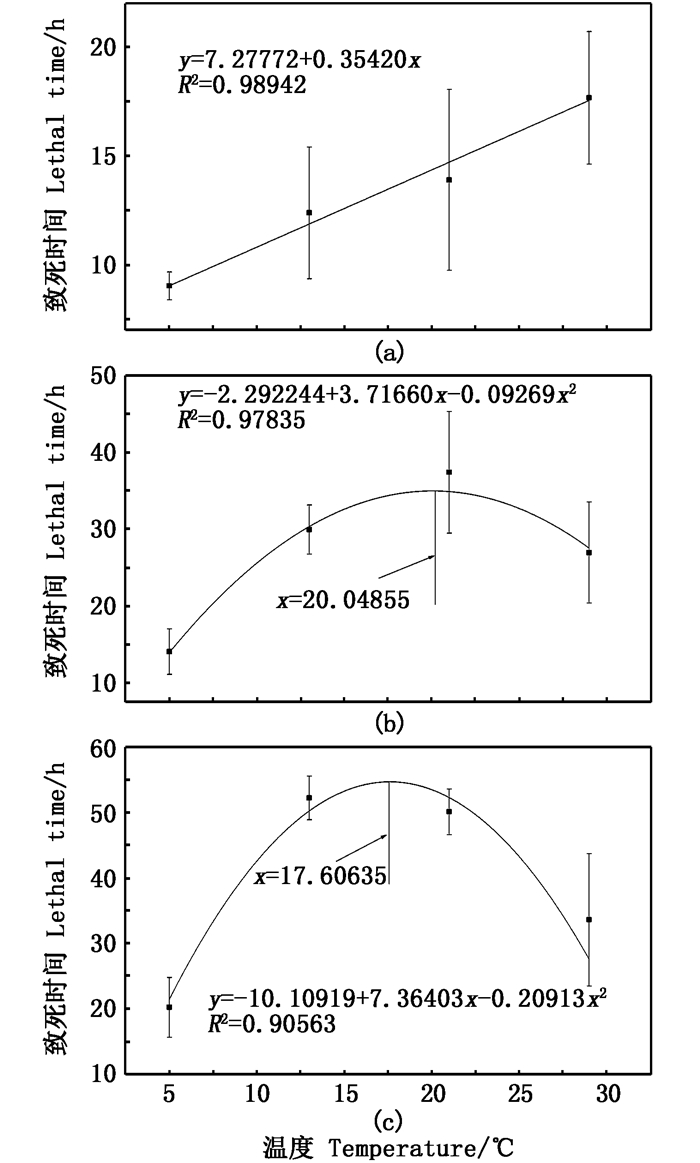
环境温度与稚贝致死时间(T0)的拟合曲线结果见图 2a,其致死时间y与温度x间的拟合曲线方程为y = 7.277 72 + 0.354 20 x,R2=0.989 42,可见,在设定的温度范围内,随着温度的升高,稚贝的致死时间(T0)也随之增大。环境温度与稚贝半致死时间(T0.5)的拟合曲线结果见图 2b,其半致死时间,y与温度x的拟合曲线方程为y = -2.292 44 + 3.716 60 x - 0.092 69 x2,R2 = 0.978 35,可见,在设定的环境温度区间内,从5~20.048 55 ℃时,随着温度的升高,其半致死时间(T0.5)也随之增大,当温度从20.048 55~ 29 ℃时,随着温度的升高,其半致死时间(T0.5)随之减小,当温度为20.048 55 ℃时,半致死时间(T0.5)达到最大。环境温度与稚贝全致死时间(T1)间的拟合曲线结果见图 2c,其全致死时间y与温度x间的拟合曲线方程为y=-10.109 19+7.364 03 x-0.209 13 x2, R2=0.905 63,可见,在设定的温度区间内,从5~17.606 35℃内,随着温度的升高其全致死时间(T1)随之升高,当温度在17.606 35~29 ℃时,随着温度的升高,其全致死时间(T1)随之降低,当温度为17.606 35 ℃时,其全致死时间(T1)达到最大。
|
图 2 不同温度对稚贝致死时间(a)、半致死时间(b)和全致死时间(c)曲线拟合 Fig. 2 Fitting curve of lethal time(a), semi-lethal time(b) and total lethal time(c) of juveniles at different temperature |
合浦珠母贝是一种暖水性海洋无脊椎变温动物,其适宜生长的温度范围为15~30 ℃、最适水温范围为23~25 ℃[15],其生理状况容易受环境温度变化的影响[16-17]。一切生物个体在受到外界环境胁迫时都有一个特定的耐受值,当外界胁迫超出其耐受阈值时,生物体将不能调整恢复。胁迫值可以认为是在一定胁迫强度下作用一段时间的值,生物体在超出其耐受阈值时,机体受到不可恢复的损伤,生物体出现致死死亡,此作用时间为致死时间(T0)。该研究中,对稚贝运输时间与存活率之间进行曲线拟合,结果显示,在运输的一段时间范围内,其存活率几乎不受运输时间的增加而降低,当超过一定时间后其存活率急剧降低,这正好符合生物体在受到胁迫状况下的死亡规律。实验中,合浦珠母贝稚贝在设定的特定条件下模拟运输,由正常养殖水温下的(31.25±0.78)℃,在短时间内分别渐变至设定温度下的5、13、21和29 ℃。结果表明,随着温度的降低,其致死时间(T0)也随之减小,表明温度越低,对稚贝造成的影响越大。ALTER等[18]和DONAGHY等[19]认为温度短时间内的变化会直接影响到生物体维持正常生长和存活相关代谢酶的活性,从而影响到机体正常生理生活状态。JIANG等[20]研究发现,随着环境温度的降低,虾夷扇贝(Patinopecten yessoensis)为减少冷应激引起的心脏跳动频率和鳃丝摆动频率的降低,从而直接影响滤水和摄食。每种水生动物都有其相应的适宜生存温度范围和最佳的生存温度,当超出其生存范围时,生物体会出现一系列的不良反应,从而导致机体免疫力低下甚至死亡[21]。而在生存温度范围内,在一定温度范围内随着温度的降低,生物体的呼吸代谢减缓,耗氧量减少,CO2和氨等的有害代谢物产量降低,因此生物在运输过程中适当的降低环境温度是提高运输存活率的有效途径[22]。该实验中,由温度与合浦珠母贝的半致死时间(T0.5)和全致死时间(T1)间的拟合曲线计算得出,当环境温度为20.048 55 ℃时其半致死时间(T0.5)达到最大,当温度为17.606 35 ℃时其全致死时间(T1)达到最大。有研究[23]认为,当运输环境温度适当的降低10 ℃,多数水生动物的耗氧率和氨类排泄物的产量可降低50%。GOLOMBIESKI等[24]研究也证实,银鲇鱼(Rhamdia quelen)在15 ℃的运输温度下其存活率显著高于20 ℃和25 ℃下的存活率。
大量研究表明,水体缺氧将直接影响到贝类的行为[25]、耗氧率[26]、新陈代谢[27]、生长以及存活[28],缺氧也是引起水生动物运输过程中死亡事故频发的重要因素。有研究[29-30]报道,贝类在长时间的缺氧状态下容易导致血细胞总数降低,即使是贝类恢复到正常溶氧状态下其血细胞数量也难以在短时间内得到恢复。合浦珠母贝为海洋双壳贝类,在溶氧为3 mg/L的水体中仍能够正常生长和存活[15],该实验结果显示,合浦珠母贝稚贝即使是脱离水体暴露在潮湿的空气中达8~15 h时, 稚贝转移到正常水体环境中仍能正常存活。实验中,模拟一般水生动物常用的干露运输、加水运输和包装充氧运输方式,其中,包装充氧运输对合浦珠母贝稚贝的致死时间(T0)、半致死时间(T0.5)和全致死时间(T1)均显著(P < 0.05)大于其他两种运输方式,而加水运输又略优于干露运输。干露运输是贝类在短时间内运输过程中常用的一种运输方式,由于双壳贝类左右壳可长时间闭合,其壳内仍可以保留一部分水, 从而避免鳃丝的暴露而引起的损伤。目前, 无水运输方式在鱼类的运输中也正逐渐兴起,它通过物理或化学的方法使鱼类进入休眠状态[31],然后在无水或潮湿状态下进行运输。但无论是贝类或者是大部分的鱼类都不能长时间的暴露在空气中,鳃丝在缺水状态下容易粘连在一起,加上水份的蒸发容易使鳃损伤丧失呼吸功能。包装充氧的运输方法可以追溯到20世纪50年代,它的首次运用是使用于观赏鱼的运输[32],这种方法现已在许多水生动物的运输中得以普及,目前包括在鱼卵(包括虾、蟹等其他水生动物的卵)、鱼苗(包括虾苗、蟹苗等)、鱼种及一些名贵种类中都得到了很好的应用。通过在密封的包装袋中充入纯氧,使水体中长时间保持较高溶氧,从而大大延长运输时间,该实验中,包装充氧运输相较于干露运输和加水运输方式大大提高了运输时间。但无论是有水运输还是无水运输,都存在一定的局限:有水运输由于设备配置和包装方式等原因出现缺氧、水质恶化及运输过程中的碰撞摩擦容易对贝类造成损害;包装充氧方式比较占空间,运输量有限,不适用于大规格贝的大批量运输,但对于稚贝在较长时间的运输过程中,适当的降低水温和环境的温度可以有效的提高其存活率。
| [1] |
LI J H, YANG C Y, WANG Q H, et al. Growth and survival of host pearl oyster Pinctada fucata martensii (Dunker, 1880) treated by different biofouling-clean methods in China[J]. Estuarine, Coastal and Shelf Science, 2018, 207: 104-108. DOI:10.1016/j.ecss.2018.04.009 |
| [2] |
MENG Z H, ZHANG B, LIU B S, et al. High carotenoids content can enhance resistance of selected Pinctada fucata families to high temperature stress[J]. Fish & Shellfish Immunology, 2017, 61: 211-218. |
| [3] |
LI H M, WANG D Q, DENG Z H, et al. Molecular characterization and expression analysis of chitinase from the pearl oyster Pinctada fucata[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2017, 203: 141-148. DOI:10.1016/j.cbpb.2016.10.007 |
| [4] |
HAO R J, WANG Z M, YANG C Y, et al. Metabolomic responses of juvenile pearl oyster Pinctada maxima to different growth performances[J]. Aquaculture, 2018, 491: 258-265. DOI:10.1016/j.aquaculture.2018.03.050 |
| [5] |
邓正华, 李海梅, 张博, 等. 珠母贝幼虫运动、自然沉降及摄食行为[J]. 中国水产科学, 2018, 25(1): 116-123. DENG Z H, LI H M, ZHANG B, et al. Swimming, natural sedimentation and ingestion of pearl oyster Pinctada margaritifera larvae[J]. Journal of Fishery Sciences of China, 2018, 25(1): 116-123. |
| [6] |
YU F F, PAN Z N, QU B L, et al. Identification of a tyrosinase gene and its functional analysis in melanin synthesis of Pteria penguin[J]. Gene, 2018, 656: 1-8. DOI:10.1016/j.gene.2018.02.060 |
| [7] |
GUAN Y Y, HE M X, WU H B. Differential mantle transcriptomics and characterization of growth-related genes in the diploid and triploid pearl oyster Pinctada fucata[J]. Marine Genomics, 2017, 33: 31-38. DOI:10.1016/j.margen.2017.01.001 |
| [8] |
YU X J, HE W H, LI H X, et al. Larval settlement and metamorphosis of the pearl oyster Pinctada fucata in response to biofilms[J]. Aquaculture, 2010, 306(1/4): 334-337. |
| [9] |
牛志凯, 刘宝锁, 张东玲, 等. 合浦珠母贝3个地理群体杂交后代生长性状和闭壳肌拉力的比较分析[J]. 南方水产科学, 2015, 11(1): 26-32. NIU Z K, LIU B S, ZHANG D L, et al. Comparative analysis of growth traits and shell-closing strength among hybrid populations from three geographical groups of pearl oyster (Pinctada fucata)[J]. South China Fisheries Science, 2015, 11(1): 26-32. DOI:10.3969/j.issn.2095-0780.2015.01.004 |
| [10] |
谭才钢, 刘宝锁, 张东玲, 等. 合浦珠母贝主要形态性状与体质量的灰色关联分析[J]. 南方水产科学, 2015, 11(2): 35-40. TAN C G, LIU B S, ZHANG D L, et al. Analysis of grey relationship between morphological traits and body weight of pearl oyster (Pinctada fucata)[J]. South China Fisheries Science, 2015, 11(2): 35-40. DOI:10.3969/j.issn.2095-0780.2015.02.005 |
| [11] |
王祎哲, 邓正华, 王雨, 等. 合浦珠母贝不同壳色选育系F6数量性状的相关性和通径分析[J]. 中国水产科学, 2018, 25(5): 988-997. WANG Y Z, DENG Z H, WANG Y, et al. Correlation and path analyses of quantitative traits in different shell color F6 lines of pearl oyster (Pinctada fucata)[J]. Journal of Fishery Sciences of China, 2018, 25(5): 988-997. |
| [12] |
刘傲东.运输胁迫对马氏珠母贝生理能量学的影响[D].海口: 海南大学, 2016. LIU A D. Transport stress on the physiological energetics of Pinctada fucata martensii Dunker[D]. Haikou: Hainan University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10589-1016084752.htm |
| [13] |
刘傲东, 李力, 侯令, 等. 缺氧与饥饿对马氏珠母贝滤水率和耗氧率的影响[J]. 基因组学与应用生物学, 2016, 35(3): 595-602. LIU A D, LI L, HOU L, et al. The influences of anoxia and starvation to Pinctada fucata martensii filtration rate and oxygen consumption rate[J]. Genomics and Applied Biology, 2016, 35(3): 595-602. |
| [14] |
POPOVIC N T, STRUNJAK-PEROVIC I, COZ-RAKOVAC R, et al. Tricaine methane-sulfonate (MS-222) application in fish anaesthesia[J]. Journal of Applied Ichthyology, 2012, 28(4): 553-564. DOI:10.1111/j.1439-0426.2012.01950.x |
| [15] |
邓正华.合浦珠母贝摄食生理与幼虫培育研究[D].上海: 上海海洋大学, 2016. DENG Z H. Feeding physiology and larval rearing of the pearl oyster Pinctada fucata[D]. Shanghai: Shanghai Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912234.htm |
| [16] |
范嗣刚, 黄桂菊, 刘宝锁, 等. 盐度和温度对大珠母贝与合浦珠母贝滤水率和摄食率的影响[J]. 水生态学杂志, 2014, 35(3): 61-65. FAN S G, HUANG G J, LIU B S, et al. Effects of salinity and temperature on the filtration rate and ingestion rate of Pinctada maxima and Pinctada fucata[J]. Journal of Hydroecology, 2014, 35(3): 61-65. DOI:10.3969/j.issn.1674-3075.2014.03.010 |
| [17] |
WANG Q H, LIU Y, ZHENG Z, et al. Adaptive response of pearl oyster Pinctada fucata martensii to low water temperature stress[J]. Fish & Shellfish Immunology, 2018, 78: 310-315. |
| [18] |
ALTER K, ANDREWARTHA S J, MORASH A J, et al. Hybrid abalone are more robust to multi-stressor environments than pure parental species[J]. Aquaculture, 2017, 478: 25-34. DOI:10.1016/j.aquaculture.2017.04.035 |
| [19] |
DONAGHY L, LAMBERT C, CHOI K S, et al. Hemocytes of the carpet shell clam (Ruditapes decussatus) and the Manila clam (Ruditapes philippinarum):current knowledge and future prospects[J]. Aquaculture, 2009, 297(1/4): 10-24. |
| [20] |
JIANG W W, LI J Q, GAO Y P, et al. Effects of temperature change on physiological and biochemical responses of Yesso scallop, Patinopecten yessoensis[J]. Aquaculture, 2016, 451: 463-472. DOI:10.1016/j.aquaculture.2015.10.012 |
| [21] |
VINAGRE C, MADEIRA D, NARCISO L, et al. Effect of temperature on oxidative stress in fish:lipid peroxidation and catalase activity in the muscle of juvenile seabass, Dicentrarchus labrax[J]. Ecological Indicators, 2012, 23: 274-279. DOI:10.1016/j.ecolind.2012.04.009 |
| [22] |
刘骁, 谢晶, 黄硕琳. 鱼类保活运输的研究进展[J]. 食品与发酵工业, 2015, 41(8): 255-260. LIU X, XIE J, HUANG S L. Advances research of transportation to keep fish alive[J]. Food and Fermentation Industries, 2015, 41(8): 255-260. |
| [23] |
IWAMA G K, PICKERING A D, SUMPTER J P, et al. Fish stress and health in aquaculture[M]. Cambridge: Cambridge University Press, 2011: 35-72.
|
| [24] |
GOLOMBIESKI J I, SILVA L V F, BALDISSEROTTO B, et al. Transport of silver catfish (Rhamdia quelen) fingerlings at different times, load densities, and temperatures[J]. Aquaculture, 2003, 216(1/4): 95-102. |
| [25] |
TALLQVIST M. Burrowing behaviour of the Baltic clam Macoma balthica:effects of sediment type, hypoxia and predator presence[J]. Marine Ecology Progress Series, 2001, 212: 183-191. DOI:10.3354/meps212183 |
| [26] |
HARRIS J O, MAGUIRE G B, EDWARDS S J, et al. Low dissolved oxygen reduces growth rate and oxygen consumption rate of juvenile greenlip abalone, Haliotis laevigata Donovan[J]. Aquaculture, 1999, 174(3/4): 265-278. |
| [27] |
WILLSON L L, BURNETT L E. Whole animal and gill tissue oxygen uptake in the Eastern oyster, Crassostrea virginica:effects of hypoxia, hypercapnia, air exposure, and infection with the protozoan parasite Perkinsus marinus[J]. Journal of Experimental Marine Biology and Ecology, 2000, 246(2): 223-240. DOI:10.1016/S0022-0981(99)00183-5 |
| [28] |
SAGASTI A, SCHAFFNER L C, DUFFY J E. Effects of periodic hypoxia on mortality, feeding and predation in an estuarine epifaunal community[J]. Journal of Experimental Marine Biology and Ecology, 2001, 258(2): 257-283. DOI:10.1016/S0022-0981(01)00220-9 |
| [29] |
MATOZZO V, MONARI M, FOSCHI J, et al. Exposure to anoxia of the clam Chamelea gallina:I. Effects on immune responses[J]. Journal of Experimental Marine Biology and Ecology, 2005, 325(2): 163-174. DOI:10.1016/j.jembe.2005.04.030 |
| [30] |
周作强, 丁晴晴, 刘其根, 等. 缺氧对贝类的胁迫效应及对其免疫系统的影响[J]. 生态毒理学报, 2013, 8(3): 324-330. ZHOU Z Q, DING Q Q, LIU Q G, et al. Stresses of hypoxia and its effects on immune system of bivalve[J]. Asian Journal of Ecotoxicology, 2013, 8(3): 324-330. |
| [31] |
白艳龙, 谭昭仪, 邸向乾, 等. 黄颡鱼无水保活技术研究[J]. 食品工业科技, 2013, 34(1): 334-337. BAI Y L, TAN Z Y, DI X Q, et al. Research of the keep-alive technology without water of yellow catfish[J]. Science and Technology of Food Industry, 2013, 34(1): 334-337. |
| [32] |
LIM L C, DHERT P, SORGELOOS P. Recent developments and improvements in ornamental fish packaging systems for air transport[J]. Aquaculture Research, 2003, 34(11): 923-935. DOI:10.1046/j.1365-2109.2003.00946.x |
2. Sanya Tropical Fisheries Research Institute, Sanya 572018, Hainan, China;
3. College of Marine Science, Hainan University, Haikou 570228, Hainan, China
 2020,
Vol. 29
2020,
Vol. 29


