2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续开发省部共建教育部重点实验室, 上海 201306;
4. 农业农村部大洋渔业资源环境科学观测实验站, 上海 201306
带鱼(Trichiurus lepturus)[1-2]是暖温性中下层重要经济鱼类,广泛分布于西太平洋、大西洋、印度洋的热带、亚热带和温带沿海海域,具群游性,性极贪食,主要以小鱼及甲壳类为食[3-5]。据FAO统计,全世界2016年带鱼产量为1.28×106 t[6]。其中伊朗水域带鱼是伊朗专属经济区支柱性渔获,也是我国进口带鱼的来源之一。
迄今为止,有关带鱼的研究多与资源分布[7-9]、种群判别[10-12]、年龄生长[13-15]和遗传变异[16]等有关。朱清澄等[17]对印尼阿拉弗拉海带鱼生物学特性进行了研究;PORTSEVP[18]对印度西海岸带鱼摄食习性进行了研究;NAHDI等[19]研究了不同时期阿拉伯海带鱼体长-体质量关系并利用建模方法探讨此区域带鱼时空变化;ABDUL[20]对阿拉伯海带鱼分布及生物学特性进行了研究。目前,关于带鱼耳石形态特征的研究尚未见报道。
鱼类耳石存在于鱼类内耳膜迷路内[21],通常是硬骨鱼类中最先钙化的结构[22-23],主要由碳酸钙(CaCO3)与有机质交互堆积而成[24],倾斜或者平置,对鱼类感知位置信息和身体平衡有着重要作用[25-26]。耳石具有较高的物种特异性[27],在形态大小、微结构特性方面因不同种类存在差异[28-29],故耳石不仅能作为鉴定鱼类年龄及生长分析的重要依据[8],亦能用于种群鉴定[30-33]。本研究对伊朗阿曼湾海域带鱼进行生物学测定,并对其矢耳石进行形态测定及分析,以补充该鱼种早期生物学资料,为年龄鉴定和种群鉴别提供数据资料。
1 材料与方法 1.1 材料来源实验样本采自2017年6—8月,采集海域为25°21′ N~25°41′ N、57°01′ E~57°53′ E(图 1)。随船现场进行常规生物学测量,其中肛长精确到1 mm,体质量精确到0.1 g;利用镊子和解剖刀从带鱼头部平衡囊内取出矢耳石,用超纯水冲洗干净并进行简单干燥处理,干燥后置于信封袋内编号保存。得到完整矢耳石样本251对,其中雌性样本149对,雄性样本102对;样本肛长范围为143~552 mm,平均值为(293.19±69.29)mm,体质量范围为43.1~1 756.1 g,平均值为(351.06±247.00)g。
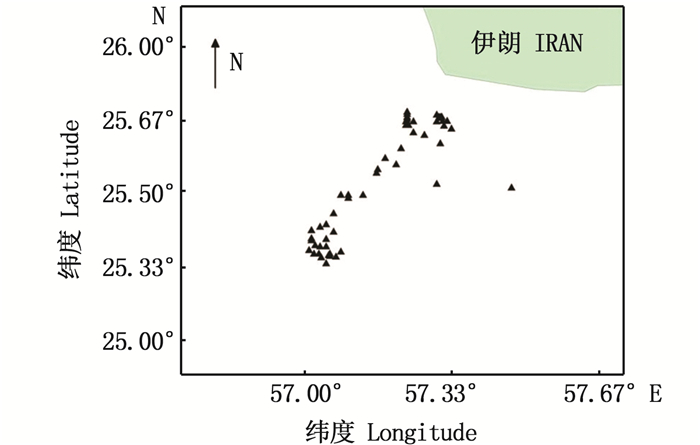
|
图 1 伊朗带鱼样本采集站点 Fig. 1 Sampling sites of Iran T. lepturus |
观察发现,伊朗带鱼的矢耳石可分为4个主要部分[32-36]:前端(Anterior),主间沟左侧,背侧、腹侧前端的叶状凸起,包括基叶、翼叶部分;后端(Posterior),主间沟右侧,背侧、腹侧后端的部分;背侧(Dorsal),主间沟上侧凸起,耳石最厚部分;腹侧(Ventral),主间沟下侧凸起,有不规则锯齿状部分。可观察到明显的基叶、翼叶和主间沟,基叶明显长于翼叶(图 2)。
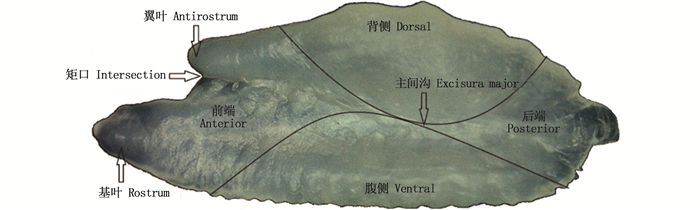
|
图 2 伊朗带鱼矢耳石分区图 Fig. 2 The zoning figure of sagitta otolith in Iran T. lepturus |
结合伊朗带鱼矢耳石外部形态特征和鱼类矢耳石形态分析的研究方法[32-39],测定的伊朗带鱼矢耳石形态学参数包括:
L1:矢耳石的总长(total statolith length, TST);
L2:高度(total statolith height, TSH);
L3:中心到背面的长度(distance from the core to the dorsal, DCD);
L4:中心到后端的长度(distance from the core to the end, DCE);
L5:中心到腹面的长度(distance from the core to the ventral, DCV);
L6:中心到基叶的长度(distance from the core to the rostrum, DCR);
L7:中心到翼叶的长度(distance from the core to the anti-rostrum, DCA);
L8:中心到矩口的长度(distance from the core to the intersection, DCI);
L9:背面到翼叶的长度(distance from the dorsal to the anti-rostrum, DDA);
L10:背面到矩口的长度(distance from the dorsal to the intersection, DDI);
L11:背面到基叶的长度(distance from the dorsal to the rostrum, DDR);
L12:背面到后端的长度(distance from the dorsal to the end, DDE);
L13:腹侧到基叶的长度(distance from the ventral to the rostrum, DVR);
L14:腹侧到矩口的长度(distance from the ventral to the intersection, DVI);
L15:腹侧到翼叶的长度(distance from the ventral to the anti-rostrum, DVA);
L16:腹侧到后端的长度(distance from the ventral to the end, DVE);
L17:基叶到矩口的长度(distance from the rostrum to the intersection, DRI);
L18:基叶到翼叶的长度(distance from the rostrum to the anti-rostrum, DRA);
L19:基叶的长度(total rostrum length, TRL);
L20:翼叶到矩口的长度(distance from the anti-rostrum to the intersection, DAI)。
结合显微镜(NiknoZOO645S体式显微镜)观测图及矢耳石核心区域截面图(图 3),在矢耳石上标识出各个形态参数的具体规范(图 4)。将矢耳石分别置于显微镜下采用CCD拍照并通过数据线将数据传入电脑,随后利用WT-1000GM v 2.0软件测量各形态参数并将数据导出[40]。测量结果精确至0.01 mm;测量2次,若2次测量的误差超过5%[41],则重新测量,否则取其平均值。

|
图 3 伊朗带鱼矢耳石打磨后平面图 Fig. 3 Sagittal plane of otolith with ground surface in Iran T. lepturus |

|
图 4 伊朗带鱼矢耳石形态参数测量示意图 Fig. 4 Measurements figure of the morphology parameter of sagitta otolith in Iran T. lepturus |
利用独立样本t检验方法比较雌雄带鱼矢耳石各参数间差异,检验数据的相关性。
根据显微镜下拍照得出的矢耳石外观图,对其进行直观的形态特征分析。并利用WT-1000GM v 2.0软件依次对每个矢耳石样本进行参数测量。
利用SPSS 23.0软件对矢耳石形态特征数据进行主成分分析[42],得到可用于描述伊朗带鱼矢耳石外型的主要形态参数。
采用Pearson相关分析理论,分析矢耳石形态参数整体及各部分间相关关系,探究矢耳石各部分生长关系及形态变化模式[43]。研究矢耳石外部形态各参数与矢耳石整体间的关系;应用不同的函数对肛长(Al)和体质量(Bm)与矢耳石主要形态参数之间的关系进行拟合分析。
2 结果与分析 2.1 形态特征分析独立样本t检验显示,伊朗带鱼雌雄个体矢耳石整体间没有表现出显著性差异(P>0.05)。性别之间矢耳石形态无差异,可统一进行分析。
伊朗带鱼矢耳石外形相对较大,长度范围为4.74~9.27 mm,宽度范围为1.80~3.91 mm,长明显大于宽, 见表 1。显微镜观测结果:矢耳石整体为长梭形,呈拱桥状弯曲,表面不平整,整体凹凸不平;腹侧有不规则锯齿状缺口,背部的脊突较腹部的叶突明显,主间沟深且明显;有较明显的基叶和翼叶,基叶向前延伸,明显超过翼叶长度。
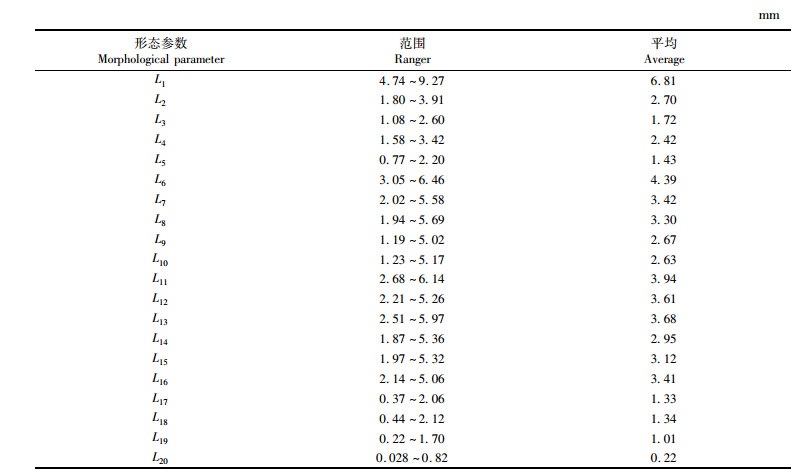
|
表 1 伊朗带鱼矢耳石形态参数值 Tab.1 Morphological parameters of sagitta otolith in Iran T. lepturus |
对上述矢耳石20个形态参数进行公因子方差分析。结果显示,这20个变量的共性方差均大于0.5,且大部分都接近或超过0.9,表明提取的公因子即选定的形态参数能够很好地反应矢耳石形态的主要信息。
对20项形态参数数据进行主成分分析(表 2),结果显示,第1、第2、第3因子解释形态参数的贡献率分别为71.963%、13.725%、5.575%,累计为91.263%。表示这3个公因子可以解释超过91%的总方差。

|
表 2 矢耳石各形态参数主成分分析及成分矩阵(因子载荷矩阵)表 Tab.2 Principal component of morphology parameter and Component Matrix (Factor Load Matrix) of Iran T. lepturus otolith |
用碎石图验证选取前3个主成分是否合理(图 5)。碎石图的判断标准是选取特征值变化趋势由陡峭趋于平缓的转折点,由图可以得出,2、3和4都是较为明显的转折点,所以选取前3个主成分是合理的。
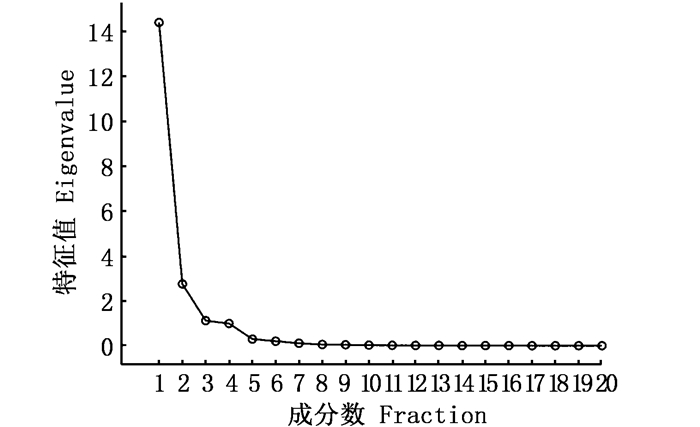
|
图 5 碎石图 Fig. 5 Scree plot |
从表 2可得出:主成分因子1与L1、L2、L6有较大的正相关,载荷系数0.994、0.959和0.989均在0.95以上,表征矢耳石整体变化;主成分因子2与L17、L19有较大正相关,载荷系数分别为0.815和0.771,表征矢耳石前端部分基叶与翼叶的变化;主成分因子3与L20有较大正相关,载荷系数分别为0.636,表征矢耳石基叶及背侧部分变化。
根据以上载荷系数的数据情况,参数TST、TSH、DCR、DRI、TRL以及DAI可代表20项形态参数来描述伊朗带鱼矢耳石的形态特征。
2.3 矢耳石生长模式分析通过分析得到矢耳石的总长(TST)在矢耳石生长过程中占的权重系数最大,所以利用Pearson相关性检验分析矢耳石的总长(TST)与其他各外部形态参数与总长(TST)的比值之间的相关性(表 3),结果显示L1与L2/L1、L4/L1、L5/L1、L11/L1、L16/L1、L17/L1、L18/L1、L19/L1、L20/L1存在负相关,与L3/L1、L6/L1、L7/L1、L8/L1、L9/L1、L10/L1、L12/L1、L13/L1、L14/L1、L15/L1呈正相关(图 6),矢耳石各部分生长模式表现为异速生长。由此可以看出,矢耳石整体变化趋势为:矢耳石长轴、短轴均随着时间异速增长,在此基础上耳石前端及背面的增长速度大于耳石后端及腹侧;基叶、翼叶也随着时间增加越来越明显,翼叶增加速度大于基叶,翼叶向外凸出愈加明显。

|
表 3 矢耳石总长与矢耳石各部分长度与其比值相关性 Tab.3 The correlation between total length and the ratios of the length of sagitta otolith various parts to total length |

|
图 6 正负相关线段示意图 Fig. 6 Positive and negative correlation line segment diagram |
为了分析矢耳石长轴和短轴的相关关系,分别用线性、对数、指数、幂函数方程进行拟合,结果显示:对数函数的拟合效果最好(P<0.01,图 7),其关系式为
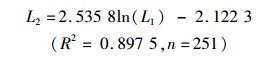 (1)
(1)

|
图 7 带鱼矢耳石长短轴的关系 Fig. 7 Relationship between length and height of T. lepturus otolith |
式中:L2、L1分别为矢耳石的高度(TSH)、矢耳石的总长(TST),n为样本数量。
这表明矢耳石长、短轴异速生长,矢耳石长轴生长速度大于短轴。
通过线性、对数、指数、幂函数模型的拟合分析及Anova模型拟合优度检验结果表明,矢耳石TST、TSH与鱼体肛长(Al)间以对数函数拟合为最佳(P<0.01),而DCR与鱼体肛长间以幂函数拟合最佳(P<0.01,图 8),关系式分别为
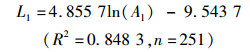 (2)
(2)
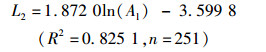 (3)
(3)
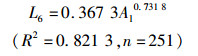 (4)
(4)

|
图 8 肛长与矢耳石主要形态参数的关系 Fig. 8 Relationships between main morphological parameters and anal length of T. lepturus otolith |
式中:L1、L2、L6分别为矢耳石的总长(TST)、矢耳石的高度(TSH)、矢耳石中心到矢耳石基叶的长度(DCR),单位为mm;Al为肛长,单位为cm;n为样本数量。
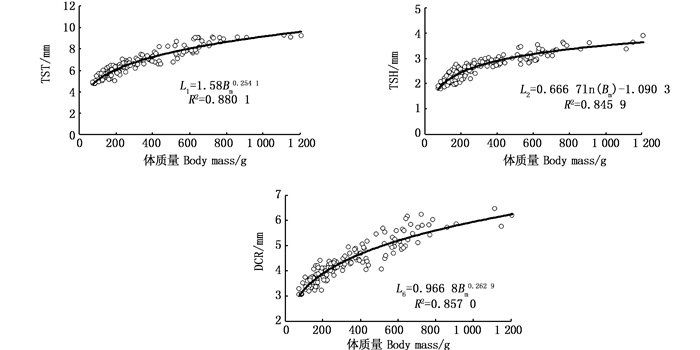
2.3.2 矢耳石主要形态特征值与体质量的关系通过4种模型的拟合分析及Anova模型拟合优度检验结果表明,矢耳石TSH与体质量(Bm)间以对数函数拟合为最佳(P<0.05),而TST、DCR与体质量间以幂函数拟合最佳(P<0.05,图 9),关系式分别为
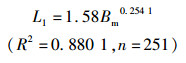 (5)
(5)
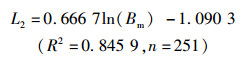 (6)
(6)
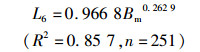 (7)
(7)
|
图 9 体质量与矢耳石主要形态参数的关系 Fig. 9 Relationships between main morphological parameters and body mass of T. lepturus otolith |
式中:L1、L2、L6分别为矢耳石的总长(TST)、矢耳石的高度(TSH)、矢耳石中心到耳石基叶的长度(DCR),单位为mm;Bm为体质量,单位为g;n为样本数量。
3 讨论 3.1 矢耳石形态特征根据显微镜观测结果,伊朗带鱼矢耳石整体呈拱形状突起,表面不平整,可分为前端、后端、背侧和腹侧等4个主要区域,且可观察到较明显的基叶和翼叶,基叶向前延伸,长度明显超过翼叶。伊朗带鱼与罗秉征等[11]、吴鹤洲等[44]研究的同属种类中国近海带鱼矢耳石外形相比,两者存在差异,其相同点是均具有明显的基叶和翼叶,且有明显的主间沟,这说明同种、属的鱼类矢耳石形态也可能会存在较大差异[34, 45],所以矢耳石常被用于鱼类种群鉴定[31],鉴于本研究中的伊朗带鱼矢耳石标本外形特征上均不存在明显差异,可推测样本所属的带鱼群体应当为同一种群。
由主成分分析结果显示,伊朗带鱼的前3个主成分方差累计贡献率可达91.263%,矢耳石的总长(TST)、矢耳石的高度(TSH)矢耳石中心到前端的长度(DCR)、矢耳石基叶到矩口的长度(DRI)、矢耳石基叶的长度(TRL)和矢耳石翼叶到矩口的长度(DAI)可表征矢耳石形态特征,其中TST、TSH和DCR描述了矢耳石整体的变化,DRI、TRL和DAI描述了矢耳石基叶与翼叶的变化。这几项形态指标在今后开展类似鱼类矢耳石形态学研究中可侧重研究。
3.2 矢耳石生长模式不同鱼类的矢耳石与其鱼体呈现出不同的关系[46-47],本研究中,在对肛长、体质量与矢耳石的长、短轴相应的实测数据进行拟合后发现,伊朗带鱼矢耳石的形态指标与鱼体肛长和体质量呈显著的函数关系,这表明矢耳石生长与其个体生长密切相关。因此,在今后研究中可利用本研究建立的函数方程式,通过测量矢耳石形态指标来推算伊朗带鱼的肛长和体质量。
伊朗带鱼矢耳石在整个生长过程中各部分生长模式表现为异速生长。矢耳石整体变化趋势为:矢耳石长、短轴均随着时间异速增长,基叶、翼叶也随着时间增加愈加明显,翼叶生长速度大于基叶。CAMPANA等[27]研究表明,成鱼矢耳石外形特征一般相对稳定,但在生长发育过程中的幼鱼阶段,矢耳石的形态会随着鱼体生长发生较大变化。
由于调查时间及范围的限制,采集的矢耳石样品相对较少,可能会对矢耳石形态特征的研究结果有一定影响,不能全面地了解伊朗带鱼整体状况,在今后的研究中需要加以补充和完善。
| [1] |
吴仁协, 张浩冉, 郭刘军, 等. 中国近海带鱼Trichiurus japonicus的命名和分类学地位研究[J]. 基因组学与应用生物学, 2018, 37(9): 3782-3791. WU R X, ZHANG H R, GUO L J, et al. Study on the nomenclature and taxonomic status of Hairtail Trichiurus japnocus from the Chinese coastal waters[J]. Genomics and Applied Biology, 2018, 37(9): 3782-3791. |
| [2] |
张波. 东、黄海带鱼的摄食习性及随发育的变化[J]. 海洋水产研究, 2004, 25(2): 6-12. ZHANG B. Feeding habits and ontogenetic diet shift of hairtail fish (Trichiurus lepturus) in East China Sea and Yellow Sea[J]. Marine Fisheries Research, 2004, 25(2): 6-12. |
| [3] |
赵洪强.东海带鱼摄食习性的研究[D].杭州: 浙江海洋学院, 2014. ZHAO H Q. Studies on the feeding habits of Trichiurus lepturus in East China Sea[D]. Hangzhou: Zhejiang Ocean University, 2014. http://www.cnki.com.cn/Article/CJFDTotal-HTYY200503002.htm |
| [4] |
颜云榕.北部湾主要鱼类摄食生态及食物关系的研究[D].青岛: 中国科学院研究生院(海洋研究所), 2010. YAN Y R. Feeding ecology and food relations of the main fishes in the Beibu Gulf, South China Sea[D]. Qingdao: Graduate School of Chinese Academic of Sciences Institute of Oceanology, Chinese Academic of Sciences, 2010. http://cdmd.cnki.com.cn/article/cdmd-80068-1011093890.htm |
| [5] |
Cite the Fish Database of Taiwanas K. T. Shao Taiwan Fish Database[EB/OL].(2018-10-13).http://fishdb.sinica.edu.tw.
|
| [6] |
FAO Yearbook. Fishery and aquaculture statistics 2016[M]. Geneva: FAO, 2018.
|
| [7] |
NARASIMHAMK A. Fishery and population dynamics of the ribbonfish Trichiurus lepturus Linnaeus off Kakinada[J]. Journal of the Marine Biological Association of India, 1994, 36(1/2): 23-27. |
| [8] |
王垚, 徐汉祥. 伏季休渔制度下东海区带鱼资源动态分析[J]. 浙江海洋学院学报(自然科学版), 2009, 28(4): 384-388. WANG Y, XU H X. Dymamic analysis on Trichiurus japonicus resources in summer closed fishing syseem in East China Sea[J]. Journal of Zhejiang Ocean University (Natural Science Edition), 2009, 28(4): 384-388. DOI:10.3969/j.issn.1008-830X.2009.04.002 |
| [9] |
严利平, 胡芬, 李圣法, 等. 东海区带鱼伏季休渔效果及其资源的合理利用[J]. 自然资源学报, 2007, 22(4): 606-612. YAN L P, HU F, LI S F, et al. The effect of summer closed fishing and the reasonable utilization on hairtail (Trichiurus japonicus) resources in the East China Sea region[J]. Journal of Natural Resources, 2007, 22(4): 606-612. DOI:10.3321/j.issn:1000-3037.2007.04.012 |
| [10] |
SHAO K T, CHANG K H, LEE S C. Electrophoretic studies of myogens for identification of Trichiuruslepturus and T.japonicus (Pisces:Trichiuridae)[J]. Studies and Essays in Commemoration of the Golden Jubilee of Academia Sinica, 1978, 721-729. |
| [11] |
罗秉征, 卢继武, 黄颂芬.中国近海带鱼耳石生长的地理变异与地理种群的初步探讨[C]//海洋与湖沼论文集.北京: 科学出版社, 1981: 181-194. LUO B Z, LU J W, HUANG S F. The geographical variation of the Otolith growth and classification of populations of the hairtails, Trichiurus haumela (Pisces, Trichiuridae) in the coastal waters of China[C]//Proceedings of Oceanologiaet Limnologia Sinica (Supplement).Beijing: Science Press, 1981: 181-194. |
| [12] |
胡翠林, 张洪亮, 张亚洲, 等. 带鱼保护区春秋季鱼类群落特征及与环境因子的关系[J]. 水产学报, 2018, 42(5): 694-703. HU C L, ZHANG H L, ZHANG Y Z, et al. Fish community structure and its relationship with environmental factors in the Nature Reserve of Trichiurus japonicus[J]. Journal of Fisheries of China, 2018, 42(5): 694-703. |
| [13] |
严利平, 胡芬, 李建生, 等. 东海带鱼年龄与生长的研究[J]. 海洋渔业, 2005, 27(2): 139-142. YAN L P, HU F, LI J S, et al. Age and growth of Trichiurus haumela in the East China Sea[J]. Marine Fisheries, 2005, 27(2): 139-142. DOI:10.3969/j.issn.1004-2490.2005.02.009 |
| [14] |
吴家骓. 浙江近海渔场带鱼的年龄和生长[J]. 浙江水产学院学报, 1985, 4(1): 9-23. WU J Z. Age and Growth of Trichiurus lepturus on the off-shore Fishing ground of Zhejiang Province[J]. Journal of Zhejiang Ocean University, 1985, 4(1): 9-23. |
| [15] |
洪秀云. 渤、黄海带鱼年龄与生长的研究[J]. 水产学报, 1980, 4(4): 361-370. HONG X Y. A study on the age and growth of the Hairtail in the Bo Hai and Huang Hai[J]. Journal of Fisheries of China, 1980, 4(4): 361-370. |
| [16] |
HSU K C, SHIHNT, NI IH, et al. Genetic variation in Trichiurus lepturus (perciformes:Trichiuridae) in waters off Taiwan:Several species or cohort contribution?[J]. The Raffles Bulletin of Zoology, 2007, 14: 886-892. |
| [17] |
朱清澄, 马伟刚, 花传祥, 等. 印尼阿拉弗拉海大西洋带鱼生物学特性的初步研究[J]. 上海水产大学学报, 2009, 18(5): 593-598. ZHU Q C, MA W G, HUA C X, et al. Study on biological characteristics of Trichiurus lepturusin the Arafura Sea of Indonesia[J]. Journal of Shanghai Ocean University, 2009, 18(5): 593-598. |
| [18] |
PORTSEVP I. The feeding of the cutlassfish, Trichiurus lepturus (Trichiuridae), off the west coast of India[J]. Journal of Ichthyology, 1980, 20(5): 60-65. |
| [19] |
AL NAHDI A, DE LEANIZ C G, KING A J. Spatio-temporal variation in length-weight relationships and condition of the ribbonfish Trichiurus lepturus (linnaeus, 1758):implications for fisheries management[J]. PLoS One, 2016, 11(8): e0161989. DOI:10.1371/journal.pone.0161989 |
| [20] |
ABDUL A P.Determination of the distribution pattern of ribbonfish Trichiurus lepturus Linnaeus, 1758 commercially exploited off Saurashtra Coast, Gujarat with its biology on a GIS platform[D]. JAU, JUNAGADH, 2014.
|
| [21] |
陈新军, 刘金立, 许强华. 头足类种群鉴定方法研究进展[J]. 上海水产大学学报, 2006, 15(2): 228-233. CHEN X J, LIU J L, XU Q H. Current status and prospects of identification methods on the Cephalopod population[J]. Journal of Shanghai Fisheries University, 2006, 15(2): 228-233. |
| [22] |
裘海雅, 徐东坡, 施炜纲. 鱼类耳石与年龄关系的研究进展[J]. 浙江海洋学院学报(自然科学版), 2009, 28(3): 331-337, 374. QIU H Y, XU D P, SHI W G. A review of the relationship between Fish Otolish and age[J]. Journal of Zhejiang Ocean University (Natural Science), 2009, 28(3): 331-337, 374. |
| [23] |
GEFFEN A J. Otolith ring deposition in relation to growth rate in herring (Clupea harengus) and turbot (Scophthalmus maximus) larvae[J]. Marine Biology, 1982, 71(3): 317-326. DOI:10.1007/BF00397048 |
| [24] |
PANFILIJ, TOMÁS J, MORALES-NIN B. Otolith microstructure in tropical fish[M]//GREEN B S, MAPSTONE B D, CARLOS G, et al. Tropical Fish Otoliths: Information for Assessment, Management and Ecology. Dordrecht: Springer, 2009: 212-248.
|
| [25] |
于世亮, 张旭光, 张云峰, 等. 长蛸平衡囊的形态结构和神经支配模式[J]. 上海海洋大学学报, 2016, 25(1): 34-43. YU S L, ZHANG X G, ZHANG Y F, et al. Morphology, structure and innervation of the statocyst in Octopus variabilis[J]. Journal of Shanghai Ocean University, 2016, 25(1): 34-43. |
| [26] |
朱国平, 魏联. 南极鱼类年龄与生长研究进展[J]. 水产学报, 2017, 41(10): 1638-1647. ZHU G P, WEI L. Age and growth of Antarctic fish species:a review[J]. Journal of Fisheries of China, 2017, 41(10): 1638-1647. |
| [27] |
CAMPANA S E, CASSELMAN J M. Stock discrimination using otolith shape analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1993, 50(5): 1062-1083. DOI:10.1139/f93-123 |
| [28] |
MUGIYAY, UCHIMURA T. Otolithresorption induced by anaerobic stress in the goldfish, Carassius auratus[J]. Journal of Fish Biology, 1989, 35(6): 813-818. DOI:10.1111/j.1095-8649.1989.tb03032.x |
| [29] |
CARLSTR M D. A crystallographic study of vertebrate otoliths[J]. Biological Bulletin, 1963, 125(3): 441-463. DOI:10.2307/1539358 |
| [30] |
胡贯宇, 方舟, 陈新军. 东太平洋茎柔鱼生活史研究进展[J]. 水产学报, 2018, 42(8): 1315-1328. HU G Y, FANG Z, CHEN X J. Review on the life history of jumbo squid (Dosidicus gigas) in the Eastern Pacific Ocean[J]. Journal of Fisheries of China, 2018, 42(8): 1315-1328. |
| [31] |
ARKHIPKIN A I. Towards identification of the ecological lifestyle in nektonic squid using statolith morphometry[J]. Journal of Molluscan Studies, 2003, 69(3): 171-178. DOI:10.1093/mollus/69.3.171 |
| [32] |
方舟, 叶旭昌, 李凤莹, 等. 摩洛哥南部沿岸两种沙丁鱼耳石形态识别的初步研究[J]. 上海海洋大学学报, 2014, 23(3): 448-455. FANG Z, YE X C, LI F Y, et al. Using otolith morphology to identify Sardinellaaurita and Sardinapilchardus in south coastal waters of Morocco[J]. Journal of Shanghai Ocean University, 2014, 23(3): 448-455. |
| [33] |
MESSIEH S N. Use of otoliths in identifying herring stocks in the southern gulf of St. Lawrence and adjacent waters[J]. Journal of the Fisheries Research Board of Canada, 1972, 29(8): 1113-1118. DOI:10.1139/f72-166 |
| [34] |
GAEMERS P A M. Taxonomic position of the cichlidae (Pisces, Perciformes) as demonstrated by the morphology of their otoliths[J]. Netherlands Journal of Zoology, 1983, 34(4): 566-595. DOI:10.1163/002829684X00290 |
| [35] |
郭弘艺, 唐文乔, 魏凯, 等. 中国鲚属鱼类的矢耳石形态特征[J]. 动物学杂志, 2007, 42(1): 39-47. GUO H Y, TANG W Q, WEI K, et al. Morphologic characters of the sagittal otoliths of the fishes of the genus Coilia from China[J]. Chinese Journal of Zoology, 2007, 42(1): 39-47. |
| [36] |
魏联, 刘子俊, 朱国平. 阿根廷外海拉式南美南极鱼矢耳石形态特征分析[J]. 海洋渔业, 2017, 39(3): 256-266. WEI L, LIU Z J, ZHU G P. Morphological features of sagittal otolith for Patagonotothen ramsayi from the waters off Argentina[J]. Marine Fisheries, 2017, 39(3): 256-266. DOI:10.3969/j.issn.1004-2490.2017.03.003 |
| [37] |
邹莉瑾, 张敏, 邹晓荣, 等. 东南太平洋公海智利竹荚鱼年龄与生长研究[J]. 上海海洋大学学报, 2010, 19(1): 61-67. ZOU L J, ZHANG M, ZOU X R, et al. Age and growth of Chilean jack mackerel (Trachurus murphyi) in the high sea waters of southeast Pacific[J]. Journal of Shanghai Ocean University, 2010, 19(1): 61-67. |
| [38] |
刘必林, 陈新军, 钟俊生. 印度洋西北海域鸢乌贼耳石的形态特征分析[J]. 上海水产大学学报, 2008, 17(5): 604-609. LIU B L, CHEN X J, ZHONG J S. Statolith morphology of the purpleback flying squid Sthenoeuthis oualaniensis in the northwest Indian Ocean[J]. Journal of Shanghai Fisheries University, 2008, 17(5): 604-609. |
| [39] |
吴超, 邹晓荣, 张敏, 等. 东南太平洋智利竹荚鱼矢耳石的形态特征分析[J]. 上海海洋大学学报, 2011, 20(6): 895-901. WU C, ZOU X R, ZHANG M, et al. Study on sagitta morphology of Chilean jack mackerel (Trachurus murphyi) in the southeast Pacific Ocean[J]. Journal of Shanghai Ocean University, 2011, 20(6): 895-901. |
| [40] |
宋利明, 吕凯凯, 杨嘉樑, 等. 马绍尔群岛海域大眼金枪鱼耳石形态[J]. 上海海洋大学学报, 2012, 21(5): 884-891. SONG L M, LÜ K K, YANG J L, et al. Morphology of bigeye tuna otolith in waters near Marshall Islands[J]. Journal of Shanghai Ocean University, 2012, 21(5): 884-891. |
| [41] |
吕凯凯.马绍尔群岛海域大眼金枪鱼(Thunnus obesus)年龄与生长研究[D].上海: 上海海洋大学, 2011. LÜ K K. Age and growth of bigeye tuna (Thunnus obesus) in waters near Marshall Islands[D]. Shanghai: Shanghai Ocean University, 2010. http://cdmd.cnki.com.cn/article/cdmd-10264-1011305058.htm |
| [42] |
张尧庭, 方开泰. 多元统计分析引论[M]. 武汉: 武汉大学出版社, 2013: 316-332. ZHANG Y T, FANG K T. Introduction to multivariate statistical analysis[M]. Wuhan: Wuhan University Press, 2013: 316-332. |
| [43] |
张阳.西北太平洋公海秋刀鱼生物学特性与耳石形态研究[D].上海: 上海海洋大学, 2012. ZHANG Y. Preliminary study on fishery biology and otolith morphology of Pacific Saury in the southwest of Pacific Ocean[D].Shanghai: Shanghai Ocean University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000029.htm |
| [44] |
吴鹤洲, 成贵书, 王建飞. 带鱼年龄鉴定问题探讨[J]. 海洋与湖沼, 1985, 16(5): 408-416, 430. WU H Z, CHENG G S, WANG J F. A study on the ageing of Hairtails, Trichiurus haumela (Forskal)[J]. OceanologiaetLimnologiaSinica, 1985, 16(5): 408-416, 430. |
| [45] |
李凤莹, 朱国平, 许柳雄. 西南大西洋拉式南美南极鱼耳石外型特征[J]. 生态科学, 2014, 33(1): 7-11. LI F Y, ZHU G P, XU L X. Morphometric features of otolith for rockcod (Patagonotothen ramsayi) in the Southwestern Atlantic Ocean[J]. Ecological Science, 2014, 33(1): 7-11. |
| [46] |
CLARKE M R, MADDOCK L. 9-Statoliths from living species of cephalopods and evolution[M]//CLARKE M R, TRUEMAN E R.Paleontology and Neontology of Cephalopods. London: Academic Press, 1988: 169-184.
|
| [47] |
郑文莲.中国鲹科等鱼类耳石形态的比较研究[C]//鱼类学论文集: 第2辑.北京: 科学出版社, 1981: 39-54. ZHENG W L. Comparative morphological studies of the otoliths of chinese Carangidae and other fish families[C]//Proceedings of Transactions of The Chinese Ichthyological Society: No.2. Beijing: Science Press, 1981: 39-54. |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


