2. 浙江海洋大学 海洋与渔业研究所, 浙江 舟山 316021;
3. 浙江海洋大学 水产学院, 浙江 舟山 316022
小黄鱼(Larimichthys polyactis)和大黄鱼(L. crocea),同属于硬骨鱼纲(Osteicthys),鲈形目(Perciformes),石首鱼科(Sciaenidae),黄鱼属(Larimichthys) [1],均为我国近海重要经济鱼类,其肉质鲜美、营养丰富深受广大消费者喜爱。20世纪80年代后期,大黄鱼人工繁殖取得成功,随后大黄鱼在福建和浙江等省迅速发展成为主要养殖鱼类[2]。但是,多年的盲目累代近交和高密度的近海网箱养殖,导致当前的养殖大黄鱼种质退化严重,主要表现为:生长速度慢、抗病性差、肉质差等[3],因此,进行大黄鱼的种质改良意义重大。小黄鱼的人工繁殖于2015年取得成功[4],2017年实现规模化繁殖,并且开始在舟山和宁波等地进行近海网箱示范养殖。养殖过程中发现,养殖小黄鱼与野生小黄鱼一样表现出明显的个体小型化现象[5],1年性成熟之后个体生长速度明显下降,2龄的小黄鱼体质量远远小于同期的大黄鱼。
杂交育种是进行种质改良的一个行之有效的方法,许多鱼类利用该方法获得了性状优良的杂交种,如“高邮杂交鲫”[6]、“杂交翘嘴鲂”[7]、“合方鲫”[8]等。大黄鱼与其他鱼类,如黄姑鱼(Nibea albiflora) [9-11]、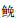
实验鱼为2017年4月下旬在浙江省海洋水产研究所试验场通过人工授精繁殖的小黄鱼、大黄鱼及其杂交子代(小黄鱼♀×大黄鱼♂),3种鱼于1 m3的玻璃钢丝桶中单独孵化培育至30日龄,分别随机取样1 000尾混合养殖于10 m3室内水泥池中,每天8:00和16:00各投喂1次人工配合饲料,随着鱼体长大适时更换更大粒径的饲料,投喂量约为体质量的3%~5%,投喂后1 h换水70%~80%。实验用水为经过黑暗沉淀后的沙滤海水,养殖过程中水温随着气温逐渐从18 ℃增加至28 ℃,盐度27~29,溶氧>5.5 mg/L,pH 7.6~8.5。待苗种达到90日龄时,转移到20 m3室内水泥池中养殖,养殖管理方式不变,海水盐度、溶氧不变,水温随着气温逐渐从28 ℃降低至15 ℃。实验鱼生长至3月龄、4月龄、6月龄、8月龄、11月龄、15月龄,分别从混合群体中随机捞取小黄鱼、大黄鱼及其杂交子代,利用丁香酚麻醉后用电子天平准确测定每尾实验鱼体质量(body weight, Y),精确到0.01 g。除了8月龄时期,其他时期取样30尾。8月龄时,3种鱼各200尾,用游标卡尺测量形态性状,包括全长(total length, X1),体长(body length, X2),头长(head length, X3),躯干长(trunk length, X4),尾部长(tail length, X5),尾柄长(caudal peduncle length, X6),尾柄高(caudal peduncle depth, X7),体高(body depth, X8),精确至0.01 cm。通过鳔支管形态区分3种鱼:小黄鱼鳔支管两分支不等长;大黄鱼鳔支管两分支近乎等长;杂交子代鳔支管首先分为两支,其中一支在与另一支几乎等长的位置再分为不等长的两支。各形态性状测量方法如表 1所述,用于进行3种鱼形态性状的差异分析。
|
表 1 3种鱼的形态性状的详细描述 Tab.1 Detailed description of the traits |
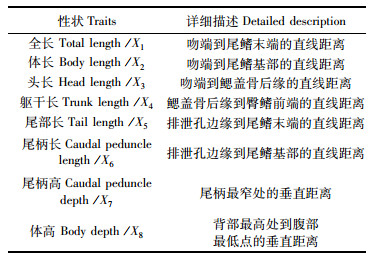
首先对测得的数据进行筛查,删除具有明显错误的样本数据。整理后的数据使用SPSS 19.0软件进行描述性统计分析。根据公式计算3种鱼的肥满度(condition factor, CF)。为了消除鱼体规格大小对各形态性状数据的影响,在进行多元统计分析之前,先将每尾鱼的所有形态性状除以其体长,进行数据标准化,然后采用欧氏距离的最短距离系统聚类法对3个群体的7个比例性状数据进行聚类分析,构建聚类关系树,用以阐明群体间的亲疏关系;采用逐步判别分析方法对3个群体样本进行判别分析,区分3个群体所有样本个体的归属;筛选出对3种鱼形态差异贡献率较大的性状分别建立判别函数,用以判别检验所有样本,并计算各群体判别准确率及综合判别准确率。肥满度和判别准确率的计算公式如下:
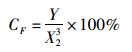 (1)
(1)
式中: CF为肥满度;Y为体质量,g;X2为体长,cm。
判别准确率%=判别正确的样本数/样本总量× 100%;
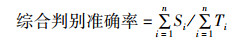 (2)
(2)
式中:n表示群体数,Si表示第i个群体判别正确的样本数,Ti表示第i个群体总样本数。
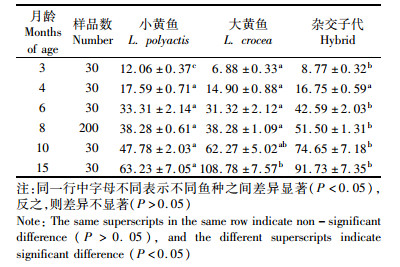
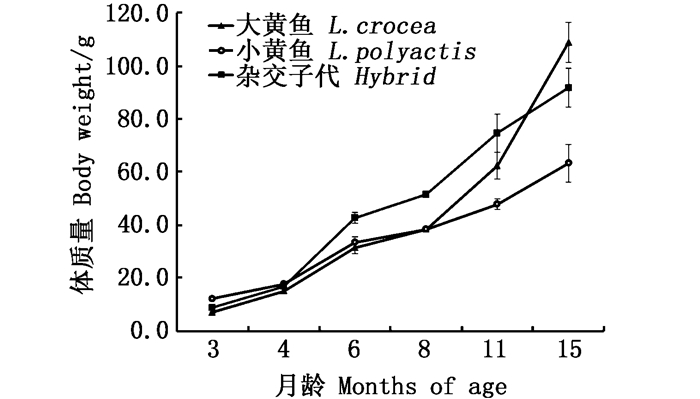
2 结果与分析 2.1 3种鱼不同月龄体质量比较分析通过表型性状体质量的测定分析实现了对同池混养的3种鱼进行生长对比分析,表 2为3种鱼在3、4、6、8、11、15月龄时期的体质量统计结果。通过单因素方差分析可以得知,除了4月龄时,3种鱼在不同月龄时期体质量存在显著差异(P < 0.05),从图 1中可清楚地看出3月龄时,小黄鱼体质量高于大黄鱼和杂交子代,但是到四月龄的时候三者较为接近,经过差异显著性检验得知,三者已经无显著差异,4月龄至6月龄,3种鱼体质量均迅速增加,表现出较高的生长速度,其中杂交子代体质量显著高于大黄鱼和小黄鱼,此状态一直维持到11月龄,随着大黄鱼生长速度的明显增加,到15月龄的时候,大黄鱼体质量高于小黄鱼和杂交子代。
|
表 2 不同月龄小黄鱼、大黄鱼及其杂交子代体质量的统计分析结果(Mean±SE) Tab.2 Statistics of body weight among L. crocea, L. polyactis and their hybrids within different months of age |
|
图 1 大黄鱼、小黄鱼及杂交子代生长过程中体质量变化曲线 Fig. 1 Curve of body weight change during growth of L. crocea, L. polyactis and their hybrids |
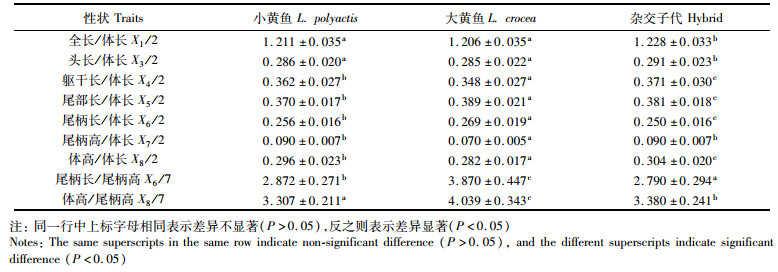
8月龄样品数据经过筛选(剔除体表有伤、烂嘴及烂鳍个体)后,小黄鱼、大黄鱼及杂交子代的有效样品数量分别为170、168及189尾。利用SPSS软件对数据进行统计分析,包括各性状的均值及变异系数的计算,以及3种鱼之间各性状表型值的差异显著性分析,结果列于表 3。从表中可以看出,所有表型性状中,体质量的变异系数远大于形态性状。3种鱼的表型性状变异系数从大到小依次为大黄鱼>杂交鱼>小黄鱼。此外,杂交鱼体质量和肥满度均显著高于大黄鱼和小黄鱼(P < 0.05),说明此时杂交鱼具有明显的生长优势。比较发现,大黄鱼的X5与杂交鱼的差异不显著,但是显著大于小黄鱼,另外大黄鱼的X6显著大于小黄鱼和杂交鱼。除了X5和X6,杂交鱼的形态性状测量值均显著高于大黄鱼和小黄鱼(P < 0.05)。

|
表 3 8月龄的小黄鱼、大黄鱼及其杂交子代表型数据描述性统计 Tab.3 Descriptive statistics of phenotypic data of L. crocea, L. polyactis and hybrids at 8 month of age |
对3个群体的7个标准化性状(作为参照的体长性状剔除)进行方差分析,结果表明,3个群体间形态性状差异显著(P < 0.05,表 3)。3种鱼的X6/X7从大到小依次为大黄鱼>小黄鱼>杂交鱼,说明大黄鱼的尾柄较小黄鱼和杂交鱼更为细长。另外,X8/X7在3种鱼之间存在显著差异(P < 0.05),从大到小依次为大黄鱼>杂交鱼>小黄鱼。此结果显示,杂交鱼在形态性状上与大黄鱼、小黄鱼存在一定差异,可以据此区分3种鱼。
|
表 4 3种鱼形态比例性状的比较分析(平均值±标准差) Tab.4 One-Way ANOVA for target traits of three fish populations (Mean±SD) |
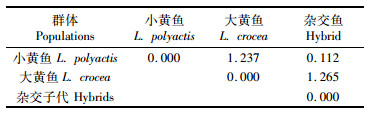
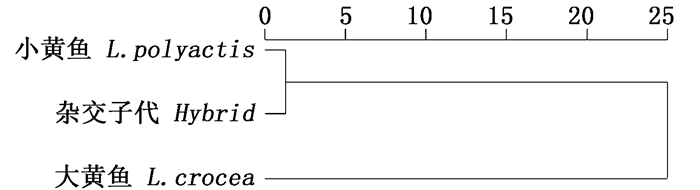
对小黄鱼、大黄鱼及杂交子代形态性状进行系统聚类分析。表 5为3种鱼标准化性状的聚类分析过程中获得的欧氏距离。从表中可以看出,杂交鱼与小黄鱼形态性状的欧氏距离最小,为0.112,所以在构建树状图时,杂交鱼与小黄鱼首先聚在一起,最后与欧氏距离较大的大黄鱼聚在一起。据此,可绘制系统聚类树状图(图 2)。从图 2中可以直观看出,杂交子代的形态性状与小黄鱼群体更为接近,并且两者与大黄鱼的遗传关系均较远。由此可知杂交子代在形态上更倾向于母本。
|
表 5 3个群体的欧氏距离(以形态差异为标准) Tab.5 Normalized euclidean distance of morphology among the three populations |
|
图 2 3个群体聚类分析树状图 Fig. 2 Cluster dendrogram of the three kinds of fish species according to morphological traits |
以3个群体所有样本的7个标准化形态性状作为候选变量进行逐步判别分析。根据各变量对模型的贡献大小,逐步剔除不相关变量,最终筛选出了对判别贡献较大的5个性状,包括X1/X2、X5/X2、X6/X2、X8/X2和X6/X7,据此可建立各个群体的判别函数。小黄鱼(Y1)、大黄鱼(Y2)及杂交鱼(Y3)的判别函数公式分别为:
Y1=-802.482-949.656×X1/X2+631.351×X5/X2+30.026×X6/X2+517.302×X8/X2+20.148×X6/X7;
Y2=-828.755-945.472×X1/X2+686.114×X5/X2-169.013×X6/X2+560.075×X8/X2+35.131×X6/X7;
Y3=-828.058-961.283×X1/X2+678.975×X5/X2-40.071×X6/X2+542.647×X8/X2+21.442×X6/X7。
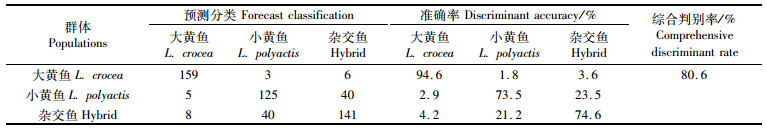
利用所建立的判别函数,对3个群体的样本进行预测分类,判别结果见表 6。结果表明3个群体的判别准确率由大到小依次为大黄鱼、杂交鱼、小黄鱼。综合判别率为80.6%。其中杂交鱼与小黄鱼判别准确率较低,两者相互误判率达到20%以上。
|
表 6 大黄鱼、小黄鱼及杂交鱼群体间判别分析 Tab.6 Discrimination analysis among three populations |
根据表 5中各个群体的判别准确率,可以发现3个群体中有一些个体的判别存在误差,为了探究其原因,作图 3。图 3所示为3个群体样本在判别空间中的分布情况。可以看出,大黄鱼与小黄鱼、杂交鱼群体区分较为明显,只有极少数的重合。而小黄鱼与杂交鱼重叠区域较大,即两者混杂较为严重,导致较多样本的误判,此结果与判别分析所得表 7结果相一致,进一步说明杂交鱼形态特征更倾向于小黄鱼群体,表现出母本效应。

|
图 3 4个地区小黄鱼判别典型得分散点图 Fig. 3 Scatter plots of canonical scores for four L. polyactis populations |
杂交育种是进行遗传改良的重要技术方法之一,鉴于此,我们进行小黄鱼和大黄鱼的杂交试验,期望借此培育出生长速度快、肉质鲜美、能够有效克服个体小型化的优良杂交后代。小黄鱼和大黄鱼均属于鲈形目石首鱼科,是黄鱼属内不同的两个种,因此,它们之间的杂交属于种间杂交。通常条件下,种间杂交成活率较低,杂交很难获得成功。但是小黄鱼与大黄鱼的杂交试验中,杂交子代的成活率较高,苗种可以正常的生长,此结果为进一步开展小黄鱼与大黄鱼的杂交育种奠定了重要基础。
本次研究发现,在整个生长过程中,小黄鱼显现一个较为稳定的生长速度,在8月龄到11月龄左右,生长速度有所降低,主要原因是此时是小黄鱼处于性腺发育繁殖时期,大量能量用于个体繁殖,生长相对停止。大黄鱼在11月龄之后表现出非常明显的生长加速直至反超杂交子代,主要原因是此时水温适宜大黄鱼生长,而且由于大黄鱼两年性成熟,所以此时所有能量全部用于生长。所以,经过15个月的跟踪测量对比分析,我们可以得出杂交子代表现为中亲优势。此结果对于解决小黄鱼体型小、生长较慢的问题具有重要意义。
3.2 杂交子代形态性状的母本效应亲本对后代基因的传递情况一直为杂交育种研究的重点,研究表明,杂交种的形态性状较为常见的是偏向于母本,即存在母本效应,然而杂交种性状变化又有其复杂性,有的性状并不遵循这一规律,如三角鲂和团头鲂的正反杂交种中存在一定的母性效应,但是一些比例性状参数和校正参数均出现偏离双亲的现象[19];高邮杂交鲫的主要形态性状偏向于母本,但是有部分性状则是介于双亲之间[6]。因此,杂交种的形态性状表现形式总体上可以分为3种类型:倾向父本、中间型和倾向母本。本研究中,小黄鱼(♀)与大黄鱼(♂)杂交子代的形态性状与母本的差异性远远低于父本,即杂交子代的各形态指标与父本大黄鱼差异较大,更接近母本小黄鱼,属于母本倾向型,该研究结果与王燕等[20]和吴水清等[21]报道的杂交石斑鱼在外部形态方面更偏向于母本的研究结果相一致。
3.3 形态差异分析鱼类的形态性状是生物最直观的种质表现之一,是分类的重要依据。形态性状差异较大的两个亲本杂交,产生的后代所具有的形态性状一般介于两亲本之间,因此能够通过形态特征对杂交种进行鉴定。本次研究中涉及的两个亲本在体型、尾柄长与尾柄高的比例等方面均有较大差异,因此利用形态差异进行杂交种及双亲的区分是可行的。鱼类属间、亚属间及种间杂交产生的形态差异研究已有较多报道[22-24]。本次研究发现,杂交子代与母本小黄鱼群体的形态差异明显较小,而与父本大黄鱼群体的形态性状差异则相对较大,说明杂交子代的形态性状更偏向于母本小黄鱼,该结果在赤眼鳟(Squaliobarbus curriculus)) ♀×鳙(Aristichthys nobilis) ♂ [25]、杂交石斑鱼[26]、杂交黄颡鱼[27]等研究中均有相似报道。出现这一现象的可能原因是杂交子代受到母本效应的影响,或者是杂交受精卵在发育过程中线粒体基因起了重要作用[28-29]。判别分析是一种根据观测指标对研究对象进行分类的多元统计分析方法,在鱼类形态学分析上得到了广泛的应用。如俞菊华等[30]通过形态学方法对奥利亚罗非鱼(Oreochromisco aureus) ♀ ×鳜(Siniperca chuatsi) ♂以及回交子代进行判别分析,判别准确率在90%以上;关文志等[31]对团头鲂与三角鲂或长春鳊杂交后代的形态性状进行判别分析,综合判别准确率86.3%;李冰等[32]利用判别分析方法从形态上区分了建鲤、黑龙江野鲤以及正反交F1,综合判别准确率为87.5%。本研究运用逐步判别法,筛选出5个不同的变量,分别构建了小黄鱼、大黄鱼及杂交鱼群体的判别公式,将标准化的形态性状数据代入方程,判定所有样本的归属,最终获得综合判别准确率为80.6%,其中,大黄鱼的判别准确率最高,为94.6%,而小黄鱼和杂交鱼的判别准确率较为接近,分别为73.5%和74.6%,两者均远低于大黄鱼。出现这种现象的主要原因是杂交子代形态性状与小黄鱼较为接近,两者在形态数据上存在较多的重合,导致两者之间误判率较高,降低了判别准确率。由此可见,判别准确率的高低能够反映出群体间形态学差异的程度。
3.4 判别准确率影响分析聚类分析和判别分析都是利用鱼类外部形态性状数据进行分析,因此,选取形态性状数目的多少对结果有很大的影响:选取数目较少可能会遗漏重要的性状,导致聚类分析不准确、判别准确率减低等。田永胜等[33]利用14个数量性状对云龙斑进行了研究,综合判别率达到98.85%;马海涛等[34]利用22个形态学数据对大菱鲆(Scophthalmus maximus)与星斑川鲽(Platichthys stellatus)的杂交种进行了判别分析,综合判别率为98.90%;李思发等[35]利用32个形态参数对吉奥罗非鱼及其亲本进行判别分析,判别准确率达93.3%。本研究中用8个性状对杂交鱼与亲本的形态差异进行研究,综合判别准确率为80.6%,稍小于上述研究结果,主要原因就是用于分析的形态性状偏少,因此,如果增加形态性状数量可以有效提高形态分类的判别能力[36-37],从而更加准确区分小黄鱼、大黄鱼和杂交鱼。
4 结论本次研究以小黄鱼、大黄鱼及杂交子代为研究对象,利用方差分析和多元统计分析方法研究了表型遗传变异情况,结果显示,杂交子代在8月龄时具有明显的生长优势,与小黄鱼亲缘关系更为接近,并且其形态性状总体上偏向小黄鱼,表现出母本效应。通过形态性状对8月龄的3种鱼进行判别分析,得知对大黄鱼的判别准确率最高,由于杂交子代与小黄鱼形态性状接近,所以两者的判别准确率较低,最终获得三者的综合判别准确率为80.6%。综上,小黄鱼、大黄鱼及杂交子代在形态上存在较明显差异,但是三者之间形态差异产生的原因,需要借助其他技术对其进行遗传本质上的研究。杂交子代在生长方面表现出一定的杂种优势,要深入分析杂种优势形成机制需借助分子标记方法,这些研究结果将为大黄鱼、小黄鱼的杂交育种提供理论指导。
| [1] |
朱元鼎, 伍汉霖, 金鑫波, 等. 福建鱼类志[M]. 福州: 福建科学技术出版社, 1984. ZHU Y D, WU H L, JIN X B, et al. The ichthyography of Fujian[M]. Fuzhou: Fujian Science and Technology Press, 1984. |
| [2] |
林丹军, 张健, 郑智莺, 等. 大黄鱼的人工繁殖研究[J]. 福建师范大学学报(自然科学版), 1991, 7(3): 71-79. LIN D J, ZHANG J, ZHENG Z Y, et al. Studies on the artificial propagation of the large yellow croake, Pseudosciaena crocea(Richardson)[J]. Journal of Fujian Normal University (Natural Science), 1991, 7(3): 71-79. |
| [3] |
颜孙安, 姚清华, 林香信, 等. 不同养殖模式大黄鱼肌肉营养成分比较[J]. 福建农业学报, 2015, 30(8): 736-744. YAN S A, YAO Q H, LIN X X, et al. Nutrient profile of large yellow croakers (Pseudosciaena crocea Richardson) grown under different aquacultural settings[J]. Fujian Journal of Agricultural Sciences, 2015, 30(8): 736-744. DOI:10.3969/j.issn.1008-0384.2015.08.003 |
| [4] |
陈睿毅, 楼宝, 詹炜, 等. 小黄鱼亲鱼驯养及苗种繁育[J]. 科学养鱼, 2016(1): 42-43. CHEN R Y, LOU B, ZHAN W, et al. Brood fish domesticating and fry breeding of small yellow croaker Larimichthys polyactis[J]. Scientific Fish Farming, 2016(1): 42-43. |
| [5] |
林龙山, 程家骅, 任一平, 等. 东海区小黄鱼种群生物学特性的分析[J]. 中国水产科学, 2004, 11(4): 333-338. LIN L S, CHENG J H, REN Y P, et al. Analysis of population biology of small yellow croaker Pseudosciaena polyactis in the East China Sea region[J]. Journal of Fishery Sciences of China, 2004, 11(4): 333-338. DOI:10.3321/j.issn:1005-8737.2004.04.010 |
| [6] |
楼允东, 张克俭, 徐庆登, 等. 高邮杂交鲫及其亲本遗传性状的比较研究[J]. 遗传, 1992, 14(4): 18-20. LOU Y D, ZHANG K J, XU Q D, et al. Comparative studies on genetic characters of Gaoyou hybrid crucian carp and its parents[J]. Hereditas (Beijing), 1992, 14(4): 18-20. DOI:10.3321/j.issn:0253-9772.1992.04.007 |
| [7] |
顾志敏, 贾永义, 叶金云, 等. 翘嘴红鲔(♀)×团头鲂(♂)杂种F1的形态特征及遗传分析[J]. 水产学报, 2008, 32(4): 533-544. GU Z M, JIA Y Y, YE J Y, et al. Studies on morphological characteristics and genetic analysis of the hybrid F1, Erythroculter ilishaeformis♂×Megalobrama amblycephal♀[J]. Journal of Fisheries of China, 2008, 32(4): 533-544. |
| [8] |
王静, 肖军, 曾鸣, 等. 白鲫×红鲫杂交后代的遗传变异[J]. 中国科学:生命科学, 2015, 58(4): 371-380. WANG J, XIAO J, ZENG M, et al. Genomic variation in the hybrids of white crucian carp and red crucian carp:evidence from ribosomal DNA[J]. Science China:Life Sciences, 2015, 58(6): 590-601. |
| [9] |
蔡明夷, 刘贤德, 翁朝红, 等. 大黄鱼与黄姑鱼杂交F1及其双亲的核型分析[J]. 集美大学学报(自然科学版), 2012, 17(5): 321-326. CAI M Y, LIU X D, WENG Z H, et al. Karyotypes of Larimichthys crocea and Nibea albiflora and their hybrids[J]. Journal of Jimei University (Natural Science), 2012, 17(5): 321-326. DOI:10.3969/j.issn.1007-7405.2012.05.001 |
| [10] |
隋班良, 蔡明夷, 刘颖, 等. 黄姑鱼♀与大黄鱼♂杂交试验与AFLP分析[J]. 集美大学学报(自然科学版), 2012, 17(4): 241-246. SUI B L, CAI M Y, LIU Y, et al. Amplified fragment length polymorphism analysis on hybrid family between Nibea albiflora ♀ and Larimichthys crocea ♂[J]. Journal of Jimei University (Natural Science), 2012, 17(4): 241-246. DOI:10.3969/j.issn.1007-7405.2012.04.001 |
| [11] |
史会来, 王奋芬, 楼宝, 等. 大黄鱼(♀)与黄姑鱼(♂)人工杂交子代的胚胎发育[J]. 水产学杂志, 2011, 24(4): 16-20. SHI H L, WANG F F, LOU B, et al. Embryonic development of hybrids of large yellow croaker (Pseudosciaena crocea, ♀)×Spotted Maigre (Nibea albiflora, ♂)[J]. Chinese Journal of Fisheries, 2011, 24(4): 16-20. DOI:10.3969/j.issn.1005-3832.2011.04.006 |
| [12] |
赵虎, 崔国强, 吕为群. 大黄鱼(♀)×鱼(♂)杂交F1和大黄鱼初孵仔鱼盐度适应性的比较研究[J]. 上海海洋大学学报, 2013, 22(4): 538-544. ZHAO H, CUI G Q, LYU W Q. Comparison of salinity tolerance of newly hatched larvae of Pseudosciaena crocea and hybrid F1 of Pseudosciaena crocea(♀)×Miichthys miiuy(♂)[J]. Journal of Shanghai University, 2013, 22(4): 538-544. |
| [13] |
王晓清, 王志勇, 谢中国, 等. 大黄鱼(♀)与(♂)杂交的遗传分析[J]. 水产学报, 2008, 32(1): 51-57. WANG X Q, WANG Z Y, XIE Z G, et al. Genetic analysis of the intergenus hybridization of Pseudosciaena crocea(♀)×Miichthys miiuy(♂)[J]. Journal of Fisheries of China, 2008, 32(1): 51-57. |
| [14] |
GARRETT D L. A new intergeneric hybrid flatfish (Pleuronectiformes:Pleuronectidae) from Puget Sound and Adjacent waters[J]. Copeia, 2005, 2005(3): 673-677. |
| [15] |
BECK M L, BIGGERS C J. Ploidy of hybrids between grass carp and bighead carp determined by morphological analysis[J]. Transactions of the American Fisheries Society, 1983, 112(6): 808-811. |
| [16] |
刘苏, 朱新平, 陈昆慈, 等. 斑鳢、乌鳢及其杂交种形态差异分析[J]. 华中农业大学学报, 2011, 30(4): 488-493. LIU S, ZHU X P, CHEN K C, et al. Morphological variations of Channa maculata, Channa argus and their hybrid (C. maculata ♀×C. argus ♂)[J]. Journal of Huazhong Agricultural University, 2011, 30. |
| [17] |
马爱军, 王新安, 雷霁霖, 等. 大菱鲆(Scophthalmus maximus)四个不同地理群体数量形态特征比较[J]. 海洋与湖沼, 2008, 39(1): 24-29. MA A J, WANG X A, LEI J L, et al. Statistic morphology difference among four turbot (Scophthalmus maximus) populations[J]. Oceanologia et Limnologia Sinica, 2008, 39(1): 24-29. DOI:10.3321/j.issn:0029-814X.2008.01.004 |
| [18] |
王新安, 马爱军, 陈超, 等. 七带石斑鱼(Epinephelus septemfasciatus)两个野生群体形态差异分析[J]. 海洋与湖沼, 2008, 39(6): 655-660. WANG X A, MA A J, CHEN C, et al. Morphological variation in two wild populations of sevenband grouper (Epinephelus septemfasciatus)[J]. Oceanologia et Limnologia Sinica, 2008, 39(6): 655-660. DOI:10.3321/j.issn:0029-814X.2008.06.017 |
| [19] |
杨怀宇, 李思发, 邹曙明. 三角鲂与团头鲂正反杂交F1的遗传性状[J]. 上海水产大学学报, 2002, 11(4): 305-309. YANG H Y, LI S F, ZOU S M. A primary study on inheritance of morphological traits from Megalobrarma amblycephala, Megalobrama terminalis to their reciprocal hybrids (F1)[J]. Journal of Shanghai Fisheries University, 2002, 11(4): 305-309. |
| [20] |
王燕, 张勇, 张海发, 等. 两种杂交石斑鱼及其亲本的形态差异分析[J]. 水产学报, 2014, 38(6): 778-785. WANG Y, ZHANG Y, ZHANG H F, et al. Comparison of morphology between two kinds of hybrid groupers and their parents[J]. Journal of Fisheries of China, 2014, 38(6): 778-785. |
| [21] |
吴水清, 郑乐云, 罗辉玉, 等. 杂交石斑鱼(斜带石斑鱼♀×赤点石斑鱼♂)与其亲本形态性状比较研究[J]. 南方水产科学, 2017, 13(5): 47-54. WU S Q, ZHENG L Y, LUO H Y, et al. Comparison of morphological traits of hybrid groupers (Epinephelus coioides ♀×E. akaara ♂) and their parents[J]. South China Fisheries Science, 2017, 13(5): 47-54. DOI:10.3969/j.issn.2095-0780.2017.05.007 |
| [22] |
林婷婷, 姚素媛, 舒琥, 等. 宝石鲈(♂)、淡水黑鲷(♀)及其杂交子一代的形态差异分析[J]. 广东农业科学, 2016, 43(3): 167-172. LIN T T, YAO S Y, SHU H, et al. Morphological variations of Scorturm barcoo(♂), Hephaestus fuliginosus(♀) and their hybrid F1[J]. Guangdong Agricultural Sciences, 2016, 43(3): 167-172. |
| [23] |
张颖, 刘晓勇, 曲秋芝, 等. 达氏鳇、施氏鲟及其杂交种(施氏鲟♂×达氏鳇♀)形态差异与判别分析[J]. 淡水渔业, 2012, 42(6): 27-32. ZHANG Y, LIU X Y, QU Q Z, et al. Comparative discriminate analysis of morphological traits among Acipenser schrenckii, Huso dauricus and their hybrid (A. schrenckii(♂)×H. dauricus(♀))[J]. Freshwater Fisheries, 2012, 42(6): 27-32. DOI:10.3969/j.issn.1000-6907.2012.06.005 |
| [24] |
曹栋正, 陈四清, 严俊丽, 等. 星突江鲽和石鲽正反杂交种的形态变异分析[J]. 中国水产科学, 2016, 23(4): 871-881. CAO D Z, CHEN S Q, YAN J L, et al. Morphological variations analysis of reciprocal hybrids from Platichthys stellatus and Kareius bicoloratus[J]. Journal of Fishery Sciences of China, 2016, 23(4): 871-881. |
| [25] |
金万昆, 俞丽, 杨建新, 等. 赤眼鳟(♀)与鳙(♂)杂交子代生物学特性[J]. 中国水产科学, 2012, 19(4): 611-619. JIN W K, YU L, YANG J X, et al. Biological characteristics of F1 hybrid generations from Squaliobarbus curriculus ((♂))×Aristichthys nobilis ((♂))[J]. Journal of Fishery Sciences of China, 2012, 19(4): 611-619. |
| [26] |
李炎璐, 陈超, 王清印, 等. 云纹石斑鱼(♀)×七带石斑鱼(♂)杂交F1形态特征与其亲本子代的比较分析[J]. 渔业科学进展, 2014, 35(5): 104-108. LI Y L, CHEN C, WANG Q Y, et al. Comparative analysis of the morphological characteristics between hybrid F1 by Epinephelus moara(♀)×E. septemfasciatus(♂) and the offspring of its parents[J]. Progress in Fishery Sciences, 2014, 35(5): 104-108. |
| [27] |
李镕, 韩林强, 艾丽, 等. 两种杂交黄颡鱼的生长与形态差异分析[J]. 水产养殖, 2016, 37(10): 29-35. LI R, HAN L Q, AI L, et al. Comparison of growth and morphology between two kinds of hybrid yellow catfish[J]. Journal of Aquaculture, 2016, 37(10): 29-35. DOI:10.3969/j.issn.1004-2091.2016.10.006 |
| [28] |
ANDERSSON M, SILVA P I M, STEFFENSEN J F, et al. Effects of maternal stress coping style on offspring characteristics in rainbow trout (Oncorhynchus mykiss)[J]. Hormones and Behavior, 2011, 60(5): 699-705. DOI:10.1016/j.yhbeh.2011.09.008 |
| [29] |
BOLNICK D I, TURELLI M, LÓPEZ-FERNáNDEZ H, et al. Accelerated mitochondrial evolution and "darwin's corollary":asymmetric viability of reciprocal F1 hybrids in centrarchid fishes[J]. Genetics, 2008, 178(2): 1037-1048. DOI:10.1534/genetics.107.081364 |
| [30] |
俞菊华, 夏德全, 杨弘, 等. 奥利亚罗非鱼(♀)×鳜(♂)杂交后代的形态[J]. 水产学报, 2003, 27(5): 431-435. YU J H, XIA D Q, YANG H, et al. Morphology of the progenies of Oreochromis aurea(♀)×Sinipperca chuatai(♂)[J]. Journal of Fisheries of China, 2003, 27(5): 431-435. |
| [31] |
关文志, 郑国栋, 吴成宾, 等. 团头鲂与三角鲂或长春鳊杂交后代的生长及形态对比分析[J]. 中国水产科学, 2017, 24(1): 31-39. GUAN W Z, ZHENG G D, WU C B, et al. Comparative analysis of growth and morphological variations among Megalobrama amblycephala, M. terminalis, Parabramis pekinensis and their hybrids[J]. Journal of Fishery Sciences of China, 2017, 24(1): 31-39. |
| [32] |
李冰, 柴学森, 张成锋, 等. 建鲤和黑龙江野鲤自交和正反交F1形态差异分析[J]. 中国水产科学, 2014, 21(1): 59-66. LI B, CHAI X S, ZHANG C F, et al. Morphometric variations analysis of Cyprinus carpio var. jian, Cyprinus carpio haermatopterus and the reciprocal F1 hybrids (Cyprinus carpio var. jian ♀×Cyprinus carpio haermatopterus ♂, Cyprinus carpio var. jian ♂×Cyprinus carpio haermatopterus ♀)[J]. Journal of Fishery Sciences of China, 2014, 21(1): 59-66. |
| [33] |
田永胜, 段会敏, 唐江, 等. 石斑鱼杂交种"云龙斑"与亲本的表型数量性状判别分析[J]. 上海海洋大学学报, 2017, 26(6): 808-817. TIAN Y S, DUAN H M, TANG J, et al. Analysis of phenotypic quantitative traits of kelp grouper, giant grouper and hybrid progeny[J]. Journal of Shanghai Ocean University, 2017, 26(6): 808-817. |
| [34] |
马海涛, 韩承慧, 滕照军, 等. 大菱鲆(Scophthalmus maximus)、星斑川鲽(Platichthys stellatus)及其杂交种的形态学分析[J]. 海洋与湖沼, 2014, 45(6): 1380-1386. MA H T, HAN C H, TENG Z J, et al. Morphological analysis to Scophthalmus maximus, Platichthys stellatus and their hybrid[J]. Oceanologia et Limnologia Sinica, 2014, 45(6): 1380-1386. |
| [35] |
李思发, 陈林, 李先仁, 等. "吉奥"罗非鱼同其亲本及近缘杂交罗非鱼形态差异比较分析[J]. 上海海洋大学学报, 2010, 19(6): 721-727. LI S F, CHEN L, LI X R, et al. Comparative analysis of morphological variations among crossbred of NEW GIFT Nile tilapia ♀×Blue tilapia ♂, their parents and close hybrid[J]. Journal of Shanghai Ocean University, 2010, 19(6): 721-727. |
| [36] |
IHSSEN P E, BOOKE H E, CASSELMAN J M, et al. Stock identification:materials and methods[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1981, 38(12): 1838-1855. |
| [37] |
赵建, 朱新平, 陈永乐, 等. 翘嘴鳜、斑鳜及其杂交种形态差异分析[J]. 华中农业大学学报, 2008, 27(4): 506-509. ZHAO J, ZHU X P, CHEN Y L, et al. Morphological variations of Siniperca chuatsi, Sniperca scherzeri and their hybrid (S. scherzeri)[J]. Journal of Huazhong Agricultural University, 2008, 27(4): 506-509. DOI:10.3321/j.issn:1000-2421.2008.04.015 |
2. Marine and Fishery Institute of Zhejiang Ocean University, Zhoushan 316021, Zhejiang, China;
3. School of Fishery of Zhejiang Oean University, Zhoushan 316022, Zhejiang, China
 2020,
Vol. 29
2020,
Vol. 29


