2. 江苏省海洋生物产业技术协同创新中心, 江苏 连云港 222005;
3. 上海海洋大学 食品学院, 上海 201306
蜈蚣藻属(Grateloupia)隶属于红藻门(Rhodophyta)、隐丝藻目(Cryptonemiales)、海膜科(Halymeniaceae)。目前全世界共报道约80种,中国共报道了32种[1]。蜈蚣藻属植物分布较为广泛,主要集中在亚洲海域,在西班牙沿海也有分布[2-3]。舌状蜈蚣藻(Grateloupia livida)是常见的蜈蚣藻属植物,可用于食用、药用和制胶等方面,其性咸寒,具有清热解毒驱虫之功效,可用于治疗喉炎、蛔虫病[4]。蜈蚣藻(Grateloupia filicina)多糖,通常占到海藻干物质的50%以上[5-6],具有抗病毒、抗凝血、抗肿瘤、调节免疫等多种生物活性[7-10],经济价值高。研究表明:蜈蚣藻多糖具有较好的抗氧化活性。例如:繁枝蜈蚣藻(Grateloupia ramosissima)具有较强的还原力,与浓度呈线性关系,当浓度为0.25 mg/mL时,还原力强于BHA(叔丁基-4羟基茴香醚)和PG(没食子酸丙脂)[11]。蜈蚣藻多糖有良好的清除·OH和·O2-的能力,清除率的半抑制质量浓度(IC50)分别为4.62 mg/mL和0.62 mg/mL[12]。TANG等[8]发现纯化后的蜈蚣藻多糖具有更好的抗氧化能力。
目前,对于舌状蜈蚣藻多糖的提取及抗氧化活性的研究较少,考虑到热水浸提法成本低,适用于大规模工业化生产[13],故本实验采取热水浸提法提取舌状蜈蚣藻多糖,同时,研究舌状蜈蚣藻多糖的抗氧化性,以期为蜈蚣藻资源的综合开发和利用提供参考和理论基础。
1 材料与方法 1.1 材料与仪器舌状蜈蚣藻采自汕头南澳岛,由汕头大学陈伟洲教授鉴定。
1,1-二苯基-2-三硝基苯肼(DPPH)、维生素C(Vc,华屿欣试剂有限公司);无水葡萄糖(分析纯,大连美仑生物技术有限公司);其余试剂均为国产分析纯。
DHG-9145A电热恒温鼓风干燥箱(上海一恒公司);800Y多功能粉碎机(永康市铂欧五金制品有限公司);HWS24电热恒温水浴锅(上海一恒公司);AvantiJ26XP高速离心机(美国贝克曼库尔特公司);RE-2000A旋转蒸发仪(上海亚荣生化仪器厂);SUNRISE吸光酶标仪(瑞士TECAN公司)。
1.2 方法 1.2.1 舌状蜈蚣藻多糖的提取舌状蜈蚣藻→清洗烘干粉碎→2倍体积无水乙醇浸泡12 h→抽滤,烘干→按照预设料液比加入蒸馏水→设置不同的温度和时间进行水浴处理→离心取上清→旋转真空浓缩→醇沉过夜→离心弃上清→依次用丙酮、无水乙醇洗涤→冻干→舌状蜈蚣藻粗多糖(GLP)[14-16]。
1.2.2 多糖含量的测定参考张婧婧等[12]和朱良等[14]的方法,首先绘制葡萄糖标准曲线,再进行舌状蜈蚣藻多糖含量的测定。
1.2.3 舌状蜈蚣藻多糖提取条件的优化分析料液比、温度、时间3种因素对粗多糖得率的影响[14-15]。以料液比为1: 30~1: 70 g/mL进行研究;选取60~100 ℃进行温度的研究;选取2~6 h 5个水平进行时间的研究,以多糖得率为评价指标,计算公式:
 (1)
(1)
式中:F为多糖得率,%;W1为舌状蜈蚣藻的质量,g;W2为粗多糖的质量,g;W3为从W2中取出的用于分析的粗多糖质量,g;V为溶解W3粗多糖定容后的体积,L;f为多糖的校正系数,约为0.9;C为多糖浓度,g/L。
1.2.4 响应面优化试验设计本文根据单因素的实验结果采用Box-Bohnken法[17-18],对热水浸提法提取舌状蜈蚣藻多糖最优工艺条件(料液比、温度、时间)进行响应面优化试验。实验设计见表 1。

|
表 1 响应面试验设计因素与水平 Tab.1 Factors and levels used in response surface analysis |
DPPH自由基清除率的测定参考ZHANG等[19-21]的方法;羟自由基清除率的测定参考CHENG等[22-24]的方法。
1.2.6 数据处理利用Excel和SPSS 22.0软件对数据进行处理和分析。
2 结果与分析 2.1 多糖含量的测定实验得到葡萄糖标准曲线回归方程:

式中:x表示质量浓度,mg/mL; y表示吸光度。
2.2 单因素试验结果 2.2.1 料液比对多糖提取的影响设置不同料液比,70 ℃水浴2 h,考察料液比对多糖得率的影响。
由图 1可知,多糖得率随着料液比的增加,呈现先增后减的趋势,当料液比达到1: 40 g/mL时,得率达到最大值11.00%。这多是因为当料液比偏小时,多糖提取不充分,多糖得率低;随着料液比的增加,物料与溶剂接触面积增加,使多糖的得率增加[25-26];当料液比大于1: 40 g/mL时,多糖得率逐渐降低,可能是由于随着料液比逐渐增加,溶剂渗透到细胞内部的扩散距离增大,导致时间延长,使得多糖得率下降[27]。同时,考虑到溶剂量大时,不利于后续实验的进行,为了提高效率,降低消耗,选择1: 30 g/mL、1: 40 g/mL、1: 50 g/mL进行响应面分析。
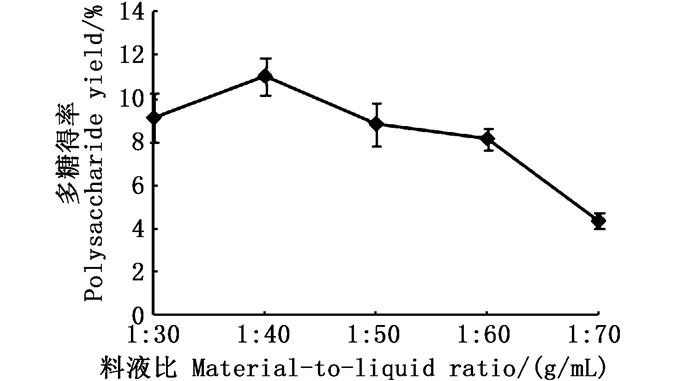
|
图 1 料液比对舌状蜈蚣藻多糖得率的影响 Fig. 1 Effect of different solid-to-solvent ratio on extraction yield of GLP |
由图 2可知:温度为60~70 ℃时,温度升高,多糖得率增加;温度为70~90 ℃时,随着温度的升高,多糖得率缓慢增长;当达到100 ℃时,多糖得率达到最大值13.38%。在一定程度上,热处理对于多糖得率起着至关重要的作用[28],多糖的溶解度会随着温度的升高而增大,得率增加[29-30]。因此,选择80、90、100 ℃进行响应面试验。
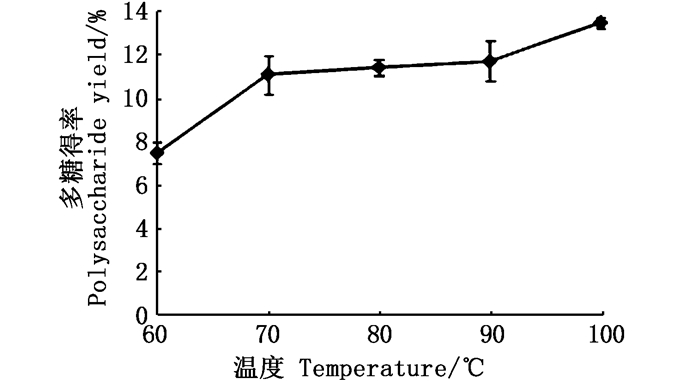
|
图 2 温度对舌状蜈蚣藻多糖得率的影响 Fig. 2 Effect of different temperature on extraction yield of GLP |
固定料液比为1: 40 g/mL,100 ℃水浴处理不同时间,观察多糖得率的变化。从图 3可以得出:多糖得率在2~4 h时间内显著增加,在4 h时达到最大15.11%,超过4 h后,多糖得率逐渐降低。这可能是随着时间的推移,多糖逐渐溶出,得率增加,提取4 h时,多糖基本溶解出来,但随着时间的继续增加,引起了多糖的降解,从而使多糖得率下降[31-35]。

|
图 3 时间对舌状蜈蚣藻多糖得率的影响 Fig. 3 Effect of different time on extraction yield of GLP |
本文选取料液比(A)、温度(B)和时间(C)作为3个自变量,以舌状蜈蚣藻多糖得率(Y)为响应值,采用Box-Behnken设计法对浸提法条件进行设计,结果见表 2。
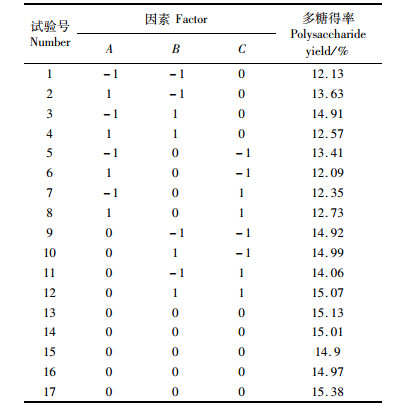
|
表 2 舌状蜈蚣藻多糖得率的响应面试验方案及结果 Tab.2 Experimental design and results for response surface analysis |
舌状蜈蚣藻多糖得率对料液比(A)、温度(B)以及时间(C)的二次多项式回归模型:Y=15.08-0.22A+0.35B-0.15C-0.96AB+0.43AC+0.23BC-1.94A2+0.17B2-0.49C2。
由表 3可知,模型的P小于0.0001,极显著,失拟项的P大于0.05,不显著,说明模型拟合良好,能较好地拟合料液比、温度、时间对多糖得率的影响。回归模型的决定系数Radj2=0.979 7,表明该模型可以拟合97.97%的响应值变化,因此该模型是可靠可信的,可以用来分析和预测多糖得率的实验结果。温度(B)、料液比与温度的交互项(AB)、料液比的二次项(A2)以及时间的二次项(C2)的P值均小于0.001,对多糖得率的影响极显著。料液比(A)、料液比与时间的交互项(AC)对多糖得率的影响高度显著(P<0.01)。时间(C)、温度与时间的交互项(BC)对多糖得率的影响显著(P<0.05)。但是,温度的二次项(B2)对于多糖得率的影响并不显著。在回归方程中,一次项系数的绝对值越大,对应因素对多糖得率的影响也越大。因此,3个因素对多糖得率的影响由大到小依次为时间、料液比、温度。

|
表 3 回归模型方差分析 Tab.3 Analysis of variance of the regression model |
由图 4可知,料液比与温度相互作用对舌状蜈蚣藻多糖得率的影响极显著,料液比与时间交互作用对舌状蜈蚣藻多糖得率的影响高度显著,而温度与时间的交互影响对于舌状蜈蚣藻多糖得率的影响显著。对以上3组图进行分析可知:时间相关的曲线倾斜率大,则时间对响应值多糖得率的影响最明显;其次为料液比,而温度对响应值多糖得率的影响较小。

|
图 4 各因素交互作用对多糖含量影响的响应面图 Fig. 4 Response surface plots showing the interactive effects of various factors on polysaccharide yield |
通过对实验模型的分析,得出料液比1: 37 g/mL、提取温度99.25 ℃、提取时间3.94 h为提取舌状蜈蚣藻多糖的最佳工艺条件,考虑到实际情况,将最佳的实验条件调整为料液比1: 37 g/mL、提取温度100 ℃、提取时间4 h,此时多糖得率为15.23%,误差为0.99 %,因此本实验得到的最优条件可靠可行,具有一定的参考价值。
2.4 体外抗氧化活性测定结果 2.4.1 舌状蜈蚣藻多糖清除DPPH自由基的能力DPPH自由基的清除率是评判抗氧化剂的抗氧化能力的常用指标[35]。由图 5可知,舌状蜈蚣藻多糖清除DPPH自由基能力呈现剂量依赖性,且具有良好的线性关系(R2>0.93)。根据回归方程,计算舌状蜈蚣藻多糖对DPPH自由基清除能力的IC50值为12.61 mg/mL,低于龙须菜中硫琼脂对DPPH自由基的IC50(17 mg/mL)[35],表明舌状蜈蚣藻多糖抗氧化性强于龙须菜中的硫琼脂,具有较好的抗氧化性。但是舌状蜈蚣藻多糖DPPH自由基清除能力明显低于Vc。

|
图 5 多糖对DPPH自由基清除能力 Fig. 5 Scavenging effect of GLP on DPPH |
由图 6可知,舌状蜈蚣藻多糖对·OH清除率呈现剂量依赖性,在0.25~2.00 mg/mL之间线性关系良好。依据清除率曲线y=20.045x+8.841 2,R2=0.944 2,计算舌状蜈蚣藻多糖对·OH的IC50为2.05 mg/mL,低于蜈蚣藻多糖对·OH的IC50(4.62 mg/mL)[36],说明舌状蜈蚣藻多糖的抗氧化性优于蜈蚣藻多糖。但由图 6可知,舌状蜈蚣藻抗氧化性明显低于Vc。

|
图 6 多糖对·OH自由基清除能力 Fig. 6 Scavenging effect of GLP on·OH |
海藻多糖的提取方法主要有溶剂提取法、酶解法、物理提取法以及复合法等,方法众多,各有利弊。目前,主要以水浸提法为主。本文采用热水浸提法提取舌状蜈蚣藻多糖,多糖提取的最佳工艺条件为料液比1: 37(g/mL)、100 ℃沸水浴提取4 h,此时多糖得率为15.23%,约为带形蜈蚣藻(Grateloupia turuturu)多糖得率[37]的1.9倍,但是明显低于蜈蚣藻(Grateloupia filicina)[38]、赛氏蜈蚣藻(Grateloupia setchellii kylin)、青岛蜈蚣藻(Grateloupia qingdaoensis)[39]。这可能是由于蜈蚣藻的种类不同,使得多糖得率不同。研究发现,提前浸泡、适当增加多糖提取次数可以提高多糖得率。同时,藻类自身的产地、生长期,以及提取时的醇沉浓度对多糖得率也有一定的影响[38, 40]。
我国是海藻养殖大国,但是海藻的利用率不高,主要用来食用、制胶等。大量研究表明,海藻多糖具有抗氧化、抗病毒、抗凝血、抗肿瘤、免疫调节等多种生物活性,有望应用于医药保健方向,提高海藻利用率以及海藻产业价值。近年来,海藻多糖的抗氧化活性受到越来越多的关注。研究表明,海藻多糖有较强的清除自由基的能力,能减少自由基的氧化反应,降低自由基对于人体细胞的氧化攻击。本文通过测定舌状蜈蚣藻多糖的DPPH自由基和羟自由基清除率,评价其体外抗氧化活性。结果表明:舌状蜈蚣藻多糖对DPPH自由基和羟自由基的清除能力均呈现剂量依赖性,随着多糖浓度的增加,自由基清除能力增强。舌状蜈蚣藻多糖对DPPH自由基和羟自由基的IC50分别为12.61 mg/mL和2.05 mg/mL,体外抗氧化活性较好,有望成为应用于食品、药品和化妆品行业的新型抗氧化剂。
| [1] |
夏邦美. 中国海藻志·第二卷·红藻门·第三册[M]. 北京: 科学出版社, 2004: 118-122. XIA B M. Chronicle of the sea of China volume Ⅱ. Red algae gate volume Ⅲ[M]. Beijing: Science Press, 2004: 118-122. |
| [2] |
MONTES M, RICO J M, GARCíA-VAZQUEZ E, et al. Molecular barcoding confirms the presence of exotic Asian seaweeds (Pachymeniopsis gargiuli and Grateloupia turuturu) in the Cantabrian Sea, Bay of Biscay[J]. PeerJ, 2017, 5: e3116. DOI:10.7717/peerj.3116 |
| [3] |
GARCIA-JIMENEZ P, MONTERO-FERNÁNDEZ M, ROBAINA R R. Molecular mechanisms underlying Grateloupia imbricata (Rhodophyta) carposporogenesis induced by methyl jasmonate[J]. Journal of Phycology, 2017, 53(6): 1340-1344. DOI:10.1111/jpy.12594 |
| [4] |
陈伟洲, 宋志民, 黄中坚. 温度、光照强度对舌状蜈蚣藻早期发育的影响[J]. 南方水产科学, 2013, 9(6): 14-19. CHEN W Z, SONG Z M, HUANG Z J. Effects of temperature and irradiance on early development of Grateloupia livida[J]. South China Fisheries Science, 2013, 9(6): 14-19. DOI:10.3969/j.issn.2095-0780.2013.06.003 |
| [5] |
DENIS C, MORANÇAIS M, LI M, et al. Study of the chemical composition of edible red macroalgae Grateloupia turuturu from Brittany (France)[J]. Food Chemistry, 2010, 119(3): 913-917. DOI:10.1016/j.foodchem.2009.07.047 |
| [6] |
RODRIGUES D, FREITAS A C, PEREIRA L, et al. Chemical composition of red, brown and green macroalgae from Buarcos bay in central west coast of Portugal[J]. Food Chemistry, 2015, 183: 197-207. DOI:10.1016/j.foodchem.2015.03.057 |
| [7] |
WANG S C, BLIGH S W A, SHI S S, et al. Structural features and anti-HIV-1 activity of novel polysaccharides from red algae Grateloupia longifolia and Grateloupia filicina[J]. International Journal of Biological Macromolecules, 2007, 41(4): 369-375. DOI:10.1016/j.ijbiomac.2007.05.008 |
| [8] |
TANG L, CHEN Y C, JIANG Z B, et al. Purification, partial characterization and bioactivity of sulfated polysaccharides from Grateloupia livida[J]. International Journal of Biological Macromolecules, 2017, 94: 642-652. DOI:10.1016/j.ijbiomac.2016.10.067 |
| [9] |
马军, 侯萍, 陈燕, 等. 几种海藻多糖抗氧化活性及体外抗脂质过氧化作用的研究[J]. 南方水产科学, 2017, 13(6): 97-104. MA J, HOU P, CHEN Y, et al. Study on antioxidant activity and anti-lipid peroxidation effect of several algal polysaccharides[J]. South China Fisheries Science, 2017, 13(6): 97-104. DOI:10.3969/j.issn.2095-0780.2017.06.012 |
| [10] |
YU Y, SHEN M Y, SONG Q Q, et al. Biological activities and pharmaceutical applications of polysaccharide from natural resources:a review[J]. Carbohydrate Polymers, 2018, 183: 91-101. DOI:10.1016/j.carbpol.2017.12.009 |
| [11] |
朱良, 张杰平, 王一飞. 繁枝蜈蚣藻多糖的抗氧化活性研究[J]. 食品科学, 2008, 29(3): 453-456. ZHU L, ZHANG J P, WANG Y F. Study on antioxidant activity of Grateloupia filicina polysaccharide[J]. Food Science, 2008, 29(3): 453-456. DOI:10.3321/j.issn:1002-6630.2008.03.097 |
| [12] |
张婧婧, 刘秋凤, 吴成业. 蜈蚣藻多糖提取工艺优化[J]. 福建水产, 2013, 35(4): 290-295. ZHANG J J, LIU Q F, WU C Y. Extraction technology optimization of polysaccharides from Grateloupia filicina[J]. Journal of Fujian Fisheries, 2013, 35(4): 290-295. DOI:10.3969/j.issn.1006-5601.2013.04.007 |
| [13] |
刘欢, 陈胜军, 杨贤庆. 海藻多糖的提取、分离纯化与应用研究进展[J]. 食品工业科技, 2018, 39(12): 341-346. LIU H, CHEN S J, YANG X Q. Advances of extraction, purification and application of polysaccharides from seaweeds[J]. Science and Technology of Food Industry, 2018, 39(12): 341-346. |
| [14] |
朱良, 张青, 王一飞, 等. 正交试验法优选繁枝蜈蚣藻粗多糖的提取工艺[J]. 食品科学, 2006, 27(2): 151-154. ZHU L, ZHANG Q, WANG Y F, et al. Optimum extraction process of polysaccharides from Grateloupia filicina by orthogonal test[J]. Food Science, 2006, 27(2): 151-154. DOI:10.3321/j.issn:1002-6630.2006.02.030 |
| [15] |
杨永利, 郭守军, 张正平, 等. 带状蜈蚣藻粗多糖的提取工艺优化[J]. 广东农业科学, 2011, 38(24): 74-76. YANG Y L, GUO S J, ZHANG Z P, et al. Optimizing study for the technics of extracting polysaccharide from the Gratelou-pia uruturu Yamada[J]. Guangdong Agricultural Sciences, 2011, 38(24): 74-76. DOI:10.3969/j.issn.1004-874X.2011.24.026 |
| [16] |
周海洋. 迷迭香多糖的抗疲劳功能及机制研究[J]. 现代预防医学, 2018, 45(1): 43-46. ZHOU H Y. Anti-fatigue mechanism of Rosmarinus officinalis L polysaccharides[J]. Modern Preventive Medicine, 2018, 45(1): 43-46. |
| [17] |
宋佳敏, 王鸿飞, 孙朦, 等. 响应面法优化金蝉花多糖提取工艺及抗氧化活性分析[J]. 食品科学, 2018, 39(4): 275-281. SONG J M, WANG H F, SUN M, et al. Optimization of extraction and antioxidant activity of polysaccharides from Cordyceps cicadae by response surface methodology[J]. Food Science, 2018, 39(4): 275-281. |
| [18] |
YANG S Y, LI Y, JIA D Y, et al. The synergy of Box-Behnken designs on the optimization of polysaccharide extraction from mulberry leaves[J]. Industrial Crops and Products, 2017, 99: 70-78. DOI:10.1016/j.indcrop.2017.01.024 |
| [19] |
ZHANG L, HU Y, DUAN X Y, et al. Characterization and antioxidant activities of polysaccharides from thirteen boletus mushrooms[J]. International Journal of Biological Macromolecules, 2018, 113: 1-7. DOI:10.1016/j.ijbiomac.2018.02.084 |
| [20] |
SUN J, ZHOU B, TANG C, et al. Characterization, antioxidant activity and hepatoprotective effect of purple sweetpotato polysaccharides[J]. International Journal of Biological Macromolecules, 2018, 115: 69-76. DOI:10.1016/j.ijbiomac.2018.04.033 |
| [21] |
SHEN S G, JIA S R, WU Y K, et al. Effect of culture conditions on the physicochemical properties and antioxidant activities of polysaccharides from Nostoc flagelliforme[J]. Carbohydrate Polymers, 2018, 198: 426-433. DOI:10.1016/j.carbpol.2018.06.111 |
| [22] |
CHENG H, HUANG G L. Extraction, characterisation and antioxidant activity of Allium sativum polysaccharide[J]. International Journal of Biological Macromolecules, 2018, 114: 415-419. DOI:10.1016/j.ijbiomac.2018.03.156 |
| [23] |
TANG Q L, HUANG G L. Preparation and antioxidant activities of cuaurbit polysaccharide[J]. International Journal of Biological Macromolecules, 2018, 117: 362-365. DOI:10.1016/j.ijbiomac.2018.05.213 |
| [24] |
吴静, 胡晓, 杨贤庆, 等. 鸢乌贼酶解产物的抗氧化稳定性与功能特性[J]. 南方水产科学, 2016, 12(5): 105-111. WU J, HU X, YANG X Q, et al. Antioxidant stability and functional properties of enzymatic hydrolysates from purple back flying squid (Symplectoteuthis oualaniensis)[J]. South China Fisheries Science, 2016, 12(5): 105-111. DOI:10.3969/j.issn.2095-0780.2016.05.013 |
| [25] |
申翔宇, 徐玲, 黄雅婷, 等. 响应面法优化绿萝花多糖提取及抗氧化活性[J]. 食品科技, 2018, 43(1): 203-209. SHEN X Y, XU L, HUANG Y T, et al. Response surface methodology for optimization of extraction process and antioxidant avtivity on Scindapsus aureus polysaccharides[J]. Food Science and Technology, 2018, 43(1): 203-209. |
| [26] |
PASANDIDE B, KHODAIYAN F, MOUSAVI Z E, et al. Optimization of aqueous pectin extraction from Citrus medica peel[J]. Carbohydrate Polymers, 2017, 178: 27-33. DOI:10.1016/j.carbpol.2017.08.098 |
| [27] |
RAZA A, LI F, XU X Q, et al. Optimization of Ultrasonic-assisted extraction of antioxidant polysaccharides from the stem of Trapa quadrispinosa using response surface methodology[J]. International Journal of Biological Macromolecules, 2017, 94: 335-344. DOI:10.1016/j.ijbiomac.2016.10.033 |
| [28] |
崔汉钊, 郝蒙蒙, 杨玲. 新疆药桑叶多糖的提取工艺与纯化分离研究[J]. 食品研究与开发, 2018, 39(15): 49-52. CUI H Z, HAO M M, YANG L. Extraction process and purification of Morus nigra leaves polysaccharide in Xinjiang[J]. Food Research and Development, 2018, 39(15): 49-52. DOI:10.3969/j.issn.1005-6521.2018.15.010 |
| [29] |
YE Z P, WANG W, YUAN Q X, et al. Box-Behnken design for extraction optimization, characterization and in vitro antioxidant activity of Cicer arietinum L. hull polysaccharides[J]. Carbohydrate Polymers, 2016, 147: 354-364. DOI:10.1016/j.carbpol.2016.03.092 |
| [30] |
林威, 于萍, 李楠, 等. 浒苔多糖的碱法提取工艺研究[J]. 温州大学学报·自然科学版, 2010, 31(5): 39-43. LIN W, YU P, LI N, et al. Study on alkali extracting technique of polysaccharide from Entermorpha prolifera[J]. Journal of Wenzhou University·Natural Sciences, 2010, 31(5): 39-43. |
| [31] |
郭超, 宋慧, 梁凤, 等. 金针菇多糖的提取工艺优化及荧光标记研究[J]. 菌物研究, 2018, 16(1): 43-50. GUO C, SONG H, LIANG F, et al. The study on the optimization of extraction technology and fluorescence labeling of Flammulina velutipes polysaccharides[J]. Journal of Fungal Research, 2018, 16(1): 43-50. |
| [32] |
陈培琳, 陈钏杰, 周雨嘉, 等. 响应面分析法优化莲子心多糖的提取工艺[J]. 福建农林大学学报(自然科学版), 2017, 46(6): 708-715. CHEN P L, CHEN C J, ZHOU Y J, et al. Optimization of extraction technology of polysaccharides from lotus plumula by response surface methodology[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2017, 46(6): 708-715. |
| [33] |
吉聪辉.枸杞残次果多糖提取工艺优化和抗氧化活性研究[D].杨凌: 西北农林科技大学, 2018. JI C H. Study on optimization of extraction and antioxidant activity in defective fruint of Lycium barbaruml[D]. Yangling: Northwest A&F University, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018974079.htm |
| [34] |
蔡彬新, 周逢芳, 姚玲灵. 海带多糖的提取工艺[J]. 食品研究与开发, 2012, 33(9): 80-82. CAI B X, ZHOU F F, YAO L L. Extraction technology of Laminaria polysaccharide[J]. Food Research and Development, 2012, 33(9): 80-82. |
| [35] |
刘秋凤, 吴成业, 苏永昌. 龙须菜中硫琼脂的体外抗氧化评价及降血糖、降血脂活性的动物试验[J]. 南方水产科学, 2013, 9(3): 57-66. LIU Q F, WU C Y, SU Y C. Study on antioxidation, animal experiments of hyperglycemia and hyperlipemia of agaropectin from Gracilaria lemaneiformis[J]. South China Fisheries Science, 2013, 9(3): 57-66. DOI:10.3969/j.issn.2095-0780.2013.03.010 |
| [36] |
张婧婧, 刘秋凤, 吴成业. 蜈蚣藻多糖纯化及抗氧化作用的研究[J]. 福建水产, 2013, 35(5): 362-367. ZHANG J J, LIU Q F, WU C Y. Study on purification and antioxidation of polysaccharides from Grateloupia filicina[J]. Journal of Fujian Fisheries, 2013, 35(5): 362-367. DOI:10.3969/j.issn.1006-5601.2013.05.005 |
| [37] |
芮雯.带形蜈蚣藻(Grateloupia turuturu)、总状蕨藻(Caulerpa racemosa)的部分化学成分分析及生物活性研究[D].广州: 暨南大学, 2006. RUI W. Study on the partial chemical constituents and the bioactivities of marine algae Grateloupia turuturu and Caulerpa racemosa[D]. Guangzhou: Jinan University, 2006. http://cdmd.cnki.com.cn/article/cdmd-10559-2007045862.htm |
| [38] |
郭守军, 杨永利, 许桂旋, 等. 蜈蚣藻多糖冷水溶和热水溶部分流变性的比较研究[J]. 食品科学, 2007, 28(6): 98-103. GUO S J, YANG Y L, XU G X, et al. Study on rheological properties of Grateloupia filicina Polysacocharide extracted in hot water or cold water[J]. Food Science, 2007, 28(6): 98-103. DOI:10.3321/j.issn:1002-6630.2007.06.018 |
| [39] |
王薇.三种蜈蚣藻多糖的提取分离及结构研究[D].青岛: 中国海洋大学, 2012. WANG W. Research in separation and structure of sulfated polysaccharides from three kinds of Grateloupia[D]. Qingdao: Ocean University of China, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10423-1012504033.htm |
| [40] |
朱艳梅, 王一飞, 张美英, 等. 蜈蚣藻多糖的提取分离及抗病毒活性的研究[J]. 中药材, 2006, 29(3): 256-259. ZHU Y M, WANG Y F, ZHANG M Y, et al. The study on the extraction and the antivirus activity of amylose extracted from Grateloupia filicina[J]. Journal of Chinese Medicinal Materials, 2006, 29(3): 256-259. DOI:10.3321/j.issn:1001-4454.2006.03.020 |
2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology, Lianyungang 222005, Jiangsu, China;
3. College of Food Science&Technology, Shanghai Ocean University, Shanghai 201306, China
 2020,
Vol. 29
2020,
Vol. 29

