2. 中国水产科学研究院南海水产研究所 农业农村部南海渔业资源开发利用重点实验室, 广东 广州 510300;
3. 中国水产科学研究院南海水产研究所深圳试验基地, 广东 深圳 518018;
4. 上海海洋大学 水产与生命学院, 上海 201306
微藻作为水产动物的开口饵料,可以促进水产动物幼体生长,提高存活率[1],增强抗逆性[2],改善水质[3],抑制有害菌的生长[4],微藻还可作为人类保健食品和生物能源的原料等广泛应用于其他行业。目前,微藻养殖逐步向规模化、工厂化养殖发展,已成为朝阳产业。
微藻的规模化培养是其产业应用的关键环节。常见的微藻培养系统可分为开放式和封闭式。传统饵料微藻培养主要采用开放式培养,在室内或室外的桶或水泥池利用自然光照进行充气培养,这种培养方式易受外界环境和天气、气候影响,不易实现微藻的高密度培养。近年来,封闭式光生物反应器培养微藻有了较大的发展,开发出了各种类型的封闭式光生物反应器,包括管道式、平板式、柱状气升式、搅拌式发酵罐和浮式薄膜袋等[5],其中管道式光反应器发展最快,其结构可调节性强,具有很大的发展潜力[6]。威氏海链藻(Thalassiosira weissflogii),属于硅藻门(Bacillariophyta),海链藻属(Thalassiosira),直径为12~43 μm,作为饵料微藻广泛应用于水产动物育苗[7-9]。微藻在培养过程中会产生大量异养菌,分解和消耗水体中的营养物质,对藻类产生竞争,影响藻细胞生长[10]。藻类在分裂或死亡过程中,也会产生一些衍生物质如铵态氮和硝态氮等[11],可能威胁到养殖生物的健康[12]。因此,饵料微藻的培养不仅要注重浓度数量,更要注重藻液中的有害物质含量是否会影响投喂幼体的健康。本研究使用一种新型的负压光生物反应器培养威氏海链藻,通过测定其培养过程中藻细胞和细菌数量变化,以及氨氮和亚硝酸氮的质量浓度变化,初步研究新型负压式光反应器培养威氏海链藻的效果,为其在饵料微藻培养与应用提供科学依据。
1 材料与方法 1.1 负压光生物反应器400 L负压光生物反应器采用6 cm ×200 cm管式光生物反应器(温州光语生物科技有限公司定制生产),包括盘旋式主体管道(通过支架固定在地面上,主体管道的两端为具有垂直高度差的较低端和较高端),以及驱动管道内部液体流动的气体动力循环装置,该装置通过管道高度差及气体动力循环装置驱动液体流动,气体管道上设置串联定时控制的电磁阀和气泵(图 1)。该反应器特点:采用双侧光照,管径小,管壁较长,有利于增加透光率及光照面积,气体动力驱动藻液循环,减小藻体细胞损伤,有利于微藻养殖产率和产量的提高,负压式光生物反应器中藻液流向靠真空泵和上下管道高度差驱动,可设置抽气时间间隔,不需要全天持续曝气,有利于上下层藻液混合,减小耗能。
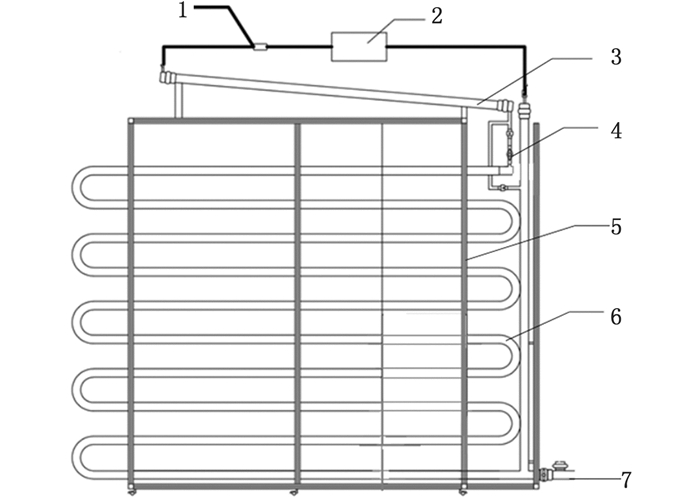
|
1.电磁阀;2.气泵;3.培养液循环罐;4.单向阀;5.不锈钢支架固定装置;6.管式光生物反应器主体管道;7.排液口 1.solenoid valve; 2.air pump; 3.culture liquid circulating tank; 4.one-way valve; 5.stainless steel support fixture; 6.tube photoreactor main pipe; 7.outlets 图 1 负压式光生物反应器示意图 Fig. 1 Sketch of negative pressure photo bioreactor |
实验设3个平行组,用处于快速生长对数期的威氏海链藻液按1:5比例进行接种扩培,初始接种密度为(1.86±0.11)×105个/mL,培养周期为9 d。威氏海链藻由上海光语生物科技有限公司提供,所用改良的f/2培养基:KNO3 100 g/L, Na2EDTA 20 g/L, KH2PO4 10 g/L, FeC6H5O7 3 g/L, MnSO4 0.2 g/L, CO(NH2)210 g/L, NaSiO3 20 g/L, B1与B12每10 L各1支。培养方式为一次性培养,反应器真空抽气与停顿时间比设置为3 min:1 min,双侧光照,光照强度为(3 000±200) lx,光暗周期比为12 h:12 h,培养温度为(15±1)℃。
1.3 测定方法 1.3.1 藻细胞数目测定每个平行组每天取1 mL藻液,用血球计数板在显微镜下记录藻细胞数目,每个平行组计数3次,取平均值。
1.3.2 微藻的比生长速率测定细胞比生长率的计算公式:
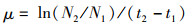 (1)
(1)
式中:N2与N1分别为t2和t1时的细胞密度。
1.3.3 细菌测定方法每个平行组每天取0.5 mL藻液,用无菌海水按10-1,10-2,10-3倍数进行稀释,分别涂布于海水异养菌培养基和TCBS(thiosulfate citrate bile saccharose)培养基上,28 ℃恒温培养,于72 h后采用平板计数法计算弧菌数量和异养菌数量。
1.3.4 氨氮与亚硝酸氮质量浓度的测定每个平行组每天取100 mL藻液,经过0.2 μm滤膜抽滤后的水样,用于氨氮与亚硝酸氮质量浓度测定,分别采用《海洋调查规范》(GB/T 12763.4—2007)中的溴酸钠氧化法和重氮-偶氮光度法测定。
1.4 数据分析采用相关性分析法研究藻密度与水质变化的关系,数据分析采用Excel 2007和SPSS 17.0软件进行处理,SigmaPlot 12.5软件进行作图。
2 结果 2.1 威氏海链藻生长规律曲线由图 2可知:在培养的第0~3天为指数增长期,并在第4天藻密度达到最高值1.5×106个/mL,在平台期维持2 d后,进入衰败期,藻密度维持在1.0×106个/mL左右。藻类生长比率随培养时间逐渐降低,第1天的比生长率最高为1.37,平台期的比生长率接近零,衰败期的藻比生长率为负值(表 1)。

|
图 2 威氏海链藻生长变化 Fig. 2 Variation of growth of Thalassiosira weissflogii |

|
表 1 威氏海链藻比生长率的变化 Tab.1 Variation of growth rate of Thalassiosira weissflogii |
由图 3可知:弧菌与异养菌数量呈现出先轻微上升后急剧下降,再逐步上升,然后再减小的变化趋势;初始弧菌与异养菌数量分别为0.97×104 cfu/mL和0.37×106 cfu/mL;第2天达到最低值, 分别为1.9×103 cfu/mL和7.1×104 cfu/mL;第3天后均逐步上升,分别于第7天与第5天达到最大值, 为2.6×104 cfu/mL和0.93×106 cfu/mL;之后再下降。
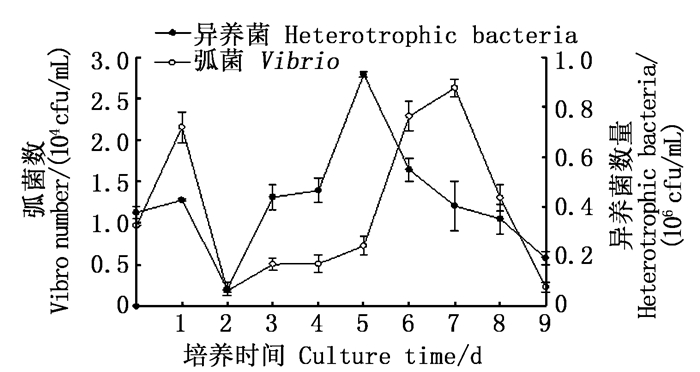
|
图 3 弧菌与异养菌的变化 Fig. 3 Change of vibrios and heterotrophic bacterium |
通过对不同培养时间的威氏海链藻密度与弧菌和异养菌数量取对数后作图,研究藻菌的互作关系。由图 4可以看出:藻类接种初期,异养菌数量高于藻密度且同时增加;之后的藻类指数生长期(2~4 d)随着藻密度增加,弧菌与异养菌数量明显受到抑制,特别是对弧菌的抑制明显,在培养的第2~5天,弧菌数量都明显低于初始值;当藻密度达到最高值时,弧菌与异养菌数量分别为5.1×103 cfu/mL、4.6×105 cfu/mL,在藻类生长平台期,细菌数量有所回升,在衰败期尤其是最后3 d,藻密度,异养菌与弧菌数量均降低。
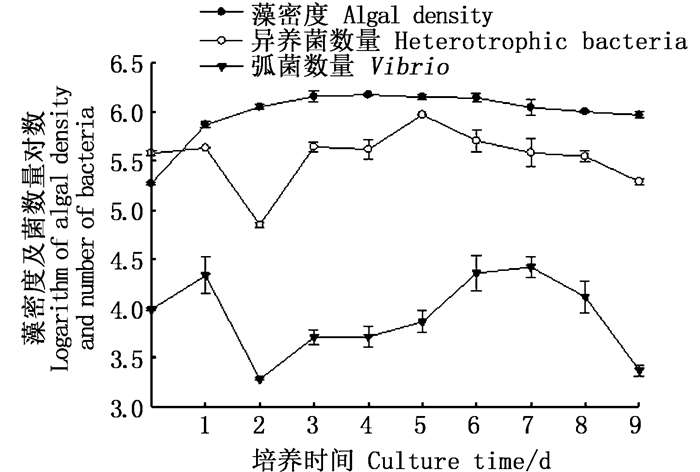
|
图 4 藻密度与细菌数量变化 Fig. 4 Variation of algal density and bacterial number |
如图 5a所示:氨氮与亚硝酸氮质量浓度变化范围为0.001 7~0.24 mg/L、0.022~0.37 mg/L,两者变化趋势相同;氨氮与亚硝酸氮质量浓度初始值最低,随培养时间而增加,同时在第6天达到最高值,第7~9天其质量浓度逐渐下降。
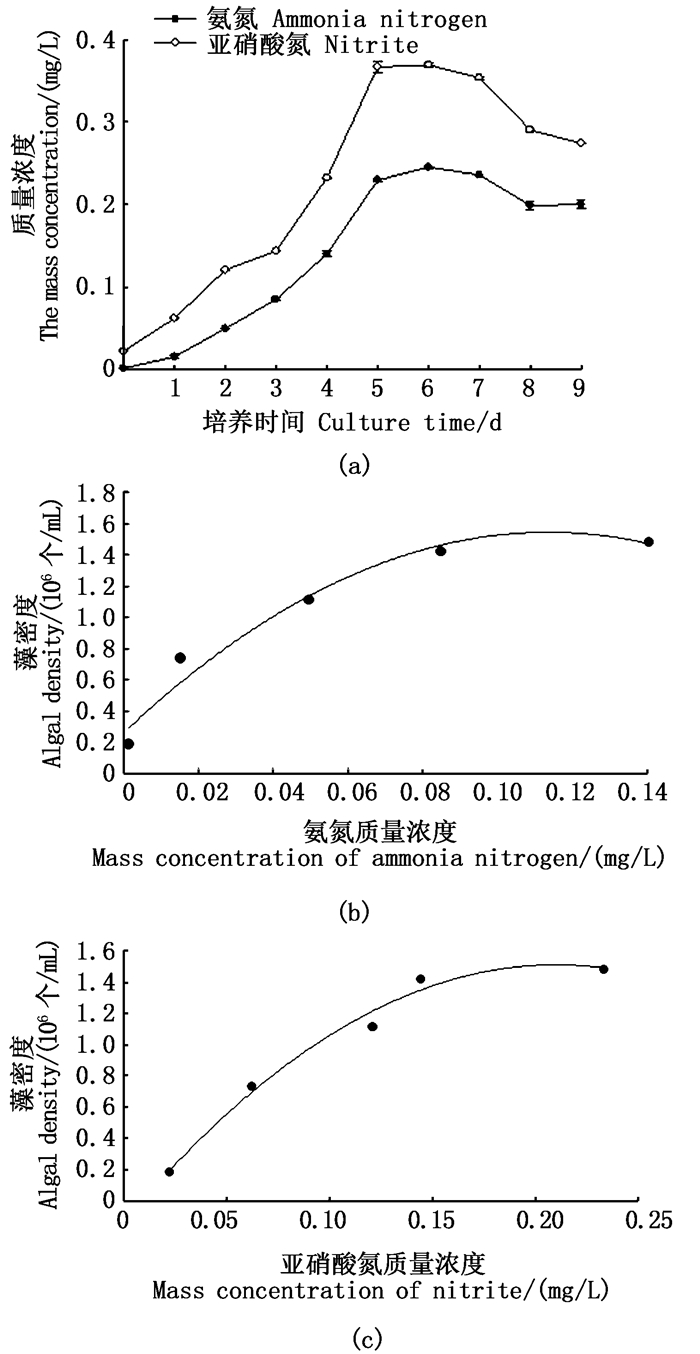
|
图 5 氨氮与亚硝酸氮质量浓度变化及藻密度相关性 Fig. 5 Correlation between ammonia nitrogen and nitrite nitrogen mass concentration and algal density |
图 5b为藻密度与氨氮质量浓度变化曲线,藻密度与氨氮质量浓度的关系可以用方程式y= -9 984.7x2+2 267.2x+25.69拟合,其中R2=0.968 2。图 5c为藻密度与亚硝酸氮质量浓度变化曲线,藻密度与亚硝酸氮质量浓度的关系可以用方程式y=-3 745.4x2+1 570.7x-13.489拟合,其中R2=0.985。氨氮与亚硝酸氮质量浓度与藻密度均呈显著正相关关系(P<0.05)。
3 讨论在之前关于威氏海链藻培养的研究中,王敏等[13]使用恒温光照培养箱对威氏海链藻进行培养,在培养的第4天达到最大密度约7.0×105个/mL,刘皓等[14]在实验室采用传统方法培养到第7天达到的最高密度约1.1×106个/mL。本研究中,威氏海链藻在培养第4天就达到最大密度1.5×106个/mL,这可能是因为负压式光照反应器有较高的透光率及混合效果。光照是微藻培养的关键因子,游文朗等[15]研究发现紫球藻适宜生长在光照强度为10 000 lx的条件下。混合是微藻培养的另一个关键因素,可以防止藻种沉淀,确保细胞均匀接触光和营养物质,改善空气与液体之间的气体交换[16]。HULATT等[17]利用管状反应器进行室外培养藻类,最高产量可达23.67 g/(m2·d)。研究所采用的负压式光生物反应器管径小且玻璃材质的管壁透光性好,气体动力驱动藻液混合和循环,减小藻体细胞损伤,光照均一性好,光照效率显著提高,促进了威氏海链藻的快速生长,提高了培养微藻的密度,缩短培养周期。研究结果表明,负压式光生物反应器是一种适合威氏海链藻高密度培养的系统。
优质微藻饵料的稳定供应是大多数水产动物幼体培育和育苗成功的重要保证。饵料微藻供应不仅仅是微藻细胞本身,还应该包括伴随藻液中常被人们所忽视的相关细菌。饵料微藻培育系统内的细菌类群的特点可直接制约微藻生产的质量和成败。已有研究[18-19]表明,微藻和细菌既存在互利互惠的关系,又存在相互拮抗和相互竞争的关系。研究所使用的扩培藻种为生产中二级培养威氏海链藻藻液,藻液中本身含有细菌,在培养初期异养菌与弧菌数量呈现出短暂上升后急速下降的趋势,并在第2天均达到最低值,此时藻细胞处于指数增长期,分裂活力较强,在与海水中异养菌及弧菌进行生态位和营养盐等因素的竞争过程中取得了优势[20],对细菌抑制作用最强。而在平台期,藻细胞增殖能力下降,分泌的有机物增多,有利于异养菌和弧菌的生长,威氏海链藻对弧菌和异养菌的抑制作用减弱,使之数量回升。在衰败期,伴随着营养物质的消耗,藻类与细菌密度都呈下降趋势。因此,负压式光生物反应器作为威氏海链藻等饵料微藻培养与应用,应选择处于指数生长末期与平台期质量较好的藻液投喂幼体。
多数藻类都有降低氨氮和亚硝酸氮含量,净化养殖水质的作用[21-22],但藻类死亡也会产生大量氨氮[23],特别是在密闭相对低溶氧的环境中,氨氮、亚硝酸氮等有毒物质难以挥发,积累在藻液中造成污染。该研究中氨氮与亚硝酸盐质量浓度随藻密度而增加,且在指数增长期,藻密度与氨氮、亚硝酸氮含量呈显著相关。这可能与本研究使用的尿素CO(NH2)2和硝酸钾作为藻类培养的碳源和氮源有关。微藻可以利用不同形式的氮源[24],在藻类培养初期,藻细胞利用尿素或NO3-分解成CO2和NH4+供细胞的尿素循环利用形成谷氨酰胺等物质,并生成O2、NO2-和NO3-[25],NH4+会积累在细胞中,当尿素被消耗完时,藻类可以利用NH4+为氮源继续生长,当到达平台期时,藻类大量死亡产生的NH4+及NO2-在反应器中较难挥发,造成NH4+与NO2-过多的积累,在负压式反应器中培养的藻液不应立即投喂,可将藻液曝气处理后再进行投喂。
实验结果表明:负压式光生物反应器可作为海洋饵料微藻培养系统,其培育的饵料微藻在指数增长末期和平台期的质量较好,适合作为水产动物幼体的饵料,为负压式光生物反应器作为海洋微藻生物饵料培养系统的应用提供了参考数据。今后的研究仍需对负压式光生物反应器培养微藻的接种密度,微藻的营养盐配方优化,藻液含有生物活性物质的变化,水体各种理化因子及藻际微生物的相互关系等进一步分析研究。
| [1] |
JAMALI H, AHMADIFARD N, ABDOLLAHI D. Evaluation of growth, survival and body composition of larval white shrimp (Litopenaeus vannamei) fed the combination of three types of algae[J]. International Aquatic Research, 2015, 7(2): 115-122. DOI:10.1007/s40071-015-0095-9 |
| [2] |
黄翔鹄, 李活, 李长玲, 等. 牟氏角毛藻对对虾育苗水质及抗逆性的影响[J]. 广东海洋大学学报, 2008, 28(6): 46-50. HUANG X H, LI H, LI C L, et al. Effect of Chaetoceros muellerion water quality and anti-stress ability of larval prawn[J]. Journal of Guangdong Ocean University, 2008, 28(6): 46-50. DOI:10.3969/j.issn.1673-9159.2008.06.010 |
| [3] |
俞建中, 梁欣欣, 魏东, 等. 三种饵料微藻在凡纳滨对虾育苗中的饲喂效果评价[J]. 现代食品科技, 2013, 29(4): 762-767. YU J Z, LIANG X X, WEI D, et al. Feeding effect evaluation of three microalgae in the larval rearing of Litopenaeus vannamei[J]. Modern Food Science and Technology, 2013, 29(4): 762-767. |
| [4] |
郑莲, 黄翔鹄, 刘楚吾, 等. 两种微藻对凡纳滨对虾养殖环境中细菌数量变化的影响[J]. 台湾海峡, 2005, 24(2): 178-182. ZHENG L, HUANG X H, LIU C W, et al. Influence of two microalgaeon bacteria communitiy structure incultural environment of Litopenaeus vannamei[J]. Journal of Oceanography in Taiwan Strait, 2005, 24(2): 178-182. DOI:10.3969/j.issn.1000-8160.2005.02.008 |
| [5] |
刘娟妮, 胡萍, 姚领, 等. 微藻培养中光生物反应器的研究进展[J]. 食品科学, 2006, 27(12): 772-777. LIU J N, HU P, YAO L, et al. Advance of photobioreactor on microalgalcultivation[J]. Food Science, 2006, 27(12): 772-777. DOI:10.3321/j.issn:1002-6630.2006.12.203 |
| [6] |
伊廷强, 叶静, 何泽超. 海洋微藻培养及光生物反应器的研究进展[J]. 化工设计, 2008, 18(3): 11-14. YI T Q, YE J, HE Z C. Research progressof cultivationof marine microalgaeand photo-bioreactor[J]. Chemical Engineering Design, 2008, 18(3): 11-14. |
| [7] |
ISMAR S M H, HANSEN T, SOMMER U. Effect of food concentration and type of diet on Acartia survival and naupliar development[J]. Marine Biology, 2008, 154(2): 335-343. DOI:10.1007/s00227-008-0928-9 |
| [8] |
SOUTHGATE P C, BRALEY R D, MILITZ T A. Ingestion and digestion of micro-algae concentratesby veliger larvae of the giant clam, Tridacnanoae[J]. Aquaculture, 2017, 473: 443-448. DOI:10.1016/j.aquaculture.2017.02.032 |
| [9] |
DUY N D Q, FRANCIS D S, PIROZZI I, et al. Use of micro-algae concentrates for hatchery culture of sandfish, Holothuriascabra[J]. Aquaculture, 2016, 464: 145-152. DOI:10.1016/j.aquaculture.2016.06.016 |
| [10] |
林伟, 陈騳, 刘秀云. 海洋微藻除菌及除菌与自然带菌微藻生长特点比较[J]. 海洋与湖沼, 2000, 31(6): 647-652. LIN W, CHEN D, LIU X Y. Marine microalgalaxenation and comparison of growth characteristics between natural and axenic marine microalgae[J]. Oceanologiaet Limnologia Sinica, 2000, 31(6): 647-652. DOI:10.3321/j.issn:0029-814X.2000.06.010 |
| [11] |
宋睿.蓝藻水华衍生物铵态氮对典型水生生物的生物效应研究[D].南京: 南京大学, 2011: 2. SONG R.Studies on cyanobacterial blooms-producing ammonia and the biologic effects on typical aquatic organisms[D].Nanjing: Nanjing University, 2011: 2. |
| [12] |
孙国铭, 汤建华, 仲霞铭. 氨氮和亚硝酸氮对南美白对虾的毒性研究[J]. 水产养殖, 2002(1): 22-24. SUN G M, TANG J H, ZHONG X M. Toxicity research of ammonia nitrogen and nitrite nitrogen to Penaeus vannamei[J]. Journal of Aquaculture, 2002(1): 22-24. DOI:10.3969/j.issn.1004-2091.2002.01.010 |
| [13] |
王敏, 田孟丹, 范耘硕, 等. 不同营养盐水平对威氏海链藻生长特性的影响[J]. 江苏农业科学, 2018, 46(3): 154-159. WANG M, TIAN M D, FAN Y S, et al. Effects of different nutrient levels on growth characteristics of Thalassiosira weissflogii[J]. Jiangsu Agricultural Sciences, 2018, 46(3): 154-159. |
| [14] |
刘皓, 高永利, 殷克东, 等. 不同氮磷比对中肋骨条藻和威氏海链藻生长特性的影响[J]. 热带海洋学报, 2010, 29(6): 92-97. LIU H, GAO Y L, YIN K D, et al. Effects of N to P ratio on the growth of two red tide diatom Skeletonema costatum and Thalassiosira weissflogii[J]. Journal of Tropical Oceanography, 2010, 29(6): 92-97. DOI:10.3969/j.issn.1009-5470.2010.06.014 |
| [15] |
游文朗, 陈必链, 王娟. 平板式光生物反应器中紫球藻培养条件的优化[J]. 植物资源与环境学报, 2006, 15(1): 30-33. YOU W L, CHEN B L, WANG J. Optimization of culture conditions of Porphyridium cruentum in the flat plate photobioreactor[J]. Journal of Plant Resources and Environment, 2006, 15(1): 30-33. DOI:10.3969/j.issn.1674-7895.2006.01.007 |
| [16] |
WANG B, LAN C Q, HORSMAN M. Closed photobioreactors for production of microalgal biomasses[J]. Biotechnology Advances, 2012, 30(4): 904-912. DOI:10.1016/j.biotechadv.2012.01.019 |
| [17] |
HULATT C J, THOMAS D N. Energy efficiency of an outdoor microalgal photobioreactor sited at mid-temperate latitude[J]. Bioresource Technology, 2011, 102(12): 6687-6695. DOI:10.1016/j.biortech.2011.03.098 |
| [18] |
刘凤路, 张福, 邸富荣, 等. 微藻复合多糖的抑菌及抗氧化研究[J]. 食品研究与开发, 2017, 38(2): 16-22. LIU F L, ZHANG F, DI F R, et al. Evaluation of antimicrobial activities and antioxidant capacity polysaccharides compounds from microalgae[J]. Food Research and Development, 2017, 38(2): 16-22. DOI:10.3969/j.issn.1005-6521.2017.02.004 |
| [19] |
陈峰, 田维娜, 孙东哲, 等. 微藻对微生物的抑制作用及其抑菌机理[J]. 中国食品学报, 2014, 14(4): 1-9. CHEN F, TIAN W N, SUN D Z, et al. Inhibition of microalgae on microbial and antibacterial mechanism:a review[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(4): 1-9. |
| [20] |
林伟, 陈騳, 刘秀云. 海洋微藻培育系统抗弧菌作用机理[J]. 海洋与湖沼, 2001, 32(1): 7-14. LIN W, CHEN D, LIU X Y. The antivibriomechanism of microalgae cultivation system[J]. Oceanologiaet Limnologia Sinica, 2001, 32(1): 7-14. DOI:10.3321/j.issn:0029-814X.2001.01.002 |
| [21] |
黄翔鹄, 李长玲, 刘楚吾, 等. 两种微藻改善虾池环境增强凡纳对虾抗病力的研究[J]. 水生生物学报, 2002, 26(4): 342-347. HUANG X H, LI C L, LIU C W, et al. Studies on two microalgae improving environment of shrimp pond and strengthening anti-disease ability of Penaeus vannamei[J]. Acta Hydrobiologica Sinica, 2002, 26(4): 342-347. DOI:10.3321/j.issn:1000-3207.2002.04.005 |
| [22] |
刘盼, 贾成霞, 杨慕, 等. 2种微藻对养殖水体中氨氮和亚硝态氮的净化作用[J]. 水产科学, 2018, 37(3): 389-393. LIU P, JIA C X, YANG M, et al. Removal of ammonia and nitrite nitrogen in aquaculture water by two species of microalgae[J]. Fisheries Science, 2018, 37(3): 389-393. |
| [23] |
王巧宁.大规模藻华区低氧对海洋生物的影响研究[D].青岛: 中国科学院研究生院(海洋研究所), 2012: 16-17. WANG Q N.The effects of hypoxia on the marine organisms in large-scale algal bloom area[D].Qingdao: Chinese Academy of Sciences (Institute of Oceanology), 2012: 16-17. |
| [24] |
张青田, 董双林, 胡桂坤, 等. 不同氮源对微藻增殖的影响[J]. 海洋科学, 2005, 29(2): 8-11. ZHANG Q T, DONG S L, HU G K, et al. Effects of different nitrogen on growth of microalgae[J]. Marine Sciences, 2005, 29(2): 8-11. DOI:10.3969/j.issn.1000-3096.2005.02.003 |
| [25] |
BENDER S J, PARKER M S, ARMBRUST E V. Coupled effects of light and nitrogen source on the urea cycle and nitrogen metabolism over a diel cycle in the marine diatom Thalassiosira pseudonana[J]. Protist, 2012, 163(2): 232-251. DOI:10.1016/j.protis.2011.07.008 |
2. Key Laboratory of South China Sea Fishery Resources Exploitation & Utilization, Ministry of Agriculture and Rural Affairs, South China Sea Fisheries Research Institute, China Academy of Fishery Sciences, Guangzhou 510300, Guangdong, China;
3. Shenzhen Base of South China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Shenzhen 518018, Guangdong, China;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


