2. 上海海洋大学 水产与生命学院, 上海 201306
肠道细菌影响宿主的生长发育、消化、营养吸收、疾病抵抗力和免疫等多种功能[1-2]。目前,学者对肠道微生物开展研究的虾类主要有:斑节对虾(Penaeus monodon)、中国对虾(Fenneropenaeus chinensis)、凡纳滨对虾(Litopenaeus vannamei)、日本沼虾(Macrobrachium nipponense)和罗氏沼虾(Macrobrachium rosenbergii)[3-7]。已有研究[7-12]表明,水产动物肠道细菌组成与动物种类、发育阶段、食物组成、环境因子和生理状态等因素密切相关。
罗氏沼虾又称马来西亚大虾或泰国虾,个体大、食性广、生长快、肉质鲜嫩、抗病力强,是目前世界上养殖产量最高的三大虾种之一。罗氏沼虾在我国有单养、与鱼类混养和与凡纳滨对虾混养等多种养殖模式。相对于畜禽动物而言,水产动物消化道短且生活于水环境中,其消化道菌群丰度更易受外界环境影响。刘其根等[13]研究表明,不同罗氏沼虾养殖模式对水质参数具有显著影响。另有研究[14-15]表明,水质参数影响养殖水体细菌种群结构,同时也影响养殖动物健康及其肠道细菌组成。因此,养殖模式有可能通过影响水质参数而影响水产动物肠道菌群结构,目前关于不同养殖模式对罗氏沼虾肠道细菌的影响还未见报道。
本实验设置6种养殖模式:罗氏沼虾单养,罗氏沼虾+浮萍(Lemna minor),罗氏沼虾+鲢(Hypophthalmichthys molitrix),罗氏沼虾+鲢+背角无齿蚌(Anodonta woodiana),罗氏沼虾+背角无齿蚌+浮萍,罗氏沼虾+背角无齿蚌+鲢+浮萍。采用高通量测序技术研究不同养殖模式罗氏沼虾肠道细菌组成,分析其与环境因子的相互作用,以期为罗氏沼虾肠道有益菌的筛选及其健康养殖提供理论参考。
1 材料与方法 1.1 养殖模式设置养殖实验于2014年7—9月进行,实验围隔设置在江苏盐城工学院校内水域中, 共24个围隔(5 m×3 m×1.8 m),采用防水刀刮布制作,配备1.5 kW增氧机1台。养殖实验共设6组:单养罗氏沼虾(MP组)、罗氏沼虾+浮萍(PP组)、罗氏沼虾+鲢(PF组)、罗氏沼虾+背角无齿蚌+鲢(PMF组)、罗氏沼虾+背角无齿蚌+浮萍(PMP组)、罗氏沼虾+鲢+背角无齿蚌+浮萍(PMPF组)。虾的放养量均为100 g/m2:有鲢组,鲢放养密度为10尾/围隔;有浮萍组,浮萍水面覆盖率为5%;有背角无齿蚌组,贝放养密度为4只/围隔。每组4个平行。放养规格:罗氏沼虾5~8 g,鲢为夏花鱼种5 g左右,河蚌为成体。
1.2 饲养管理实验期间不换水。每天投喂罗氏沼虾商品饲料3次,投饲率为虾体质量的3%~4%,具体根据虾的摄食和天气情况调整投喂量。养殖期间水温为21.4~31.7 ℃。
1.3 水样采集与水质指标测定养殖64 d,用采水器采集距池水表面20 cm左右深度水样,测定DO、pH、浊度、COD、BOD、NO3-N、NO2-N、NH3-N、TN、TP、PO4-P、有机碳(TOC)和叶绿素a浓度(Chl.a)等水质指标。其中DO、pH和浊度分别采用便携式DO仪(Lovibond SD150D)、pH计(Lovibond pH110)和浊度仪(Lovibond ET4200)现场测量,NO2-N和NH3-N采用多参数水质测定仪测定(Lovibond ET7919)。TOC采用有机碳测定仪测定(ANALYTIKJENA MULTI N/C ®2100),Chl.a水样处理和保存根据金相灿等[16],取300 mL水样经微孔滤膜过滤后,将带样品的滤膜剪碎放入10 mL离心管中-20 ℃静置保存24 h,采用乙醇-超声波法测定Chl.a [17]。其他项目取样和检测按照渔业水质监测方法进行[18]。
1.4 肠道样品采集与基因组DNA提取养殖64 d,取样前停食24 h。肠道样品采集:用70%乙醇擦拭虾体表面,用灭菌镊子和剪刀取出罗氏沼虾肠道。每个围隔取3尾虾肠道合并,置于1.5 mL无菌冷冻管中,置于-80 ℃保存备用。
采用QiaGen粪便DNA提取试剂盒提取细菌DNA,所有样品DNA提取步骤均按照试剂盒说明书进行。提取到的样品基因组DNA经1%琼脂糖凝胶电泳检测合格后,相同养殖模式的4个样本合并为一个样,用于高通量测序。
1.5 高通量测序分析针对细菌16S rRNA基因V3 + V4区设计含barcode的特异引物338F/806R,引物序列为338F:5′-ACTCCTACGGGAGGCAGCA-3′,806R:5′-GGACTACHVGGGTWTCTAAT-3′。PCR扩增采用20 μL反应体系:5 × Fast Pfu Buffer 4 μL,2.5 mmol/L dNTPs 2 μL,引物338F/806R各0.8 μL,FastPfu DNA聚合酶0.4 μL,模板10 ng,补足dd H2O至20 μL。PCR条件:95 ℃变性120 s;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,27个循环;最后72 ℃延伸10 min。
PCR产物经过2%琼脂糖凝胶电泳检测,条带清晰,片段大小合适(430 bp左右),使用AxyPrep DNA凝胶回收试剂盒(Axygen,美国)切胶回收PCR产物,以Tris-HCl洗脱后连接“Y”接头,使用磁珠筛选去除接头自连片段,按照每个样品测1万条序列加入1 ng PCR产物的标准富集PCT产物,然后用0.1 mol/L的NaOH溶液变性,获得单链DNA片段,构建测序文库后在16s-338F-806R Miseq平台进行高通量测序(美吉生物公司,上海)。
1.6 数据分析 1.6.1 水质数据分析采用Excel 2007处理数据,并用SPSS 17.0软件分别对各组水化学指标进行单因素方差分析,随后进行LSD多重比较,差异性以P < 0.05表示。
1.6.2 肠道细菌多样性分析Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。具体分析方法如下:(1)OTU聚类分析,利用软件平台Usearch(vsesion 7.1 http://drive5.com/uparse/)对所有序列进行OTU划分,在97%相似水平下的OTU进行生物信息统计分析。(2)分类学分析,采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析。(3)物种丰富度指数(Chao 1)、香农指数(Shannon)、辛普森指数(Simpson)和物种丰富度指数(ACE)公式计算细菌生态多样性指数,Mothur软件用于指数评估的OTU相似水平97% (0.97)。(4)样本聚类树与柱状图组合分析,样本聚类树采用软件Qiime计算beta多样性距离矩阵,计算距离矩阵的算法为bray curtis。群落结构图:利用R语言工具作图或在Excel中编辑作图。(5)采用CANOCO 4.5 for Windows软件对环境因子与肠道微生物群落组成变化相关性进行冗余分析(RDA),并用499次非限制性蒙特卡罗检验法验证计算结果显著性。
2 结果与分析 2.1 罗氏沼虾不同养殖模式下水质指标由表 1可知:罗氏沼虾不同养殖模式对水体浊度、PO4-P、TN和Chl.a具有显著影响(P < 0.05)。PF组浊度最大且显著高于PP、PMF和PMP组(P < 0.05)。MP组PO4-P浓度最大且显著大于其余各组(P < 0.05)。PF组TN浓度最大且显著大于其余各组(P < 0.05),其次为MP组。PF组Chl.a浓度最高且显著高于其余各组(P < 0.05)。
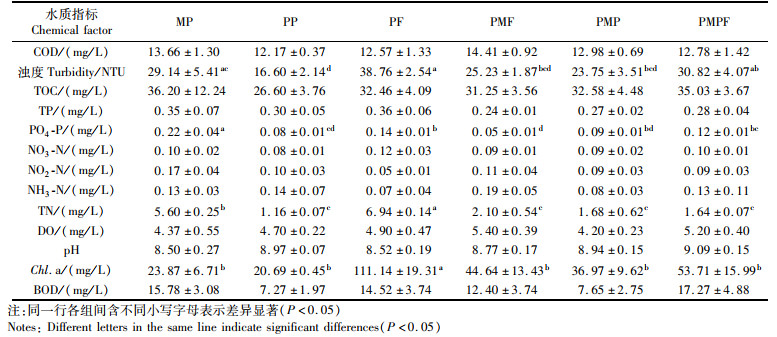
|
表 1 罗氏沼虾不同养殖模式对水质指标的影响 Tab.1 Effect of chemical factors of different cultural patterns of Macrobrachium rosenbergii |
由表 2可知,不同养殖模式罗氏沼虾肠道细菌多样性指数和物种丰富度有较大差异:PF组肠道细菌ACE和Chao 1分别为512和511,高于其余各组,说明其物种丰富度最高;PMF组肠道细菌丰富度最低,其ACE和Chao 1分别为207和169;MP组罗氏沼虾肠道细菌多样性指数最大(4.08),其次为PF组(3.56),最低为PMF组(1.27)。
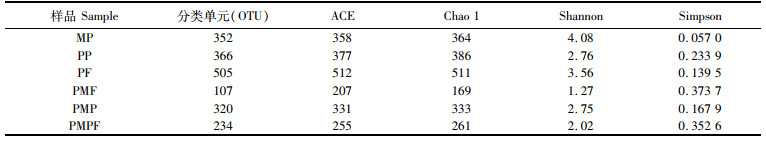
|
表 2 在97%相似度水平上样品中细菌的丰富度和多样性指数 Tab.2 Richness and diversity index of bacteria in samples at the 97% similarity level |
由表 3可知:PF组罗氏沼虾肠道细菌组成在门、纲、目、科和属水平皆最多,而PMF组肠道细菌在上述分类水平上均最少。

|
表 3 不同养殖模式罗氏沼虾肠道细菌菌群的基本构成 Tab.3 Composition of intestinal bacteria of Macrobrachium rosenbergii in different experimental treatments |
由图 1可知:6组样品中的细菌聚为2类,其中PMP、PMPF、MP和PF组聚为一类,PP和PMF聚为一类。
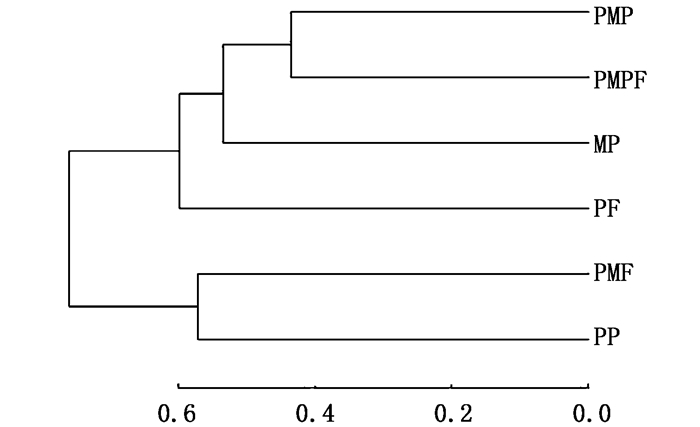
|
图 1 不同养殖模式罗氏沼虾肠道细菌的聚类分析 Fig. 1 Cluster analysis of microbes in intestine of Macrobrachium rosenbergii in different experimental treatments at the phylum level |
按占10%以上为优势菌门统计,变形菌门(Proteobacteria)、软壁菌门(Tenericute)和厚壁菌门(Firmicutes)在几种养殖模式的虾肠道中相对丰度较大(图 2)。MP、PP、PF、PMP和PMPF组中均以变形菌门相对丰度最高,对应OTU数量占该样品全部OTU的59.31%、83.17%、47.77%、57.41%和78.91%。PMF组罗氏沼虾肠道中软壁菌类相对丰度最大(53.33%),其次为变形菌门(44.88%)。MP组中优势种菌门为变形菌门(59.31%)和厚壁菌门(16.42%);PP组和PMPF组中优势菌均为变形菌门;PF组优势菌为变形菌门(47.77%)和软壁菌门(30.41%);PMF组以软壁菌门(53.33%)和变形菌门(44.88%)为优势菌;PMP组以变形菌门(57.41%)、软壁菌门(21.13%)和厚壁菌门(14.96%)为优势菌。
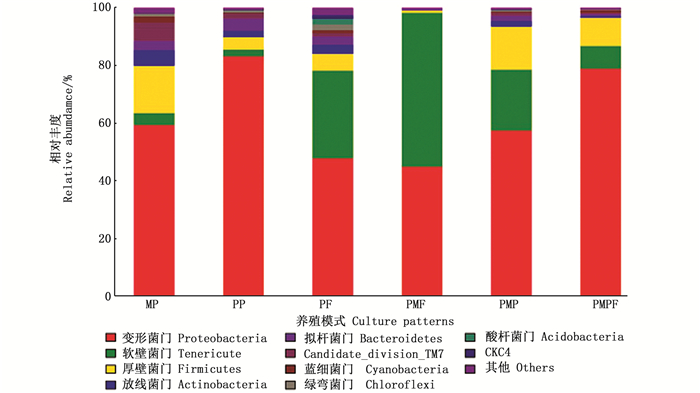
|
其他为丰度低于1%的部分 Others refers to a partial combination with abundance less than 1% 图 2 罗氏沼虾肠道细菌种群在门水平上的结构与分布 Fig. 2 Structure and distribution of bacterial communities at the phylum level in intestine of Macrobrachium rosenbergii in different experimental treatments |
在属(或科)水平上,不同养殖模式间罗氏沼虾肠道优势细菌(丰度大于1%的优势微生物)的组成及丰度存在明显不同(图 3)。MP组中主要优势菌属为气单胞菌属(Aeromonas)和乳球菌属(Lactococcus),分别占19.98%和7.77%;PP组主要为柠檬酸杆菌属(Citrobacter)、肠杆菌科(Enterobacteriaceae,未鉴定到属)和气单胞菌属,分别占45.97%、12.12%和7.09%;PF组主要为Candidatus Hepatoplasma和气单胞菌属,分别占30.21%和21.21%;PMF组主要为Candidatus Hepatoplasma、柠檬酸杆菌属和肠杆菌科,分别占53.33%、27.46%和15.06%;PMP组主要为气单胞菌属、Candidatus Hepatoplasma、乳球菌属和柠檬酸杆菌属分别占34.52%、20.36%、11.22%和8.43%;PMPF组主要优势菌为气单胞菌属、肠杆菌科和Candidatus Hepatoplasma,分别占57.84%、9.67%和7.55%。
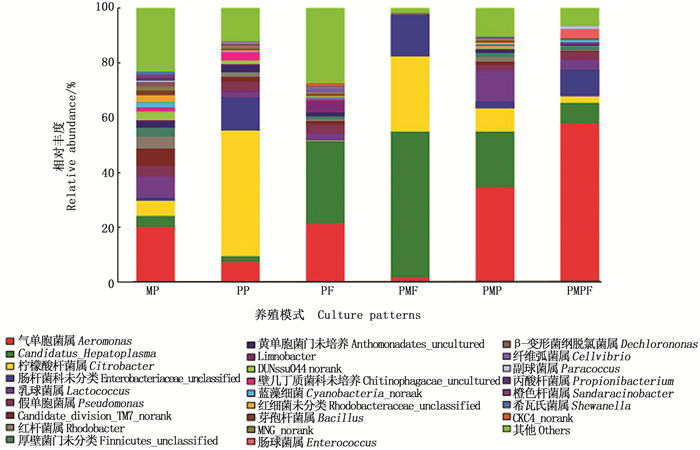
|
其他为丰度低于1%的部分 Others refers to a partial combination with abundance less than 1% 图 3 罗氏沼虾肠道中细菌种群在属(或科)水平上的结构与分布 Fig. 3 Structure and distribution of bacterial communities at the genus level in intestine of Macrobrachium rosenbergii in different experimental treatments |
由图 4可知:蒙特卡罗置换检验表明环境因子TP对罗氏沼虾肠道细菌群落具有显著影响(P < 0.05)。第一排序轴能解释的物种变量为37.9%,环境因子TP、TN和NO3-N与第一轴正相关,相关系数分别为0.92、0.80和0.66。第二排序轴能解释的物种变量为28.7%,NO2-N与第二轴正相关,相关系数为0.80。TP对罗氏沼虾肠道细菌多样性影响的大小顺序是:MP> PF>PP>PMP>PMPF>PMF。PMF和PMPF组,PMP和PP组罗氏沼虾肠道细菌相似,MP和PF组肠道细菌与其余各组差异较大。
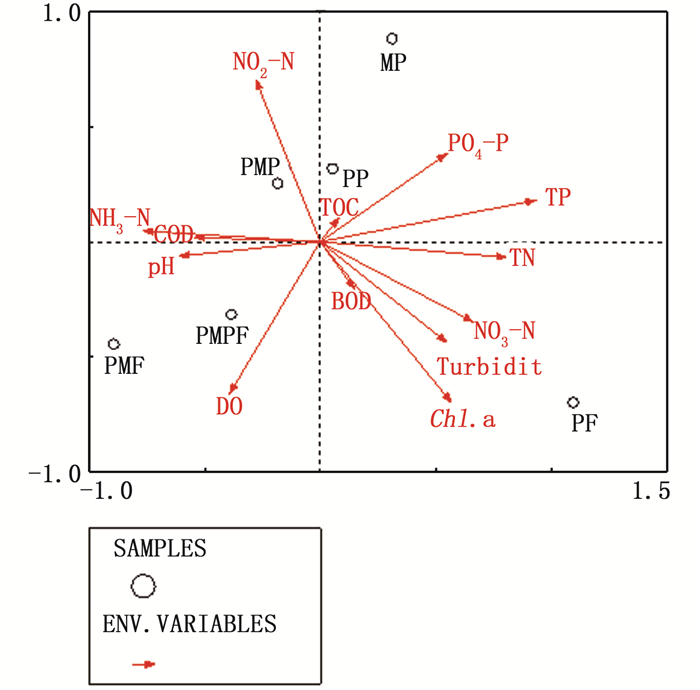
|
图 4 不同养殖模式罗氏沼虾肠道细菌群落与环境因子RDA排序图 Fig. 4 Correlation analysis between environmental factors and bacterial communities in intestine of Macrobrachium rosenbergii in different experimental treatments |
由图 5可知:第一、二排序轴能解释的物种变量为60.6%和83.9%。NH3-N和DO与第一轴正相关,相关系数为0.67和0.82。NO3-N、Chl.a、TN和BOD与第二轴呈正相关,相关系数分别为0.85、0.96、0.56和0.53。不同种类的微生物对环境因子的适应性差异显著。肠棕气单胞菌(Aeromonas enteropelogenes)、肠球菌(Enterococcus)和格氏乳球菌(Lactococcus garvieae)与NO3-N和TN呈正相关。红细菌属(Rhodobacter)和假单胞菌(Pseudomonas vranovensis)与TP和PO4-P呈正相关。
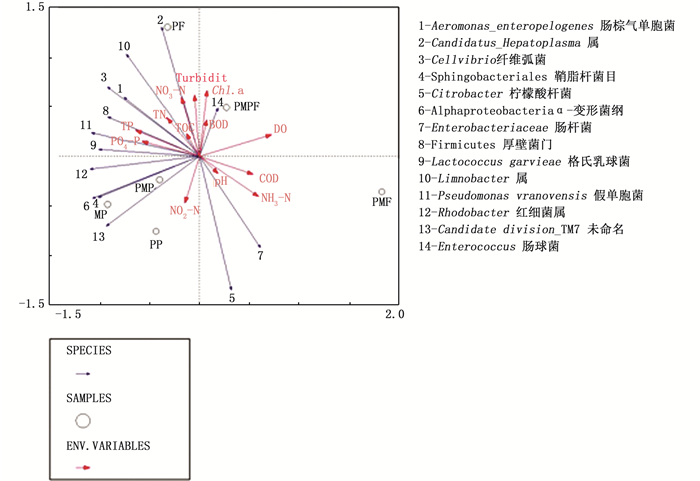
|
图 5 不同养殖模式罗氏沼虾肠道主要优势群落与环境因子RDA排序图 Fig. 5 Correlation analysis between environmental factors and dominant bacterial communities in intestine of Macrobrachium rosenbergii in different experimental treatments |
脊椎动物宿主肠道存在的由宿主特异性选择决定的某种或某些特殊的微生物种类,称为该物种的核心菌群。研究发现鱼类跟哺乳动物相似,肠道中也存在着与宿主种类相关的特有的核心菌群[19-20],宿主的基因型对鱼类肠道菌群有着重要的选择作用,这种选择作用可能会弱化诸如驯养状态、宿主栖息地等影响肠道菌群的因素[20]。目前关于虾类肠道核心菌群的研究较少。TZENG等[6]比较了不同栖息环境日本沼虾肠道细菌组成,发现主要为变形菌门,其次是厚壁菌门和放线菌门。RUNGRASSAMEE等[9]研究发现不同发育阶段的斑节对虾肠道优势菌都是γ-变形菌门。ZHANG等[10]研究得到不同脂肪源饲养的凡纳滨对虾肠道优势菌均为变形菌门和软壁菌门。郁维娜等[21]发现健康和患病的凡纳滨对虾肠道主要菌群均为变形菌门(51.2%)、放线菌门(27.2%)。MENTE等[7]研究处于蜕壳不同阶段罗氏沼虾的肠道优势菌,发现主要为γ-变形菌门,其次为厚壁菌门。MIAO等[22]研究生物絮团和对照组罗氏沼虾肠道菌群,发现其优势菌群也为变形菌门和厚壁菌门。本试验研究得到不同养殖模式罗氏沼虾肠道优势菌组成类似,分别是变形菌门、软壁菌门和厚壁菌门,这一结果与其他虾肠道优势菌亦类似。由此可以推测,变形菌门和厚壁菌门可能是罗氏沼虾肠道的核心菌群,其主要由罗氏沼虾基因型决定。本研究中,PMF组软壁菌门丰度最大(53.33%),高于变形菌门(44.88%),而其余组中则是变形菌门丰度最大,说明肠道软壁菌门可能受环境影响较大。据此推测,不同养殖模式对罗氏沼虾肠道核心菌门组成无影响,但影响其优势菌门丰度。
3.2 水质因子对罗氏沼虾肠道菌群落结构影响相对于畜禽动物,水生动物消化道短且生活在水环境中,除了宿主基因外,肠道微生物更易受到生境及食物的影响。孙振丽等[12]研究表明,凡纳滨对虾肠道菌群结构与养殖环境微生物存在密切的相互作用。通过向养殖水体大量投饵补充有机碳物质以保持一定碳氮比,定向调控养殖系统微生物群落的生物絮团技术目前已成功运用于南美白对虾养殖。MIAO等[22]通过向罗氏沼虾养殖水体中加入枯草杆菌(Bacillus subtillis)和乳球菌属(Lactococcus),并加糖蜜调节C/N比培养生物絮团,发现这两种菌在水体和虾肠道中存在较高比例。目前养殖模式对肠道细菌的影响仅见少量报道,蔡仲石[23]采用PCR-DGGE技术研究鲢肠道微生物,得出混养模式多样性高于单养模式,且不同放养模式鲢肠道微生物存在一定差异,分别具有不同的优势菌。本研究中,不同养殖模式罗氏沼虾肠道细菌的Shannon指数和各种菌类的相对丰度比例具有一定差异。分析表明:养殖模式对水体浊度、PO4-P、TN和Chl.a具有显著影响(P<0.05),RDA分析表明TP显著影响罗氏沼虾肠道菌群多样性,环境因子TP、TN和NO3-N与第一轴正相关;NO2-N与第二轴正相关;有益菌肠球菌和格氏乳酸菌与NO3-N和TN呈正相关。由此可见,养殖模式可通过影响水体营养盐种类尤其是磷和氮含量从而影响罗氏沼虾肠道微生物群落结构。目前关于环境因子对虾类肠道细菌的影响研究较少。尹军霞等[15]发现,凡纳滨对虾肠道中厌氧菌、双歧杆菌随水温升高而显著增加。相对与虾,食性和生境对鱼类肠道细菌的影响有较多的研究[24-27]。SCHMIDT等[28]研究表明在只改变饲养水环境盐浓度的前提下,黑花鳉(Poecilia sphenops)在适应盐浓度的过程中,肠道菌群的主要种类发生了变化。SULLAM等[29]研究发现,野生特立尼达孔雀鱼(Poecilia reticulata)与饲养孔雀鱼肠道微生物组成具有显著差异,不同河流生存的同种野生鱼肠道微生物组成也不同。鱼类肠道微生物在抑制病原微生物、肠道微生物代谢产物对促进免疫系统应答等方面具有重要作用。因此,鱼类通过改变肠道微生物结构来增强免疫能力可能是其适应生境的一种手段。本研究中,各种养殖模式水体营养盐尤其是磷存在差异,推测不同养殖模式罗氏沼虾肠道微生物结构的差异可能与其适应各自的生境有关。
本实验结果表明:(1)罗氏沼虾养殖模式对水体浊度、PO4-P、TN和Chl.a具有显著影响,与其他动植混养可显著降低水体PO4-P含量。(2)养殖模式不影响罗氏沼虾肠道核心菌门类,但影响优势菌门、主要优势菌属的丰度。(3)TP显著影响罗氏沼虾肠道微生物结构,养殖模式可通过影响水体营养盐尤其是氮磷的含量影响罗氏沼虾肠道微生物群落结构。
| [1] |
HOOPER L V, MIDTVEDT T, GORDON J I. How host-microbial interactions shape the nutrient environment of the mammalian intestine[J]. Annual Review of Nutrition, 2002, 22: 283-307. DOI:10.1146/annurev.nutr.22.011602.092259 |
| [2] |
RAWLS J F, SAMUEL B S, GORDON J I. Gnotobiotic zebrafish reveal evolutionarily conserved responses to the gut microbiota[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(13): 4596-4601. DOI:10.1073/pnas.0400706101 |
| [3] |
CHAIYAPECHARA S, RUNGRASSAMEE W, SURIYACHAY I, et al. Bacterial community associated with the intestinal tract of P.monodon in commercial farms[J]. Microbial Ecology, 2012, 63(4): 938-953. DOI:10.1007/s00248-011-9936-2 |
| [4] |
ZHANG M L, SUN Y H, CHEN K, et al. Characterization of the intestinal microbiota in Pacific white shrimp, Litopenaeus vannamei, fed diets with different lipid sources[J]. Aquaculture, 2014, 434: 449-455. DOI:10.1016/j.aquaculture.2014.09.008 |
| [5] |
LIU H D, WANG L, LIU M, et al. The intestinal microbial diversity in Chinese shrimp (Fenneropenaeus chinensis) as determined by PCR-DGGE and clone library analyses[J]. Aquaculture, 2011, 317(1/4): 32-36. |
| [6] |
TZENG T D, PAO Y Y, CHEN P C, et al. Effects of host phylogeny and habitats on gut microbiomes of oriental river prawn (Macrobrachium nipponense)[J]. PLoS One, 2015, 10(7): e0132860. DOI:10.1371/journal.pone.0132860 |
| [7] |
MENTE E, GANNON A T, NIKOULI E, et al. Gut microbial communities associated with the molting stages of the giant freshwater prawn Macrobrachium rosenbergii[J]. Aquaculture, 2016, 463: 181-188. DOI:10.1016/j.aquaculture.2016.05.045 |
| [8] |
RUNGRASSAMEE W, KLANCHUI A, MAIBUNKAEW S, et al. Characterization of intestinal bacteria in wild and domesticated adult black tiger shrimp (Penaeus monodon)[J]. PLoS One, 2014, 9(3): e91853. DOI:10.1371/journal.pone.0091853 |
| [9] |
RUNGRASSAMEE W, KLANCHUI A, CHAIYAPECHARA S, et al. Bacterial population in intestines of the black tiger shrimp (Penaeus monodon) under different growth stages[J]. PLoS One, 2013, 8(4): e60802. DOI:10.1371/journal.pone.0060802 |
| [10] |
ZHANG M L, SUN Y H, CHEN K, et al. Characterization of the intestinal microbiota in Pacific white shrimp, Litopenaeus vannamei fed diets with different lipid sources[J]. Aquaculture, 2014, 434: 449-455. DOI:10.1016/j.aquaculture.2014.09.008 |
| [11] |
ZHENG Y F, YU M, LIU Y, et al. Comparison of cultivable bacterial communities associated with Pacific white shrimp (Litopenaeus vannamei) larvae at different health statuses and growth stages[J]. Aquaculture, 2016, 451: 163-169. DOI:10.1016/j.aquaculture.2015.09.020 |
| [12] |
孙振丽, 宣引明, 张皓, 等. 南美白对虾养殖环境及其肠道细菌多样性分析[J]. 中国水产科学, 2016, 23(3): 594-605. SUN Z L, XUAN Y M, ZHANG H, et al. Bacterial diversity in the Penaeus vannamei Boone intestine and aquaculture environment[J]. Journal of Fishery Sciences of China, 2016, 23(3): 594-605. |
| [13] |
刘其根, 杨洋, 唐永涛, 等. 罗氏沼虾与三角帆蚌、鲢和鳙混养模式优化[J]. 水产学报, 2014, 38(11): 1855-1864. LIU Q G, YANG Y, TANG Y T, et al. Experimental study on structure optimization for polyculture of giant freshwater prawn with triangle sail mussel, silver carp and bighead carp[J]. Journal of Fisheries of China, 2014, 38(11): 1855-1864. |
| [14] |
张皓.养殖环境微生物群落的动态变化及与水环境的互作[D].苏州: 苏州大学, 2015. ZHANG H.The dynamic changes of microbial communities in aquaculture environment and interactions with water environment[D].Suzhou: Soochow University, 2015. |
| [15] |
尹军霞, 沈文英, 郦萍. 水温对南美白对虾肠道菌群影响的研究[J]. 海洋科学, 2004, 28(5): 33-36. YIN J X, SHEN W Y, LI P. Study on the influence of water temperature on the intestinal microflora of Penaeus vannamei[J]. Marine Sciences, 2004, 28(5): 33-36. DOI:10.3969/j.issn.1000-3096.2004.05.007 |
| [16] |
金相灿, 屠清瑛. 湖泊富营养化调查规范[M]. 2版.北京: 中国环境科学出版社, 1990: 160-188. JIN X C, TU Q Y. The investigation standard of lake eutrophication[M]. 2nd ed.Beijing: China Environmental Science Press, 1990: 160-188. |
| [17] |
章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1991: 345-347. ZHANG Z S, HUANG X F. Methods for the plankton study in freshwater[M]. Beijing: Science Press, 1991: 345-347. |
| [18] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会.GB 11607-1989渔业水质标准[S].北京: 中国标准出版社, 1989. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China.GB 11607-1989 Water quality standard for fisheries[S].Beijing: Standards Press of China, 1989. |
| [19] |
WU S G, WANG G T, ANGERT E R, et al. Composition, diversity, and origin of the bacterial community in grass carp intestine[J]. PLoS One, 2012, 7(2): e30440. DOI:10.1371/journal.pone.0030440 |
| [20] |
ROESELERS G, MITTGE E K, STEPHENS W Z, et al. Evidence for a core gut microbiota in the zebrafish[J]. ISME Journal, 2011, 5(10): 1595-1608. DOI:10.1038/ismej.2011.38 |
| [21] |
郁维娜, 戴文芳, 陶震, 等. 健康与患病凡纳滨对虾肠道菌群结构及功能差异研究[J]. 水产学报, 2018, 42(3): 399-409. YU W N, DAI W F, TAO Z, et al. Characterizing the compositional and functional structures of intestinal micro-flora between healthy and diseased Litopenaeus vannamei[J]. Journal of Fisheries of China, 2018, 42(3): 399-409. |
| [22] |
MIAO S Y, ZHU J Y, ZHAO C Z, et al. Effects of C/N ratio control combined with probiotics on the immune response, disease resistance, intestinal microbiota and morphology of giant freshwater prawn (Macrobrachium rosenbergii)[J]. Aquaculture, 2017, 476: 125-133. DOI:10.1016/j.aquaculture.2017.04.027 |
| [23] |
蔡仲石.三种不同环境中鲢鳙肠道微生物研究[D].上海: 上海海洋大学, 2014. CAI Z S.The research of intestinal microbial in Hypophthalmichthys molitrix and Aristichthys nobilis in three different environment[D].Shanghai: Shanghai Ocean University, 2014. |
| [24] |
HENNERSDORF P, MROTZEK G, ABDUL-AZIZ M A, et al. Metagenomic analysis between free-living and cultured Epinephelus fuscoguttatus under different environmental conditions in Indonesian waters[J]. Marine Pollution Bulletin, 2016, 110(2): 726-734. DOI:10.1016/j.marpolbul.2016.05.009 |
| [25] |
LI J J, NI J J, LI J L, et al. Comparative study on gastrointestinal microbiota of eight fish species with different feeding habits[J]. Journal of Applied Microbiology, 2014, 117(6): 1750-1760. DOI:10.1111/jam.2014.117.issue-6 |
| [26] |
LIU H, GUO X W, GOONERATNE R, et al. The gut microbiome and degradation enzyme activity of wild freshwater fishes influenced by their trophic levels[J]. Scientific Reports, 2016, 6: 24340. DOI:10.1038/srep24340 |
| [27] |
车建锋, 李志斐, 王广军, 等. 混养池塘生物膜微生物群落功能多样性特征分析[J]. 上海海洋大学学报, 2017, 26(6): 862-871. CHE J F, LI Z F, WANG G J, et al. Microbial metabolic characteristics of biofilm communities in polyculture pond[J]. Journal of Shanghai Ocean University, 2017, 26(6): 862-871. |
| [28] |
SCHMIDT V T, SMITH K F, MELVIN D W, et al. Community assembly of a euryhaline fish microbiome during salinity acclimation[J]. Molecular Ecology, 2015, 24(10): 2537-2550. DOI:10.1111/mec.13177 |
| [29] |
SULLAM K E, RUBIN B E R, DALTON C M, et al. Divergence across diet, time and populations rules out parallel evolution in the gut microbiomes of Trinidadian guppies[J]. The ISME Journal, 2015, 9(7): 1508-1522. DOI:10.1038/ismej.2014.231 |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


