2. 上海市水产养殖工程技术研究中心, 上海 201306;
3. 水产科学国家级实验教学示范中心, 上海 201306
抗生素在集约化动物养殖过程中过度使用一直备受诟病,人们迫切需要找到一些环保、安全的替代品以保障养殖动物的健康生长。益生菌被认为是饲用抗生素的重要替代品。研究表明,使用益生菌不仅可以促进水产动物的生长[1-2]、提高存活率[3-4],也能减少水生动物病害的发生概率[5-6]。光合细菌(photosynthetic bacteria,PSB)是一类以光作为能源、能在厌氧光照条件下进行不放氧光合作用的益生菌[7],它们有多种不同的代谢途径,可以通过降解废物、提供营养等作用达到益生效果。通常光合细菌指α-变形细菌纲中的一些特定群体,即紫色非硫细菌。目前应用较广的光合细菌主要有红假单胞菌属(Rhodopseudomonas)、红螺菌属(Rhodospirillum)和红微菌属(Rhodomicrobium)等。光合细菌易消化,富含蛋白质、类胡萝卜素、生物因子和维生素[8],可以作为饵料、饲料添加剂饲喂鱼虾。同时,活体光合细菌在代谢过程中可以降解水体中的亚硝酸盐、硫化物等有毒物质,起到净化水质[9]、预防疾病等作用,因此光合细菌被广泛应用于水产养殖业[10]。
凡纳滨对虾(Litopenaeus vannamei)是世界上重要的经济虾类养殖品种[11],近几年因传染性疾病及高密度养殖的应激胁迫等造成凡纳滨对虾的大规模死亡,给养殖企业造成了重大损失[12]。现代医学研究表明,肠道微生物群落结构被认为是影响机体消化机能和免疫抗病的重要影响因子[13-14]。养殖水体中泼洒光合细菌对水产动物生长性能的影响已有较多报道[15-16],但在饲料中添加光合细菌的应用效果研究较少有报道。本试验选用不同光合细菌喷涂的饲料投喂凡纳滨对虾幼虾,通过检测对虾肝胰腺消化酶和肠道及其内容物微生物种类及相对丰富度,评估对虾摄食含不同光合细菌饲料后其消化能力及肠道微生物组成,以期为光合细菌在凡纳滨对虾养殖上高效应用提供指导。
1 材料与方法 1.1 实验虾苗及管理实验用虾苗购自青浦彰显渔业合作社,暂养于5.0 m × 2.5 m × 1.8 m的水泥池中,暂养期间投喂虾片并逐步淡化,直至表观盐度为0。淡化完成后暂养池中适量接种单生卵囊藻(Oocystis solitaria) (9 × 104个/mL)和四尾栅藻(Scenedesmus quadricauda) (2 × 105个/mL)。日投喂市售商品饲料3次,每2天换1次水,换水量约为水体的1/4;连续充氧,保持溶氧在6 mg/L以上,氨氮小于0.2 mg/L,亚硝酸小于0.005 mg/L,pH为7.8 ~ 8.5,水温为(30±2) ℃。
1.2 实验设置与管理实验设1个对照组和3个光合细菌处理组。对照组(A组)投喂商品饲料(不喷涂光合细菌),实验组B、C和D分别喷涂市售光合细菌菌液、红假单胞菌菌液和红螺菌菌液。市售光合细菌由上海某公司生产,红假单胞菌菌液和红螺菌菌液由实验室纯种厌氧培养。饲料喷涂时,取2 g饲料平铺在培养皿中,用微型医用喷雾器均匀喷涂0.2 mL菌液(调节浓度1 × 1010个/mL)于饲料上,阴凉处放置1 h后用于投喂。
实验在水体体积为100 L的20个水族箱中进行,每组5个平行,每个平行组投放凡纳滨对虾[(1.21 ± 0.24) g]幼虾10尾。使用暂养池水作为养殖用水。实验期间每日投喂3次(6:00,17:00,22:00),每次饱食投喂,连续充气,并用暂养池水流水养殖,控制日换水量100%。实验持续2周。
1.3 实验样品的采集养殖实验开始前,随机从暂养池中取20尾幼虾,测量体长体质量后采集肠道用于检测初始的肠道菌落组成。养殖2周后,从各养殖水箱中分别取对虾,测量其体长、体质量后,用手术刀切断对虾头胸甲和腹部连接处,并切去尾节,然后用无菌解剖针挑取消化道,放入1.5 mL无菌离心管中,同一平行内的虾消化道作为一个样品,用于微生物多样性的检测。用镊子摘取肝胰腺,放入5 mL离心管,用于消化酶的测定。所有样品冰冻保存带回实验室,用于后续分析。
1.4 消化酶的测定将采集的肝胰腺样品称重,按1:9加入磷酸缓冲溶液,冰水浴匀浆,4 ℃离心(3 000 r/min,15 min)取上清液,用于消化酶活性比活力的测定。酶液的蛋白质浓度采用考马斯亮兰法测定。淀粉酶活力的测定采用南京建成淀粉酶(AMS)测试盒法,每毫克蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。蛋白酶活力的测定采用福林酚法[17],每毫克蛋白在40 ℃、pH为9.8条件下,1 min水解酪素产生1 μg酪氨酸定义为1个酶活力单位。脂肪酶活力的测定使用对硝基苯酚法[18],在37 ℃条件下,每毫克蛋白在本反应体系中与底物反应1 min,释放出1 μmol对硝基苯酚的酶量定义为1个脂肪酶活力单位。
1.5 DNA的抽提与质检对于肠道微生物采用环境样DNA提取试剂盒(Axygen® AxyPrepTM Bacterial Genomic DNA Purification Miniprep Kits)完成基因组DNA抽提,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA完整性,Qubitpicogreen荧光定量系统定量DNA浓度。
1.6 目标区域扩增及产物纯化PCR试验采用高保真DNA聚合酶:TaKaRa EX Taq。PCR仪型号:Applied Biosystems 2720 Thermal Cycler。16S rDNA引物采用16S rDNA-341F:CCTACGGGNGGCWGCAG,16S rDNA-785R:GACTACHVGGGTATCTAATCC。扩增产物使用2%琼脂糖凝胶电泳检测,使用AxyPrepTM Mag PCR Clean-Up Kit (AXYGEN公司)磁珠回收纯化,检验合格后用于定量建库。PCR产物委托晶能生物技术(上海)有限公司进行Miseq高通量测序,比对RDP数据库分析微生物多样性。
1.7 数据分析用Mothur软件对所得序列进行分析,以97%相似性为标准划分操作分类单元(operational taxonomic unit,OTU),同时,对物种的丰富度指数(Chao和ACE)、香农指数(Shannon index)、辛普森指数(Simpson index)进行计算。同时, 采用SPSS 22软件对不同样品OTU数据及其他数据进行单因素方差分析,Duncan氏法进行多重比较,处理间P<0.05则认为差异显著。
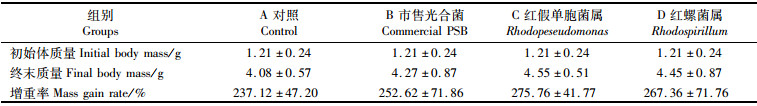
2 结果与分析 2.1 投喂不同光合细菌喷涂饲料对凡纳滨对虾生长及肝胰腺消化酶活性的影响实验用对虾初始质量为(1.21 ± 0.24)g,经不同光合细菌菌液喷涂饲料饲养2周后,各组对虾体质量增长明显,光合细菌处理组的平均增长率大于对照组,但差异不明显(P>0.05,表 1)。
|
表 1 摄食喷涂不同光合细菌饲料2周后凡纳滨对虾的生长情况 Tab.1 Growth of white shrimp L. vannamei fed diets coated with different photosynthetic bacteria for two weeks |
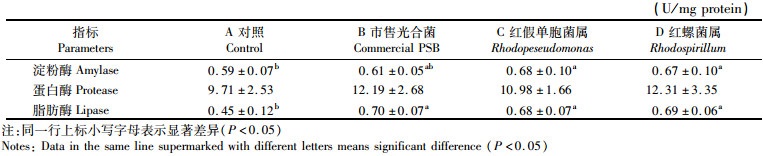
对虾肝胰腺消化酶活力分析发现,各处理组对虾蛋白酶活力差异不显著(P>0.05)。但3个光合细菌实验组对虾脂肪酶活力均显著高于对照组(P<0.05)。喷涂红假单胞菌(C组)和红螺菌(D组)的饲料,淀粉酶活力显著高于对照组(A组,P<0.05,表 2)。
|
表 2 摄食喷涂不同光合细菌饲料的凡纳滨对虾肝胰腺消化酶活力 Tab.2 Activities of digestive enzymes in hepatopancreas of white shrimp fed diets coated with different photosynthetic bacteria |
凡纳滨对虾肠道微生物群落多样性指数通过高通量测序获得序列。初始样品(CS)检出OTU平均数为105。2周后A、B、C和D组平均检出的OTU数为234、285、313、356,明显增多。所有样品的Coverage指数均在0.996以上,说明样品中的序列被测出的概率较高。
从表 3可知,反映对虾肠道微生物群丰富度的指标Chao和ACE指数,养殖实验2周后各组均显著高于养殖实验开始时(P<0.05),但养殖结束时摄食喷涂不同光合细菌饲料的对虾其肠道微生物丰富度无显著差异(P>0.05)。从肠道微生物多样性指标Simpson指数看,养殖终末值明显小于养殖实验初始值,而养殖终末的Shannon指数均明显大于养殖初始值,其中D组Simpson和Shannon指数均与初始值存在显著差异(P<0.05)。

|
表 3 投喂不同光合细菌喷涂饲料对凡纳滨对虾肠道微生物群丰富度和多样性的影响 Tab.3 Effects of different PSB coating diets on abundance and diversity of intestinal microflora of white shrimp L. vannamei |
将肠道微生物丰富度大于1%的菌纲作为主要微生物群进行统计,实验凡纳滨对虾肠道主要微生物群如图 1所示。实验开始之前CS组对虾肠道检测出的主要微生物群只有γ-变形细菌纲(Gammaproteobacteria,91.44%)和梭菌纲(Clostridia,1.50%)。经过2周的养殖实验,各组凡纳滨对虾肠道主要微生物群的数量均增多。投喂普通商品饲料的对照组(A组)对虾肠道主要群落组成为γ-变形细菌纲(74.39%)、α-变形细菌纲(Alphaproteobacteria,7.17%)、浮霉状菌纲(Planctomycetia,7.07%)、蓝细菌纲(Cyanobacteria,2.23%)和鞘脂杆菌纲(Sphingobacteriia 2.20%)。投喂市售光合细菌喷涂饲料的B组对虾肠道主要微生物群为γ-变形细菌纲(71.51%)、梭菌纲(6.62%)、浮霉状菌纲(5.50%)、α-变形细菌纲(5.09%)和蓝细菌纲(4.09%)。投喂红假单胞菌喷涂饲料的C组对虾肠道主要微生物群为γ-变形细菌纲(63.41%)、α-变形细菌纲(9.98%)、浮霉状菌纲(9.72%)、蓝细菌纲(4.79%)和鞘脂杆菌纲(1.30%)。投喂红螺菌喷涂饲料的D组对虾肠道主要微生物群较多,分属9个纲,分别是γ-变形细菌纲(44.73%)、浮霉状菌纲(16.79%)、α-变形细菌纲(10.95%)、放线细菌纲(Actinobacteria 1.07%)、蓝细菌纲(5.75%)、梭菌纲(2.53%)、鞘脂杆菌纲(1.27%)、Chloroplast (1.08%)和暖绳菌纲(Caldilineae 1.06%)。

|
CS.养殖实验开始前;A.对照组;B.喷涂市售光合细菌组;C.喷涂红假单胞菌组;D.喷涂红螺菌组 CS.initial state; A. control; B. commercial PSB treatment; C. Rhodopeseudomonas treatment; D.Rhodospirilum treatment 图 1 摄食不同光合细菌喷涂饲料2周后凡纳滨对虾肠道主要微生物群纲水平组成 Fig. 1 Intestinal microbial compositions at class level in white shrimp L. vannamei fed diets coated with different photosynthetic bacteria for 2 weeks |
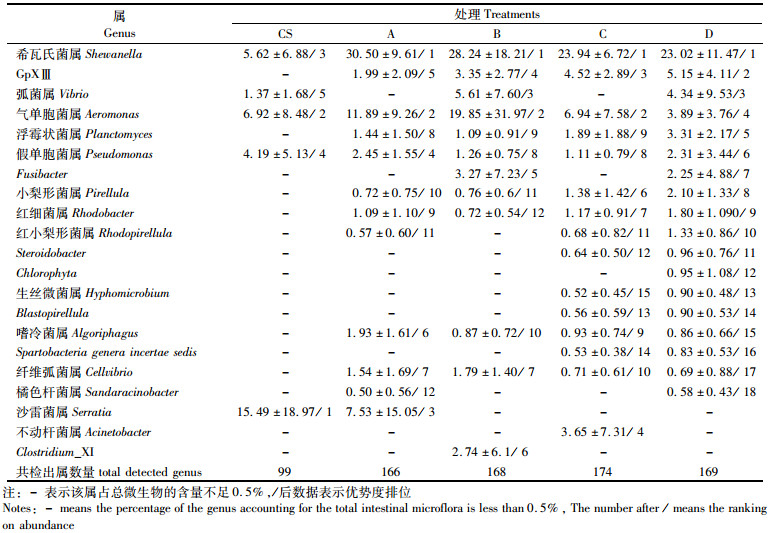
将检测到的肠道微生物丰富度大于0.5%的属作为主要属进行统计分析(表 4)。实验初始时凡纳滨对虾肠道主要微生物只有5个属,饲养2周后,对照组(A)对虾肠道主要微生物增加到12个属,摄食B、C和D组对虾肠道主要微生物属分别有12、15和18个属。实验初始时凡纳滨对虾肠道中最多的微生物为沙雷菌属(Serratia);而养殖2周后各组对虾肠道中最多的微生物为希瓦氏菌属(Shewanella)。实验结束时各组虾肠道共同检测到的主要微生物有9个属,分别是:希瓦氏菌属、气单胞菌属(Aeromonas、Algoriphagus)、纤维弧菌属(Cellvibrio)、GpXⅢ、Pirellula、浮霉状菌属(Planctomyces)、假单胞菌(Pseudomonas)和红细菌属(Rhodobacter)。其中,希瓦氏菌属、气单胞菌属和假单胞菌也是实验初始时对虾肠道中的主要微生物。
|
表 4 摄食不同光合细菌喷涂饲料2周后凡纳滨对虾肠道微生物群的主要属百分比及其排位 Tab.4 Percentages and ranking of main genus of intestinal microflora in white shrimp L. vannamei fed diets coated with different photosynthetic bacteria for 2 weeks |
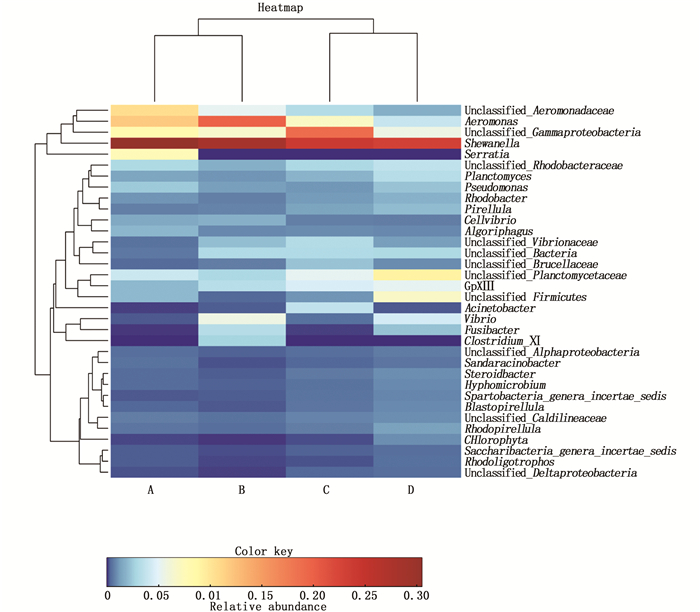
为进一步比较差异性,将养殖2周后平均含量大于0.25%的属做成热图。热图可以用颜色变化直观反映多个样品在各分类水平上群落组成的相似性和差异性。对照的A组中沙雷菌属和未分类的Unclassified_Aeroomonadaceae高于实验组B、C和D。从热图可以直观地看出各组肠道中希瓦菌属的含量都非常高,说明希瓦菌属在肠道中所占比例非常高(图 2)。
|
图 2 投喂光合细菌2周后主要微生物在属水平上的热图(百分比大于0.25%) Fig. 2 Heat map of microorganisms at genus level (percentage>0.25%) |
光合细菌相关制剂在水产中被广泛使用和研究。CHUMPOL等[15]研究表明,某些光合细菌对凡纳滨对虾养殖水体的水质保持有良好效果,相关制剂使用后增加了对虾成活率,提高了虾的生长情况。CAO等[19]将光合细菌与其他益生菌在生产中混用,发现可以提高凡纳滨对虾的产量。本实验,将光合细菌直接喷涂于饲料之上进行投喂,结果显示养殖2周后,3种不同的光合细菌菌液均没有显著增加凡纳滨对虾的增重率,而CHAI等[1]从肠道中分离培养某益生菌后饲喂凡纳滨对虾,30 d后对虾增重率显著提高。王刚等[20]在饲料中添加芽孢杆菌投喂中华鳖,15 d后增重率显著提高。这说明本实验中对虾增重率无显著差异可能与投喂时间较短有关,如果适当延长投喂时间可能会显著改善虾体增重情况。推测益生菌对水生动物生长的改善,可能受到益生菌种类、饲喂时长等因素的影响。
消化酶活性的高低可以作为衡量水产动物消化水平高低的重要参考指标。有诸多研究[21-23]表明,益生菌等物质能够调节凡纳滨对虾肠道消化能力和增强肠道功能。WANG等[24]研究结果显示,在饲料中补充光合细菌进行投喂,可以提高鲤鱼肠道中脂肪酶、蛋白酶和淀粉酶的活性。WANG[25]还研究发现将光合细菌与其他益生菌混合,可以提高凡纳滨对虾肠道中脂肪酶、蛋白酶、纤维素酶和淀粉酶的活性。本实验研究的是肝胰腺消化酶,结果显示,在饲料中补充3种光合细菌对凡纳滨对虾蛋白酶活力差异不显著,但补充后均能显著提高脂肪酶活力,补充沼泽红假单胞菌和深红红螺菌组淀粉酶活力也显著提高,表明消化酶活力的提高可能与光合细菌的种类有关,这种差异或许与不同光合细菌的代谢生理有关。
丰富度指数和多样性指数是检测样品微生物多样程度和复杂性的重要指标,其数值的差异反映的是群落结构和物种数目的不同,其指标通过划分的OTU数所反映。由于基于高通量测序技术的变革革新[26],其应用也越来越广泛,尤其在生物学和临床方面。本实验通过高通量测序检测对虾肠道OTU的平均数量均大于105,表明其检测结果有一定的代表性。微生物数量变化有一定的波动性。温度也会影响微生物数量的变化,而且肠道微生物的改变,在一定程度上受水环境微生物与水体浮游藻类的影响[27-29]。相关研究[30]还表明与凡纳滨对虾相关的细菌群落与生长阶段和健康状况有一定的联系。本研究中,在实验用水相同的情况下,表 3的结果表明,随着对虾的生长,对虾肠道微生物群落的丰富度和多样性都会增加,但是否投喂光合细菌喷涂饲料以及喷涂何种光合细菌没有显著改变对虾肠道微生物群的整体丰富度和多样性。ZHANG等[31]认为对虾肠道环境对微生物群落的建立具有选择性压力,因此其整体丰富度和多样性不能轻易改变。表 4也表明,各组对虾肠道中检测到的共有微生物主要有9个属,这些属的微生物占对虾肠道检出微生物总量的50%以上。这也从另一个角度表明这些属或许是对虾肠道中重要的固有微生物。DEVARAJA等[32]在使用某益生菌后发现,微生物产品的应用对正常微生物群落没有产生不利影响。然而,HOSTINS等[33]发现在水中加入某商业益生元会提高水体中微生物的丰富度。
从对虾肠道微生物群的具体组成看,摄食3种光合细菌饲料的对虾肠道γ-变形细菌纲比例大量减少,这种现象在红螺菌处理组更为明显,其所占比例减少一半以上,表明虽然光合细菌的使用不能轻易改变对虾肠道微生物丰富度和多样性,但在一定程度上可以改变其微生物群落组成和比例。这一点从肠道微生物属阶元上的分析也证实了。未经光合细菌处理组对虾肠道中,沙雷菌属是位列第3的主要菌类;而在光合细菌处理的3组对虾肠道中,沙雷菌属不再是主要菌类。虽然某些类型的沙雷氏菌属是人类和其他动物的条件致病菌[34-35],但是并没有充分的证据和研究表明这些属在肠道中的差异会对虾产生有利或者不利的影响。此外,养殖实验结束时,B组和D组均检测到了较高比例的弧菌,然而,该两组对虾的生长并没有受到显著影响(表 1),推测在肠道中菌群的整体组成及比例或许比单一细菌的含量更具有重要意义。
综上所述,摄食喷涂光合细菌的饲料2周后,凡纳滨对虾生长改善不显著,但肝胰腺脂肪酶活力显著增强。随着对虾生长,其肠道微生物丰富度和多样性都会提高。使用光合细菌不会显著改变对虾肠道微生物群的整体丰富度和多样性,但会在一定程度上丰富肠道主要微生物属的组成和比例。
| [1] |
CHAI P C, SONG X L, CHEN G F, et al. Dietary supplementation of probiotic Bacillus PC465 isolated from the gut of Fenneropenaeuschinensis improves the health status and resistance of Litopenaeus vannamei against white spot syndrome virus[J]. Fish & Shellfish Immunology, 2016, 54: 602-611. |
| [2] |
ADEOYE A A, YOMLA R, JARAMILLO-TORRESA, et al. Combined effects of exogenous enzymes and probiotic on Nile tilapia (Oreochromis niloticus) growth, intestinal morphology and microbiome[J]. Aquaculture, 2016, 463: 61-70. DOI:10.1016/j.aquaculture.2016.05.028 |
| [3] |
SHA Y J, WANG L, LIU M, et al. Effects of lactic acid bacteria and the corresponding supernatant on the survival, growth performance, immune response and disease resistance of Litopenaeus vannamei[J]. Aquaculture, 2016, 452: 28-36. DOI:10.1016/j.aquaculture.2015.10.014 |
| [4] |
ZHOU X X, WANG Y B, LI W F. Effect of probiotic on larvae shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities[J]. Aquaculture, 2009, 287(3/4): 349-353. |
| [5] |
LIU H Y, LI Z, TAN B P, et al. Isolation of a putative probiotic strain S12 and its effect on growth performance, non-specific immunity and disease-resistance of white shrimp, Litopenaeus vannamei[J]. Fish & Shellfish Immunology, 2014, 41(2): 300-307. |
| [6] |
RAMESH D, VINOTHKANNA A, RAI A K, et al. Isolation of potential probiotic Bacillus spp. and assessment of their subcellular components to induce immune responses in Labeorohita against Aeromonashydrophila[J]. Fish & Shellfish Immunology, 2015, 45(2): 268-276. |
| [7] |
杨官娥, 张肇铭, 熊琦. 光合细菌化学成分和生理活性研究进展[J]. 中草药, 2005, 36(7): 1089-1092. YANG G E, ZHANG Z M, XIONG Q. Advances in studies on chemical constituents and physiological activity of photosynthetic bacteria[J]. Chinese Traditional and Herbal Drugs, 2005, 36(7): 1089-1092. DOI:10.3321/j.issn:0253-2670.2005.07.051 |
| [8] |
王绍校, 杨惠芳, 黄志勇, 等. 嗜盐光合细菌的分离鉴定及其营养成分分析[J]. 应用与环境生物学报, 2003, 9(3): 298-301. WANG S X, YANG H F, HUANG Z Y, et al. Isolation and identification of marine photosynthesis bacteria and analysis of their nutritional compositions[J]. Chinese Journal of Applied and Environmental Biology, 2003, 9(3): 298-301. DOI:10.3321/j.issn:1006-687X.2003.03.019 |
| [9] |
熊晖, 梁运祥. 外加光合细菌对养殖水体水质及微生物群落的影响[J]. 湖北农业科学, 2011, 50(22): 4682-4685. XIONG H, LIANG Y X. Study on the impact of external photosynthetic bacteria on water quality and microbial community of aquaculture water[J]. Hubei Agricultural Sciences, 2011, 50(22): 4682-4685. DOI:10.3969/j.issn.0439-8114.2011.22.041 |
| [10] |
谢航, 陈婕, 邱宏端. 原生质体融合选育耐高温耐盐红螺菌的研究[J]. 上海海洋大学学报, 2011, 20(6): 866-872. XIE H, CHEN J, QIU H D. Study on the breeding of Rhodospirillaceae bacteria with salt-resistance and high temperature-resistance by protoplast fusion[J]. Journal of Shanghai Ocean University, 2011, 20(6): 866-872. |
| [11] |
王鑫磊, 李航, 黄旭雄, 等. 饲料中胆固醇含量对淡水养殖凡纳滨对虾生长性能、抗弧菌和抗亚硝态氮胁迫能力的影响[J]. 动物营养学报, 2016, 28(8): 2639-2649. WANG X L, LI H, HUANG X X, et al. Effects of dietary cholesterolcontent on growth performance, Vibrio and nitrite nitrogen stress resistant abilities of Litopenaeus vannamei cultured in freshwater[J]. Chinese Journal of Animal Nutrition, 2016, 28(8): 2639-2649. DOI:10.3969/j.issn.1006-267x.2016.08.037 |
| [12] |
刘双印, 徐龙琴, 李道亮, 等. 基于物联网的南美白对虾疾病远程智能诊断系统[J]. 中国农业大学学报, 2014, 19(2): 189-195. LIU S Y, XU LQ, LI D L, et al. Research on remote system for disease diagnosis of Penaeus vannamei based on Internet of things[J]. Journal of China Agricultural University, 2014, 19(2): 189-195. |
| [13] |
GARFIAS-LÓPEZ J A, CASTRO-ESCARPULI G, CÁRDENASP E, et al. Immunization with intestinal microbiota-derived Staphylococcus aureus and Escherichia coli reduces bacteria-specific recolonization of the intestinal tract[J]. Immunology Letters, 2018, 196: 149-154. DOI:10.1016/j.imlet.2018.02.007 |
| [14] |
CHEN GJ, XIE MH, WAN P, et al. Digestion under saliva, simulated gastric and small intestinal conditions and fermentation invitro by human intestinal microbiota of polysaccharides from Fuzhuan brick tea[J]. Food Chemistry, 2018, 244: 331-339. DOI:10.1016/j.foodchem.2017.10.074 |
| [15] |
CHUMPOL S, KANTACHOTE D, NITODA T, et al. The roles of probiotic purple nonsulfur bacteria to control water quality and prevent acute hepatopancreatic necrosis disease (AHPND) for enhancement growth with higher survival in white shrimp (Litopenaeus vannamei) during cultivation[J]. Aquaculture, 2017, 473: 327-336. DOI:10.1016/j.aquaculture.2017.02.033 |
| [16] |
王梦亮, 郭小青, 梁生康, 等. 光合细菌(PSB)对鲤鱼肠道菌群及肠消化功能的影响[J]. 中国微生态学杂志, 1999, 11(3): 146-148. WANG M L, GUO X Q, LIANG S K, et al. Effect of photosynthetic bacteria on intestinal microflora and the activity of digestive enzyme of carps[J]. Chinese Journal of Microecology, 1999, 11(3): 146-148. DOI:10.3969/j.issn.1005-376X.1999.03.008 |
| [17] |
陆文清, 李德发, 任继平, 等. 福林显色法测定饲料用蛋白酶活力的要点分析[J]. 饲料研究, 2003(9): 29-30. LU W Q, LI D F, REN J P, et al. Key analysis of the determination of protease activity in feed by Folin chromatography[J]. Feed Research, 2003(9): 29-30. DOI:10.3969/j.issn.1002-2813.2003.09.010 |
| [18] |
李蓓, 李晓晖, 衣杰荣. 对硝基苯酚法对雅致放射毛霉脂肪酶特性的研究[J]. 食品工业科技, 2011, 32(11): 220-222, 263. LI B, LI X H, YI J S. Determination on lipase enzymatic characteristics and activity of Actinomucorelegans by pNP method[J]. Science and Technology of Food Industry, 2011, 32(11): 220-222, 263. |
| [19] |
CAO Y C, WEN G L, LI Z J, et al. Effects of dominant microalgae species and bacterial quantity on shrimp production in the final culture season[J]. Journal of Applied Phycology, 2014, 26(4): 1749-1757. DOI:10.1007/s10811-013-0195-0 |
| [20] |
王刚, 朱站英, 华雪铭, 等. 国产鱼粉饲料中添加卵黄抗体、丁酸钠和枯草芽孢杆菌对中华鳖生长和摄食偏好的影响[J]. 上海海洋大学学报, 2017, 26(3): 376-382. WANG G, ZHU Z Y, HUA X M, et al. Effect of egg yolk antibody, sodium butyrate and Bacillus subtilis supplementation in domestic fish meal based feed on growth and feeding preference of China soft-shelled turtle[J]. Journal of Shanghai Ocean University, 2017, 26(3): 376-382. |
| [21] |
李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对凡纳滨对虾Litopenaeus vannamei肠道微生物群落的影响[J]. 南方水产, 2005, 1(3): 54-59. LI Z J, LIN L, YANG Y Y, et al. Effect of Bacillus commercial probiotic on intestinal microflora of white shrimp, Litopenaeus vannamei[J]. South China Fisheries Science, 2005, 1(3): 54-59. DOI:10.3969/j.issn.2095-0780.2005.03.009 |
| [22] |
DUAN Y F, ZHANG Y, DONG H B, et al. Effect of dietary Clostridium butyricum on growth, intestine health status and resistance to ammonia stress in Pacific white shrimp Litopenaeus vannamei[J]. Fish &Shellfish Immunology, 2017, 65: 25-33. |
| [23] |
唐杨, 刘文亮, 宋晓玲, 等. 饲料中补充蜡样芽孢杆菌对凡纳滨对虾生长及其肠道微生物组成的影响[J]. 水产学报, 2017, 41(5): 766-774. TANG Y, LIU W L, SONG X L, et al. Effects of dietary with Bacillus cereus on the growth rate and intestinal microflora of Litopenaeus vannamei[J]. Journal of Fisheries of China, 2017, 41(5): 766-774. |
| [24] |
WANG Y B, XU Z R. Effect of probiotics for common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities[J]. Animal Feed Science and Technology, 2006, 127(3/4): 283-292. |
| [25] |
WANG Y B. Effect of probiotics on growth performance and digestive enzyme activity of the shrimp Penaeus vannamei[J]. Aquaculture, 2007, 269(1/4): 259-264. |
| [26] |
REUTER J A, SPACEK D V, SNYDER M P. High-throughput sequencing technologies[J]. Molecular Cell, 2015, 58(4): 586-597. DOI:10.1016/j.molcel.2015.05.004 |
| [27] |
李存玉, 徐永江, 柳学周, 等. 池塘和工厂化养殖牙鲆肠道菌群结构的比较分析[J]. 水产学报, 2015, 39(2): 245-255. LI C Y, XU Y J, LIU X Z, et al. Comparative analysis of composition, diversity and origin of intestinal bacterial community in pond-and indoor tank-culture Japanese flounder (Paralichthys olivaceus)[J]. Journal of Fisheries of China, 2015, 39(2): 245-255. |
| [28] |
查广才, 周昌清, 麦雄伟. 凡纳滨对虾低盐度高产虾池环境微生物生态研究[J]. 生态科学, 2006, 25(3): 231-235. ZHA G C, ZHOU C Q, MAI X W. Environmental bacteria in Litopenaeus vannamei low salinity intensive stocking ponds[J]. Ecologic Science, 2006, 25(3): 231-235. DOI:10.3969/j.issn.1008-8873.2006.03.010 |
| [29] |
YANG W, ZHENG C, ZHENG Z M, et al. Nutrient enrichment during shrimp cultivation alters bacterioplankton assemblies and destroys community stability[J]. Ecotoxicology and Environmental Safety, 2018, 156: 366-374. DOI:10.1016/j.ecoenv.2018.03.043 |
| [30] |
ZHENG Y F, YU M, LIU Y, et al. Comparison of cultivable bacterial communities associated with Pacific white shrimp (Litopenaeus vannamei) larvae at different health statuses and growth stages[J]. Aquaculture, 2016, 451: 163-169. DOI:10.1016/j.aquaculture.2015.09.020 |
| [31] |
ZHANG M L, SUN Y H, CHEN K, et al. Characterization of the intestinal microbiota in Pacific white shrimp, Litopenaeus vannamei, fed diets with different lipid sources[J]. Aquaculture, 2014, 434: 449-455. DOI:10.1016/j.aquaculture.2014.09.008 |
| [32] |
DEVARAJA T N, YUSOFF F M, SHARIFF M. Changes in bacterial populations and shrimp production in ponds treated with commercial microbial products[J]. Aquaculture, 2002, 206(3/4): 245-256. |
| [33] |
HOSTINS B, LARA G, DECAMP O, et al. Efficacy and variations in bacterial density in the gut of Litopenaeus vannamei reared in a BFT system and in clear water supplemented with a commercial probiotic mixture[J]. Aquaculture, 2017, 480: 58-64. DOI:10.1016/j.aquaculture.2017.07.036 |
| [34] |
闵涛玲, 杨启银, 曩潇潇, 等. 光合细菌菌剂中-株粘质沙雷氏菌的分离与鉴定[J]. 安徽农业科学, 2006, 34(22): 5837-5838, 5841. MIN T L, YANG Q Y, NANG X X, et al. Isolation and identification of a Serratiamarcescens from photosynthetic bacteria[J]. Journal of Anhui Agricultural Sciences, 2006, 34(22): 5837-5838, 5841. DOI:10.3969/j.issn.0517-6611.2006.22.008 |
| [35] |
MIZUNO Y, NARIMATSU H, KISHI Y, et al. Structural problems of medical news reports in newspapers:a verification of news reports on an incident of mass nosocomial Serratia infection[J]. Journal of Infection and Chemotherapy, 2010, 16(2): 107-112. DOI:10.1007/s10156-009-0013-4 |
2. Shanghai Engineering Research Center of Aquaculture, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


