长江在镇江市境内的五峰山岸咀处分岔,主江绕扬中岛北面流过,支流则沿扬中南侧前行,江水在炮子洲再度交汇。从五峰山岸咀到炮子洲的长江支流长约43.9 km,名为太平洲捷水道,俗称扬中夹江。根据《长江江豚拯救行动计划2016—2025》政策内容要求,“在长江干流、沿江湖泊及其他适宜水体新建3至5处迁地保护区”,选择适宜水域开展长江江豚迁地保护工作,扬中夹江作为备选水域之一,需要掌握其水域环境及水生生物特征,评价其作为备选迁地水域的适宜性。浮游植物是水体生态系统的初级生产者,淡水生态系统浮游植物的平均光合作用效率是6.5%[1],作为初级生产力为浮游动物、鱼类和大型草食动物提供生存所必需的食物,是淡水生态系统中最基础的一环。浮游植物群落结构的变化直接影响浮游动物与鱼类的变化,进而有可能影响直接以鱼类为食的长江江豚的种群分布。目前国内关于扬中夹江水域浮游植物的研究未见报道,本研究拟通过对扬中夹江浮游植物的种群生态特征及其对水环境理化因子的响应,为评价扬中夹江水域生态环境、支撑长江江豚迁地保护工作提供科学依据。
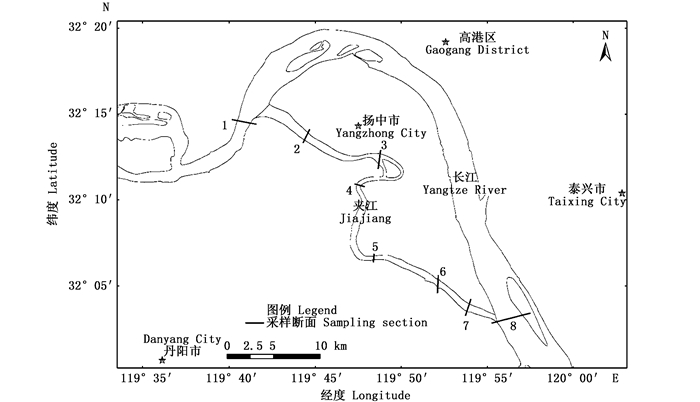
1 材料与方法 1.1 采样区域2017年全年在扬中夹江进行4次采样调查,分别为1月(冬季)、4月(春季)、7月(夏季)、10月(秋季)。根据夹江的总体水文特征设置了8个断面,其中:1#断面和8#断面位于长江干流中,分别位于上下游;2#断面位于扬中三桥附近,3#断面和4#断面分别位于江心洲上下游,5、6、7#断面位于夹江下游江段;每个断面设置3个采样点,共计24个采样点(图 1)。
|
图 1 浮游植物采样点设置图 Fig. 1 Sampling sites of phytoplankton |
浮游植物样品采用柱状采水器进行采集,水深在3 m以内的于表层0.5 m处采集水1 L,水深3~10 m的于表层和底层各采水500 mL,现场加入鲁哥试剂(10~15 mL)固定,并加入1%体积的甲醛液进行保存。现场测定水温、pH、浊度、溶氧(测定仪器为哈希HQ30D及哈希2100Q)等环境指标,水样4 ℃保存,运回实验室进行总氮、总磷等水质理化指标的测定。
浮游植物定量样品静置沉淀24 h,浓缩并定容至50 mL待镜检。浮游植物的观察计数用0.1 mL浮游植物计数框在10×40倍光学显微镜下进行。计数时充分摇匀浓缩液,吸取0.1 mL在光学显微镜下进行鉴定。浮游植物种类鉴定参考的资料用书为《中国淡水藻志》、《中国淡水藻类-系统、分类及生态》。总氮(TN)、总磷(TP)、溶解性总氮(DTN)、溶解性总磷(DTP)等化学环境数据均采用国家水质标准监测分析方法[2]。叶绿素α采用热乙醇萃取分光光度法测定[3]。
1.3 数据处理与分析优势度采用如下公式计算:
 (1)
(1)
式中:Ni为第i种的物种个体数;N为总个体数;fi为第i种的出现频率。Y>0.02为优势种。利用SPSS 20.0软件和CANOCO of Windows 4.5软件对数据进行统计分析。
根据夹江浮游植物现存量的调查结果,对夹江的渔产潜力进行评估。评估公式[4]如下:
 (2)
(2)
式中:F为渔产潜力,kg/km2;m为生物调查的平均生物量,kg/km2;P/B为主要饵料生物现存量与生物量之比;a为饵料利用率;E为饵料系数;浮游植物P/B系数为50,对浮游植物的利用率为20%,饵料系数为30。
2 结果与分析 2.1 水环境理化因子调查水域溶解氧(DO)均值的最大值出现在春季,为(8.42±0.24) mg/L,最小值出现在冬季,为(5.76±0.22) mg/L;TN(总氮)含量变幅为0.48~3.04 mg/L,均值为(2.13±0.66) mg/L,最大值出现在春季,最小值出现在春季;TP(总磷)含量变幅为0.03~0.23 mg/L,均值为(0.11±0.04) mg/L,最大值出现在秋季,最小值出现在春季;DO、TN、TP在不同季节间差异均为极显著(P<0.01)。见表 1。

|
表 1 扬中夹江水质参数 Tab.1 Quality parameters of Yangzhong Jiajiang River |
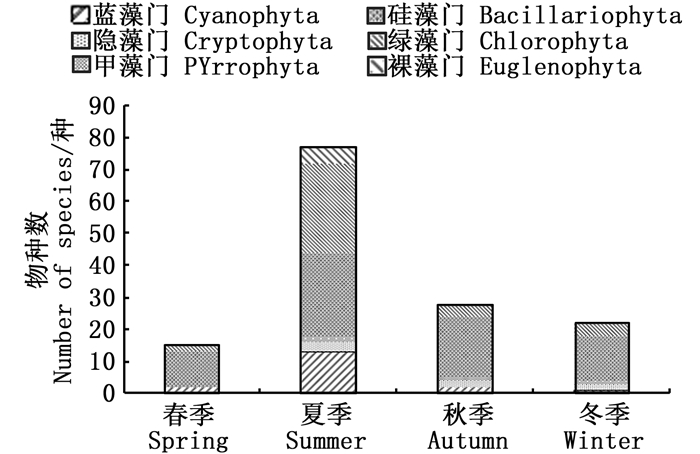
本次调查共鉴定出浮游植物6门93种,其中:硅藻门36种,占38.71%;绿藻门31种,占33.33%;蓝藻门15种,占浮游动物总物种数的16.13%;裸藻门5种,占5.38%;隐藻门和甲藻门均为3种,各占3.23%。
夏季物种数最多,为77种;其次为秋季,28种;冬季和春季较少,依次为22种和15种。夏季绿藻门种类数最多,其次是硅藻门,甲藻门种类数最少;硅藻门种类数在其余季节占据优势;蓝藻门种类数在夏季达到最大值,其余季节相差不大;硅藻门及绿硅藻门在四季的分布情况与蓝藻门一致;隐藻门与甲藻门在春季没有发现,在其余季节分布比较均匀;裸藻门出现次数最少,仅在夏季有出现。见图 2。
|
图 2 浮游植物种类组成变化 Fig. 2 Variation of species composition of phytoplankton |
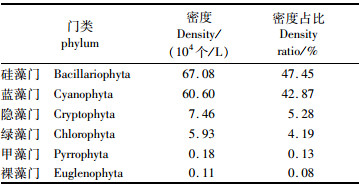
浮游植物密度全年变幅为1.44×104~180.85×104个/L,均值为35.34×104个/L,其中最大值出现在秋季的2#断面采样点,最小值出现在春季的1#断面采样点。硅藻门和蓝藻门是浮游植物密度构成主体,占比依次为47.45%和42.87%,其余各门占比均较低(表 2)。
|
表 2 不同门类浮游植物生物密度占比 Tab.2 Density ratio of phytoplankton in different phyla |
4个采样季节浮游植物密度存在极显著差异(P<0.01),表现为秋季最高(58.34×104个/L),春季最低(21.28×104个/L)。春季、夏季均为蓝藻门物种密度最高,占比均超过50%;秋季和冬季则为硅藻门物种密度最高;主要门类的物种存在明显的演替规律,硅藻门物种密度在秋季最高,其次为冬季,夏季第三,春季最低;绿藻门密度在夏季最高,其次为秋季,再次为冬季,春季最低;蓝藻门密度在夏季最高,其次为秋季和春季,冬季最低。见图 3。

|
图 3 夹江浮游植物生物密度的季度变化 Fig. 3 Seasonal variation of density of phytoplankton in Jiajiang River |
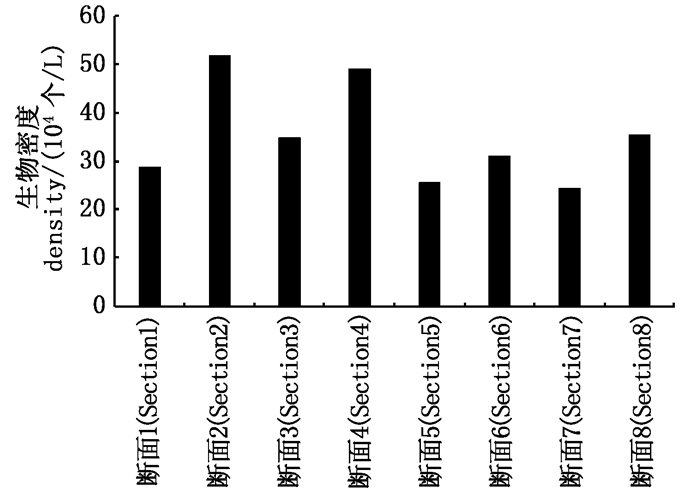
空间分析显示,各断面浮游植物密度无显著差异(P>0.05),最大值出现在2#断面,为52.03×104个/L,最小值出现在7#断面,为24.63×104个/L(图 4)。
|
图 4 夹江浮游植物生物密度的空间分布 Fig. 4 Spatial distribution of density of phytoplankton in Jiajiang River |
浮游植物年生物量变幅为0.004 3~0.898 9 mg/L,均值为0.183 5 mg/L,最大值出现在秋季的8#断面采样点,最小值出现在春季的1#断面,硅藻门物种是浮游植物生物量主体,占比为78.42%,其次是蓝藻门,为13.53%,裸藻门最少,为0.68%。见表 3。

|
表 3 不同门类浮游植物生物量占比 Tab.3 Biomass ratio of phytoplankton in different phyla |
从4个季度分析调查水域浮游植物生物量的季节变化特征,结果显示,4个季度之间的生物量差异性极显著(P<0.01),生物量表现为秋季最高(0.346 8 mg/L),其次为夏季(0.182 9 mg/L),冬季第3(0.133 2 mg/L),春季最低(0.071 0 mg/L)。硅藻门在4个季节中生物量均为最高,其次为蓝藻门,4个季度中占比最少的为裸藻门,第二少为绿藻门。蓝藻门夏季生物量最高,其次为秋季,再次为春季,冬季最低;硅藻门秋季生物量最高,冬季和夏季较接近,春季最低;绿藻门生物量夏季最高,其次为秋季,再次为冬季,春季最低;隐藻门秋季生物量最高,其次为冬季,夏季第三,春季未发现。见图 5。
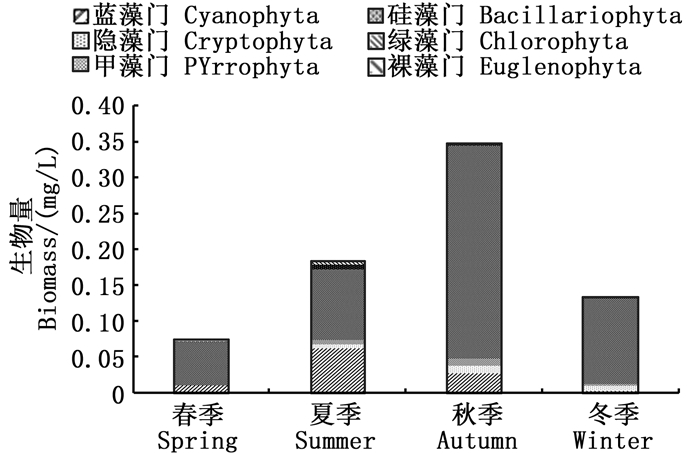
|
图 5 夹江浮游植物生物量的季节变化 Fig. 5 Seasonal variation of biomass of phytoplankton in Jiajiang River |
浮游植物生物量空间差异不显著(P>0.05),最大值出现在8#断面,为0.264 0 mg/L,最小值出现在5#断面,为0.140 9 mg/L(图 6)。
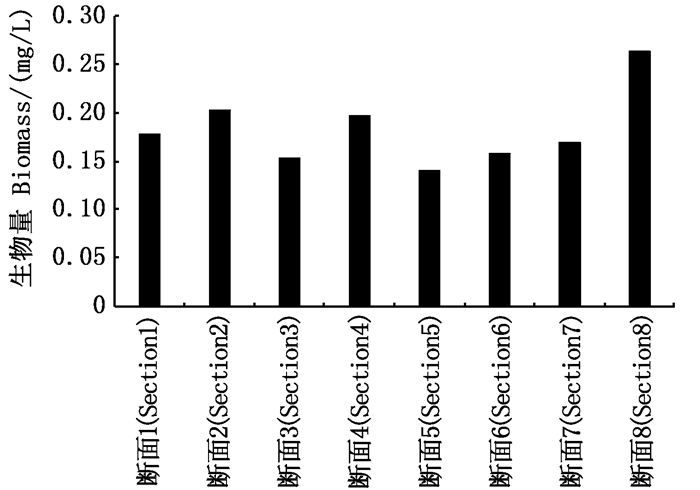
|
图 6 夹江浮游植物生物量的空间分布 Fig. 6 Spatial distribution of biomass of phytoplankton in Jiajiang River |
以4个季度的浮游植物密度数据统计该水域浮游植物群落多样性特征值,结果如下:Shannon-Weiner指数(H′)变幅为0.45~2.32,均值为1.61;Margalef丰富度指数(D)变幅为0.66~3.41,均值为2.13;Pielou均匀度指数(J′)变幅为0.33~0.98,均值为0.72。
调查水域优势种共出现15种,其中蓝藻门6种,硅藻门7种,隐藻门2种;以全年的调查结果统计优势种有8种,分别为微囊藻(Microcystis sp.)、假鱼腥藻(Pseudoanabaena sp.)、卷曲鱼腥藻(Anabaena circinalis)、颗粒直链藻(Melosira granulata)、小环藻(Cyclotella sp.)、梅尼小环藻(Cyclotella meneghiniana)、针杆藻(Synedra sp.)、尖尾蓝隐藻(Chroomonas acuta);统计各季度优势种,结果显示,春季4种,夏季6种,秋季7种,冬季8种;其中小环藻、颗粒直链藻和针杆藻作为优势种在4个季度出现频率较高(表 4)。

|
表 4 扬中夹江浮游植物优势种季节变化 Tab.4 Seasonal variations of dominant species of phytoplankton in Jiajiang |
对夹江物种数据和环境数据进行DCA分析[5],得到4个排序轴梯度最大值均小于3,故应进行冗余分析RDA。选取夹江中15个优势种浮游植物(表 4,依次排序sp1~sp15)进行RDA冗余分析。RDA分析结果显示:物种与环境因子的轴1和轴2的特征值分别为0.173和0.137,物种与环境的相关性达到了0.773和0.787,物种-环境相关性累计百分比分别为31.0%和55.5%。以上数据表明,RDA分析能够很好地反映夹江浮游植物与环境因子之间的相关性。从图 7可以看出,浮游植物样品多数与水温(T)、溶解态总磷(DTP)成正相关关系,与叶绿素a(Chl.a)成负相关关系。
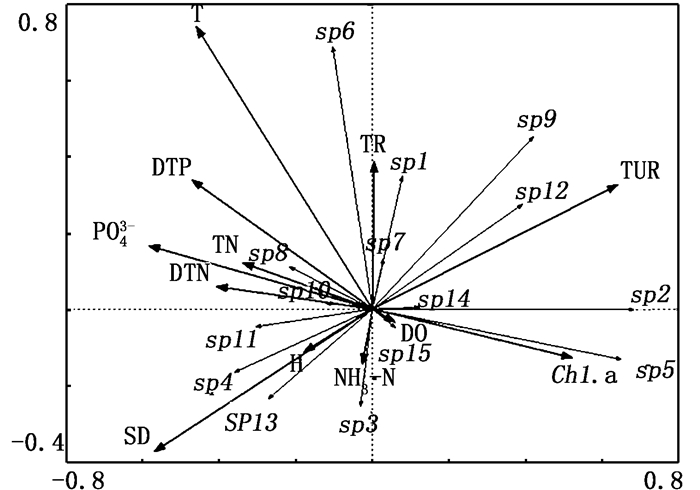
|
图 7 夹江浮游植物物种与环境因子的RDA排序图 Fig. 7 RDA ordination diagram between phytoplankton species and environmental factors in Jiajiang River |
夹江年平均生物量为0.183 5 mg/L,平均水深9.6 m,可估算渔产潜力约为587.2 kg/km2,水域面积约为24.88 km2,估算夹江渔产潜力为14.61 t/a,按每头长江江豚每天捕食5 kg计算,食物需求量最低为1.825 t/a。综合考虑鱼类资源群落结构组成、长江江豚适口鱼类比例以及捕食效率等因素,估算夹江对长江江豚的环境容纳量大于8头。
3 讨论 3.1 浮游植物群落结构的季节演替夹江夏季平均水温达30 ℃,高温适合蓝藻生长繁殖,使得蓝藻物种数在夏季达到最多,同时夏季属于丰水期,绿藻种类较常见,夹江夏季物种数最多的为蓝藻和绿藻。全年总种类组成方面,硅藻门与绿藻门最多,这与黑龙江[6]、松花江[7]、黄河[8]的研究结果相一致,苏皖交界河网区也呈现硅藻与绿藻种类占据优势的结果[9]。秋季水温下降导致绿藻种类大量减少,造成总种类比夏季少。冬季优势种为硅藻,这主要是因为冬季温度较低,为枯水期,水混合度较好,形成了适合硅藻生长的环境,而在丰水期常见的蓝绿藻,由于温度降低不利于其生长,在枯水期就很少出现[10-11]。
全年蓝藻与硅藻生物密度最高,这与汉丰湖各支流的生物密度分布类似[12]。夏季处于丰水期,优势种为蓝藻,蓝藻门在夏季开始大量生长导致夏季浮游植物生物密度较高[13-14],冬季浮游植物生物密度普遍偏小,硅藻门占据很大优势,主要为小环藻和颗粒直链藻等。这可能与夹江冬季水流相对缓慢有关,研究表明对于冬春10 ℃左右的温度,在合适的光照条件下,小环藻在短短几天就会建立种群优势,而其他种类藻类受水温影响较大[15]。秋季浮游植物的现存量达到最大,与秋季硅藻的迅速生长和夏季遗留下来的蓝藻有关。生物量的季节变化趋势与生物密度基本相一致,冬季生物密度比秋季低而生物量却比冬季高,主要是由于冬季湿重比较大的颗粒直链藻及舟形藻较多,而春季小型的小环藻占优势。
3.2 浮游植物的空间特征夹江调查水域在8个断面的浮游植物生物密度差异不显著。2#断面位于夹江最开始位置,此处水域相对于主航道来说,水体流速较慢,水体中适宜的扰动有利于微囊藻的生长[16],因此微囊藻的生物密度较高,2#断面相对于主航道有一段距离,受上游航道的影响相对较小,较易形成稳定的浮游植物群落结构,因此浮游植物生物密度高。5#断面、6#断面和7#断面位于夹江航道的最末端,水体环境已经很稳定,较上游影响小,因此浮游植物生物密度较为接近。7#断面位于最末端,上游来水流经此地时水体中携带的营养盐等已经很少,且7#断面所处环境流速更慢,硅藻适宜生活在一定流动性水体中,而硅藻所占总体生物密度比重较大,因此生物密度最低。2#断面生物密度虽然最高,但多为微囊藻等一些小型藻类,因此生物量并不是最高。8#断面位于两条分叉河流的交汇区,流速较快,流速较快适宜于硅藻的生长繁殖[17],一些大型硅藻的存在使得8#断面的生物量达到最高。
3.3 浮游植物与环境因子的关系夹江水域夏季平均水温在30.23 ℃,冬季平均水温在6.15 ℃,水温变化幅度较大,已成为较重要的影响因子。水温能显著改善水中的浮游植物整体结构,许多水体水温均成为限制性因子,越来越多人认为水温是影响浮游植物生长的最直接因素[18-19]。水温对于颤藻等有较强的正相关作用,颤藻具有典型的温度高繁殖加快,温度低迅速衰落的特征,夏季随着水温升高颤藻等开始了大量繁殖。溶解性总磷(DTP)能显著加快浮游植物的生长,在一定的范围之内,溶解性总磷含量与浮游植物成正相关,DTP的增多会促进浮游植物的生长,而且当DTP量多于浮游植物所需量时,浮游植物能积累过多的磷酸盐转化为颗粒形式储存起来,待需要时再进行释放[20],因此溶解性总磷成为夹江浮游植物的限制性因子。氮、悬浮物和磷是影响浮游植物生长及其群落结构的重要环境因子,营养盐数量的增多会促进藻类的繁殖,藻类丰度越高,则透明度越低,水质越差[21]。叶绿素a(Chl.a)与许多因素有关,不仅与光照、营养盐水平、温度等环境因子有关,还与浮游植物群落结构密切相关[22-24]。特定区间内,浮游植物对于Chl.a的吸收系数的时空变化与Chl.a浓度分布相似,空间分布特征表明,小粒径浮游植物在低浓度Chl.a中更占优势,而高浓度的Chl.a更利于大粒径浮游植物的存活[25],夹江小粒径浮游植物占据优势,当Chl.a浓度变高时小粒径浮游植物数量反而减少,导致总体浮游植物现存量降低。
夹江浮游植物以蓝藻门的微囊藻及硅藻门的小环藻等为主,这些小型藻类占据浮游植物主体;浮游植物现存量各断面无显著差异,夹江内浮游植物趋于稳定;根据浮游植物估算渔产潜力足够供给8头以上的江豚食物。总体来看,夹江浮游植物目前状况能满足作为江豚备选迁地保护区的要求。
| [1] |
史为良. 内陆水域鱼类增殖与养殖学[M]. 北京: 中国农业出版社, 1980: 73-93. SHI W L. Fish breeding and aquaculture in inland waters[M]. Beijing: China Agriculture Press, 1980: 73-93. |
| [2] |
VASI I G, KALINTHA B P. Aminoacid composition of leafy vegetables[J]. Journal of the Institution of Chemists, 1980, 152: 13-16. |
| [3] |
陈宇炜, 高锡云. 浮游植物叶绿素a含量测定方法的比较测定[J]. 湖泊科学, 2000, 12(2): 185-188. CHEN Y W, GAO X Y. Comparison of two methods for phytoplankton chlorophyll-a concentration measurement[J]. Journal of Lake Sciences, 2000, 12(2): 185-188. DOI:10.3321/j.issn:1003-5427.2000.02.015 |
| [4] |
代梨梨, 龚迎春, 冯伟松, 等. 江苏镇江长江豚类保护区浮游动物群落结构特征及江豚生存状况评估[J]. 水生态学杂志, 2011, 32(5): 30-36. DAI L L, GONG Y C, FENG W S, et al. Community structureof zooplankton and its relationship to survivability ofYangtze dolphin in Zhenjiang Yangtze dolphin nature reserve, Jiangsu Province[J]. Journal of Hydroecology, 2011, 32(5): 30-36. |
| [5] |
SHANNON C E, WEAVER W. The mathematical theory of communication[M]. London: University of Illinois Press, 1949.
|
| [6] |
中国水产科学研究院黑龙江水产研究所.三江平原地区水产资源调查及其发展规划的研究报告[R].哈尔滨: 黑龙江水产研究所, 1985: 5-7. Heilongjiang River Fishery Research Institute of Chinese Academy of Fishery Science. Research report on aquatic resources investigation and development plan in Sanjiang plain area[R]. Research of Heilongjiang River Fishery Research Institute, 1985: 5-7. |
| [7] |
卢晏生. 松花江污染对浮游生物、着生藻类影响的初步研究[J]. 环境科学, 1985, 6(1): 33-39. LU Y S. Preliminary study on the effects of Songhua River pollution on plankton and algal growth[J]. Environmental Science, 1985, 6(1): 33-39. |
| [8] |
黄河流域水资源保护局. 黄河水资源保护科技成果与论文选编[M]. 郑州: 黄河水利出版社, 1995. The Yellow River Basin Water Resources Protection Bureau. Scientific and technological achievements and papers of the Yellow River water resources protection[M]. Zhengzhou: The Yellow River Water Conservancy Press, 1995. |
| [9] |
胡俊, 郑金秀, 池仕运, 等. 苏皖交界河网区浮游植物群落结构及其与环境因子关系的研究[J]. 长江流域资源与环境, 2017, 26(2): 282-288. HU J, ZHENG J X, CHI S Y, et al. Study on phytoplankton community and its relations to the environmental factors in the Qingyi/Guxi river network[J]. Resources and Environment in the Yangtze Basin, 2017, 26(2): 282-288. DOI:10.11870/cjlyzyyhj201702014 |
| [10] |
李瑾, 吴洁, 巩兵, 等. 浙江青山水库浮游植物群落结构的研究初报[J]. 浙江农业学报, 1998, 10(3): 122-127. LI J, WU J, GONG B, et al. Primary study on the phytoplankton community in Qingshan Reservoir of Zhejiang Province[J]. Acta Agriculturae Zhejiangensis, 1998, 10(3): 122-127. |
| [11] |
胡韧, 林秋奇, 王朝晖, 等. 广东省典型水库浮游植物组成与分布特征[J]. 生态学报, 2002, 22(11): 1939-1944. HU R, LIN Q Q, WANG Z H, et al. Phytoplankton composition and distribution in typical reservoirs of Guangdong province[J]. Acta Ecologica Sinica, 2002, 22(11): 1939-1944. DOI:10.3321/j.issn:1000-0933.2002.11.020 |
| [12] |
朱梦灵, 潘晓洁, 郑志伟, 等. 汉丰湖支流浮游植物群落结构及环境因子影响分析[J]. 水生态学杂志, 2014, 35(6): 46-52. ZHU M L, PAN X J, ZHENG Z W, et al. Phytoplankton community structure and its correlation with environmental factors in tributaries of Hanfeng Lake[J]. Journal of Hydroecology, 2014, 35(6): 46-52. DOI:10.3969/j.issn.1674-3075.2014.06.007 |
| [13] |
秦伯强, 王小冬, 汤祥明, 等. 太湖富营养化与蓝藻水华引起的饮用水危机——原因与对策[J]. 地球科学进展, 2007, 22(9): 896-906. QIN B Q, WANG X D, TANG X M, et al. Drinking water crisis caused by eutrophication and cyanobacterial bloom in lake Taihu:cause and measure[J]. Advances in Earth Science, 2007, 22(9): 896-906. DOI:10.3321/j.issn:1001-8166.2007.09.003 |
| [14] |
孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考[J]. 生态学报, 2005, 25(3): 589-595. KONG F X, GAO G. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes[J]. Acta Ecologica Sinica, 2005, 25(3): 589-595. DOI:10.3321/j.issn:1000-0933.2005.03.028 |
| [15] |
王敏.嘉陵江出口段小环藻水华发生规律及其生物毒性研究[D].重庆: 重庆大学, 2009: 3-4. WANG M. Study on the occurrence regularity of cyclotella bloom and its biological toxicity in outlet section of the Jialing River[D]. Chongqing: Chongqing University, 2009: 3-4. http://cdmd.cnki.com.cn/article/cdmd-10611-2009148439.htm |
| [16] |
颜润润, 逄勇, 王珂. 太湖风浪对两种淡水藻生长影响的试验研究[J]. 人民长江, 2007, 38(11): 124-126. YAN R R, PANG Y, WANG K. Test and study for influence of wind and wave to algea produce in the Taihu lake[J]. Yangtze River, 2007, 38(11): 124-126. DOI:10.3969/j.issn.1001-4179.2007.11.047 |
| [17] |
张远, 郑丙辉, 刘鸿亮. 三峡水库蓄水后的浮游植物特征变化及影响因素[J]. 长江流域资源与环境, 2006, 15(2): 254-258. ZHANG Y, ZHENG B H, LIU H L. Characteristics of phytoplankton composition with analysis of its impact factors after impounding of the Three Gorges reservoir[J]. Resources and Environment in the Yangtze Basin, 2006, 15(2): 254-258. DOI:10.3969/j.issn.1004-8227.2006.02.024 |
| [18] |
REYNOLDS C S. The ecology of freshwater phytoplankton[M]. Cambridge: Cambridge University Press, 1984.
|
| [19] |
吕培顶, 费尊乐, 毛兴华, 等. 渤海水域叶绿素a的分布及初级生产力的估算[J]. 海洋学报, 1984, 6(1): 90-98. LV P D, FEI Z L, MAO X H, et al. Distribution of chlorophyll a and estimation of primary productivity in Bohai waters[J]. Acta Oceanologica Sinica, 1984, 6(1): 90-98. |
| [20] |
王振红, 石圣吉, 李顺兴. 九龙江河口春季磷的形态分配及浮游植物对磷的响应[J]. 环境监测管理与技术, 2008, 20(4): 62-65. WANG Z H, SHI S J, LI S X. The constituent distribution of phosphorus to phytoplankton of Jiulong River estuary in spring[J]. The Administration and Technique of Environmental Monitoring, 2008, 20(4): 62-65. DOI:10.3969/j.issn.1006-2009.2008.04.018 |
| [21] |
崔扬, 朱广伟, 李慧赟, 等. 天目湖沙河水库水质时空分布特征及其与浮游植物群落的关系[J]. 水生态学杂志, 2014, 35(3): 10-18. CUI Y, ZHU G W, LI H Y, et al. Spatial and temporal distribution characteristics of water quality in Shahe reservoir within Tianmuhu reservoir and its relationship with phytoplankton community[J]. Journal of Hydroecology, 2014, 35(3): 10-18. DOI:10.3969/j.issn.1674-3075.2014.03.002 |
| [22] |
沈新强, 胡方西. 长江口外水域叶绿素a分布的基本特征[J]. 中国水产科学, 1995, 2(1): 71-80. SHEN X Q, HU F X. Basic characteristics of distribution of chloropyll a in the Changjiang estuary[J]. Journal of Fishery Sciences of China, 1995, 2(1): 71-80. DOI:10.3321/j.issn:1005-8737.1995.01.009 |
| [23] |
陈怀清, 钱树本. 青岛近海微型、超微型浮游藻类的研究[J]. 海洋学报, 1992, 14(3): 105-113. CHEN H Q, QIAN S B. Study on micro and ultra micro phytoplankton in Qingdao offshore[J]. Acta Oceanologica Sinica, 1992, 14(3): 105-113. |
| [24] |
孟顺龙, 徐跑, 李丹丹, 等. 团头鲂池塘工业化生态养殖系统中浮游植物群落结构分析[J]. 上海海洋大学学报, 2018, 27(1): 79-90. MENG S L, XU P, LI D D, et al. Community structure of phytoplankton in pond industrial eco-aquaculture system culturing Megalobrama amblycephala[J]. Journal of Shanghai Ocean University, 2018, 27(1): 79-90. |
| [25] |
张晋芳.长江口南部邻近海域浮游植物的吸收特性及其参数化研究[D].上海: 华东师范大学, 2013. ZHANG J F. Parameterization and variability of phytoplankton absorption properties in south adjacent coastal ocean of the Yangtze estuary[D]. Shanghai: East China Normal University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10269-1013267704.htm |
 2019,
Vol. 28
2019,
Vol. 28


