2. 中国水产科学研究院长江水产研究所 农业农村部淡水生物多样性保护重点实验室, 湖北 武汉 430223;
3. 农业农村部淡水鱼类种质监督检验测试中心, 湖北 武汉 430223
L-色氨酸是人和动物的一种必需氨基酸,对机体内外均有重要作用:对内直接参与合成蛋白质,构成机体组织[1],肝脏、肾脏、脑等器官代谢,产生具有生物活性的中间产物,如5-羟色胺[2-3]、尼克酸、L-犬尿氨酸[2];对外如L-犬尿氨酸可参鱼类繁殖期的信息交流[4]。相关研究[5-6]表明,大多数鱼类能感受到几乎所有氨基酸的刺激,一些鱼类嗅上皮组织中含有L-氨基酸结合蛋白[7],由此推测L-色氨酸亦可能在鱼体外发挥信息交流作用。中华鲟和长江鲟均为我国特有种,属于国家一级保护动物,已被世界自然保护联盟(IUCN)红色目录列为极危(CR)物种。尽管作者[8-9]已成功实现了中华鲟和长江鲟的全人工繁殖,但在人工繁殖过程中,存在个别催产后的雌鱼未排卵或排卵不彻底的情况,影响繁殖效果,而L-色氨酸可能有利于诱导促进雌雄的繁殖行为发生。本实验通过引进和改良检测哺乳动物和植物等样品中L-色氨酸的方法,并应用于鱼类尿液,成功建立了用高效液相色谱-荧光法测定中华鲟和长江鲟尿液L-色氨酸的方法,为进一步研究L-色氨酸对中华鲟和长江鲟繁殖过程中的信息交流提供技术支撑。
1 材料与方法 1.1 主要仪器及设备主要仪器及设备:Agilent 1260 LC高效液相色谱仪(美国Agilent公司);symmetry@ C18色谱柱(250 mm×4.6 mm,5 μm,美国Waters公司);梅特勒ME204E电子分析天平(瑞士METTLER TOLEDO公司);离心机(GL-20B,高速冷冻离心机,上海安亭科学仪器公司);ENVI-18固相萃取小柱(3 cc/ 500 mg,美国Waters公司);尼龙针式过滤器(0.22 μm/13 mm,安徽biosharp公司)。
1.2 标准品及试剂标准品及试剂:L-色氨酸标准品(色谱纯,美国Sigma-Aldrich公司);甲醇(色谱纯,美国JT Baker公司);甲酸(色谱纯,上海Aladdin公司);乙腈(色谱纯,美国JT Baker公司);乙酸铵(分析纯,美国JT Baker公司);氢氧化钠(分析纯,上海Macklin公司)。
1.3 样品材料 1.3.1 样品来源所用样品分别取自中国水产科学研究院长江水产研究所荆州太湖基地催产前的6尾性成熟中华鲟尿液(2017年10月),以及宜宾市珍稀水生陆生动物研究所(长江上游自然保护区珍稀特有鱼类驯养救护中心)催产前的12尾性成熟长江鲟尿液(2018年3月)。
1.3.2 样品采集方法采用活体采样的方法。将鱼体置于担架,腹部朝上,由专业人员双手沿腹部从胸鳍向尾鳍滑行按压至出现清亮透明无色的尿液,用消毒过的500 mL烧杯接取,再分装记录。
1.4 实验方法 1.4.1 标准溶液配制准确称取10 mg L-色氨酸标准品于100 mL棕色容量瓶中,加入800 μL NaOH溶液(1 mol/L),超纯水定容至100 mL,配制成终浓度为100 μg/mL的母液,于-20 ℃避光保存。
1.4.2 样品前处理提取:取1 mL尿液于2 mL离心管,6 000 r/min离心10 min,转移上清液至10 mL离心管,避光静置10 min,依次加入1 mL甲醇和1 mL乙腈,涡旋振荡1 min,避光静置5 min,4 000 r/min离心20 min,转移上清液至10 mL离心管,待净化。
净化:依次加入10 mL甲醇、5 mL超纯水、5 mL乙酸铵(0.015 mol/L,pH=5)活化ENVI-18固相萃取小柱。将上清液加入小柱,依靠重力作用使上清液全部过柱。依次加入2 mL乙酸铵(0.015 mol/L,pH=5)和6 mL乙酸铵(0.015 mol/L,pH=6)[10]并收集滤液和洗脱液,取1 mL样液,0.22 μm针式过滤膜过滤至上样小瓶待上机。
1.4.3 色谱条件色谱柱:symmetry@ C18色谱柱(250 mm ×4.6 mm,5 μm,美国Waters公司);柱温:35 ℃;流动相:A为乙腈,B为1%(体积分数)甲酸水溶液,洗脱程序:A:B=10:90(体积分数),等度洗脱;流速:1.0 mL/min;进样量:30 μL;荧光波长:λex=285 nm,λem=353 nm。
2 结果与讨论 2.1 样品前处理过程优化国内外有关L-色氨酸的检测方法主要有高效液相色谱-质谱法[11-14]、高效液相色谱-二极管阵列检测器检测法[15]、比色法[16]、高效液相色谱法[17-18]等。通常,人和动物尿液样品的检测多用高效液相色谱-质谱法、高效液相色谱-二极管阵列检测器检测法和比色法等,其中,比色法受人为因素影响误差较大,质谱、二极管和高效液相联用的方法前处理所需试剂种类众多,衍生化反应过程复杂,处理时间较长,且需要较丰富的操作经验,不适用于大批量样品的快速检测。高效液相色谱法多用于植物[17]、微生物发酵液[18]、血液[11]等样品的检测,较少用于鱼类尿液的检测。
鲟鱼尿液样品中大部分是水和无机离子,少量含氮有机物[19]和采样过程中混入的杂质,基质成分较简单,物理方法提取净化待测物即可达到理想的效果。静置沉淀、高速离心可初步降低非目标物质的含量,甲醇、乙腈提取目标物,固相萃取柱和尼龙滤膜进一步过滤掉大分子杂质,净化目标物。整个前处理过程试剂种类少、步骤少,无衍生化反应用时少,降低了目标物的损失率。
2.2 色谱条件选择 2.2.1 流动相的选择实验观察流动相的组成及pH对分析物的影响。采用同一浓度标准品在3组流动相检测出峰情况,3组流动相分别为:(1)乙腈-超纯水(10:90,体积分数);(2)甲醇-超纯水(10:90,体积分数);(3)乙腈-1%(体积分数)甲酸水溶液(10:90,体积分数)。结果表明,选择流动相组(1)和(2)未出现目标峰,流动相组(3)出现对称性较好且尖锐的目标峰。原因可能是L-色氨酸的等电点为5.89[20],母液中一定量的NaOH促使L-色氨酸解离出H+,L-色氨酸自身带负电,流动相组(1)和(2)呈中性,目标物未能与流动相结合或结合量极少,色谱峰面积响应值较低,几乎与基线相平。选择流动相组(3),带负电的L-色氨酸与带部分正电的流动相结合,通过检测器,目标峰与基线分离,且峰形较尖锐,对称性良好。由于L-色氨酸自身特殊的结构,可溶于稀酸、稀碱,母液中加入的强碱,一方面母液中L-色氨酸粉剂可充分溶解,另一方面促进L-色氨酸解离带电,加入1%(体积分数)甲酸,促进带负电的L-色氨酸与流动相结合,提高峰面积的响应值(图 1)。

|
图 1 选择流动相乙腈-1%(体积分数)甲酸水溶液(10:90,体积分数)的色谱图 Fig. 1 Chromatogram of a sample with mobile phase of acetonitrile-1% (volume fraction) formic acid aqueous solution (10:90, volume fraction) |
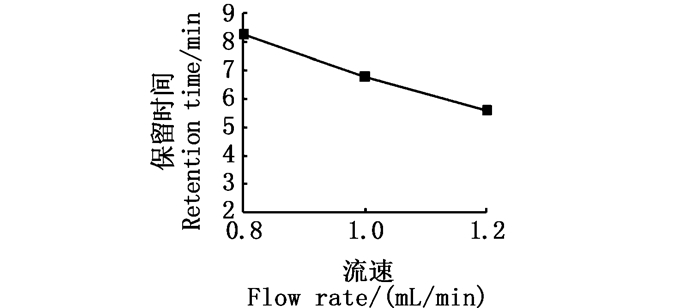
观测3种流速0.8 mL/min、1.0 mL/min和1.2 mL/min对L-色氨酸保留时间的影响,结果显示L-色氨酸保留时间随流速的增大而提前(图 2),其中:选择0.8 mL/min流速下保留时间为(8.25±0.02)min,相对标准差(RSD)为0.21%;选择1.0 mL/min流速下保留时间为(6.76±0.04)min,RSD为0.62%;选择1.2 mL/min流速下保留时间为(5.58±0.10)min,RSD为1.74%。
|
图 2 流速和保留时间的关系图 Fig. 2 Relationship between flow rate and retention time |
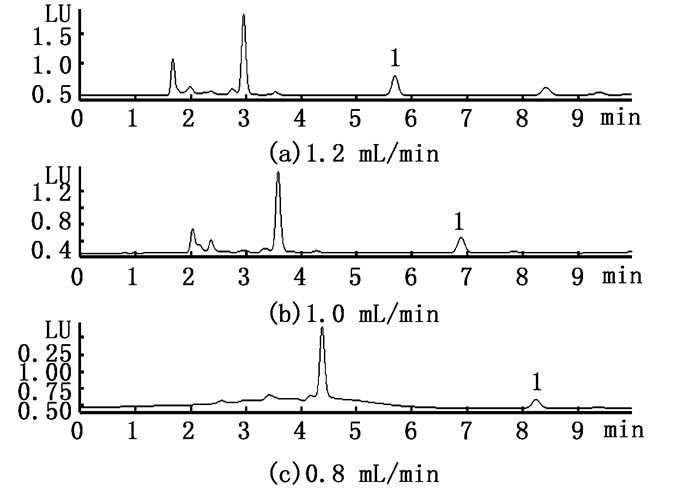
由图 3可知,杂质峰大部分出现在5 min之前,仅少量出现在7.5 min之后。选择1.2 mL/min,目标峰保留时间与杂质峰保留时间较接近,不易与杂质峰分离,且流速过大,不利于延长色谱柱的使用寿命;选择0.8 mL/min,分析时间过长,色谱峰变宽;选择流速1.0 mL/min,目标峰在6.78 min左右与杂质峰较好地分离,且目标峰两侧没有杂质峰的干扰,峰形较好。
|
图 3 3种流速下的色谱图 Fig. 3 Chromatogram about three flow rates |
L-色氨酸自身结构含有苯环,随流动相通过紫外检测器或荧光检测器,均能检测到目标物。因此,在能够达到检测要求的条件下,使用高效液相色谱仪代替与高效液相色谱仪联用的仪器设备,可降低仪器成本和操作难度。考虑到样品中L-色氨酸含量可能较低,因此选择相同浓度下响应值较高的荧光检测器。实验考察3组荧光波长λex=285 nm和λem=353 nm,λex=260 nm[21-22]和λem=340 nm[23],λex=280 nm和λem=440 nm[16],在色谱条件不变的情况下分别设置,结果显示在波长为λex=285 nm,λem=353 nm处得到较好的峰形,且基线平稳(图 1)。
2.3 标准曲线、检出限和定量限取母液配制成一系列不同浓度梯度(2.000,1.000,0.500,0.200,0.100,0.050,0.020,0.010 μg/mL)的工作液,按优化后的色谱条件进行分析,以L-色氨酸的色谱峰面积为纵坐标(y),对应的质量浓度为横坐标(x)绘制标准曲线。实验结果表明,L-色氨酸在0.010~2.000 μg/mL的范围内线性关系良好,线性回归方程为y=247.27x-0.125 5(R2 = 1)。以3倍和10倍信噪比分别求得检出限(LOD)为0.005 μg/mL、定量限(LOQ)为0.020 μg/mL。其线性范围及检测限均能满足样品检测要求。
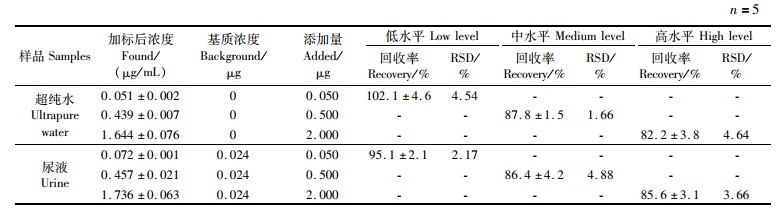
2.4 回收率以超纯水为空白基质,长江鲟尿液为样品基质,每种基质分别添加低(0.050 μg/mL)、中(0.500 μg/mL)、高(2.000 μg/mL)3个水平的L-色氨酸标准品,按实验方法进行空白加标回收实验,每个水平平行测定5次。结果显示:L-色氨酸空白加标回收率为82.2%~102.1%,RSD为1.66%~4.64%;基质加标回收率为85.6%~95.1%,RSD为2.17%~4.88%。所测结果回收率在70%~120%范围内,RSD均小于5.0%,表明检测结果稳定性良好,数据准确可靠,满足样品检测要求,可用于实际样品的检测(表 1)。
|
表 1 空白基质和样品基质在低、中、高3个水平下的加标回收率及相对标准偏差 Tab.1 Recoveries and RSD of standard sample at low level, medium level and high level in blank substrate and sample substrate |
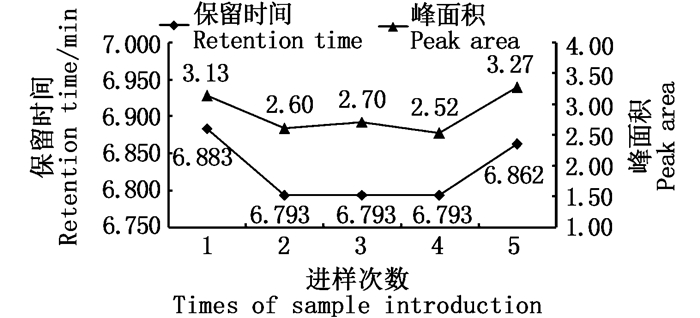
取质量浓度为0.010 μg/mL的L-色氨酸标准品溶液,重复进样5次,测定其色谱峰面积。结果显示:保留时间为6.883~6.862 min(平均值为6.825 min),RSD为0.58%;色谱峰面积为2.52~3.27(平均值为2.85),色谱峰面积RSD为10.48%。5次进样的保留时间及色谱峰面积变化结果见图 4。
|
图 4 标样(0.010 μg/mL)保留时间及峰面积结果 Fig. 4 Result of retention time and peak area about standard sample (0.010 μg/mL) |
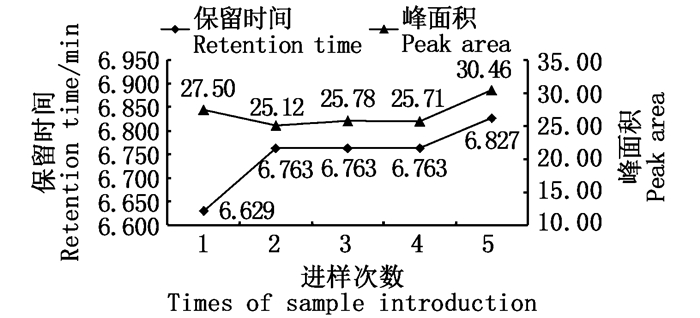
取质量浓度为0.100 μg/mL的L-色氨酸标准品溶液,重复进样5次,测定其色谱峰面积。结果显示:保留时间为6.629~6.827 min(平均值为6.749 min),RSD为0.96%;色谱峰面积为25.12~30.64(平均值为26.91),RSD为7.22%。5次进样的保留时间及色谱峰面积变化结果见图 5。
|
图 5 标样(0.100 μg/mL)保留时间及峰面积结果 Fig. 5 Result of retention time and peak area about standard sample (0.100 μg/mL) |
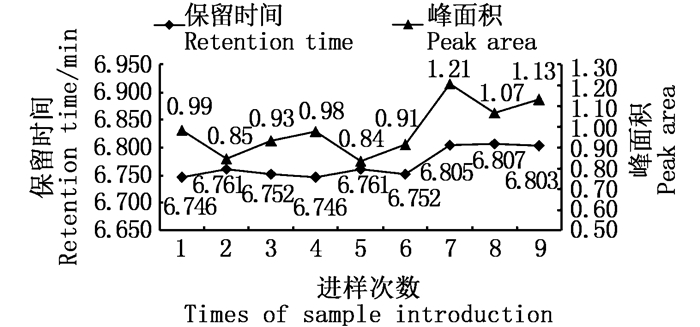
取空白基质加标(0.050 μg/mL)溶液,重复进样9次,测定其色谱峰面积。结果显示:保留时间为6.746~6.807 min(平均值为6.770 min),RSD为0.37%;色谱峰面积为0.84~1.21(平均值为0.99),RSD为12.06%。9次进样的保留时间及色谱峰面积变化结果见图 6。
|
图 6 空白基质加标(0.050 μg/mL)保留时间及峰面积结果 Fig. 6 Result of retention time and peak area about blank matrix with standard sample (0.050 μg/mL) |
结果表明:标准溶液低水平(0.010 μg/mL)和中水平(0.100 μg/mL)及空白基质加标溶液重复进样,L-色氨酸保留时间RSD均小于1%,稳定性和精密性均良好;色谱峰面积RSD较高,但均小于15%,其中低水平标准样液和空白基质加标色谱峰面积差异较大,原因可能是目标物浓度过低,色谱峰响应值较小,误差较大,表明浓度过低,检测结果精密度越低。因此,检测目标物浓度较低的样品时,应尽量减少稀释倍数,或加入浓缩步骤,相对提高上样溶液目标物的浓度,尽量避免手动积分出峰面积,减少因主观因素造成的误差。
2.6 实际样品检测 2.6.1 中华鲟尿液L-色氨酸检测取6尾中华鲟的尿液,每尾鱼3个平行,按照实验方法第1.3节对样品进行处理,利用高效液相色谱仪依照1.4节中色谱条件检测样品中的L-色氨酸。0.010 μg/mL标样色谱图见图 7b,其中:1尾中华鲟尿液目标物色谱图见图 7a;中华鲟尿液L-色氨酸浓度见表 2。

|
图 7 中华鲟尿液目标物成分(a),0.010 μg/mL标样(b)和长江鲟尿液目标物成分(c)色谱图 Fig. 7 Chromatogram of target compound of urine from A. sinensis (a), 0.010 μg/mL standard sample (b) and target compound of urine from A. dabryanus (c) |

|
表 2 不同中华鲟尿液(n=6)和长江鲟尿液(n=12)中L-色氨酸的浓度 Tab.2 Concentration of L-tryptophan from different A. sinensis urine (n=6) and A. dabryanus urine (n=12) |
取12尾长江鲟的尿液,方法同第2.5.1节中华鲟尿液L-色氨酸检测。其中1尾长江鲟尿液目标物色谱图见图 7c;长江鲟尿液L-色氨酸浓度见表 2。
图 7显示,0.010 μg/mL L-色氨酸标样,中华鲟尿液和长江鲟尿液目标物保留时间接近。中华鲟尿液目标物平均保留时间为(6.747±0.005)min,长江鲟尿液目标物平均保留时间为(6.848±0.021)min。从表 2看出,中华鲟尿液和长江鲟尿液目标物保留时间相对标准偏差(RSD)分别为0.31%和0.08%,保留时间基本一致。由第2.5节结果得知,质量浓度为0.010 μg/mL的L-色氨酸标准品溶液平均保留时间为(6.825±0.044)min,两种鲟鱼尿液目标物平均保留时间与0.010 μg/mL L-色氨酸标样平均保留时间比较结果见表 3。中华鲟尿液目标物和0.010 μg/mL的L-色氨酸标样的保留时间无显著性差异(P>0.05),表明中华鲟尿液目标物保留时间与L-色氨酸标准品保留时间一致,进一步说明中华鲟尿液中含有L-色氨酸。长江鲟尿液目标物与0.010 μg/mL的L-色氨酸标样的保留时间有显著差异(P < 0.05),表 2表明长江鲟尿液目标物保留时间基本一致(RSD为0.08%),且图 7c目标峰1左右两边无杂峰干扰,可认为目标峰1即为L-色氨酸的色谱峰,然而出现与0.010 μg/mL的L-色氨酸标样的保留时间有差异的原因可能是更换新的流动相引起保留时间不稳定而出现偏差。

|
表 3 L-色氨酸标样(0.010 μg/mL)、中华鲟尿液目标物和长江鲟尿液目标物保留时间差异 Tab.3 Difference of retention time among L-try standard sample (0.010 μg/mL), urine of A. sinensis and A. dabryanus |
从表 2可看出:每一尾中华鲟的尿液均检测出L-色氨酸,且不同个体尿液中L-色氨酸含量差异较大(RSD为81.77%);每一尾长江鲟的尿液均检测出L-色氨酸,不同个体尿液中L-色氨酸含量差异不大(RSD为2.8%)。由于中华鲟和长江鲟每年的繁殖群体数量有限,加之大部分鱼在采样时没有尿液,因此,中华鲟和长江鲟的尿液样品数量较少。此研究中样品检测结果仅表明中华鲟和长江鲟尿液中含有L-色氨酸,但个体间是否有显著差异,需要增加样本数量,进行后续研究。
L-色氨酸是鱼类的必需氨基酸,需从外界环境或饵料获得,经过自身消化系统,在正常情况下,其代谢产物如L-犬尿氨酸随尿液排出[24],然而,本实验在中华鲟和长江鲟的尿液中检测到L-色氨酸。据相关文献,一些鱼类的生活史中,前列腺素类、含氮化合物[25]、类固醇结合物[26]和氨基酸及氨基酸代谢物[4]可随尿液排泄到环境中,且一些物质只在繁殖季节或者某一性别的鱼类排出[27],诱导雄性排精或雌性产卵,已在性成熟雌性马苏大马哈鱼(Oncorhynchus masou)的尿液中发现L-犬尿氨酸,并参与繁殖期的信息交流,是马苏大马哈鱼重要的性信息素[4]。本实验中,中华鲟和长江鲟的尿液均取自繁殖群体,且样品没有混入其他杂质,由此推测,中华鲟和长江鲟尿液中L-色氨酸可能与其群体信息交流有关,下一步将重点开展这方面的研究工作。
3 结论本实验首次建立了高效液相色谱快速检测中华鲟和长江鲟尿液中L-色氨酸的分析方法。以甲醇-乙腈(1:1)提取L-色氨酸,经ENVI-18固相萃取小柱净化,无需进行衍生化反应;采用symmetry@ C18色谱柱(250 mm×4.6 mm,5 μm),优化色谱条件,在荧光波长λex=285 nm,λem=353 nm,流速1.0 mL/min条件下可将尿液中L-色氨酸与杂质峰很好地分离。另外,该方法L-色氨酸标准曲线线性关系良好,回收率、精密度及准确率均符合检测分析要求,可适用于鲟鱼类尿液L-色氨酸定性及定量检测。这为进一步研究鲟鱼尿液中L-色氨酸对鲟鱼的作用提供快速准确的检测方法,对掌握L-色氨酸在鲟鱼类信息交流过程中的作用有重要意义。
| [1] |
蒋婕, 陈福旺, 孟秀娟, 等. L-色氨酸的研究进展[J]. 畜牧与兽医, 2012, 44(s1): 66-70. JIANG J, CHEN F W, MENG X J, et al. The research progress of L-tryptophan[J]. Animal husbandry and Veterinarian, 2012, 44(s1): 66-70. |
| [2] |
甄乾娜.高效液相色谱法分析色氨酸代谢及其在临床诊断中的应用[D].重庆: 重庆医科大学, 2011. ZHEN Q N.Analysis of application of tryptophan catabolism in clinical diagnosis by HPLC[D].Chongqing: Chongqing University of Medical Sciences, 2011. |
| [3] |
赵明江, 周小秋. 色氨酸对应激诱导鱼类皮质醇分泌的影响[J]. 水产科学, 2007, 26(7): 420-422. ZHAO M J, ZHOU X Q. The effect of dietary tryptophan on the stress-induced secretion of cortisol[J]. Fisheries Science, 2007, 26(7): 420-422. DOI:10.3969/j.issn.1003-1111.2007.07.014 |
| [4] |
YAMBE H, KITAMURA S, KAMIO M, et al. L-Kynurenine, an amino acid identified as a sex pheromone in the urine of ovulated female masu salmon[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(42): 15370-15374. DOI:10.1073/pnas.0604340103 |
| [5] |
赖晓健, 洪万树, 张其永. 鱼类嗅觉系统和性信息素受体的研究进展[J]. 动物学杂志, 2013, 48(2): 298-305. LAI X J, HONG W S, ZHANG Q Y. Research progresses in fish olfactory system and sex pheromonal receptors[J]. Chinese Journal of Zoology, 2013, 48(2): 298-305. |
| [6] |
COLE T B, STACEY N E. Olfactory responses to steroids in an African mouth-brooding cichlid, Haplochromis burtoni (Günther)[J]. Journal of Fish Biology, 2006, 68(3): 661-680. DOI:10.1111/jfb.2006.68.issue-3 |
| [7] |
危起伟, 李罗新, 杜浩, 等. 中华鲟全人工繁殖技术研究[J]. 中国水产科学, 2013, 20(1): 1-11. WEI Q W, LI L X, DU H, et al. Research on technology for controlled propagation of cultured Chinese sturgeon (Acipenser sinensis)[J]. Journal of Fishery Sciences of China, 2013, 20(1): 1-11. |
| [8] |
龚全, 刘亚, 杜军, 等. 达氏鲟全人工繁殖技术研究[J]. 西南农业学报, 2013, 26(4): 1710-1714. GONG Q, LIU Y, DU J, et al. Study on artificial reproduction of cultured Acipenser dabryanus Dumeril[J]. Southwest China Journal of Agricultural Sciences, 2013, 26(4): 1710-1714. DOI:10.3969/j.issn.1001-4829.2013.04.083 |
| [9] |
BRUCH R C, RULLI R D. Ligand binding specificity of a neutral L-amino acid olfactory receptor[J]. Comparative Biochemistry and Physiology Part B:Comparative Biochemistry, 1988, 91(3): 535-540. DOI:10.1016/0305-0491(88)90018-1 |
| [10] |
郭岚, 潘萍萍, 谭婷, 等. 超高效液相色谱-荧光法测定大鼠尿液中的黄蝶呤、异黄蝶呤、酪氨酸和色氨酸[J]. 南昌大学学报(理科版), 2014, 38(3): 218-221. GUO L, PAN P P, TAN T, et al. Determination of xanthopterin, isoxanthopterin, tyrosine and tryptophan in mouse urine by UPLC-LD[J]. Journal of Nanchang University (Natural Science), 2014, 38(3): 218-221. DOI:10.3969/j.issn.1006-0464.2014.03.004 |
| [11] |
徐开成, 于瑞莲, 杨云菲, 等. LC-MS/MS法同时测定大鼠血浆中L-色氨酸和L-犬尿氨酸浓度的研究[J]. 中国药科大学, 2016, 47(6): 714-718. XU K C, YU R L, YANG Y F, et al. Simultaneous determination of L-tryptophan and L-kynurenine in rat plasma by LC-MS/MS[J]. Journal of China Pharmaceutical University, 2016, 47(6): 714-718. |
| [12] |
郭岚, 孙玄, 鄢爱平, 等. 高效液相色谱-串联质谱法同时测定大鼠尿液中五种可能的癌症标志物[J]. 分析科学学报, 2015, 31(5): 611-615. GUO L, SUN X, YAN A P, et al. Simultaneous determination of five potential cancer biomarkers in mouse urine by high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Analytical Science, 2015, 31(5): 611-615. |
| [13] |
支小平, 崔盼盼, 柳英霞. 高效液相色谱-串联质谱法同时测定人体尿液中的酪氨酸和色氨酸[J]. 南昌大学学报(理科版), 2016, 40(4): 341-345. ZHI X P, CUI P P, LIU Y X. Simultaneous determination of tyrosine and tryptophan in human urine by HPLC-MS/MS[J]. Journal of Nanchang University (Natural Science), 2016, 40(4): 341-345. DOI:10.3969/j.issn.1006-0464.2016.04.008 |
| [14] |
吴智明, 张林, 李楠. 液相色谱-电喷雾串联质谱法分析大肠癌患者尿液色氨酸及其代谢产物[J]. 重庆医学, 2014, 43(25): 3369-3371. WU Z M, ZHANG L, LI N. Simultaneous determination of tryptophan and its metabolites in urine from colorectal cancer patients by liquid chromatography-electrospray tandem mass spectrometry[J]. Chongqing Medicine, 2014, 43(25): 3369-3371. DOI:10.3969/j.issn.1671-8348.2014.25.042 |
| [15] |
郭岚, 潘萍萍, 鄢爱平, 等. UPLC-DAD测定大鼠尿液中的黄蝶呤、异黄蝶呤、酪氨酸和色氨酸[J]. 分析实验室, 2013, 32(7): 6-9. GUO L, PAN P P, YAN A P, et al. Determination of xanthopterin, isoxanthopterin, tyrosine and tryptophan in mouse urine by UPLC-DAD[J]. Chinese Journal of Analysis Laboratory, 2013, 32(7): 6-9. |
| [16] |
李婷婷, 刘若男, 顾月清. 基于比色法快速测定尿液中色氨酸的含量[J]. 生命科学仪器, 2018, 16(1): 43-47. LI T T, LIU R N, GU Y Q. Rapid determination of tryptophan in urine based on colorimetric method[J]. Life Science Instruments, 2018, 16(1): 43-47. |
| [17] |
张带荣. 高效液相色谱荧光法测定紫苏子中色氨酸[J]. 中国医院药学杂志, 2008, 28(15): 1277-1279. ZHANG D R. Quantitative determination of tryptophan in perilla frutescens seeds by HPLC with fluorescence detection[J]. Chinese Journal of Hospital Pharmacy, 2008, 28(15): 1277-1279. DOI:10.3321/j.issn:1001-5213.2008.15.016 |
| [18] |
陈军, 徐礼生, 张兴桃, 等. 高效液相色谱法测定酶法制备L-色氨酸[J]. 食品与生物技术学报, 2017, 36(3): 327-330. CHEN J, XU L S, ZHANG X T, et al. Study on high performance liquid chromatography method for determination of enzymatic preparation of L-tryptophan[J]. Journal of Food Science and Biotechnology, 2017, 36(3): 327-330. DOI:10.3969/j.issn.1673-1689.2017.03.016 |
| [19] |
HUNN J B. Chemical composition of rainbow trout urine following acute hypoxic stress[J]. Transactions of the American fisheries society, 1969, 98(1): 20-22. DOI:10.1577/1548-8659(1969)98[20:CCORTU]2.0.CO;2 |
| [20] |
邱伟强, 刘冰宣, 陈舜胜, 等. HPLC法快速测水产品中游离芳香族氨基酸含量的研究[J]. 上海海洋大学学报, 2013, 22(4): 629-633. QIU W Q, LIU B X, CHEN S S, et al. Rapid analysis of free aromatic amino acids in aquatic product by high performance liquid chromatography[J]. Journal of Shanghai Ocean University, 2013, 22(4): 629-633. |
| [21] |
任亚萍, 唐爱国, 周前选, 等. 高效液相色谱-荧光法同时测定血清中的色氨酸和酪氨酸[J]. 检验医学, 2010, 25(10): 756-760. REN Y P, TANG A G, ZHOU Q X, et al. High performance liquid chromatography-fluorescence detection for the determination of tryptophan and tyrosine in serum[J]. Laboratory Medicine, 2010, 25(10): 756-760. DOI:10.3969/j.issn.1673-8640.2010.10.003 |
| [22] |
穆萨.高效液相色谱-荧光法同时测定重性抑郁障碍患者血清酪氨酸、5-羟色胺和色胺酸[D].长沙: 中南大学, 2011. MU S.Simultaneous determination of tyrosine, tryptophan and 5-hydroxytryptamine concentrations in serum of major depressive disorder patients by high performance liquid chromatography-fluorescence detection[D].Changsha: Central South University, 2011. |
| [23] |
杨永丽, 崔盼盼, 谭婷, 等. 高效液相色谱-荧光法同时测定人体尿液中的酪氨酸和色氨酸[J]. 分析科学学报, 2016, 32(5): 634-638. YANG Y L, CUI P P, TAN T, et al. Simultaneous determination of tyrosine and tryptophan in human urine by HPLC-FLD[J]. Journal of Analytical Science, 2016, 32(5): 634-638. |
| [24] |
霍湘, 王安利, 杨建梅. 鱼类对氨基酸的吸收代谢与需求[J]. 水利渔业, 2005, 25(3): 1-3. HUO X, WANG A L, YANG J M. Absorption, metabolism and demand of amino acids in fish[J]. Reservoir Fisheries, 2005, 25(3): 1-3. DOI:10.3969/j.issn.1003-1278.2005.03.001 |
| [25] |
FORSTER R P, GOLDSTEIN L. Formation of excretory products[J]. Fish Physiology, 1969, 1: 313-350. DOI:10.1016/S1546-5098(08)60086-2 |
| [26] |
SCOTT A P, LILEY N R. Dynamics of excretion of 17α, 20β-dihydroxy-4-pregnen-3-one 20-sulphate, and of the glucuronides of testosterone and 17β-oestradiol, by urine of reproductively mature male and female rainbow trout (Oncorhynchus myklss)[J]. Journal of Fish Biology, 1994, 44(1): 117-129. |
| [27] |
YAMBEM H, SHINDO M, YAMAZAKI F. A releaser pheromone that attracts males in the urine of mature female masu salmon[J]. Journal of Fish Biology, 1999, 55(1): 158-171. DOI:10.1111/jfb.1999.55.issue-1 |
2. Key Lab of Freshwater Biodiversity Conservation, Ministry of Agriculture and Rural Affairs, Yangtze River Fisheries Research Institute, CAFS, Wuhan 430223, Hubei, China;
3. Freshwater Fish Germplasm Quality Supervision and Testing Center, Ministry of Agriculture and Rural Affairs, Wuhan 430223, Hubei, China
 2019,
Vol. 28
2019,
Vol. 28


