2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306;
3. 国家淡水水产品加工技术研发分中心, 上海 201306
南极磷虾是围绕极地分布的无脊椎动物,主要以最小的浮游植物为食,是迄今为止发现的含有最高蛋白质的生物[1],蛋白水解产物中氨基酸种类丰富,含有18种氨基酸,包含人体所需的8种必需氨基酸[2],因此其开发和利用空间巨大。生物活性肽是指一类具有生理作用的肽类化合物,目前具有易被人体消化吸收、促进免疫力、延缓衰老、抑制微生物生长、抗病毒、降血压、降血脂等功效,其分子量一般在10 ku以下,是目前国内外极具研究性和发展前景的功能因子[3]。目前,已有南极磷虾抗氧化肽的相关研究,高颖等[4]研究发现3种低氟南极磷虾多肽的抗氧化活性与选用的蛋白水解酶、氨基酸组成、分子质量分布和其二级结构有关。赵敏等[5]研究发现通过在饲料中添加南极磷虾粉可以显著提高雄鱼的抗氧化功能。王继宏等[6]利用中性蛋白酶和胰蛋白酶酶解南极磷虾得到分子量为5~10 ku的活性肽具有良好的超氧阴离子自由基、DPPH自由基以及羟基自由基清除能力。
高速逆流色谱(High-speed Countercurrent Chromatography,HSCCC)是一种新型的液-液分配的色谱技术,由于不采用固体支持物,有效地避免了样品出现不可逆吸附、污染、变性失活等情况[7]。本研究通过选用复合酶酶解南极磷虾虾粉,经超滤分离得到不同分子量范围的多肽,进一步采用高速逆流色谱技术进行分离纯化,通过比较4个抗氧化指标综合评定具有较好抗氧化活性的组分,为研究水产品中的生物活性成分提供科学依据。
1 材料与方法 1.1 材料与仪器 1.1.1 材料捕捞于南极FAO 48.2区的南极磷虾运至实验室后置于-80 ℃冰箱保存备用。
1.1.2 试剂木瓜蛋白酶(酶活为53736U)购于上海生物工程股份有限公司,枯草杆菌中性蛋白酶(酶活为29290U)、复合酶(酶活为52238U)购于上海源叶生物科技有限公司,抗超氧阴离子自由基试剂盒购于南京建成生物科技研究所,超低分子量标准蛋白购于BIO-RAD,2, 2-联苯基-1-苦基肼基购于美国Sigma公司, L-抗坏血酸酸、三氯化铁、水杨酸、铁氰化钾、三氯乙酸、菲洛嗪、无水甲醇、过氧化氢均购自中国国药集团。
1.1.3 仪器与设备真空冷冻干燥箱CHRIST ALPHA1-2(京博劢行仪器有限公司);超滤杯及超滤膜8400(上海摩速科学器材有限公司);冷冻离心机GL-20G-11(上海安亭科学仪器厂);酸度计PHS-3E(深圳市优米仪器设备有限公司);紫外分光光度计UV-2000(北京普析通用仪器有限责任公司);匀浆仪BILON-WX08(上海比朗仪器制造有限公司);高速逆流色谱仪TBE20A/300B(上海同田生化技术有限公司);高效液相色谱仪Agilent 1260(安捷伦科技有限公司);反相柱RESOURCE RPC (美国GE)。
1.2 实验方法 1.2.1 南极磷虾虾粉多肽的制备取冷冻南极磷虾于无菌采样袋中,冷水解冻后经真空冷冻干燥制得虾粉。分别选择木瓜蛋白酶、中性蛋白酶和复合酶作为水解酶,在其最适温度和pH条件下,按料液质量体积比1:10(g/mL)加入50 mmol/L Tris-Hcl缓冲液水浴酶解4 h,沸水浴灭酶15 min,离心取上清液后,采用甲醛滴定法测其水解度[8],最终选取水解度最高的酶作为实验水解酶。后将上清液经超滤分离得到分子量 < 1 ku、1~3 ku、3~5 ku、5~10 ku和 > 10 ku 5个分子量范围的多肽,经真空冷冻干燥制成南极磷虾多肽粉。
1.2.2 南极磷虾虾粉多肽的体外抗氧化实验以超氧阴离子自由基清除率、羟基自由基清除率、DPPH自由基清除率和Fe2+螯合率为指标,评价南极磷虾虾粉多肽的体外抗氧化活性。超氧阴离子自由基清除率按照抗超氧阴离子试剂盒说明书进行测定(货号A052)。DPPH自由基清除率根据布冠好等[9]的实验方法测定。羟基自由基清除率参照王继宏等[6]的方法。Fe2+螯合率的测定参照JMO等[10]的方法。
1.2.3 分子量5~10 ku多肽的高效液相色谱检测利用高效液相色谱技术(HPLC)对样品进行扫描,可以了解样品组分的复杂程度和极性[11],选用C18反相色谱柱,在流速为1 mL/min、最大压力为3 000 psi、上样浓度为4 mg/mL、上样量为20 μL、检测波长为214 nm、柱温20 ℃的条件下进行梯度洗脱。流动相A选用2%乙腈和水(含有0.1%三氟乙酸),流动相B选用80%乙腈和水(含有0.1%三氟乙酸),梯度洗脱条件见表 1。

|
表 1 HPLC梯度洗脱流动相配比 Tab.1 HPLC gradient elution mobile phase ratio |
根据HPLC检测出的多肽极性,选择进行HSCCC分离的溶剂体系,并对各个体系进行分配系数(K值)的测定。K值是达到分配平衡时样品在两种互不相溶的溶剂中的活度(常近似为浓度)之比,采用HPLC进行测定[12]。
1.2.5 HSCCC的条件选择固定相的保留率与分离效果有着直接的关系,因此主机转速、水浴温度和流动相流速等影响因素的参数均以固定相的保留率为指标。操作步骤:在制备型HSCCC上,以20 mL/min的流速将固定相泵满主机,再以适当的流速泵入流动相,在出口处收集固定相,当出口处有流动相流出时,表明固定相和流动相在螺旋管内达到了动态平衡。固定相的保留率为
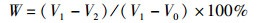 (1)
(1)
式中:W为保留率;V1为主机螺旋管及管道体积,mL;V2为推出的流动相体积,mL;V0为进样环体积,mL。
1.2.6 数据处理实验数据采用Origin 9.1和SPSS 21.0软件进行处理。
2 结果与分析 2.1 3种蛋白酶加酶量及水解度的测定以水解度为指标来选取水解酶,意在比较水解程度与抗氧化活性之间的关系。结果表明:中性蛋白酶的最适酶添加量为2 500 U/g,水解度达到31.34%;木瓜蛋白酶的最适酶添加量为2 200 U/g,水解度达到33.26%;复合酶的最适酶添加量为2 000 U/g,水解度达到37.75%(图 1)。因此,复合酶在其最佳水解条件下水解度最高,即水解更充分, 其次是木瓜蛋白酶和中性蛋白酶。这是因为复合酶既发挥了中性蛋白酶对肽链水解位点的无明显选择性,又发挥了木瓜蛋白酶的专一性,使得水解程度大大增加,因此采用复合酶作为实验水解用酶, 加酶量为2 000 U/g。
|
图 1 3种蛋白酶加酶量对水解度的影响 Fig. 1 Effect of the amount of three proteases added on the degree of hydrolysis |
由表 2可知,分子量小于10 ku时,随着分子量的增加,其对超氧阴离子、DPPH、羟基自由基清除率和Fe2+的螯合率都随之增加。通过数据的显著性差异分析,可以得出分子量范围在5~10 ku的多肽抗氧化活性显著高于其余组分。当多肽浓度为10 mg/mL时,其超氧阴离子自由基清除率达到21.28%,DPPH自由基清除率为86.52%,对羟基自由基清除率达到53.49%,Fe2+螯合率为85.35%。张元元等[13]使用木瓜蛋白酶提取到到南极磷虾多肽,研究结果表明分子量小于5 ku的多肽具有较好的抗氧化活性,且在多肽浓度为20 mg/mL时超氧阴离子自由基清除率为19.62%,DPPH自由基清除率为74.33%,其结果均低于本研究。原因可能是选取不同蛋白酶酶解得到的多肽链不同。就目前关于多肽的研究来看,这可能是因为抗氧化作用与组氨酸有关[14]。

|
表 2 多肽分子量对抗氧化能力的影响 Tab.2 Effect of molecular mass on antioxidant capacity |
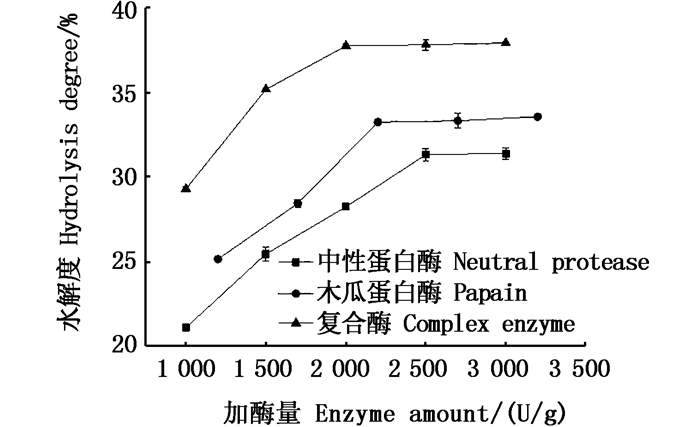
多肽样品的复杂程度及极性大小可以通过HPLC扫描有初步了解。从图 2可以看出,在20 min时大部分多肽组分已经被洗脱出来,根据梯度洗脱的条件,表明这些组分是由含量小于20%的乙腈洗脱出来的,从而可以判断出多肽样品偏极性,因此在HSCCC中应采用极性或中等极性溶剂体系作进一步分离。
|
图 2 分子量范围5~10 ku多肽的高效液相色谱图 Fig. 2 High performance liquid chromatogram of molecular mass range 5-10 ku polypeptide |
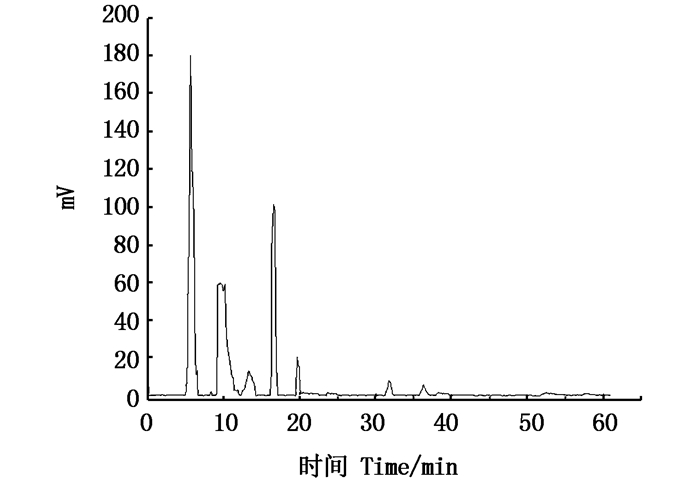
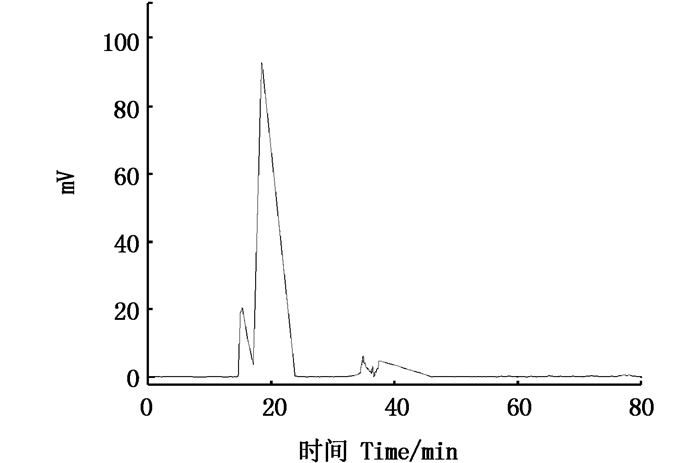
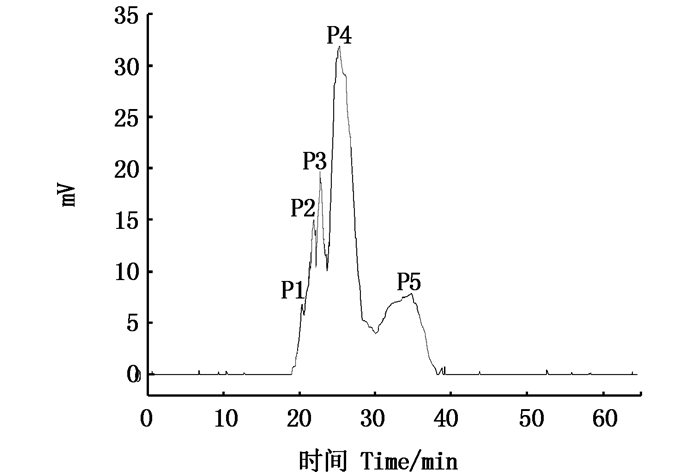
高速逆流色谱是一种液-液分配色谱技术,其原理是利用被分离物质的分配系数差异使物质分离。表 3中G1、G2、G3为中等溶剂体系,G4、G5、G6为极性溶剂体系。这6种溶剂体系符合以下要求:上下相分层时间在30 s内,K值为0.5~2.0,适合作为HSCCC分离南极磷虾虾粉多肽的系统[15]。对这6个溶剂体系进行HSCCC发现,含有氯仿和正丁醇的体系有利于南极磷虾虾粉活性肽的分离,即G6体系有初步的分离效果,其分析型HSCCC的图谱如图 3所示,结果显示G6体系已有分离趋势,因此调整G6体系中丁醇的用量,最终确定溶剂体系体积比为氯仿:正丁醇:甲醇:水=4:0.75:3:2(G7),色谱条件:进样量5 mg,下相做固定相,上相做流动相,反转,转速为1 700 r/min,流动相流速为0.5 mL/min, 214 nm下进行洗脱。根据图 4可以看出,G7体系下的色谱图分离趋势比较明显,可以标注出5个组分, 记为P1、P2、P3、P4、P5。后经HPLC测定溶剂体系的K值见表 3。
|
图 3 G6体系下分子量5~10 ku多肽的分析型HSCCC图 Fig. 3 Analytical HSCCC map of molecular mass 5-10 ku polypeptide under G6 system |
|
图 4 G7体系下分子量5~10 ku多肽的分析型HSCCC图 Fig. 4 Analytical HSCCC map of molecular mass 5-10 ku polypeptide under G7 system |

|
表 3 溶剂系统的筛选及K值测定 Tab.3 Screening of solvent system and determination of K value |
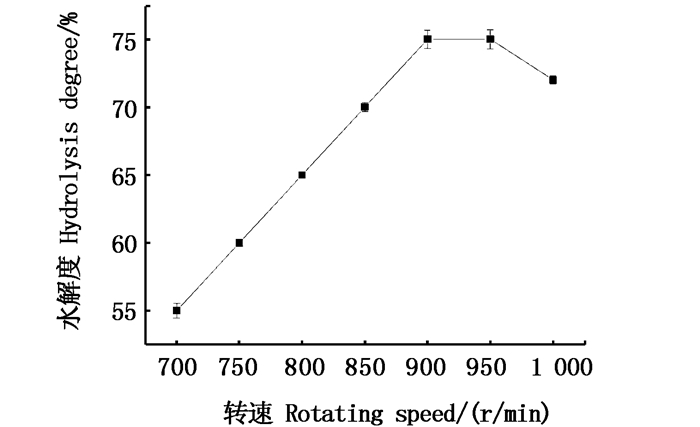
在使用HSCCC分离样品的过程中,应选择合适的转速以提高其固定相的保留率。由图 5可知:当转速小于900 r/min时,随着转速的增加固定相保留率也随之增加。这是因为随着转速的增加,螺旋柱在做行星运动时产生的离心力增加,使得流动相与固定相能在螺旋管内得到较好的分配,从而提高固定相的保留率。当转速高于950 r/min时,固定相的保留率开始下降。其原因是两相体系在螺旋管内剧烈混合产生了溶剂乳化的现象,造成固定相的流失[16]。因此,在本体系中最终采用900 r/min的主机转速进行实验。
|
图 5 主机转速对固定相保留率的影响 Fig. 5 Effect of host speed on stationary phase retention |
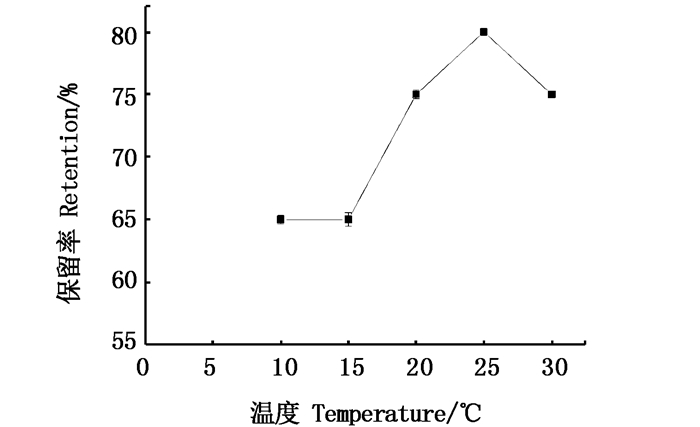
从图 6可以看出,当恒温水浴的温度小于25 ℃时,固定相的保留率随着温度的升高而升高。这是由于温度升高后,使得两相溶剂系统的分层时间缩短,减小了溶液的传质阻力而实现固定相保留率的提高。当温度达到25 ℃时,其保留率达到最大。当温度高于25 ℃后,随着温度的升高固定相的保留率开始下降。这是因为温度升高使得体系的黏度发生变化,同时温度较高时螺旋管在高速旋转时会产生较强的摩擦热,从而对固定相的保留率及设备都产生影响[17]。因此,最终采用25 ℃的恒温水浴温度。
|
图 6 水浴温度对固定相保留率的影响 Fig. 6 Effect of water bath temperature on retention of stationary phase |
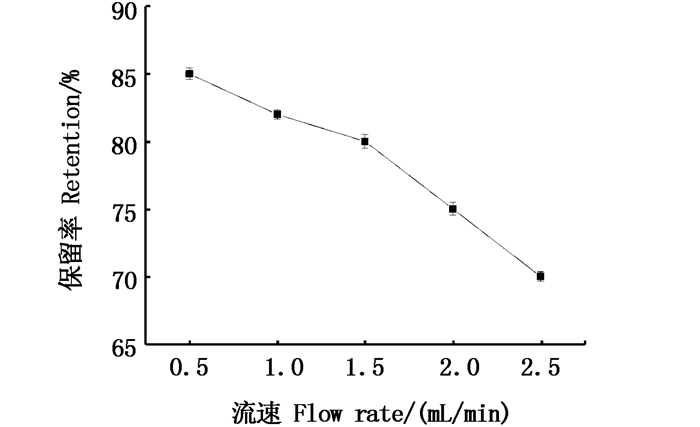
流动相流速的大小会影响到HSCCC螺旋管内上相和下相的平衡体系,从而关系到固定相保留率的大小。一般来讲,流动相的流速与固定相的保留率成反比。由图 7可以看出,流速越小时固定相保留率越低。流速过大会导致固定相的流失,而流速过小会使得分离时间过长,从而降低其分离效率。综合考虑本研究中流速选择为1.5 mL/min,此时固定相的保留率为80%。
|
图 7 流动相流速对固定相保留率的影响 Fig. 7 Effect of mobile phase flow rate on stationary phase retention |
样品溶解液的加入会改变两相之间的动态平衡,使得固定相有一定的流失,因此适宜的加样浓度在分离中也有很大影响。本研究用流动相溶剂配置质量浓度分别为5、10、20和30 mg/mL的样品溶液,在上述最佳条件下,即主机转速为900 r/min、恒温水浴温度为25 ℃、流动相的流速为1.5 mL/min时进样,进样量为5 mL。比较得出当样品的质量浓度为20 mg/mL时,样品既具有较高的保留率,又能实现样品组分的分离,分离图谱见图 8,结果显示该实验体系在合适的时间内达到较好的分离,因此选用最佳的进样质量浓度是20 mg/mL。
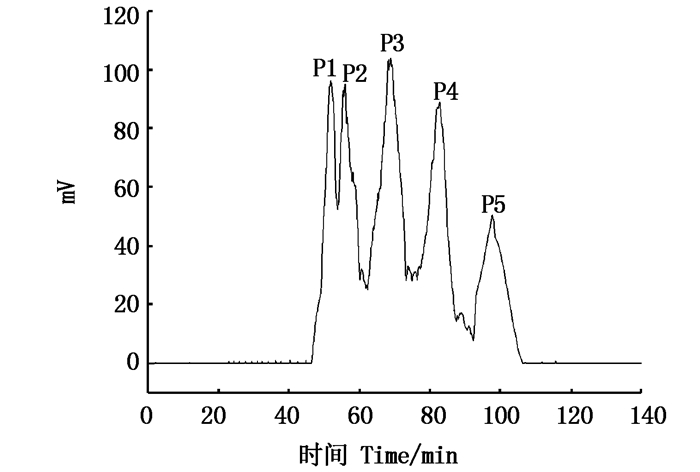
|
图 8 G7体系下分子量5~10 ku多肽的制备型HSCCC图谱 Fig. 8 Preparative HSCCC map of molecular mass 5-10 ku polypeptide under G7 system |
HSCCC的出峰顺序与被分离物质的K值有关,分配系数小的先被洗脱出来,分配系数大的后被洗脱下来,即P1~P5组分在该体系中K值是依次增大的。将经HSCCC分离收集到的5个组分进行体外抗氧化实验,各多肽组分的质量浓度均为5 mg/mL,结果见表 4。结果表明:P3组分清除超氧阴离子自由基的能力和Fe2+螯合能力均显著高于其余4个组分(P < 0.05),分别为37.18%和92.33%;P2组分的DPPH自由基清除率最高,为90.33%;P5组分的羟基自由基清除率最高,为70.11%。与未经HSCCC分离的对照组相比,抗氧化活性均得到明显增强。在相同多肽浓度下,王继宏[18]对南极磷虾肽进行HSCCC分离纯化得到7个多肽组分,经抗氧化研究表明,其清除羟基、DPPH自由基和超氧阴离子自由基能力最高为61.35%、27.43%和70.98%。对比本研究得到的P5组分的多肽,其羟基自由基清除率比王继宏[18]的研究结果高出14.28%,DPPH自由基清除率高出2.21倍,这可能是木瓜蛋白酶属巯基蛋白酶,可水解多肽中精氨酸、赖氨酸和苯丙氨酸的羧基端,并能优先水解芳香L-氨基酸的肽键。相关研究[19]表明,具有芳香族氨基酸残基的多肽有较好的抗氧化效果。

|
表 4 HSCCC分离后多肽的抗氧化活性 Tab.4 Antioxidant activity of peptides after separation by HSCCC |
选取综合抗氧化性能最好的多肽进行HSCCC分离并将分离得到的组分进行同样的抗氧化性能比较,从而确定抗氧化性能最好的组分。本研究以水解度为评价指标,比较了中性蛋白酶、木瓜蛋白酶和复合酶的水解效果,最终采用复合酶酶解南极磷虾虾粉。酶解工艺:加酶量2 000 U/g,料液比1:10,酶解温度50 ℃,pH 7.5,酶解时间4 h,该条件下南极磷虾虾粉蛋白水解度为37.75%。然后将经超滤分离后的多肽进行抗氧化试验。研究表明:复合酶酶解法制备的生物活性肽具有一定的清除超氧阴离子、DPPH自由基、羟基自由基、螯合Fe2+的能力,其中以分子量在5~10 ku的多肽抗氧化活性最好。
采用HSCCC对超滤得到的分子量5~10 ku多肽进一步分离纯化,得到了抗氧化效果更好的南极磷虾多肽。其溶剂体系体积比为氯仿:丁醇:甲醇:水=4:0.75:3:2,主机反转,转速900 r/min、恒温水浴温度25 ℃、流动相的流速1.5 mL/min,进样浓度20 mg/mL。在该体系下分离共得到5个组分,经测定:当浓度为5 mg/mL时,P3组分清除超氧阴离子自由基的能力和Fe2+螯合能力均显著高于其余4个组分,分别为37.18%和92.33%;P2组分的DPPH自由基清除率为90.33%;P5组分的羟基自由基清除率为70.11%。与未经HSCCC分离的对照组相比,抗氧化活性均得到明显增强。本实验为南极磷虾肽的分离纯化寻找新的方法并提供理论基础,同时为抗氧化南极磷虾肽产品的开发利用奠定基础。为更好地了解抗氧化能力与多肽结构的关系,后期拟进一步对P2、P3和P5组分进行氨基酸的组成和排序分析。
| [1] |
曾晓波, 王海英, 林永成. 食物中的生物活性肽:生物活性及研究进展[J]. 食品工业科技, 2004, 25(4): 151-155. ZENG X P, WANG H Y, LIN Y C. The bioactivity and its research on bioactive peptide in food[J]. Science and Technology of Food Industry, 2004, 25(4): 151-155. |
| [2] |
林琳, 李八方. 鱿鱼皮胶原蛋白水解肽抗氧化活性研究[J]. 中国海洋药物杂志, 2006, 25(4): 48-51. LIN L, LI B F. Studies on the antioxidation activity of squid (Dosidicus eschrichitii Steenstrup) skin gelatin hydrolysate[J]. Chinese Journal of Marine Medicine, 2006, 25(4): 48-51. |
| [3] |
WANG Y C, WANG S S, WANG J F, et al. Preparation and anti-osteoporotic activities in vivo of phosphorylated peptides from Antarctic krill (Euphausia superba)[J]. Peptides, 2015, 68: 239-245. DOI:10.1016/j.peptides.2014.10.004 |
| [4] |
高颖, 王彦超, 常耀光, 等. 三种低氟南极磷虾肽的ACE抑制作用及抗氧化活性研究[J]. 食品工业科技, 2016, 37(2): 82-87. GAO Y, WANG Y C, CHANG Y G, et al. ACE inhibition and antioxidant activities of three types of Antarctic krill(Euphausia superba) peptides with low fluorine content[J]. Science and Technology of Food Industry, 2016, 37(2): 82-87. |
| [5] |
赵敏, 梁萌青, 郑珂珂, 等. 饲料中添加南极磷虾粉对半滑舌鳎(Cynoglossus semilaevi)雄性亲鱼繁殖性能及抗氧化功能的影响[J]. 渔业科学进展, 2016, 37(6): 49-55. ZHAO M, LIANG M Q, ZHENG K K, et al. Effects of dietary antarctic krill on the reproductive performance and antioxidant function in male broodstock tongue sole (Cynoglossus semilaevis)[J]. Progress in Fishery Sciences, 2016, 37(6): 49-55. |
| [6] |
王继宏, 汪之和, 田鑫, 等. 南极磷虾抗氧化多肽制备的研究[J]. 食品工业科技, 2014, 35(3): 109-112. WANG J H, WANG Z H, TIAN X, et al. Preparation of Antarctic krill peptides with anti-oxidant activity[J]. Science and Technology of Food Industry, 2014, 35(3): 109-112. |
| [7] |
曹学丽. 高速逆流色谱分离技术及应用[M]. 北京: 化学工业出版社, 2005: 11-13. CAO X L. High-speed countercurrent chromatography separation technology and its application[M]. Beijing: Chemical Industry Press, 2005: 11-13. |
| [8] |
刘丽红, 雷清华. 茚三酮比色法与甲醛滴定法测定棉籽粕蛋白水解度的比较[J]. 化学工程与装备, 2012(11): 160-163. LIU L H, LEI Q H. Comparison of ninhydrin colorimetry and formaldehyde titration in determination of cottonseed protein hydrolytic degree[J]. Chemical Engineering & Equipment, 2012(11): 160-163. |
| [9] |
布冠好, 杨国宇, 李宏基. 肌肽对肉品体系中脂类氧化的抑制作用[J]. 河南工业大学学报(自然科学版), 2011, 32(4): 44-48. BU G H, YANG G Y, LI H J. Inhibition effects of carnosine on lipid peroxidation in meat product system[J]. Journal of Henan University of Technology (Natural Science Edition), 2011, 32(4): 44-48. |
| [10] |
FERNANDES J M O, SMITH V J. A novel antimicrobial function for a ribosomal peptide from rainbow trout skin[J]. Biochemical and Biophysical Research Communications, 2002, 296(1): 167-71. DOI:10.1016/S0006-291X(02)00837-9 |
| [11] |
邹晓莉, 黎源倩, 曾红燕, 等. 反相高效液相色谱法测定人肌腱中的胶原蛋白[J]. 色谱, 2006, 24(3): 263-266. ZOU X L, LI Y Q, ZENG H Y, et al. Determination of collagen in tendon by reversed-phase high performance liquid chromatography[J]. Chinese Journal of Chromatography, 2006, 24(3): 263-266. DOI:10.3321/j.issn:1000-8713.2006.03.012 |
| [12] |
胡菊华, 冷欣夫. 反相高效液相色谱法测定某些有机化合物的分配系数[J]. 色谱, 1992, 10(6): 344-346. HU J H, LENG X F. Determination of partition coefficients for some pesticides by using reversed-phase high performance liquid chromatography (HPLC)[J]. Chinese Journal of Chromatography, 1992, 10(6): 344-346. |
| [13] |
张元元, 汪之和, 陈敏, 等. 南极磷虾肽制备工艺优化及体外抗氧化研究[J]. 上海海洋大学学报, 2016, 25(5): 786-793. ZHANG Y Y, WANG Z H, CHEN M, et al. Technology optimization of the peptide preparation for Euphausia superba and study on the antioxidant activity in vitro[J]. Journal of Shanghai Ocean University, 2016, 25(5): 786-793. |
| [14] |
WU H C, CHEN H M, SHIAN C Y. Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel (Scomber austriasicus)[J]. Food Research International, 2003, 36(9/10): 949-957. |
| [15] |
程杰, 符晓晖, 王维娜. 高速逆流色谱在中药分离中溶剂体系的筛选[J]. 中草药, 2008, 39(8): 1272-1275. CHENG J, FU X H, WANG W N. Screening of solvent system in Chinese medicine separation by high speed countercurrent chromatography[J]. Chinese Traditional and Herbal Drugs, 2008, 39(8): 1272-1275. |
| [16] |
沈莲清, 许明峰. 高速逆流色谱分离芝麻菜种子中的硫代葡萄糖苷[J]. 食品与生物技术学报, 2007, 26(6): 13-16. SHEN L Q, XU M F. Separation of glucosinolate from eruca sative seed by high-speed counter-current chromatography[J]. Journal of Food Science and Biotechnology, 2007, 26(6): 13-16. DOI:10.3321/j.issn:1673-1689.2007.06.004 |
| [17] |
陆丽利.黄酒中活性肽的分离纯化的研究[D].上海: 上海海洋大学, 2011. LU L L. Preparation and purification of peptides with ACE ihibitory activity from rice wine[D]. Shanghai: Shanghai Ocean University, 2011. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1946951 |
| [18] |
王继宏.南极磷虾抗氧化肽制备和纯化的研究[D].上海: 上海海洋大学, 2015. WANG J H. Preparation and purification of antarctic krill peptides with anti-oxidant activity[D]. Shanghai: Shanghai Ocean University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10264-1015975213.htm |
| [19] |
农珍妮, 赵钟兴, 韦藤幼, 等. 具有DPPH自由基抑制活性的蚕蛹蛋白酶解液脱色工艺优化[J]. 食品科学, 2015, 36(2): 12-18. NONG Z N, ZHAO Z X, WEI T Y, et al. Decolorization of silkworm pupae protein hydrolyzate with DPPH radical scavenging activity[J]. Food Science, 2015, 36(2): 12-18. |
2. Engineering Research Center for Processing and Storage of Shanghai Seawater Products, Shanghai 201306, China;
3. National Freshwater Aquatic Products Processing Technology R & D Center, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


