2. 青岛海洋科学与技术国家试点实验室海洋生物与生物技术实验室, 山东 青岛 266235;
3. 夏威夷太平洋大学自然科学系, 夏威夷 檀香山 96813;
4. 中国地质大学 生物地质与环境地质国家重点实验室, 湖北 武汉 430074;
5. 中国地质大学 地球科学学院, 湖北 武汉 430074;
6. 中国地质大学 地质过程与矿产资源国家重点实验室, 湖北 武汉 430074
稳定碳、氢同位素分析作为海洋地球化学领域一种重要的研究工具,已在重建古环境[1]和古气候[2],研究有机碳循环[3],分辨不同生物代谢与合成过程(例如,细菌参与的硫酸盐还原和甲烷氧化过程,磷脂合成的MVA和MEP途径,微生物源CH4的乙酸脱羧和CO2还原合成途径)[4-5],检测环境污染[6]以及追踪生物摄食习性[7-8]和生长代谢过程[9]等方面取得重要成果。而二维单体同位素分析(two-dimensional compound specific isotope analysis, 2D-CSIA)在分辨微生物不同生长代谢过程[10],指示特定的生物降解途径[11]方面有极大潜力。近年来,随着对深海尤其是深渊的开发和研究[12],嗜高压微生物逐渐成为一个研究热点。深海沉积物中的微生物承受着数百倍大气压强的静水压力(>10 MPa)[12],为了适应此类极端环境,嗜高压微生物合成了独特的脂类和调控基因[13],并且,其磷脂脂肪酸的稳定碳、氢同位素分馏在高压下也出现相应改变[14-15]。
研究发现,不同的生物合成途径和代谢过程会对微生物磷脂脂肪酸的碳、氢同位素产生不同改造[16-18]。实验表明,在高静水压力下,革兰氏阴性细菌通过不同途径合成的脂肪酸[15],氢同位素组成存在巨大差异,并且当压力升高时,碳稳定同位素出现规律性负偏[14]。该结果说明,传统同位素分馏思路已经不适合解决深海及深渊生物地球化学循环问题,如物源示踪[19]、古环境重建[20]。海底沉积物中的二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)主要来源于海洋微生物的代谢和生物合成,很少由表层浮游植物沉降获得[14]。有机物在迁移过程中,其同位素比值会随微生物的生物再合成和在生命代谢过程中的利用而改变[21-22],使深海及深渊同位素示踪更加困难。
目前,对深海沉积物中微生物的磷脂脂肪酸和同位素变化特征的研究已取得一定进展[14-15, 23],然而,表层细菌在高压下是否具有相似同位素和脂肪酸变化特征尚未得到证实,并且,前人研究大多集中在革兰氏阴性细菌[24-25]。研究表明,革兰氏阳性细菌在某些海洋活动中发挥着重要作用[26-27]。因此,为了研究革兰氏阳性细菌在不同生长压力下,磷脂脂肪酸的变化特征和稳定碳、氢同位素分馏,本文选择一株来自表层的革兰氏阳性细菌Bacillus subtilis,通过测定其磷脂脂肪酸δD和δ13C,并对比前人在深海革兰氏阴性细菌方面的研究成果,揭示微生物脂类的碳、氢稳定同位素分馏与生长压力的关系,从而为探索深海及深渊有机物循环提供一种新的研究思路和手段。
1 材料与方法 1.1 不同压力梯度下细菌培养Bacillus subtilis是一株广泛分布于地表浅层各种环境中的革兰氏阳性细菌。其生理生态特征和基因序列等已有深入研究[28]。预实验数据表明,该菌株可以在小于40 MPa压力下生长,并与另一株已有深入研究的革兰氏阳性耐高压细菌Sporosarcina sp.DSK25为近源属[29],因而本文以Bacillus subtilis作研究对象,更具对比意义。
菌株的培养实验如下:首先将冷藏在4 ℃纯菌液中的细菌接种在液体培养基中,置于35 ℃, 0.1 MPa条件下培养24小时以上进行活化和稀释。培养基成分为:DifcoTM Marine Broth 2216(Becton Dickinson and Company)、去离子水。将活化后的菌液涂平板,24小时后挑选平板中的单菌落,一份接种于固体培养基中(培养基成分:DifcoTM Marine Broth 2216、去离子水、琼脂),待长出菌落后进行测序;另一份接种至液体培养基中,在波长600 nm的荧光下测量菌液OD值。待生长至稳定期,以1%的接种量接种于单一碳源培养基中(培养基成分:包含50 mmol/L葡萄糖和0.04%酵母提取物的海水60 mL(Sigma Chem.Co),20 mL FlorinertTM FC-40 (Sigma-Aldrich.Co.)。FC-40在使用前置入4 ℃环境下连续通入高纯氧12小时以上,并在加入高压培养袋前全部通过0.22 μm的无菌滤膜过滤。接种后的单一碳源培养液置于高压培养袋中用封口机密封,放入便携式高压培养釜(南通飞宇公司)中,分别加压至0.1, 10, 20, 30, 40, 50 MPa,放入30 ℃恒温箱中进行培养。根据细菌在预实验中波长600 nm荧光下的OD值,在稳定期取出培养袋,将培养液进行10 000 g离心,收集细胞,准备磷脂提取和同位素分析。
1.2 脂类分离和提取将细胞干物质溶解在二氯甲烷、甲醇、磷酸缓冲液(用磷酸二氢钾配制,浓度为50 mmol/L,pH为7.4)比例为2:1:0.8的混合试剂中[30]。静置一夜后向混合试剂中加入二氯甲烷和去离子水,至甲醇、二氯甲烷、水的比例为1:1:0.9,用氮气将溶剂吹干即可得到总脂类。将提取出的总脂类用7:3的正己烷:二氯甲烷混合试剂溶解后转移至含有100 mg硅胶的层析柱(Supleco,Inc., Bellefonte, PA)上,分别用正己烷、二氯甲烷、乙酸、甲醇依次分离出总脂类中的碳氢化合物、中性脂、醣脂、磷脂组分。将磷脂衍生化后进行气相色谱-质谱(Gas Chromatography-Mass Spectrometer, GC-MS)分析和碳、氢稳定同位素分析。
1.3 脂肪酸甲酯GC-MS分析磷脂脂肪酸经过特定的甲基化程序后上机测试。本文采用Agilent 7890B气相色谱仪,配合Agilent 5977A质谱检测器分析脂肪酸甲酯。色谱柱为30 m ×0.25 mm×0.25 μm i.d. HP-5ms石英毛细管柱(J & W Scientific, Folsom, CA, USA)。升温程序为:50~150 ℃以10 ℃/min的速率升温,接着以5 ℃/min升温至310 ℃并保持15分钟。先通过保留时间,并对比标准谱库,对单个化合物定性,再利用内标法定量,内标物为硬脂酸甲酯(Sigma-Aldrich.Inc.)。脂肪酸按照总碳个数与双键个数比值来表示。甲基支链脂肪酸用i(异)或者a(反异)表示。
1.4 脂肪酸甲酯的碳、氢同位素分析脂肪酸甲酯氢同位素在生物地质与环境地质国家重点实验室(武汉)测定。测试仪器为与Delta plus XP质谱仪连用的ThermoFinnigan微量气相色谱仪。化合物裂解温度为1 440 ℃。每测试四次,用碳原子数在16至30的烃类化合物的混合溶剂对仪器作校准。根据同位素质量守恒法则,用甲酯化中引入的甲基对脂肪酸氢同位素作校正。每个化合物的氢同位素测量三次以上,相对误差控制在5‰以内[10]。海水和甲醇的氢同位素分别在国家海洋局第三海洋研究所(厦门)和中科院地球环境研究所(西安)测定。采用Finnigan Delta Plus XL同位素比值质谱仪与Finnigan Thermal Conversion/Elemental分析仪连用测定海水氢同位素。利用Mat Delta Plus同位素比值质谱仪与6890气相色谱仪连用测定甲醇氢同位素。同时选择两份同批次的试剂作重复测量。测定的氢同位素数值用δD表示,代表样品中氘和氢稳定同位素比值与维也纳标准平均海水(Vienna Standard Mean Ocean Water, VSMOW)中氘、氢比值的对比。碳同位素比值以δ13C表示,代表相对于碳酸盐标准物质(Pee Dee Belemnite, PDB)的δ值,δ用以下公式表示
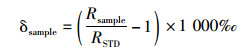
式中:Rsample表示样品中重同位素与轻同位素的比值,RSTD为标准物质的对应同位素比值。碳同位素在地质过程与矿产资源国家重点实验室(武汉)测定。测试仪器为气相色谱-同位素比值质谱仪。色谱柱为DB-5ms毛细管柱(30 m×0.25 mm×0.25 μm), 程序升温:初始炉温50 ℃,保持1分钟后以10 ℃/min升温至120 ℃,保持5分钟,再以5 ℃/min升温至310 ℃,保持20分钟。载气为氦气,流速1.2 mL/min。以角鲨烷为内标,样品平行测定两次,标准方差在0.5‰以内[10, 14-15]。葡萄糖的碳同位素在上海海洋大学摄食生态实验室测定,测试仪器为稳定同位素质谱仪(ISOPRIME 100, Isoprime Corporation, Cheadle, UK)。
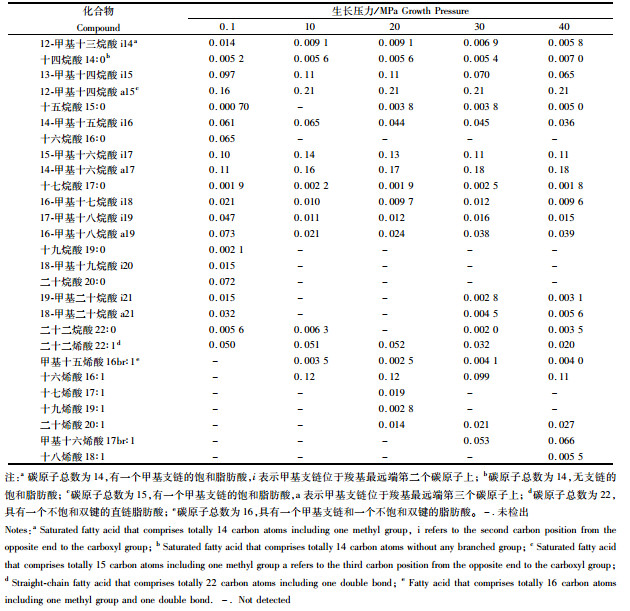
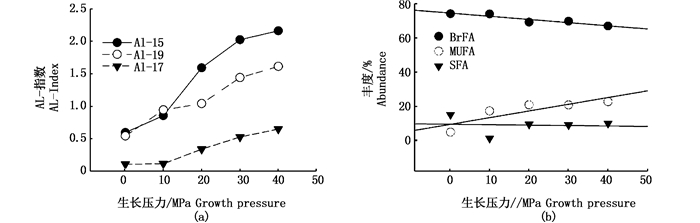
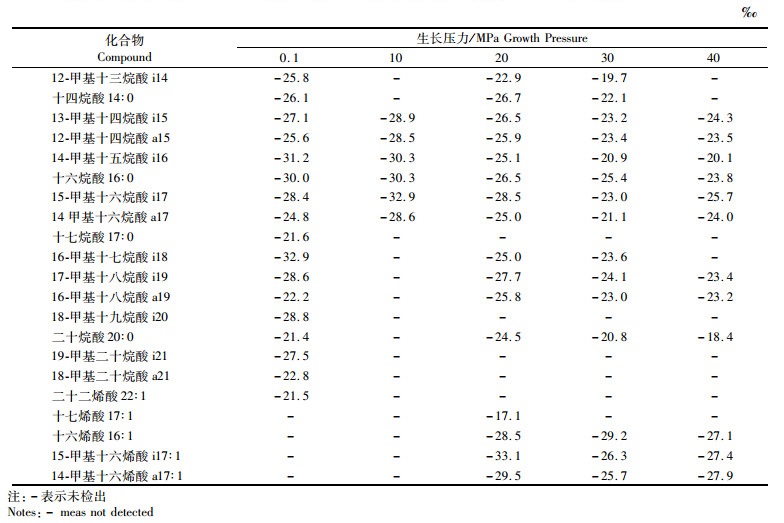
2 结果 2.1 Bacillus subtilis脂肪酸组成Bacillus subtilis合成3种脂肪酸:饱和脂肪酸(saturated fatty acid, SFA),单不饱和脂肪酸(monounsaturated fatty acid, MUFA),支链脂肪酸(branched chain fatty acid, BrFA)。脂肪酸在不同生长压力下百分含量见表 1。其中,BrFA含量随压力升高而降低,MUFA与BrFA相反,这两种脂肪酸与压力之间都呈现出一定线性关系(图 1),R2值分别为0.873 (BrFA) (t=4.541, 0.01<P<0.02)、0.734(MUFA) (t=2.877, 0.05<P<0.1),而SFA在压力从0.1上升至10 MPa时含量明显降低,随之出现上升趋势并在20 MPa后保持稳定。在所有生长压力下,BrFA含量均超过67%,是MUFA和SFA含量总和的两倍。在高压下(>10 MPa),MUFA含量远高于SFA(表 1,图 1)。令AI=(Ca-Ci)/Ci(其中Ca代表特定的反异支链脂肪酸含量,Ci代表对应的异支链脂肪酸含量),可观察到a15与i15、a17与i17、a19与i19的AI指数随压力增加而升高(图 1)。Bacillus subtilis在50 MPa下不生长,因此本文相关数据均在40 MPa之下获得。
|
表 1 不同生长压力下Bacillus subtilis脂肪酸含量(以每个压力梯度下的含量百分比表示) Tab.1 Abundance (in percentage converted from bulk density under each growth pressure) of fatty acids in Bacillus subtilisgrown at different pressures |
|
图 1 AI指数(a)和脂肪酸含量(b)随生长压力变化的趋
Fig. 1 Tendency of AI index (a) and concentration variations (b) of fatty acids changing with growth pressures
|
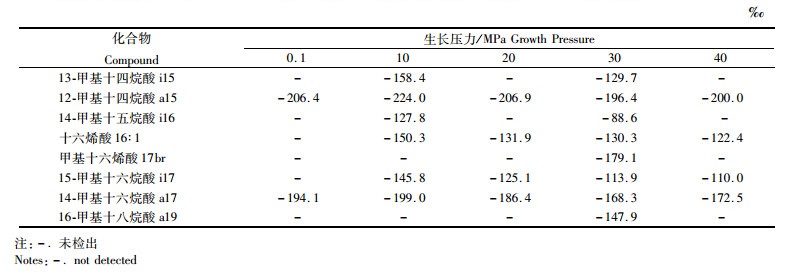
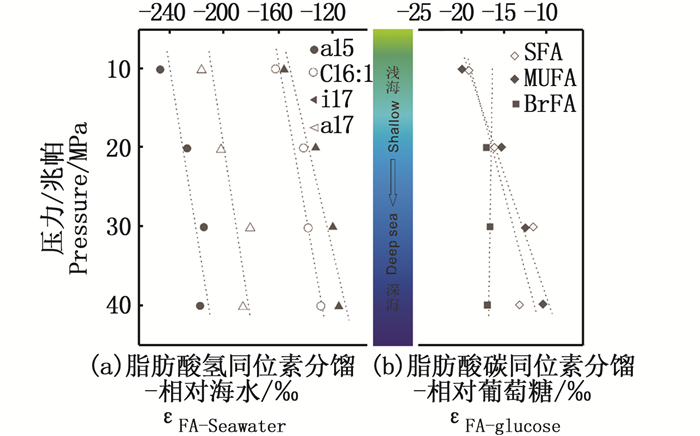
菌株中3种脂肪酸相对VSMOW的δD值均出现较大负偏。其中BrFA在0.1~40 MPa下负偏最明显(图 2),BrFA相对于海水的氢同位素分馏εfa/sw{εa/b=[(1 000+δa)/(1 000+δb)-1]×1 000; fa, fatty acids; sw, seawater}的平均值为-184.6‰,MUFA的εfa/sw平均值为-145.9‰。BrFA中a15在10 MPa下,εfa/sw达到-244.9‰,是所有生长压力中观测到的最大氢同位素分馏(表 2)。a15、i17、a17的εfa/sw值与压力之间存在较强的线性关系(图 2),R2分别为0.761(t=2.524, 0.1<P<0.2)、0.908(t=4.442, 0.02<P<0.05)和0.811 (t=2.930, 0.05<P<0.1),随着压力的升高,氢同位素负偏趋势减弱(图 2)。单不饱和脂肪酸16:1与压力线性拟合的R2值为0.871 (t=3.675, 0.05<P<0.1)。在所有生长压力下,反异支链脂肪酸氢同位素明显轻于异支链和单不饱和脂肪酸(表 2,图 2)。
|
表 2 不同生长压力下Bacillus subtilis脂肪酸氢同位素组成 Tab.2 Hydrogen isotope composition of fatty acids in Bacillus subtilis grown under different pressures |
|
图 2 不同生长压力(海水深度)下Bacillus subtilis脂肪酸碳(b)、氢(a)同位素分馏特征
Fig. 2 Carbon (b) and hydrogen (a) isotopic fractionation patterns of fatty acids in Bacillus subtilis grown under different pressures (ocean depth)
|
碳同位素在所有生长压力下相对于碳酸盐标准均出现负偏,3种脂肪酸在10 MPa时的碳同位素最轻,为-30.1‰,而在40 MPa时最重,达到-24.0‰。当生长压力从10增加至40 MPa时,SFA与BrFA的碳同位素负偏趋势减弱(图 2),并且,SFA、BrFA相对于底物葡萄糖的碳同位素分馏εfa/g(g, glucose)与压力之间为正相关关系,R2值分别为0.963 (t=7.215, 0.01<P<0.02)、0.815 (t=2.968, 0.05<P<0.1)(图 2)。在生长压力大于20 MPa时,BrFA碳同位素轻于MUFA和SFA,并且随压力增加无明显变化趋势(表 3,图 2)。
|
表 3 Bacillus subtilis在不同生长压力下脂肪酸的碳同位素组成 Tab.3 Carbon isotope composition of fatty acids in Bacillus subtilisgrown under different pressures |
Bacillus subtilis在不同生长压力下都合成了饱和、单不饱和与支链脂肪酸,但是并未出现高压下在革兰氏阴性细菌中检测到的长链多不饱和脂肪酸(long chain polyunsaturated fatty acids, PUFA),这与报道过的另一株分离自深海沉积物中的革兰氏阳性细菌Sporosarcina sp.DSK25相吻合[32]。细菌的细胞膜磷脂双分子层对其适应高压环境有重要作用。研究表明,革兰氏阴性细菌通过合成更多的单不饱和与长链多不饱和脂肪酸,增加细胞膜流动性,来适应高压环境[33-34];而革兰氏阳性细菌可能通过增加中链多不饱和与反异支链脂肪酸的含量来适应高压条件[32]。本文的脂肪酸分析结果表明,AI指数的上升,可能受到压力影响,即,Bacillus subtilis通过增加反异支链脂肪酸的含量,减缓或降低异支链脂肪酸合成来适应生长压力的提高。此外,单不饱和脂肪酸在菌株的高压适应过程中也起了一定作用。因此,革兰氏阳性细菌的适压机制可能与阴性细菌不同,前者通过合成PUFA,而后者则通过增加MUFA和BrFA来应对生长压力的提高。
3.2 压力控制的碳、氢同位素分馏与深海及深渊生物地球化学循环本文首次研究了革兰氏阳性细菌Bacillus subtilis在不同生长压力下细胞膜磷脂脂肪酸的碳、氢同位素分馏特征,分析了两种不同微生物同位素分馏的差异。这项工作对于研究深海有机物循环、物源示踪、海洋有机质垂向分布特征等具有重要意义。同时,本项研究也为探索深海及深渊生物地球化学循环提供了良好的研究手段和思路。本项研究结果表明,革兰氏阳性细菌Bacillus subtilis生物合成的单不饱和与支链脂肪酸的氢同位素分馏与生长压力(海水深度)之间存在较显著的线性相关性:随着压力提高,氢同位素分馏逐渐减弱。这一结果与革兰氏阴性细菌的氢同位素分馏不同。在高压下,阴性细菌中的PUFA氢同位素相对常压下的非多不饱和脂肪酸出现严重负偏[15]。因此,在海洋中,随着海水深度的增加,革兰氏阴性和阳性细菌可能会表现出不同的氢同位素分馏特征。这种现象可能与压力影响下的氘同位素效应有关。较高的静水压力会抑制同位素效应[35],使生物合成过程中同位素分馏作用减弱;同时,高压可能会加强酶的催化效率[35]。脂肪酸生物合成过程中的氢分别来自于丙二酰辅酶A、乙酰辅酶A、NADPH和海水[36]。其中,NADPH具有较轻的δD值,因此,在脂肪酸合成过程中,压力可能使氢从NADPH向脂肪酸的转移效率提高,反应更完全,故而氢同位素分馏减弱。而革兰氏阴性细菌中PUFA氢同位素在高压下负偏可能与长链多不饱和脂肪酸合成途径有关[15, 37]。
与氢同位素分馏类似,Bacillus subtilis碳同位素分馏也随着压力增加而负偏趋势减弱,这与革兰氏阴性细菌相反。研究表明,耐压型革兰氏阴性细菌的碳同位素分馏受到同位素动力学(εPDH)影响[38],压力会促进该效应,使分馏增强[14],从而同位素负偏加强,因此地表革兰氏阳性细菌碳同位素分馏可能由其他因素主导。本文中,SFA和BrFA碳同位素变化显著,而MUFA在高压下保持稳定,基本不随压力变化。这一特征可能与MUFA在生长压力升高时含量增多有关。
海底沉积物中的原核生物中,革兰氏阴性细菌丰度较高(在浅海沉积物中丰度达70%~ 90%),数量较多[39],前人的研究也主要集中在革兰氏阴性细菌。然而,革兰氏阳性细菌对海底微生物群落的形成有重要贡献,其中,浅海沉积物中芽孢杆菌纲丰度可达34.4%[40]。研究表明,革兰氏阳性细菌在金属氧化和多环芳烃降解过程中发挥了重要作用[26-27]。并且最新研究显示,在海床数千米之下的古老沉积物中,产孢子的革兰氏阳性细菌占据优势种群[41],而该古老沉积物所代表的深部生物圈,蕴藏着巨大的生物和能量资源[42]。因而,本文通过研究陆地表层革兰氏阳性细菌Bacillus subtilis在压力控制下的碳、氢同位素分馏,填补了在革兰氏阳性细菌深海及深渊生物地球化学方面的研究空白,也对探索深部生物圈具有一定指示意义。
综上所述,革兰氏阳性细菌Bacillus subtilis的碳、氢同位素分馏与生长压力之间显示出较显著的线性关系,碳、氢同位素分馏随压力升高负偏趋势减弱,并与阴性细菌的分馏特征存在一定差别。本文也进一步突显了微生物在海洋有机物循环中的重要作用,并且从压力与同位素分馏的角度切入,为研究深海及深渊同位素地球化学提供了一定的思路和手段。
| [1] |
HERRMANN N, BOOM A, CARR A S, et al. Hydrogen isotope fractionation of leaf wax n-alkanes in southern African soils[J]. Organic Geochemistry, 2017, 109: 1-13. DOI:10.1016/j.orggeochem.2017.03.008 |
| [2] |
LI C, SESSIONS A L, VALENTINE D L, et al. D/H variation in terrestrial lipids from Santa Barbara Basin over the past 1400 years:a preliminary assessment of paleoclimatic relevance[J]. Organic Geochemistry, 2011, 42(1): 15-24. DOI:10.1016/j.orggeochem.2010.09.011 |
| [3] |
HAYES J M, STRAUSS H, KAUFMAN A J. The abundance of 13C in marine organic matter and isotopic fractionation in the global biogeochemical cycle of carbon during the past 800Ma[J]. Chemical Geology, 1999, 161(1/3): 103-125. |
| [4] |
VALENTINE D L, CHIDTHAISONG A, RICE A, et al. Carbon and hydrogen isotope fractionation by moderately thermophilic methanogens[J]. Geochimica et Cosmochimica Acta, 2004, 68(7): 1571-1590. DOI:10.1016/j.gca.2003.10.012 |
| [5] |
SESSIONS A L, BURGOYNE T W, SCHIMMELMANN A, et al. Fractionation of hydrogen isotopes in lipid biosynthesis[J]. Organic Geochemistry, 1999, 30(9): 1193-1200. DOI:10.1016/S0146-6380(99)00094-7 |
| [6] |
BRAECKEVELT M, FISCHER A, KÄSTNER M. Field applicability of Compound-Specific Isotope Analysis (CSIA) for characterization and quantification of in situ contaminant degradation in aquifers[J]. Applied Microbiology and Biotechnology, 2012, 94(6): 1401-1421. DOI:10.1007/s00253-012-4077-1 |
| [7] |
薛彬, 蒋日进, 王凯, 等. 应用稳定同位素技术分析枸杞岛近岸海域褐菖#的食性[J]. 水产学报, 2017, 41(9): 1415-1423. XUE B, JIANG R J, WANG K, et al. Feeding habits of Sebastiscus marmoratus in the Gouqi Island based on stable istope analysis[J]. Journal of Fisheries of China, 2017, 41(9): 1415-1423. |
| [8] |
张波, 袁伟, 戴芳群. 应用稳定同位素技术研究崂山湾夏季鱼类群落的摄食生态[J]. 水产学报, 2016, 40(4): 585-594. ZHANG B, YUAN W, DAI F Q. Study on feeding ecology of fish community in Laoshan Bay during summer using stable carbon and nitrogen isotopes[J]. Journal of Fisheries of China, 2016, 40(4): 585-594. |
| [9] |
李建华, 陈新军, 方舟. 哥斯达黎加海域茎柔鱼角质颚稳定同位素研究[J]. 上海海洋大学学报, 2013, 22(6): 936-943. LI J H, CHEN X J, FANG Z. Stable isotope of beak for Dosidicus gigas off Costa Rica coast[J]. Journal of Shanghai Ocean University, 2013, 22(6): 936-943. |
| [10] |
FEISTHAUER S, VOGT C, MODRZYNSKI J, et al. Different types of methane monooxygenases produce similar carbon and hydrogen isotope fractionation patterns during methane oxidation[J]. Geochimica et Cosmochimica Acta, 2011, 75(5): 1173-1184. DOI:10.1016/j.gca.2010.12.006 |
| [11] |
DORER C, VOGT C, KLEINSTEUBER S, et al. Compound-specific isotope analysis as a tool to characterize biodegradation of ethylbenzene[J]. Environmental Science & Technology, 2014, 48(16): 9122-9132. |
| [12] |
FANG J S, ZHANG L, BAZYLINSKI D A. Deep-sea piezosphere and piezophiles:geomicrobiology and biogeochemistry[J]. Trends in Microbiology, 2010, 18(9): 413-422. DOI:10.1016/j.tim.2010.06.006 |
| [13] |
李学恭, 徐俊, 肖湘. 深海微生物高压适应与生物地球化学循环[J]. 微生物学通报, 2013, 40(1): 59-70. LI X G, XU J, XIAO X. High pressure adaptation of deep-sea microorganisms and biogeochemical cycles[J]. Microbiology China, 2013, 40(1): 59-70. |
| [14] |
FANG J S, UHLE M, BILLMARK K, et al. Fractionation of carbon isotopes in biosynthesis of fatty acids by a piezophilic bacterium Moritella japonica strain DSK1[J]. Geochimica et Cosmochimica Acta, 2006, 70(7): 1753-1760. DOI:10.1016/j.gca.2005.12.011 |
| [15] |
FANG J S, LI C, ZHANG L, et al. Hydrogen isotope fractionation in lipid biosynthesis by the piezophilic bacterium Moritella japonica DSK1[J]. Chemical Geology, 2014, 367: 34-38. DOI:10.1016/j.chemgeo.2013.12.018 |
| [16] |
SESSIONS A L, JAHNKE L L, SCHIMMELMANN A, et al. Hydrogen isotope fractionation in lipids of the methane-oxidizing bacterium Methylococcus capsulatus[J]. Geochimica et Cosmochimica Acta, 2002, 66(22): 3955-3969. DOI:10.1016/S0016-7037(02)00981-X |
| [17] |
OSBURN M R, DAWSON K S, FOGEL M L, et al. Fractionation of hydrogen isotopes by sulfate-and nitrate-reducing bacteria[J]. Frontiers in Microbiology, 2016, 7: 1166. |
| [18] |
VINSON D S, BLAIR N E, MARTINI A M, et al. Microbial methane from in situ biodegradation of coal and shale:a review and reevaluation of hydrogen and carbon isotope signatures[J]. Chemical Geology, 2017, 453: 128-145. DOI:10.1016/j.chemgeo.2017.01.027 |
| [19] |
段毅, 宋金明, 张辉. 南沙海区生物单体脂类碳同位素研究[J]. 中国科学(D辑), 2004, 47(9): 889-894. DUAN Y, SONG J M, ZHANG H. Carbon isotopic studies of individual lipids in organisms from the Nansha sea area, China[J]. Science in China Series D:Earth Sciences, 2004, 47(7): 593-598. |
| [20] |
刘玉萍, 王延华, 杨浩. 脂肪酸单体碳同位素的沉积学记录及其环境意义[J]. 水土保持研究, 2017, 24(6): 376-381. LIU Y P, WANG Y H, YANG H. Fatty acid distribution and compound-specific characteristics of carbon isotopic records in the sediments and environmental significance[J]. Research of Soil and Water Conservation, 2017, 24(6): 376-381. |
| [21] |
SCHOUTEN S, BRETELER W C M K, BLOKKER P, et al. Biosynthetic effects on the stable carbon isotopic compositions of algal lipids:implications for deciphering the carbon isotopic biomarker record[J]. Geochimica et Cosmochimica Acta, 1998, 62(8): 1397-1406. DOI:10.1016/S0016-7037(98)00076-3 |
| [22] |
SUN M Y, ZOU L, DAI J H, et al. Molecular carbon isotopic fractionation of algal lipids during decomposition in natural oxic and anoxic seawaters[J]. Organic Geochemistry, 2004, 35(8): 895-908. DOI:10.1016/j.orggeochem.2004.04.001 |
| [23] |
FANG J S, BARCELONA M J, ABRAJANO T, et al. Isotopic composition of fatty acids of extremely piezophilic bacteria from the Mariana Trench at 11, 000m[J]. Marine Chemistry, 2002, 80(1): 1-9. |
| [24] |
VALENTINE D L, CHIDTHAISONG A, RICE A, et al. Carbon and hydrogen isotope fractionation by moderately thermophilic methanogens[J]. Geochimica et Cosmochimica Acta, 2004, 68(7): 1571-1590. DOI:10.1016/j.gca.2003.10.012 |
| [25] |
LEAVITT W D, FLYNN T M, SUESS M K, et al. Transhydrogenase and growth substrate influence lipid hydrogen isotope ratios in Desulfovibrio alaskensis G20[J]. Frontiers in Microbiology, 2016, 7: 918. |
| [26] |
FRANCIS C A, TEBO B M. Enzymatic manganese (Ⅱ) oxidation by metabolically dormant spores of diverse Bacillus species[J]. Applied and Environmental Microbiology, 2002, 68(2): 874-880. |
| [27] |
ZHUANG W Q, TAY J H, MASZENAN A M, et al. Importance of Gram-positive naphthalene-degrading bacteria in oil-contaminated tropical marine sediments[J]. Letters in Applied Microbiology, 2003, 36(4): 251-257. DOI:10.1046/j.1472-765X.2003.01297.x |
| [28] |
惠明, 窦丽娜, 田青, 等. 枯草芽孢杆菌的应用研究进展[J]. 安徽农业科学, 2008, 36(27): 11623-11624, 11627. HUI M, DOU L N, TIAN Q, et al. Advances in application research of Bacillus subtilis[J]. Journal of Anhui Agricultural Sciences, 2008, 36(27): 11623-11624, 11627. DOI:10.3969/j.issn.0517-6611.2008.27.002 |
| [29] |
KATO C, QURESHI M H. Pressure response in deep-sea piezophilic bacteria[J]. Journal of Molecular Microbiology and Biotechnology, 1999, 1(1): 87-92. |
| [30] |
FANG J S, FINDLAY R H. The use of a classic lipid extraction method for simultaneous recovery of organic pollutants and microbial lipids from sediments[J]. Journal of Microbiological Methods, 1996, 27(1): 63-71. DOI:10.1016/0167-7012(96)00929-3 |
| [31] |
SESSIONS A L. Isotope-ratio detection for gas chromatography[J]. Journal of Separation Science, 2006, 29(12): 1946-1961. DOI:10.1002/(ISSN)1615-9314 |
| [32] |
WANG J N, LI J T, DASGUPTA S, et al. Alterations in membrane phospholipid fatty acids of Gram-positive piezotolerant bacterium Sporosarcina sp. DSK25 in response to growth pressure[J]. Lipids, 2014, 49(4): 347-356. |
| [33] |
NOGI Y, KATO C, HORIKOSHI K. Psychromonas kaikoae sp. nov., a novel piezophilic bacterium from the deepest cold-seep sediments in the Japan Trench[J]. International Journal of Systematic and Evolutionary Microbiology, 2002, 52(5): 1527-1532. |
| [34] |
DELONG E F, YAYANOS A A. Biochemical function and ecological significance of novel bacterial lipids in deep-sea procaryotes[J]. Applied and Environmental Microbiology, 1986, 51(4): 730-737. |
| [35] |
NORTHROP D B. Unusual origins of isotope effects in enzyme-catalysed reactions[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2006, 361(1472): 1341-1349. DOI:10.1098/rstb.2006.1875 |
| [36] |
WAKIL S J, STOOPS J K, JOSHI V C. Fatty acid synthesis and its regulation[J]. Annual Review of Biochemistry, 1983, 52: 537-579. DOI:10.1146/annurev.bi.52.070183.002541 |
| [37] |
RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie, 2004, 86(11): 807-815. DOI:10.1016/j.biochi.2004.09.017 |
| [38] |
MONSON K D, HAYES J M. Carbon isotopic fractionation in the biosynthesis of bacterial fatty acids. Ozonolysis of unsaturated fatty acids as a means of determining the intramolecular distribution of carbon isotopes[J]. Geochimica et Cosmochimica Acta, 1982, 46(2): 139-149. DOI:10.1016/0016-7037(82)90241-1 |
| [39] |
MORIARTY D J W, HAYWARD A C. Ultrastructure of bacteria and the proportion of Gram-negative bacteria in marine sediments[J]. Microbial Ecology, 1982, 8(1): 1-14. |
| [40] |
GONTANG E A, FENICAL W, JENSEN P R. Phylogenetic diversity of gram-positive bacteria cultured from marine sediments[J]. Applied and Environmental Microbiology, 2007, 73(10): 3272-3282. DOI:10.1128/AEM.02811-06 |
| [41] |
FANG J S, KATO C, RUNKO G M, et al. Predominance of viable spore-forming piezophilic bacteria in high-pressure enrichment cultures from~1.5 to 2.4 km-deep coal-bearing sediments below the ocean floor[J]. Frontiers in Microbiology, 2017, 8: 137. |
| [42] |
方家松, 张利. 探索深部生物圈[J]. 中国科学:地球科学, 2011, 54(6): 750-759. FANG J S, ZHANG L. Exploring the deep biosphere[J]. Science China Earth Sciences, 2011, 54(2): 157-165. |
2. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology, Qingdao 266235, Shandong, China;
3. Department of Natural Sciences, Hawaii Pacific University, Honolulu, HI 96813, U. S. A;
4. State Key Laboratory of Biogeology and Environmental Geology, China University ofGeosciences, Wuhan 430074, Hubei, China;
5. Faculty ofEarth Sciences, China University ofGeosciences, Wuhan 430074, Hubei, China;
6. State Key Laboratory ofgeological processes and Mineral Resources, China University ofGeosciences, Wuhan 430074, Hubei, China
 2018,
Vol. 27
2018,
Vol. 27


