2. 上海海洋大学 农业农村部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
随着水产养殖规模不断增加,养殖过程中产生的固体废弃物所引发的水质恶化和环境污染等问题日益突出[1-2]。如何有效控制固体废弃物排放,实现其资源化利用,是我国水产养殖业可持续发展进程中面临的重要课题之一。
生物絮凝技术基于城市污水处理中活性污泥技术,通过提高水体碳氮比(C/N)促使异养细菌数量优势生长[3],利用异养细菌同化氨氮,大量的异养细菌群落与浮游动植物、悬浮颗粒物通过絮凝作用形成微生物絮团[4],微生物絮团可以作为饲料再次进行投喂。生物絮凝技术被证明可以提高饲料蛋白的利用效率,实现固体废弃物的资源化利用[5-6]。
pH不仅直接影响处理过程中活性污泥微生物的种类、数量、代谢方式和代谢产物的类型、表面特性,而且与活性污泥的沉降性和沉降过程密切相关[7-9]。本实验拟利用悬浮式生物反应器培养微生物絮团,研究不同pH对微生物絮团的营养组分、活性及氨氮转化效率的影响,希望能为水产养殖固体废弃物的处理和资源化利用提供参考。
1 材料与方法 1.1 悬浮式生物反应器自制悬浮式微生物反应器装置参考LU等[10],有机玻璃材质,桶状,有效体积为10 L,高为100.0 cm,内径为15.0 cm,外径为15.8 cm(图 1)。烧瓶实验采用玻璃锥形瓶反应器,有效体积2 L。烧瓶实验取9个相同的玻璃锥形瓶,曝气设备为ACO-008B型电磁式空气泵(功率135 W、曝气量100 L/min)分接9个相同规格的石英砂曝气石,为反应器提供相同溶解氧浓度和混合强度。

|
1.空气泵;2.曝气石;3.排水口 1.Air pump; 2. Aerolite; 3. Discharge port 图 1 培养絮团用的悬浮式微生物反应器示意图 Fig. 1 Schematic diagram of suspended growth reactors |
养殖固体废弃物收集于上海海洋大学循环水养殖系统研究平台中高体革
取50 g烘干(105 ℃)粉状高体革
|
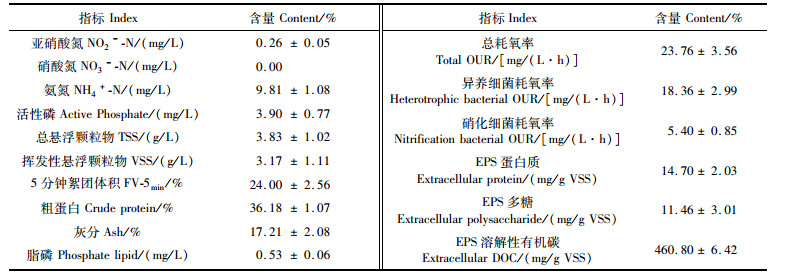
表 1 微生物絮团培养10 d后反应器中水质、絮团性能和营养指标(平均数±标准差) Tab.1 The indexes of water quality and bioflocs after 10 days of cultivating (Mean± SD) |
培养后的微生物絮团悬浊液均匀转入9个洁净的2 L玻璃锥形瓶,锥形瓶内放入石英砂曝气石间歇式曝气30 min。用10% HCl、10% NaOH和20% NaHCO3溶液分别调控pH为6.5、7.5、8.5共3个处理组[12-14],每组3个平行。每日进行氨氮、亚硝酸氮、硝酸氮及细菌相关指标检测,连续监测5 d,其间不添加碳源,比较不同pH条件下锥形瓶中的主要氮素指标和细菌组成变化情况。
1.4 分析项目与测定方法 1.4.1 水质指标水质分析于每日上午进行:水样经0.45 μm滤膜过滤后,用N-(1-萘基)-乙二胺光度法测亚硝酸氮(NO2--N)、紫外分光光度法测硝酸氮(NO3--N)、纳氏试剂分光光度法测总氨氮(total ammonium nitrogen, TAN)、钼锑抗分光光度法测溶解性磷酸盐、用TOC-V·CPH型有机碳分析仪测定DOC、过硫酸钾氧化-紫外分光光度法测总氮(total nitrogen, TN)[15]。温度、溶解氧、pH、氧化还原电位用YSI556MPS多参数水质测定仪测定。总无机氮(total inorganic nitrogen, TIN)为NO2--N、NO3--N、TAN之和,总有机氮(TON)为TN与TIN之差。
1.4.2 絮团活性指标耗氧速率(oxygen uptake rate,OUR)测定方法:添加NaClO3、ATU抑制剂,用YSI 5000直接测定[16],采用钼锑抗分光光度法测定脂磷[17-18]。
1.4.3 絮团沉降性能与营养指标[19]5分钟内沉降絮团体积与混合液总体积比例为5分钟絮团体积指数(FV-5min),滤纸烘干法测定混合液悬浮固体浓度(mixed liquor suspended solid,MLSS),马弗炉(400~550 ℃)灼烧法测挥发性悬浮固体浓度(volatile suspended solids,VSS);凯氏定氮法测絮团粗蛋白含量;马弗炉(400~550 ℃)灼烧法测粗灰分含量。
采用甲酰胺提取絮团胞外聚合物(extracellular polymeric substances,EPS)[20],以葡萄糖为标准采用苯酚-硫酸法测定胞外多糖;以牛血清白蛋白为标准采用Bradford法测定胞外蛋白质[21]。
1.5 数据分析采用Microsoft Excel和Origin进行数据分析,以平均值±标准差(Mean± SD)表示。
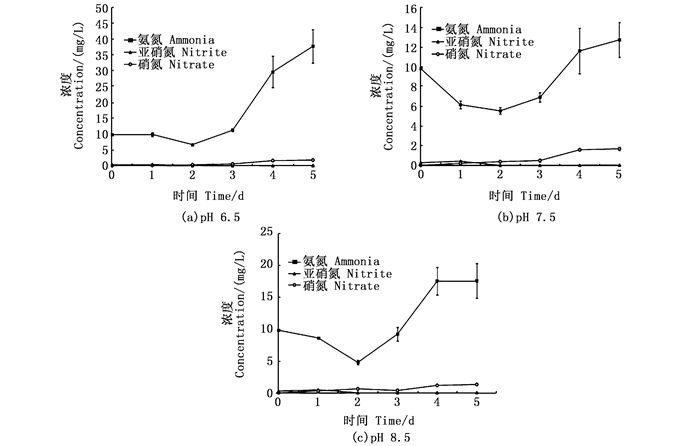
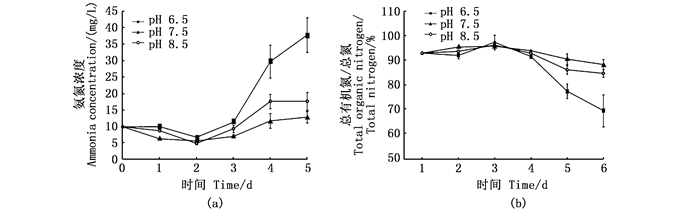
2 结果与分析 2.1 不同pH对反应器中氮、磷的影响 2.1.1 主要氮素指标如图 2所示,3个处理组中亚硝酸盐氮浓度都接近0 mg/L。3个实验组的硝酸盐氮浓度在实验后期逐渐升高,但积累不明显。不同pH对反应器中总氨氮浓度变化较大,都呈升高趋势,实验开始的总氨氮浓度为9.81 mg/L,实验结束时pH 6.5、pH 7.5、pH 8.5组的总氨氮浓度分别为37.71、12.74、17.55 mg/L。pH 6.5组的总氨氮浓度显著高于pH 7.5、pH 8.5组,pH 6.5组的总有机氮占总氮百分比下降明显,且显著低于pH 7.5、pH 8.5组(图 3)。结果表明,pH 7.5、pH 8.5组的总氨氮向有机氮转化率高于pH 6.5组。
|
图 2 不同pH处理组中亚硝酸盐氮(NO2--N)、硝酸盐氮(NO3--N)和总氨氮(TAN)浓度的变化 Fig. 2 Change of the concentration of nitrite-N, nitrate-N and total ammonium nitrogen (TAN) in three groups |
|
图 3 不同pH处理组中总氨氮浓度(TAN, a)和总溶解有机氮与总氮的比值(TON/TN, b)的变化 Fig. 3 Change of the concentration of total ammonia nitrogen (a) and TON/TN (b) in different pH groups |
不同pH实验组中溶解性磷酸盐去除效果都较好(图 4)。pH 6.5、pH 7.5、pH 8.5组的溶解性磷酸盐去除速率分别为1.29、0.92、0.80 mg/(L·d)。pH 6.5组的溶解性磷酸盐的去除率最高,但pH 6.5组的溶解性磷酸盐浓度显著高于pH 7.5、pH 8.5中溶解性磷酸盐浓度。

|
图 4 不同pH处理组中溶解性磷酸盐浓度变化 Fig. 4 Change of the concentration of dissolved phosphate in different pH groups |
不同pH实验组的脂磷含量变化趋势相似(图 5),组间差异不显著。脂类含量随着pH增大而升高,但差异不显著。

|
图 5 不同pH反应器中微生物絮团脂磷含量的变化 Fig. 5 Change of the phosphate lipid content of microbial flocs in different pH reactor |
本文用OUR表示微生物活性。如图 6所示,不同pH组的总微生物耗氧率、异养细菌耗氧率逐渐增加,各pH实验组间无显著差异。3个pH组的硝化细菌耗氧率都处于较低水平,各组间无差异性。可看出,在不同pH组中,硝化细菌的活性显著低于异养细菌的活性,异养细菌活性略低于总微生物活性,其中pH 6.5组的总微生物耗氧率、异养细菌耗氧率以及硝化细菌耗氧率都略高于pH 7.5和8.5组。

|
图 6 不同pH反应器中微生物絮团总微生物耗氧率(总-UUR, a)、异养细菌耗氧率(异-OUR, b)和硝化细菌耗氧率(硝-OUR, c)的变化 Fig. 6 Change of the total oxygen uptake rates (OUR) of the total bacteria, heterotrophic bacteria and the nitrifying bacteria in the microbial flocs in the three pH groups |
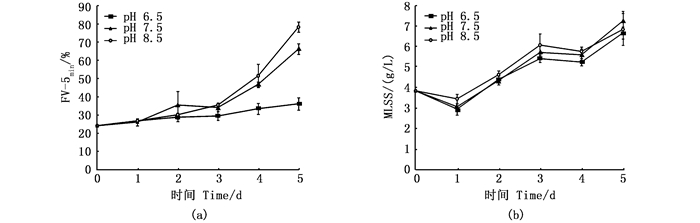
不同pH对微生物絮团沉降比影响较大(图 7a)。3个pH组的FV-5min都呈上升趋势,实验结束时pH 6.5、pH 7.5、pH 8.5组的FV-5min分别为36%、66%、78%。可以看出,FV-5min值随着pH增大而升高。如图 7b所示,3个pH反应器中微生物絮团的MLSS含量逐渐上升,各组间无显著差异,表明不同pH条件下,微生物絮团的有机物含量差异不明显。pH对微生物絮团FV-5min的影响较明显,pH 6.5组的微生物絮团沉降性能明显优于pH 7.5和pH 8.5组的微生物絮团。
|
图 7 不同pH反应器中5分钟絮团体积(FV-5min, a)和混合液悬浮固体浓度(MLSS, b)的变化 Fig. 7 Change of the FV-5min of microbial flocs and mixed liquor suspended solid (MLSS) in different pH reactors |
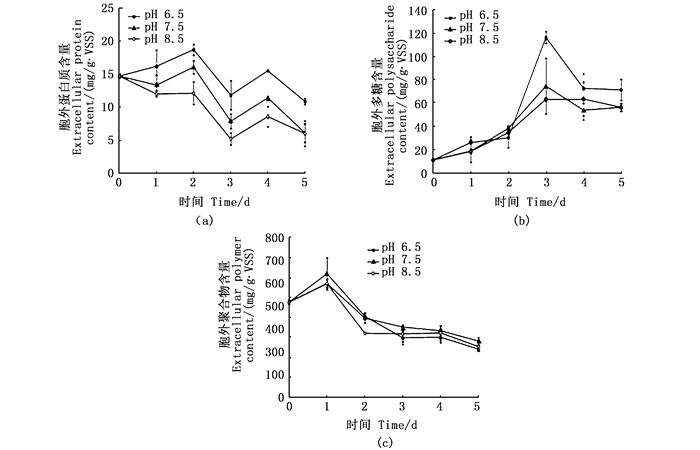
3个pH组生物絮团的胞外蛋白质、胞外多糖含量变化趋势相同(图 8a和b),其中pH 6.5组中生物絮团的胞外蛋白质、胞外多糖含量最高,pH 8.5组中生物絮团的胞外蛋白质含量最低。不同pH对絮团胞外多糖含量影响较小(图 8b)。实验期间,各pH组的EPS总有机碳含量基本保持稳定,其中pH 6.5组的EPS总有机碳含量略高于pH 7.5、pH 8.5组,且差异不显著(图 8c)。
|
图 8 不同pH处理组中微生物絮团胞外聚合物粗蛋白质含量(a)、多糖含量(b)和总量(c)的变化 Fig. 8 Changes of crude protein (a), polysaccharide (b) of the EPS and the total EPS content of microbial flocs in different pH groups |
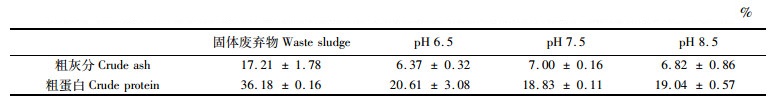
由表 2可知:pH 6.5组的灰分含量略低于pH 7.5组和pH 8.5组,但无显著差异;pH 6.5组的微生物絮团粗蛋白含量高于pH 7.5、pH 8.5组。与实验启动时所用高体革
|
表 2 不同pH处理组中微生物絮团的粗灰分和粗蛋白含量(平均值±方差) Tab.2 The crude ash and crude protein content of microbial flocs in different pH reactors (Mean± SD) |
本实验研究了不同pH对微生物絮团活性、营养组分及氨氮转化效率的影响。不同pH反应器中亚硝酸盐氮、硝酸盐氮浓度都较低,表明实验期间硝化作用较弱,这符合生物絮团养殖水体中以氨氮异养同化过程为主的特征[31]。絮团主要由细菌等微生物组成,死亡的细菌会被降解而产生氨氮,可能会造成氨氮的再释放[5]。本实验各处理组中均存在总氨氮的明显积累,这可能是因为絮团释放氨氮的速率大于异养细菌同化氨氮的速率。
pH 6.5组的溶解性磷酸盐的去除率最高,这可能是由于pH降低会导致微生物细胞结构和功能破坏,细胞内聚磷在酸性条件下被水解,磷释放;若pH升高,碱性环境下会产生磷酸盐沉淀,使部分磷沉积到了菌胶团表面,不利于磷的去除[22]。从整个实验过程来看,pH为6.5~8.5时,序批式反应器培养的微生物絮团对溶解性磷酸盐去除效果较好,原因可能是间歇式曝气的厌氧和好氧阶段符合聚凝菌厌氧放磷和好氧吸磷的生物特性,有利于聚凝菌充分发挥除磷作用[23]。
图 6表明,絮团总OUR主要来自于异养细菌OUR,表明异养细菌是微生物絮团微生物中的优势菌群。本实验表明微生物絮团的EPS含量与pH关系密切:pH 6.5组的EPS总量、胞外蛋白质含量和胞外多糖含量都高于pH 7.5、pH 8.5组,表明pH为6.5的弱酸性环境更利于微生物絮团中EPS、胞外蛋白、胞外多糖的合成。这与郑蕾等[32]的实验结果EPS浓度及多糖、蛋白质浓度均随pH的增大而升高不一致。可能原因是本研究中提取EPS的样品是反应器中的混合液,而非过滤后的微生物絮团。李延军等[33]研究得出好氧颗粒污泥体系上清液中EPS含量的变化不同于颗粒污泥,酸性条件下EPS含量最大,碱性条件下的EPS含量与中性条件差别不大。研究提取出的EPS含量主要以多糖为主,这与程丽妹等[34]的研究结论相符。
实验结束时3个处理组的微生物絮团粗蛋白含量都显著下降,主要原因是实验期间未向反应器补充氮源。絮团的粗蛋白主要由菌体蛋白组成。菌体死亡后,菌体蛋白中的氮被降解成氨氮,溶解在水中,因此,絮团粗蛋白含量降低,水体中氨氮浓度升高[5, 35]。
不同pH对微生物絮团的灰分含量和粗蛋白含量影响较小。pH 6.5组培养的生物絮团的沉降性能较好、粗蛋白含量最高且有机成分含量较高。这与之前得到的pH 6.5组培养的微生物絮团的总微生物活性、异养细菌活性、硝化细菌活性以及EPS含量都高于pH 7.5、pH 8.5组的结果一致。
| [1] |
农业部渔业局. 中国渔业统计年鉴(2013)[M]. 北京: 中国农业出版社, 2013. The People's Republic of China Ministry of Agriculture, Fisheries Bureau. China fishery statistical yearbook (2013)[M]. Beijing: China Agriculture Press, 2013. |
| [2] |
刘长发, 綦志仁, 何洁, 等. 环境友好的水产养殖业-零污水排放循环水产养殖系统[J]. 大连水产学院学报, 2002, 17(3): 220-226. LIU C F, QI Z R, HE J, et al. Environmental friendship aquaculture-Zero discharge integrated recirculating aquaculture systems[J]. Journal of Dalian Fisheries University, 2002, 17(3): 220-226. DOI:10.3969/j.issn.1000-9957.2002.03.008 |
| [3] |
赵清, 张珞平. 海水养殖自身污染的定量化研究[J]. 海洋环境科学, 2004, 23(3): 77-80. ZHAO Q, ZHANG L P. Study on quantitative methods of self-pollution of mariculture[J]. Marine Environmental Science, 2004, 23(3): 77-80. DOI:10.3969/j.issn.1007-6336.2004.03.022 |
| [4] |
AVNIMELECH Y. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 1999, 176(3/4): 227-235. |
| [5] |
HARGREAVES J A. Biofloc production systems for aquaculture[R]. Southern Regional Aquaculture Center Publication, 2013.
|
| [6] |
LUO G Z, ZHANG N, TAN H X, et al. Efficiency of producing bioflocs with aquaculture waste by using poly-β-hydroxybutyric acid as a carbon source in suspended growth bioreactors[J]. Aquacultural Engineering, 2017, 76: 36-40. |
| [7] |
ZHANG K Q, PAN L Q, CHEN W B, et al. Effect of using sodium bicarbonate to adjust the pH to different levels on water quality, the growth and the immune response of shrimp Litopenaeus vannamei reared in zero-water exchange biofloc-based culture tanks[J]. Aquaculture Research, 2017, 48(3): 1194-1208. DOI:10.1111/are.12961 |
| [8] |
魏佳虹, 孙宝盛, 赵双红, 等. pH对SBR处理效果及活性污泥微生物群落结构的影响[J]. 环境工程学报, 2017, 11(3): 1953-1958. WEI J H, SUN B S, ZHAO S H, et al. Effect of pH on operational performance and microbial community structure of activated sludge of SBR[J]. Chinese Journal of Environmental Engineering, 2017, 11(3): 1953-1958. |
| [9] |
璩绍雷, 孙宝盛, 赵双红, 等. pH对间歇进水序批式生物反应(SBR)工艺活性污泥沉降性能和微生物结构的影响[J]. 环境化学, 2016, 35(3): 508-515. QU S L, SUN B S, ZHAO S H, et al. pH activated sludge sedimentation performance and the structure of the microbe of SBR technology[J]. Environmental Chemistry, 2016, 35(3): 508-515. |
| [10] |
LU L, TAN H X, LUO G Z, et al. The effects of Bacillus subtilis on nitrogen recycling from aquaculture solid waste using heterotrophic nitrogen assimilation in sequencing batch reactors[J]. Bioresource Technology, 2012, 124: 180-185. DOI:10.1016/j.biortech.2012.07.084 |
| [11] |
潘云峰, 罗国芝, 谭洪新, 等. 不同碳源对水产养殖固体颗粒物生物絮凝效果的比较[J]. 水处理技术, 2011, 37(11): 20-25. PAN Y F, LUO G Z, TAN H X, et al. The comparison of different carbon sources impact on the bioflocs formation of solid waste of aquaculture[J]. Technology of Water Treatment, 2011, 37(11): 20-25. |
| [12] |
周健, 罗勇, 龙腾锐, 等. 胞外聚合物、Ca2+及pH值对生物絮凝作用的影响[J]. 中国环境科学, 2004, 24(4): 437-441. ZHOU J, LUO Y, LONG T R, et al. Effects of extracelluar polymeric substances, Ca2+ and pH on bioflocculation[J]. China Environmental Science, 2004, 24(4): 437-441. DOI:10.3321/j.issn:1000-6923.2004.04.012 |
| [13] |
王振华, 谷坚, 管崇武, 等. 几种碱性试剂对循环水养殖系统中pH调节的研究[J]. 中国农学通报, 2010, 26(1): 308-311. WANG Z H, GU J, GUAN C W, et al. Study of pH value adjustment using alkaline reagents in the recirculating aquaculture system[J]. Chinese Agricultural Science Bulletin, 2010, 26(1): 308-311. |
| [14] |
雷宁. pH值、碱度对化工污水脱氮工艺的影响[J]. 甘肃科技, 2011, 27(1): 27-31, 142. LEI N. Influence of pH value and alkalinity on chemical wastewater denitrification process[J]. Gansu Science and Technology, 2011, 27(1): 27-31, 142. DOI:10.3969/j.issn.1000-0952.2011.01.012 |
| [15] |
国家环境保护局. 水和废水监测分析方法[M]. 3版. 北京: 中国环境科学出版社, 1989. State Environmental Protection Administration of China. Methods of monitoring and analyzing for water and wastewater[M]. 3rd ed. Beijing: China Environmental Science Press, 1989. |
| [16] |
陈曦, 戴兴春, 黄民生, 等. A2/O系统PHB和OUR监测及其分析研究[J]. 工业水处理, 2009, 29(9): 77-80. CHEN X, DAI X C, HUANG M S, et al. Study on PHB and OUR monitoring and analysis in A2/O system[J]. Industrial Water Treatment, 2009, 29(9): 77-80. DOI:10.3969/j.issn.1005-829X.2009.09.023 |
| [17] |
于鑫, 张晓键, 王占生. 饮用水生物处理中生物量的脂磷法测定[J]. 给水排水, 2002, 28(5): 1-5. YU X, ZHANG X J, WANG Z S. Biomass examination by Lipid'P method for drinking water bio treatment[J]. Water&Wastewater Engineering, 2002, 28(5): 1-5. |
| [18] |
魏谷, 于鑫, 叶林, 等. 脂磷生物量作为活性生物量指标的研究[J]. 中国给水排水, 2007, 23(9): 1-4. WEI G, YU X, YE L, et al. Study on lipid-P as viable biomass indicator[J]. China Water&Wastewater, 2007, 23(9): 1-4. DOI:10.3321/j.issn:1000-4602.2007.09.001 |
| [19] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007. ZHANG L Y. Analysis of the quality of feed and feed detection technology[M]. 3rd ed. Beijing: China Agricultural University Press, 2007. |
| [20] |
ADAV S S, LEE D J. Extraction of Extracellular polymeric substances from aerobic granule with compact interior structure[J]. Journal of Hazardous Materials, 2008, 154(1/3): 1120-1126. |
| [21] |
ZHANG B, SUN B S, JIN M, et al. Extraction and analysis of extracellular polymeric substances in membrane fouling in submerged MBR[J]. Desalination, 2008, 227(1/3): 286-294. |
| [22] |
彭赵旭, 彭永臻, 于振波, 等. 活性污泥系统对环境pH值变化的响应[J]. 哈尔滨商业大学学报(自然科学版), 2011, 27(4): 539-543. PENG Z X, PENG Y Z, YU Z B, et al. Responses of activated sludge system to variation of pH value[J]. Journal of Harbin University of Commerce (Natural Sciences Edition), 2011, 27(4): 539-543. DOI:10.3969/j.issn.1672-0946.2011.04.007 |
| [23] |
WHANG L M, FILIPE C D M, PARK J K. Model-based evaluation of competition between polyphosphate-and glycogen-accumulating organisms[J]. Water Research, 2007, 41(6): 1312-1324. DOI:10.1016/j.watres.2006.12.022 |
| [24] |
LAZAROVA V, MANEM J. Biofilm characterization and activity analysis in water and wastewater treatment[J]. Water Research, 1995, 29(10): 2227-2245. DOI:10.1016/0043-1354(95)00054-O |
| [25] |
桑军强, 王志农, 李福志, 等. 饮用水生物处理中微生物量和活性的测定方法[J]. 环境污染治理技术与设备, 2005, 6(8): 88-90. SANG J Q, WANG Z N, LI F Z, et al. Measurement of biomass and microbial activity in the biological treatment process of drinking water[J]. Techniques and Equipment for Environmental Pollution Control, 2005, 6(8): 88-90. |
| [26] |
GARCIA-OCHOA F, GOMEZ E, SANTOS V E, et al. Oxygen uptake rate in microbial processes:an overview[J]. Biochemical Engineering Journal, 2010, 49(3): 289-307. DOI:10.1016/j.bej.2010.01.011 |
| [27] |
WINGENDER J, NEU T R, FLEMMING H C. What are bacterial extracellular polymeric substances?[M]//WINGENDER J, NEU T R, FLEMMING H C. Microbial Extracellular Polymeric Substances: Characterization, Structure and Function. Berlin, Herdelberg: Springer, 1999: 1-19.
|
| [28] |
LIU H, FANG H H P. Characterization of electrostatic binding sites of Extracellular Polymers by linear programming analysis of titration data[J]. Biotechnology and Bioengineering, 2002, 80(7): 806-811. DOI:10.1002/bit.10432 |
| [29] |
SHENG G P, YU H Q, LI X Y. Extracellular polymeric substances (EPS) of microbial aggregates in biological wastewater treatment systems:a review[J]. Biotechnology Advances, 2010, 28(6): 882-894. DOI:10.1016/j.biotechadv.2010.08.001 |
| [30] |
YU G H, HE P J, SHAO L M, et al. Extracellular proteins, polysaccharides and enzymes impact on sludge aerobic digestion after ultrasonic pretreatment[J]. Water Research, 2008, 42(8/9): 1925-1934. |
| [31] |
杨旭楠, 林兴锐, 符诗雨, 等. 感潮河流沉积物中溶解氧对硝化细菌垂向分布的影响[J]. 中山大学学报(自然科学版), 2013, 52(5): 91-96. YANG X N, LIN X R, FU S Y, et al. Effect of dissolved oxygen on the vertical distribution of nitrifying bacteria in Tidal River Sediment[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2013, 52(5): 91-96. |
| [32] |
郑蕾, 田禹, 孙德智. pH值对活性污泥胞外聚合物分子结构和表面特征影响研究[J]. 环境科学, 2007, 28(7): 1507-1511. ZHENG L, TIAN Y, SUN D Z. Effects of pH on the surface characteristics and molecular structure of extracellular polymeric substances from activated sludge[J]. Environmental Science, 2007, 28(7): 1507-1511. DOI:10.3321/j.issn:0250-3301.2007.07.017 |
| [33] |
李延军, 李秀芬, 华兆哲, 等. 好氧颗粒污泥胞外聚合物的产生及其分布[J]. 环境化学, 2006, 25(4): 439-443. LI Y J, LI X F, HUA Z Z, et al. Production of extracellular polymeric substances from aerobic granular sludge and its distribution[J]. Environmental Chemistry, 2006, 25(4): 439-443. DOI:10.3321/j.issn:0254-6108.2006.04.011 |
| [34] |
程丽妹, 陈家捷, 高锦芳, 等. 生物絮凝-罗非鱼养殖系统启动阶段絮体胞外聚合物、粗蛋白和总氨基酸变化[J]. 淡水渔业, 2018, 48(1): 69-74. CHENG L M, CHEN J J, GAO J F, et al. Changes of EPS, protein and amino acids in bioflocs during the start-up period of a biofloc system for tilapia cultivation[J]. Freshwater Fisheries, 2018, 48(1): 69-74. DOI:10.3969/j.issn.1000-6907.2018.01.011 |
| [35] |
姚妙兰, 罗国芝, 谭洪新, 等. 两种不同方法处理粪便对生物絮团组分的影响[J]. 上海海洋大学学报, 2018, 27(4): 494-501. YAO M L, LUO G Z, TAN H X, et al. Effect of processing fish droppings in two different ways on biofloc components[J]. Journal of Shanghai Ocean University, 2018, 27(4): 494-501. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture and Rural Affairs, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


