2. 上海大自然水族研究所, 上海 200090;
3. 水域环境生态上海高校工程研究中心, 上海 201306
类胡萝卜素是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌和藻类的黄色、橙红色或红色的色素之中[1],具有保健视觉系统[2]和皮肤组织、抵抗不良环境等功能。研究表明,金鱼体色的形成取决于从食物中获取的色素含量[3-4],其中,类胡萝卜素含量是最主要的因素之一。目前从植物体内提取类胡萝卜素的工艺研究[5-8]取得长效进展,但尚缺少对鱼类体内类胡萝卜素提取工艺的研究报道。
红草金鱼(red Carassius auratus)作为金鱼的主要品系之一,因其具有艳丽的色彩、适应性以及抗病力强、食性广且饲养简便等优点,深受观赏鱼爱好者的喜爱。目前,已有关于富含类胡萝卜素的物质影响红草金鱼体色变化的实验研究且取得成果[9-10],但对其体内类胡萝卜素提取工艺的研究比较少。因此,本实验以红草金鱼为研究对象,探究不同提取工艺对其体内类胡萝卜素提取效果的差异性,优选出最佳的提取条件,为今后金鱼色素提取及有关研究与应用等工作提供理论依据。
1 材料与方法 1.1 实验材料红草金鱼购自上海市浦东新区泥城日升花卉水族馆,鱼龄为9~10个月,体长5.0~8.0 cm,体质量为2.5~4.5 g,实验鱼共200尾。实验用鱼为经处理剪碎的红草金鱼鲜样和经120 ℃恒温鼓风干燥箱干燥2 h后的红草金鱼干样。
1.2 实验仪器主要仪器:电热恒温鼓风干燥箱(DHG-9036A),电子天平(FA2004-200 g),4 000 r/min离心机(TDL-6A),紫外-可见分光光度计(UV-2000);主要试剂:丙酮(分析纯),95%乙醇(分析纯)。
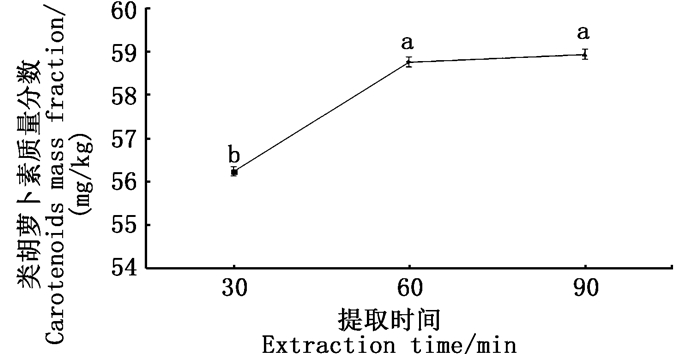
1.3 检测方法以类胡萝卜素总量为指标测定红草金鱼的色素含量,在紫外分光光度计436 nm波长[11-12]处进行测定,记录各组色素萃取液的吸光度值后计算各组金鱼总类胡萝卜素的质量分数:
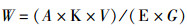 (1)
(1)
式中:W为类胡萝卜素质量分数,mg/kg;A为吸光度值;K为常数(104);V为提取液的体积,mL;E为摩尔消光系数(2 500);G为样品质量,g。
采用Excel软件进行数据处理,SPSS 17.0软件进行差异性分析,PRISM软件进行绘图。
1.4 实验设计以红草金鱼为实验对象,其体内类胡萝卜素含量为测定指标,进行色素提取效果的差异性研究,通过单因素试验和正交试验,确定不同提取方式:提取样品、提取料液比、提取时间、提取次数、不同混合萃取剂和提取温度等因素的最佳提取工艺,各因素设置3组平行,结果取平均值。
1.4.1 提取样品分别取0.4 g红草金鱼干样与鲜样,用体积比为1:1的乙醇-丙酮溶液作色素萃取剂,料(g)液(mL)比为1:15,50 ℃的条件下提取60 min,测定不同提取样品对红草金鱼体内类胡萝卜素提取效果的差异。
1.4.2 提取料液比取0.4 g红草金鱼干样,用体积比为1:1的乙醇-丙酮溶液作色素萃取剂,50 ℃的温度下,以5组料(g)液(mL)比分别为1:10、1:15、1:20、1:25和1:30提取60 min,测定不同料液比对红草金鱼体内类胡萝卜素提取效果的差异。
1.4.3 提取时间取0.4 g红草金鱼干样,用体积比为1:1的乙醇-丙酮溶液作色素萃取剂,料(g)液(mL)比1:15,50 ℃的温度下,分别提取30、60和90 min,测定不同提取时间对红草金鱼体内类胡萝卜素提取效果的差异。
1.4.4 提取次数取0.4 g红草金鱼干样,体积比为1:1的乙醇-丙酮溶液作萃取剂,料(g)液(mL)比1:15,50 ℃的温度下提取30 min,然后加入相同的提取溶剂再提取30 min,每次提取时间共60 min,相同条件下提取3次,测定不同提取次数对红草金鱼体内类胡萝卜素提取效果的差异。
1.4.5 萃取剂取0.4 g红草金鱼干样,料(g)液(mL)比1:15,50 ℃的温度下提取60 min,分别以V(乙醇):V(丙酮)=1:0、V(乙醇):V(丙酮)=0:1、V(乙醇):V(丙酮)=1:1、V(乙醇):V(丙酮)=2:1、V(乙醇):V(丙酮)=1:2等5种混合有机溶剂为萃取剂进行提取,测定不同提取试剂对红草金鱼体内类胡萝卜素提取效果的差异。
1.4.6 提取温度取0.4 g红草金鱼干样,体积比为1:1的乙醇-丙酮溶液作萃取剂,料(g)液(mL)比1:15,分别在30、40、50、60、70和80 ℃的温度下提取60 min,测定不同提取温度对红草金鱼体内类胡萝卜素提取效果的差异。
2 结果 2.1 提取样品对提取效率的影响由图 1可得,不同提取样品,类胡萝卜素提取效果呈现极显著差异(P<0.01),干样提取的类胡萝卜素含量(质量分数)为56.16 mg/kg,而鲜样提取的类胡萝卜素含量(质量分数)为9.6 mg/kg。综合分析可得,单因素试验中最佳提取样品为经120 ℃恒温鼓风干燥箱干燥2 h后的红草金鱼干样。
|
图中不同字母表示处理间差异显著(P<0.01) Different letters in the figure mean significant difference at P < 0.01 level 图 1 不同提取样品对提取类胡萝卜素含量的影响 Fig. 1 Effects of different extraction samples on the content of carotenoids extracted |
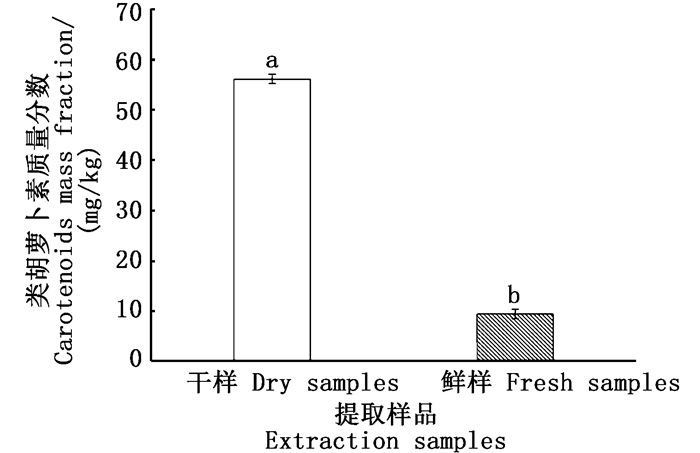
由图 2可得:料(g)液(mL)比为1:10时,类胡萝卜素提取含量(质量分数)为56.04 mg/kg;料(g)液(mL)比为1:15时,类胡萝卜素提取含量(质量分数)最高,为78.12 mg/kg,与其余各组呈现极显著差异(P<0.01);当料(g)液(mL)比为1:20与1:25时,类胡萝卜素提取含量(质量分数)效果不佳,且两组差异性不明显,分别为32.64 mg/kg和31.56 mg/kg;当料(g)液(mL)比为1:30时,所提取的类胡萝卜素含量(质量分数)最低,为23.46 mg/kg。因此,根据单因素试验结果可得最优料(g)液(mL)比为1:15。
|
图中不同字母表示处理间差异显著(P<0.01) Different letters in the figure mean significant difference at P < 0.01 level 图 2 不同料液比对提取的类胡萝卜素含量的影响 Fig. 2 Effects of different solid-liquid ratios on the content of carotenoids extracted |
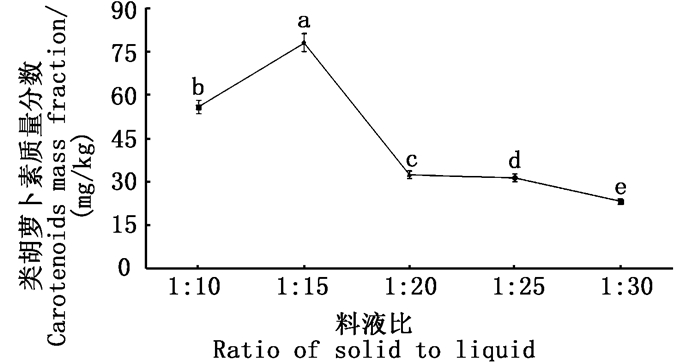
由图 3可得:提取时间为30 min时,类胡萝卜素提取含量(质量分数)为56.22 mg/kg,与其余两组呈显著差异(P<0.05);当提取时间为60 min和90 min时,类胡萝卜素提取含量(质量分数)分别为58.74 mg/kg和58.92 mg/kg,90 min提取效果稍大于60 min,单因素ANOVA过程进行方差分析无显著性差异。因此,根据试验结果, 最佳提取时间为90 min,如实验过程中为节省实验时间,提取时间取60 min为宜。
|
图中不同字母表示各处理组间差异显著(P<0.05) Different letters in the figure mean significant difference at P < 0.05 level 图 3 不同提取时间对提取的类胡萝卜素含量的影响 Fig. 3 Effects of different extraction time on the content of carotenoids extracted |
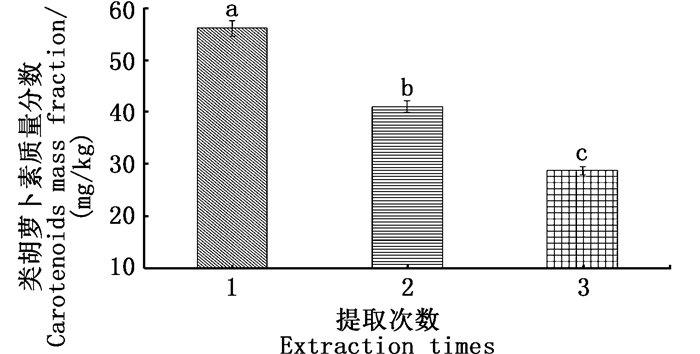
由图 4可得,第一次提取的类胡萝卜素含量(质量分数)为55.98 mg/kg,第二次提取的类胡萝卜素含量(质量分数)为40.98 mg/kg,第三次提取的类胡萝卜素含量(质量分数)为28.69 mg/kg,随着萃取次数的增加,每次提取的类胡萝卜素的含量均比上一次有所减少,且单因素方差分析差异性显著,经过两次提取类胡萝卜素含量占很大比重且综合时间等其他因素,提取次数以两次为宜。
|
图中不同字母表示各处理组间差异显著(P<0.01) Different letters in the figure mean significant difference at P < 0.01 level 图 4 不同提取次数对提取的类胡萝卜素含量的影响 Fig. 4 Effects of different extraction times on the content of carotenoids extracted |
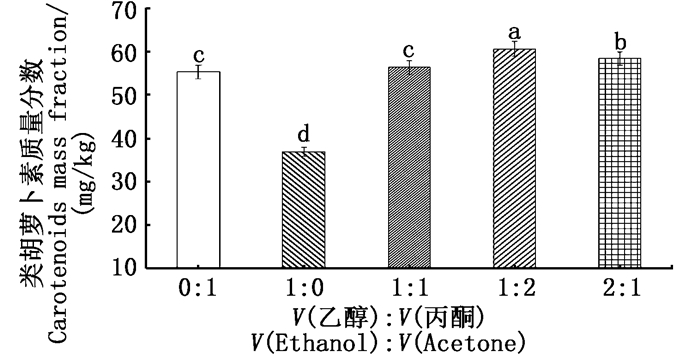
由图 5可得:V(乙醇):V(丙酮)=0:1与1:1时,类胡萝卜素含量(质量分数)为55~57 mg/kg,提取效果无明显差异;V(乙醇):V(丙酮)=1:0时,类胡萝卜素含量(质量分数)仅为36.72 mg/kg,提取效果最差;V(乙醇):V(丙酮)=1:2时,类胡萝卜素含量(质量分数)为61 mg/kg,提取效果最优。单因素方差分析,除V(乙醇):V(丙酮)=2:1外,与其余各组呈现极显著差异(P<0.01)。综合分析,由图 5可知,选用V(乙醇):V(丙酮)=1:2作为萃取剂提取效果最好。
|
图中不同字母表示处理间差异显著(P<0.01) Different letters in the figure mean significant difference at P < 0.01 level 图 5 不同有机溶剂对提取的类胡萝卜素含量的影响 Fig. 5 Effects of different organic solvents on the content of carotenoids extracted |
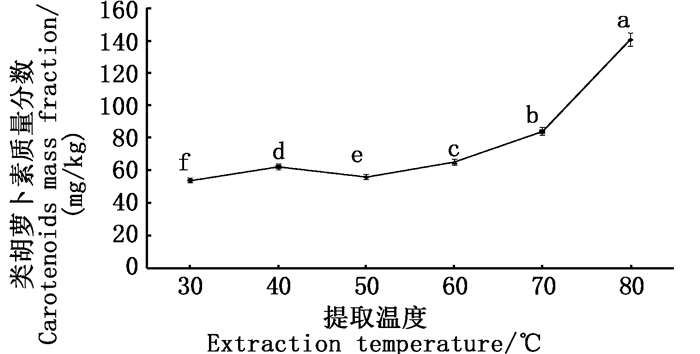
由图 6可得:当提取温度为30~60 ℃时,类胡萝卜素含量并无太大差异,呈平缓趋势;当提取温度为60~80 ℃时,所提取的类胡萝卜素的含量(质量分数)呈递增趋势,在80 ℃时达到最大,为140.58 mg/kg。单因素方差分析,与其余各组均呈现极显著差异(P<0.01),因此提取温度以80 ℃为宜。以上其他影响因素的单因素试验中温度控制在50 ℃,由于实验中控制单一变量,因此对其他因素实验结果与分析并无影响。
|
图中不同字母表示处理间差异显著(P<0.01) Different letters in the figure mean significant difference at P < 0.01 level 图 6 不同提取温度对提取的类胡萝卜素含量的影响 Fig. 6 Effects of different extraction temperature on the content of carotenoids extracted |
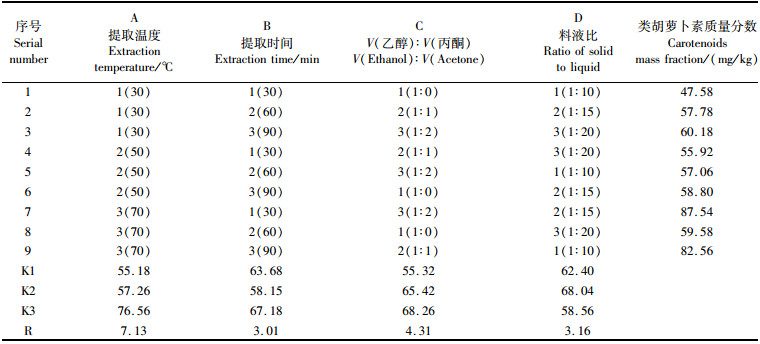
由于单因素试验[13-14]存在单一性与偶然性,为避免实验结果出现较大误差,在单因素试验的基础上进行多因素正交试验。以红草金鱼干样为实验材料,全面考察提取温度、提取时间、混合有机溶剂比及料(g)液(mL)比等4个影响参数的作用大小和优化组合,设计4因素3水平的正交试验,其结果见表 1。
|
表 1 红草金鱼类胡萝卜素提取工艺的L9(34)正交试验结果及其极差分析 Tab.1 L9(34) Orthogonal test results and analysis |
根据单因素试验,当提取温度为50~80 ℃时,所提取的类胡萝卜素含量呈递增趋势,因此正交试验中结合实际的实验条件,最高温度设为70 ℃,取3组等梯度温度作为实验提取温度,即30、50、70 ℃。
从正交试验结果R分析得出,4个因素对红草金鱼体内类胡萝卜素提取效果的影响程度从大到小依次为A、C、D、B,即:提取温度对红草金鱼色素提取的影响最大,其中K3最大,表明水平试验结果A3最优;其次对提取效果影响较大的因素为有机溶液比,其中K3最大,表明水平试验结果C3效果最好;料(g)液(mL)比以K2最大,因此水平试验D2最优;影响最小的因素为提取时间,以K3最大,因此水平试验B3最优。从正交试验结果得出的最佳提取条件为:A3B3C3D2,即最佳提取温度70 ℃、最佳提取时间90 min、最佳有机溶液比1:2、最佳料液比1:15,与单因素试验结果相符合。
3 讨论 3.1 提取温度对红草金鱼类胡萝卜素含量的影响在单因素试验中,提取温度设置的最高温度为80 ℃,且根据SPSS单因素差异性分析,为最佳提取温度,由于实验条件限制未设置更高温度,因此对于类胡萝卜素含量提取的最佳温度是否会更高,将在后续实验中做进一步研究。在正交试验中,由于控制实验变量,因此最高温度设置为70 ℃对实验所得结论并无影响。
单因素试验中,提取温度为80 ℃时提取效果明显大于70 ℃,且正交试验结果表明,在一定温度范围内,提取效果随提取温度呈上升趋势,因此综合考虑两项试验结果,最佳提取温度为80 ℃。
3.2 不同提取条件下的类胡萝卜素含量有较大差别SPSS单因素分析中,提取样品、料液比、提取次数、萃取剂、提取温度均采用显著性水平0.01,且均小于该值,呈极显著水平,表明各最佳提取条件下均可取得最大提取效率。提取时间采用显著性水平0.05且小于该值,呈显著水平,相比其他提取因素显著性差异较低。单因素试验结果表明,提取时间为90 min时类胡萝卜素含量提取效果最佳为58.92 mg/kg,与提取时间为60 min所提取的类胡萝卜素含量无较大差异,如实验时间有限,提取时间可取60 min;正交试验表明,最佳提取时间为90 min,与提取时间30 min以及60 min相比,提取效果明显。因此,综合考虑单因素试验和正交试验结果,最佳提取时间应为90 min。由于单因素试验中控制变量,而正交试验中4个因素相互影响,因此两项试验结果存在差异。
由本实验结果可知,不同提取条件下的类胡萝卜素含量有很大差别,实验中类胡萝卜素含量(质量分数)提取最高可达140.58 mg/kg,但此数据并不是在所有条件均为最佳状态下提取,因此红草金鱼类胡萝卜素可提取的最高含量有待深入研究。本文只对类胡萝卜素的提取进行了研究,因此,最佳提取条件是否同样适用于其他色素提取需进一步实验证明。
3.3 红草金鱼色素以及类胡萝卜素含量及利用情况红草金鱼是重要的观赏鱼类,由于其自身的生活习性以及饲养简单,因此多作为重要的实验材料,黄斌等[9]利用红色草金鱼探究日粮添加芜萍对其生长及体色的影响,结果表明随着饲料中芜萍含量的增加,皮肤中类胡萝卜素含量逐渐上升,红色草金鱼体色更加艳丽。程云生等[10]利用红草金鱼作为实验材料探究饲料中组合色素对其体色的影响,结果表明不同的色素组合对其体色变化有很大差别。但鲜有关于红草金鱼色素、类胡萝卜素含量以及利用情况的相关报道,且由于饲养情况、个体大小以及鱼体部位不同,其色素和类胡萝卜素含量也有较大差异。因此,通过对其体内色素以及类胡萝卜素含量深入研究,可为今后红草金鱼的资源化利用提供科学参考。
4 结论与展望单因素试验和正交试验结果得出,在红草金鱼类胡萝卜素提取工艺中各因素存在相互作用,因此需要综合考虑各因素对实验的影响,从而筛选出最佳提取工艺与效果。综合分析两项试验结果,红草金鱼类胡萝卜素提取工艺的最佳条件:提取样品为红草金鱼干样、料(g)液(mL)比1:15、提取时间90 min、提取次数2次、V(乙醇):V(丙酮)= 1:2、提取温度80 ℃。根据此试验结果进行金鱼类胡萝卜素的提取工作,为之后提取与测定金鱼体内类胡萝卜素含量及其各色素组分的研究提供了重要的参考依据。
| [1] |
镡龙. 类胡萝卜素着色作用研究进展[J]. 北京农业, 2014(12): 13. TAN L. Research progress on the coloring of carotenoids[J]. Beijing Agriculture, 2014(12): 13. DOI:10.3969/j.issn.1000-6966.2014.12.009 |
| [2] |
LI B X, ROGNON G T, MATTINSON T, et al. Supple-mentation with macular carotenoids improves visual performance of transgenic mice[J]. Archives of Biochemistry and Biophysics, 2018, 649: 22-28. DOI:10.1016/j.abb.2018.05.003 |
| [3] |
刘金海, 王安利, 王维娜. 金鱼总色素及色素组分的比较研究[J]. 水生生物学报, 2007, 31(1): 73-77. LIU J H, WANG A L, WANG W N. Comparative studies on the total pigment and pigment components of goldfish[J]. Acta Hydrobiologica Sinica, 2007, 31(1): 73-77. DOI:10.3321/j.issn:1000-3207.2007.01.011 |
| [4] |
MATSUDA K, KOJIMA K, SHIMAKURA S, et al. Regulation of food intake by melanin-concentrating hormone in goldfish[J]. Peptides, 2009, 30(11): 2060-2065. DOI:10.1016/j.peptides.2009.02.015 |
| [5] |
莫玉楠, 张鲁刚, 王国芳. 橙色大白菜类胡萝卜素提取与测定方法研究[J]. 西北农林科技大学学报(自然科学版), 2014, 42(3): 206-214. MO Y N, ZHANG L G, WANG G F. Extraction and determination of total carotenoids in orange heading Chinese cabbages[J]. Journal of Northwest A & F University (Nature Science Edition), 2014, 42(3): 206-214. |
| [6] |
MA X W, ZHANG B, MA Y L, et al. Carotenoid accumulation and expression of carotenoid biosynthesis genes in mango flesh during fruit development and ripening[J]. Scientia Horticulturae, 2018, 237: 201-206. DOI:10.1016/j.scienta.2018.04.009 |
| [7] |
周俊良, 沈佳奇, 韩秀梅, 等. 提取火龙果果皮红色素主要工艺的比较研究[J]. 浙江农业科学, 2017, 58(1): 110-114. ZHOU J L, SHEN J Q, HAN X M, et al. Comparative study on the main extraction process of red pigment from the skin of dragon fruit[J]. Journal of Zhejiang Agricultural Science, 2017, 58(1): 110-114. |
| [8] |
李雄辉, 赵萍, 季清荣. 不同提取工艺对栀子黄色素提取效果的比较[J]. 食品研究与开发, 2006, 27(6): 192-194. LI X H, ZHAO P, JI Q R. Comparison of different extraction process to the effect about gardenia yellow pigment[J]. Food Research and Development, 2006, 27(6): 192-194. DOI:10.3969/j.issn.1005-6521.2006.06.071 |
| [9] |
黄斌, 黄勇, 汪利. 日粮添加芜萍对红色草金鱼生长及体色的影响[J]. 水产科学, 2011, 30(10): 617-620. HUANG B, HUANG Y, WANG L. Effects of duckweed Wolffia arrhiza Wimmer dry powder in diet on growth and body color of goldfish Carassius auratus[J]. Fisheries Science, 2011, 30(10): 617-620. DOI:10.3969/j.issn.1003-1111.2011.10.006 |
| [10] |
程云生, 陈世金, 李静, 等. 饲料中组合色素对红草金鱼体色的影响[J]. 淡水渔业, 2015, 45(5): 94-99. CHENG Y S, CHEN S J, LI J, et al. Effects of combinated dietary pigments on body color of red Carassius auratus[J]. Freshwater Fisheries, 2015, 45(5): 94-99. DOI:10.3969/j.issn.1000-6907.2015.05.016 |
| [11] |
严娟, 蔡志翔, 沈志军, 等. 黄肉桃果实中类胡萝卜素提取和测定方法研究[J]. 果树学报, 2015, 32(6): 1267-1274. YAN J, CAI Z X, SHEN Z J, et al. Extraction and analytical methods of carotenoids in fruit of yellow flesh peach[J]. Journal of Fruit Science, 2015, 32(6): 1267-1274. |
| [12] |
BENMEZIANE A, BOULEKBACHE-MAKHLOUF L, MAPELLI-BRAHM P, et al. Extraction of carotenoids from cantaloupe waste and determination of its mineral composition[J]. Food Research International, 2018, 111: 391-398. DOI:10.1016/j.foodres.2018.05.044 |
| [13] |
吴琴, 陈珣. 单因素实验结合响应面法优化朱砂根总皂苷的提取工艺[J]. 医药导报, 2014, 33(8): 1080-1082. WU Q, CHEN X. Optimization of extraction technology for total saponins of Ardisia crenata by singlefactor experiment combined with response surface methodology[J]. Herald of Medicine, 2014, 33(8): 1080-1082. DOI:10.3870/yydb.2014.08.028 |
| [14] |
ZHUANG Y C, ZHANG C, OU L L, et al. Determination of total flavonoids in leaves of Paliurus ramosissimus and orthogonal experiment optimization process[J]. Medicinal Plant, 2018, 9(2): 40-43, 47. |
2. Institute of Nature Aquarium Research Institute, Shanghai 200090, China;
3. Engineering Research Center for Water Environment Ecology in Shanghai, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


