2. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
中华绒螯蟹(Eriocheir sinensis),俗称河蟹,是蜕壳类甲壳动物,一生需要经历约18 ~ 21次蜕壳[1]。相关研究[2-3]发现,中华绒螯蟹具有好打斗与抢食的生活习性,造成了养殖生产上成活率较低和总产量不高等情况。因而,中华绒螯蟹个体养殖也逐渐引起了人们的重视。早在1998年,杨培根等[4]开展了中华绒螯蟹的个体笼养实验。最近几年,黄姝等[5]在250 L的实验水槽内进行了中华绒螯蟹成蟹阶段的个体蜕壳与生长观察,在200 d的实验期内,实验蟹进行了4次蜕壳,每次蜕壳后的体质量增长为48.7%~80.1%。陈娇[6]在室内60 L水槽内对成蟹在一个蜕壳周期内的个体蜕壳与生长进行了连续观察与测定,发现河蟹的肥满度达60%左右时启动下一次蜕壳。然而,由于受个体养殖设施等条件的制约,国内对中华绒螯蟹的个体养殖实验一直较少。
近年来,一种新型的蟹类个体养殖系统“蟹公寓”开始在海水蟹类中出现[7]。同时,本实验室与上海泓循环境科技发展有限公司联合开发了“蟹龙宫”河蟹个体养殖系统,该系统由个体养殖盒、水处理系统、控温系统和杀菌系统等组成,其目的是为中华绒螯蟹修建一栋栋“宫殿式宿舍”,让每只蟹生活在“单间宿舍”内,每栋“宿舍”配备独立的进水与排水系统、控温系统和水处理系统。“蟹龙宫”将“扁平开放式”的蟹类群体养殖转变为“立体封闭式”的蟹类个体养殖,可减少相互间的打斗与伤害。然而,目前尚未见利用这些个体养殖系统进行中华绒螯蟹研究的公开报道。
观察“蟹龙宫”系统养殖中华绒螯蟹在一个蜕壳周期内的蜕壳与生长,了解中华绒螯蟹在当前新型个体养殖系统中的蜕壳与生长特性,探讨开展中华绒螯蟹工厂化个体养殖的可行性,并为其他水产生物的个体养殖提供相关资料与数据。
1 材料与方法 1.1 实验材料实验河蟹为处于蜕壳间期的中华绒螯蟹“江海21”蟹种,取自上海海洋大学水产动物种质试验站(上海市浦东新区新场镇),规格为15~25 g/只,雌雄各49只,共98只。
1.2 实验设计“蟹龙宫”为本实验室与上海泓循环境科技发展有限公司合作开发的自动控温循环水全封闭的“宫殿式”河蟹个体养殖系统,设定水温均为(26±2)℃。系统内每个养殖盒内放养1只实验蟹。放养前用SCOUT SE型电子天平(精度为0.1 g)称量体表无水分的蟹体质量,用游标卡尺(精度为0.01 mm)测量每只实验蟹的头胸甲长、头胸甲宽和体高。待实验蟹在“蟹龙宫”系统内适应并蜕一次壳后开始正式实验。
饲养期间,每天上午8:00观察河蟹的活动与摄食情况,并清除残饵。采用饱食投喂法每日上午9:00投喂河蟹专用配合饲料1次(约0.8 g)。
1.3 生长性状测定河蟹在“蟹龙宫”内完成第1次蜕壳后的第3天,头胸甲变硬时开始正式实验,此时测量每只蟹的体质量、头胸甲长、头胸甲宽和体高等生长指标作为初始值,之后每隔3天测量其体质量,并在每次测量时从第三步足基部抽取血淋巴300~400 μL,如此3 d重复1次,直至所有实验蟹完成第2次蜕壳。第2次蜕壳后的第3天,再测量其体质量、头胸甲长、头胸甲宽和体高并统计蜕壳间期(前后两次蜕壳间的间隔天数)。
1.4 体色RGB值测定为了解河蟹蜕壳周期中的背甲体色变化动态,掌握蜕壳进程,在每隔3天的表型性状测定时,用CS-10型色差仪测量实验河蟹背甲随机5个位点的色度RGB值,然后取平均值作为该期的色度RGB值。
1.5 血清制备与蜕皮激素(EH)含量测定上述抽取的血淋巴液经室温下自然凝固后,在4 ℃下离心10 min(12 000 r/min)。收集上清液,迅速置于-80 ℃冰箱中保存。然后使用Crab Ecdysone Elisa试剂盒(北京冬歌伟业科技有限公司)对蜕皮激素(EH)含量进行测定,具体测定方法按说明书进行。
1.6 数据统计分析相关生长指标的计算如下:
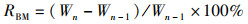 (1)
(1)
 (2)
(2)
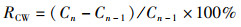 (3)
(3)
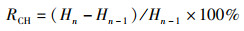 (4)
(4)
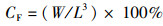 (5)
(5)
式中:RBM为体质量增长率,%;W为体质量,g;RCL为头胸甲长增长率,%;L为头胸甲长,mm;RCW为头胸甲宽增长率,%;C为头胸甲宽,mm;RCH为体高增长率,%;H为体高,mm;n为蜕壳次数;CF为肥满度,%。
利用SPSS 20.0软件对上述参数进行方差分析和相关性分析。
2 结果 2.1 生长特性 2.1.1 生长参数变化在“蟹龙宫”饲养模式下的1个蜕壳周期内,实验河蟹的存活率为47.96%,蜕壳后的体质量平均增长率为33.19%,头胸甲长、头胸甲宽和体高的平均增长率为12.12%~14.97%,平均蜕壳间期达59.35 d。进一步分析发现,雌雄河蟹在这些指标的增长率上不存在显著差异(P>0.05),见表 1。
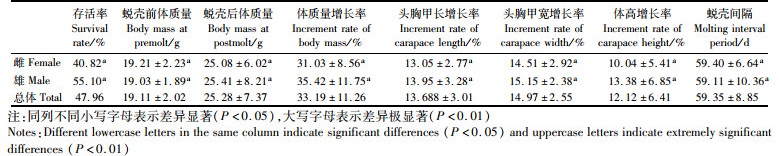
|
表 1 “蟹龙宫”饲养中华绒螯蟹的生长性状增长率与蜕壳间期 Tab.1 Incremental rate of growth traits and molting interval of Chinese mitten crab reared in the "Crab Palace" system |
在“蟹龙宫”饲养环境中,正式实验前在蜕壳前雄蟹肥满度为61.23%±1.68%,雌蟹为60.12%±1.16%,平均为60.68%±1.20%。蜕壳后3 d的雄蟹肥满度为55.95%±1.18%,雌蟹为54.96%±1.57%,平均为55.45%±1.26%。然后肥满度逐步提高,直到下一次蜕壳时肥满度雄蟹为61.36%±1.12%,雌蟹为60.32%±1.01%,平均为60.84%±1.76%。实验河蟹在蜕壳前后的肥满度差异极显著(P<0.01),见图 1。
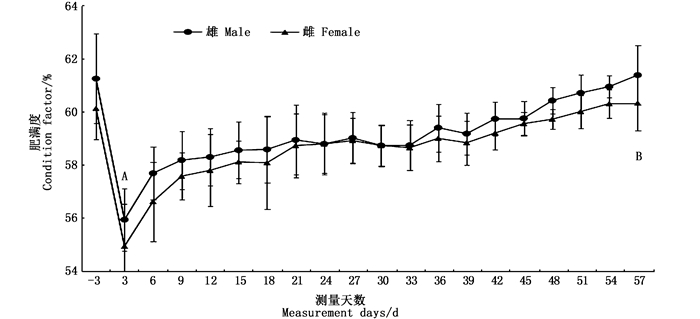
|
不同小写字母表示差异显著(P < 0.05),大写字母表示差异极显著(P < 0.01) Different lowercase letters indicate significant differences (P < 0.05) and uppercase letters indicate extremely significant differences (P < 0.01) 图 1 “蟹龙宫”饲养中华绒螯蟹的肥满度变化 Fig. 1 Condition factor changes of Chinese mitten crab reared in the "Crab Palace" system |
通过连续测定“蟹龙宫”内实验河蟹的体色色度值(RGB)发现:刚蜕壳后河蟹的体色为靛青色,色度值较低,平均为62.08±10.91;随着生长的进行,色度值逐步升高,至蜕壳前色度值达109.17±5.41,体色为黄褐色。经统计,河蟹在蜕壳前后的体色RGB值差异极显著(P<0.01),见图 2。
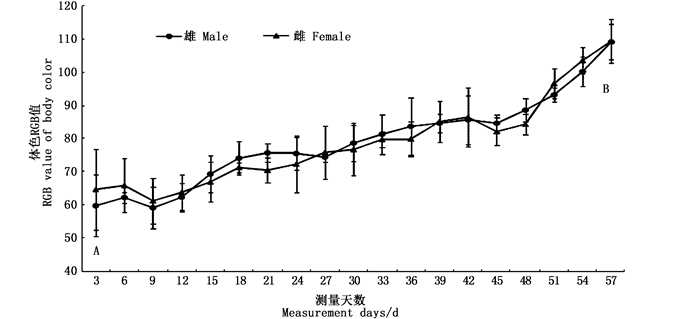
|
不同小写字母表示差异显著(P < 0.05),大写字母表示差异极显著(P < 0.01) Different lowercase letters indicate significant differences (P < 0.05) and uppercase letters indicate extremely significant differences (P < 0.01) 图 2 “蟹龙宫”饲养中华绒螯蟹的体色色度值(RGB)变化 Fig. 2 The RGB value changes of body color of Chinese mitten crab reared in the "Crab Palace" system |
在“蟹龙宫”的饲养环境中,中华绒螯蟹蜕壳后的第3天EH平均含量为(4.61±0.77)IU/mL,除第6天测量的EH含量有所下降外,随着时间的进行,其含量缓慢上升。至下一次蜕壳时,雌蟹的EH平均含量达(14.44±0.57)IU/mL,雄蟹达(14.06 ±0.95)IU/mL,平均达(14.18±0.72) IU/mL,见图 3。
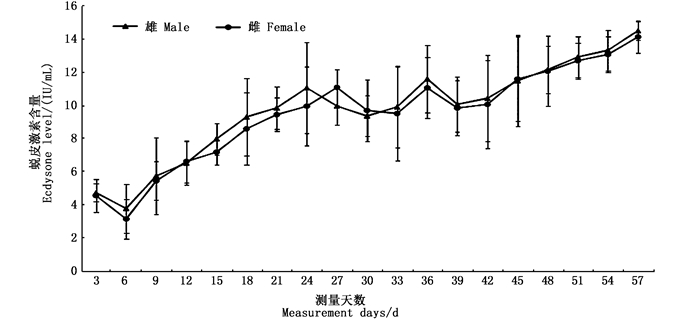
|
图 3 “蟹公寓”饲养中华绒螯蟹的蜕皮激素含量变化 Fig. 3 Ecdysone content changes of Chinese mitten crab reared in the "Crab Palace" system |
通过对“蟹龙宫”饲养河蟹的蜕壳前生长性状与其蜕壳后增长率进行相关分析发现,蜕壳前的体质量、头胸甲长、头胸甲宽和体高与各自的蜕壳后增长率呈直线线性关系,但均不存在显著相关性(P>0.05),见图 4。

|
图 4 “蟹龙宫”饲养中华绒螯蟹蜕壳前后生长性状的相关性 Fig. 4 Relationship of growth traits between premolt and post-molt stages for Chinese mitten crab reared in the "Crab Palace" system |
通过对“蟹龙宫”饲养河蟹的蜕壳前EH含量与蜕壳后生长性状增长率进行相关分析发现,蜕壳前EH含量与蜕壳后增长率也呈直线线性关系,但也均不存在显著相关性(P>0.05),见图 5。
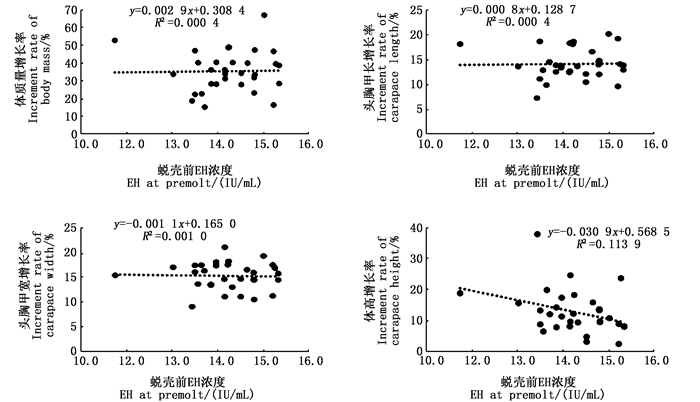
|
图 5 “蟹龙宫”饲养中华绒螯蟹的蜕壳前EH含量与蜕壳后生长性状增长率的关系 Fig. 5 Relationship of EH at premolt and increment rate of growth traits at post-molt for Chinese mitten crab reared in the "Crab Palace" system |
通过对蜕壳间期与蜕壳后生长性状增长率进行相关分析发现,河蟹蜕壳间期的长短与蜕壳后生长性状的增长率也不存在显著相关性(P>0.05),见图 6。
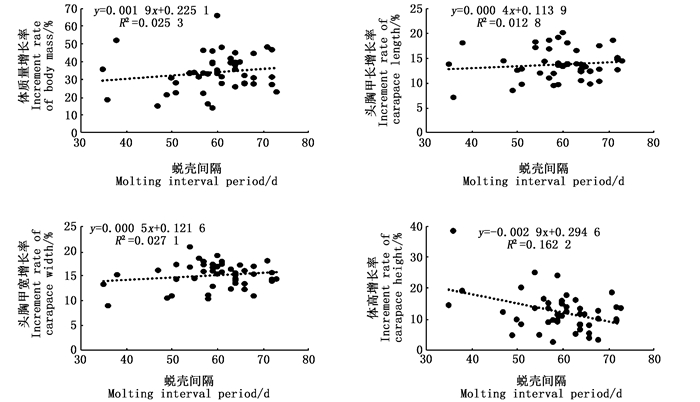
|
图 6 “蟹龙宫”饲养中华绒螯蟹的蜕壳间期与蜕壳后生长性状增长率的关系 Fig. 6 Relationship of molting interval period and increment rate of growth traits at post-molt for Chinese mitten crab reared in the "Crab Palace" system |
河蟹的生长必须通过蜕壳来完成,其生长表现为非连续的跳跃性特点。相关研究表明, 河蟹蜕壳后的增重率差异极大,有的个体高达160%,而有的增重率却不到10%[8-9]。河蟹这种蜕壳后增重率差异极大的现象来自于遗传和环境的双重作用和交互作用。在本实验的“蟹龙宫”养殖模式下,河蟹蜕壳后增重率波动不大,80%的河蟹个体集中在30%~40%(平均为33.19%±11.26%)。这是因为在本研究中:各实验河蟹来源为新品种“江海21”,其遗传一致性较好;另一方面是“蟹龙宫”中各实验蟹的生长环境几乎一致,环境对蜕壳后增重率差异影响较小。实验结果也间接指出,在生产上河蟹蜕壳后的增重率差异,环境变量的作用巨大。研究发现,实验河蟹蜕壳后的平均增重率和成活率相对较低,蜕壳间期也较长,与池塘环境中存在较大差别[10],推测是每3 d抽取血淋巴对生长造成了较大胁迫。因而,将进一步调整实验方案,优化实验过程,深入比较“蟹龙宫”饲养环境与野外池塘的河蟹生长差异和机制。
肥满度是判定动物对环境适应的生理状态和营养状况的综合指标,已有学者将其作为衡量三疣梭子蟹(Portunus tritubercatus)生长状况的重要指标之一[11-13]。何杰[10]对池塘养殖河蟹的调查发现,随着体内营养物质的不断增加,积累到一定程度就导致蜕壳的产生。在本研究的“蟹龙宫”饲养环境中,通过对一个蜕壳周期内的肥满度的连续测定,发现肥满度在蜕壳后呈上升趋势,当达到60%或以上时,河蟹启动下一次蜕壳。该结果也与陈娇等[14]的研究结果相吻合,再一次说明当中华绒螯蟹体内的营养物质积累到一定程度,即肥满度达到60%左右时,将启动蜕壳。
蜕皮激素在甲壳动物生长发育过程中起着重要的作用,当其积累到一定量时即可引起蜕皮现象的发生[15]。WARNER等[16]通过注射外源蜕皮激素(2.14 μg/g),可促进螯虾(Orconectes obscures)的提早蜕皮。黄姝[17]研究发现,当EH浓度高于14 IU/mL时,河蟹会发生蜕壳。同样,在本研究的“蟹龙宫”环境中,雌蟹蜕壳前的EH平均含量为14.44 IU/mL,雄蟹为14.06 IU/mL,雌雄平均达14.18 IU/mL。两种养殖方式与环境均说明,河蟹体内的EH含量达到14 IU/mL时,可以看作河蟹启动蜕壳的标记之一。
中华绒螯蟹体色取决于类胡萝卜素含量[18]。而河蟹自身不能合成类胡萝卜素,但可以直接将食物中的类胡萝卜素沉积或转化为自身所需的类胡萝卜素[19-20]。虾青素是甲壳动物体表色素中最主要的类胡萝卜素,它与蛋白质一起形成蓝色的虾青素蛋白,使许多甲壳动物呈现出深青蓝体色[21]。本研究发现,随着蜕壳后营养物质的不断积累,河蟹的背甲壳色度值也不断增加,且色度值与蜕壳间期呈显著正相关(P<0.05),这可能是虾青素等色素物质不断沉积的结果。同时,本研究通过蜕壳前的生长情况、EH含量和蜕壳间期时长分别与蜕壳后生长性状的增长率进行相关分析,均未发现显著的相关性,这需要今后的研究进一步加以验证。
| [1] |
王武, 王成辉, 马旭洲. 河蟹生态养殖[M]. 2版. 北京: 中国农业出版社, 2014. WANG W, WANG C H, MA X Z. Ecological culture of Chinese mitten crab aquaculture[M]. 2nd ed. Beijing: China Agriculture Press, 2014. |
| [2] |
姜连峰. 浅谈河蟹生产[J]. 垦殖与稻作, 2003(6): 46-47. JIANG L F. Preliminary studies on river crab production[J]. Reclaiming and Rice Cultivation, 2003(6): 46-47. DOI:10.3969/j.issn.1673-6737.2003.06.020 |
| [3] |
何奇. 河蟹蜕壳期间注意事项[J]. 渔业致富指南, 2009(15): 53. HE Q. Matters needing attention during crab molting[J]. Fishery Guide to be Rich, 2009(15): 53. |
| [4] |
杨培根, 李晨虹. 笼养中华绒螯蟹的蜕壳与生长[J]. 上海水产大学学报, 1998, 7(2): 158-161. YANG P G, LI C H. Molting and growth of Chinese mitten crab, Eriocheir sinensis, raised in plastics cage[J]. Journal of Shanghai Fisheries University, 1998, 7(2): 158-161. |
| [5] |
黄姝, 王中清, 茅海成, 等. 中华绒螯蟹在实验室条件下的成蟹阶段蜕壳与生长观察[J]. 上海海洋大学学报, 2014, 23(3): 359-365. HUANG S, WANG Z Q, MAO H C, et al. Observation on molting and growth of adult Chinese mitten crab reared in the laboratory condition[J]. Journal of Shanghai Ocean University, 2014, 23(3): 359-365. |
| [6] |
陈娇.中华绒螯蟹蜕壳、生长的个体观察和相关基因的表达分析[D].上海: 上海海洋大学, 2016: 9. CHEN J.Observation on individual molting, growth and analysis of relative gene expression in Chinese mitten crab[D].Shanghai: Shanghai Ocean University, 2016: 9. |
| [7] |
黄伟卿, 张艺, 叶海辉, 等. "蟹公寓"培育红膏蟹养殖技术研究[J]. 科学养鱼, 2017(1): 35-36. HUANG W Q, ZHANG Y, YE H H, et al. Research on breeding technology of crabs in "crab apartment"[J]. Scientific Fish Farming, 2017(1): 35-36. |
| [8] |
张列士, 陆锦天. 中华绒螯蟹(Eriocheir sinensis)蜕壳和生长的研究进展[J]. 水产科技情报, 2001, 28(6): 246-250. ZHANG L S, LU J T. Study progress of the moult and growth of Chinese mitten-handed crab (Eriocheir sinensis)[J]. Fisheries Science&Technology Information, 2001, 28(6): 246-250. DOI:10.3969/j.issn.1001-1994.2001.06.002 |
| [9] |
张超. 中华绒螯蟹幼蟹蜕壳与生长的初步研究[J]. 水利渔业, 2007, 27(2): 58-60. ZHANG C. Studies on the molting and growth of the young mitten crab[J]. Reservoir Fisheries, 2007, 27(2): 58-60. DOI:10.3969/j.issn.1003-1278.2007.02.025 |
| [10] |
何杰. 中华绒螯蟹池塘生态养殖群体生长特征研究[J]. 水利渔业, 2005, 25(6): 10-11, 28. HE J. Population growth characteristics of the mitten crab in ecological aquaculture ponds[J]. Reservoir Fisheries, 2005, 25(6): 10-11, 28. DOI:10.3969/j.issn.1003-1278.2005.06.004 |
| [11] |
郑海波.中华绒螯蟹的品质分析与比较[D].无锡: 江南大学, 2008. ZHENG H B.Analysis and comparison of the quality of Chinese Mitten Crab[D].Wuxi: Jiangnan University, 2008. |
| [12] |
高保全, 刘萍, 李健, 等. 三疣梭子蟹4个野生群体肥满度的初步研究与比较分析[J]. 中国海洋大学学报, 2012, 42(s1): 51-53. GAO B Q, LIU P, LI J, et al. A preliminary study on relative fatness of Portunus trituberculatus[J]. Periodical of Ocean University of China, 2012, 42(s1): 51-53. |
| [13] |
杨品红, 李梦军, 黄春红, 等. 大通湖中华绒螯蟹(Eriocheir sinensis)品质分析与评价[J]. 海洋与湖沼, 2014, 45(3): 637-643. YANG P H, LI M J, HUANG C H, et al. Nutrients analysis and quality assessment of Eriocheir sinensis from Datong lake, Hunan Province[J]. Oceanologia et Limnologia Sinica, 2014, 45(3): 637-643. |
| [14] |
陈娇, 岳武成, 陈晓雯, 等. 中华绒螯蟹蜕壳生长及其与相关基因表达的关联分析[J]. 动物学杂志, 2016, 51(6): 1059-1070. CHEN J, YUE W C, CHEN X W, et al. Observation on individual molting, growth and association analysis with relative gene expression in Chinese mitten crab (Eriocheir sinensis)[J]. Chinese Journal of Zoology, 2016, 51(6): 1059-1070. |
| [15] |
MELLON JR D, GREER E. Induction of precocious molting and claw transformation in alpheid shrimps by exogenous 20-hydroxyecdysone[J]. Biological Bulletin, 1987, 172(3): 350-356. DOI:10.2307/1541714 |
| [16] |
WARNER A C, STEVENSON J R. The influence of ecdysones and eyestalk removal on the molt cycle of the crayfish Orconectes obscurus[J]. General and Comparative Endocrinology, 1972, 18(3): 454-462. DOI:10.1016/0016-6480(72)90026-3 |
| [17] |
黄姝.EcR和MIH基因在中华绒螯蟹蜕壳过程中的相互调节机制研究[D].上海: 上海海洋大学, 2017: 132. HUANG S.Study on reciprocal regulation mechanism of MIH and EcR genes in the molting process of Chinese mitten crab, Eriocheir sinensis[D].Shanghai: Shanghai Ocean University, 2017: 132. |
| [18] |
TERUHISA K, TADASHI K, CHICHESTER C O. The bio-synthesis of astaxanthin.Ⅵ.the carotenoids in the prawn, Penaeus japonicus Bate (part Ⅱ)[J]. International Journal of Biochemistry, 1972, 3(15): 363-368. DOI:10.1016/0020-711X(72)90051-1 |
| [19] |
冷向军, 李小勤. 水产动物着色的研究进展[J]. 水产学报, 2006, 30(1): 138-143. LENG X J, LI X Q. The recent advance of aquatic animal pigmentation[J]. Journal of Fisheries of China, 2006, 30(1): 138-143. |
| [20] |
CHIEN Y H, SHIAU W C. The effects of dietary supplementation of algae and synthetic astaxanthin on body astaxanthin, survival, growth, and low dissolved oxygen stress resistance of Kuruma prawn, Marsupenaeus japonicus Bate[J]. Journal of Experimental Marine Biology and Ecology, 2005, 318(2): 201-211. DOI:10.1016/j.jembe.2004.12.016 |
| [21] |
CIANCI M, RIZKALLAH P J, OLCZAK A, et al. The molecular basis of the coloration mechanism in lobster shell:β-crustacyanin at 3.2-A resolution[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(15): 9795-9800. DOI:10.1073/pnas.152088999 |
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


