2. 农业农村部水产品贮藏保鲜质量安全风险评估实验室, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
生物被膜(Biofilm)是细菌生存的一种重要形态。全球约80%的食源性疾病的暴发都与生物被膜密切相关,细菌生物被膜的形成是引发细菌持续性感染的关键因素之一[1]。自然界中90%以上的食源性致病菌都能形成生物被膜[2]。副溶血弧菌(Vibrio parahaemolyticus)作为中国水产品中头号食源性致病菌,其引起的食物中毒事件占总的食物中毒事件的60%以上[3]。食用被副溶血弧菌污染的食物可能引起肠胃炎疾病(伴随腹痛、腹泻、恶心、呕吐等症状),严重时会导致死亡[4]。该菌不仅可以在不锈钢、玻璃以及塑料等常用于食品加工业的非生物材料表面形成生物被膜[5],还可以在虾壳、蟹壳等生物材料表面形成生物被膜[6],相较于细菌其抗性增加,更加难以被清除[7],因此极易造成水产品的严重污染并导致疾病暴发。鱼类作为水产品的重要组成部分,其消费量逐年递增,然而,目前针对副溶血弧菌在鱼鳞表面形成生物被膜的研究尚未见报道。因此,研究副溶血弧菌在鱼鳞表面形成生物被膜的情况具有重要意义。
由于生物被膜的特殊结构,其内部细菌可以抵抗宿主免疫应答,使得其耐药性远强于浮游态细菌[8]。因此,生物被膜一旦形成就很难被传统杀菌方法清除。酸性电解水作为一种新型消毒剂,不仅可以用于制药和食品工业[9],有效地杀灭副溶血弧菌和其他细菌[10-12],还可以用来清除细菌在非生物材料表面形成的生物被膜[13]。相较于传统消毒剂,酸性电解水的优势在于其拥有较强的杀菌效果,且酸性电解水对自然环境和人体健康具有无害性[14-15]。
选择水产品中分离的副溶血弧菌作为研究对象,运用电子扫描显微镜和胞外聚合物分析法系统地研究副溶血弧菌在最适生长温度下在鱼鳞表面形成生物被膜的动态过程,并比较分析不同温度条件下其在鱼鳞表面形成生物被膜的情况。同时,还研究了酸性电解水对鱼鳞表面副溶血弧菌生物被膜的清除效果,以期为有效控制和清除水产品运输、储藏和加工过程中副溶血弧菌生物被膜的污染提供可靠的数据基础。
1 实验方法 1.1 鱼鳞材料的处理实验参照HAN等[6]的方法并略做修改。实验中用到的鱼购买自上海市芦潮港水产品交易中心。首先用无菌剪刀将鱼鳞剪为直径12 mm的圆形,然后将处理好的鱼鳞放入24孔板中置于超净工作台中,用紫外线对鱼鳞正反两面各照射30 min。
1.2 副溶血性弧菌的活化所用的菌株为本实验室于水产品中分离得到的副溶血弧菌VP-S36。将保存在-80 ℃冰箱中的副溶血弧菌划线于TCBS琼脂培养基上,37 ℃培养16~24 h,挑取单菌落接种于5 mL TSB (NaCl, 3%)培养基中,置于转速250 r/min恒温(37 ℃)摇床中培养10 h,用酶标仪将菌液在600 nm处的光学浓度(Optical density)调为0.4 (OD600 nm=0.4)。
1.3 副溶血性弧菌生物被膜的培养参照SONG等[16]的方法并略做修改。将鱼鳞置于无菌24孔板中,加入990 μL TSB培养基以及10 μL调整好光学浓度的细菌悬浮液,分别置于37 ℃恒温培养箱中静置培养12、24、36、48、60和72 h以及4、10、15、25和40 ℃恒温培养箱中静置培养60 h。培养结束后用酶标仪测定悬浮液在595 nm处的光学浓度值(OD595 nm),随后弃去悬浮液,用无菌磷酸盐缓冲液(Phosphate buffer solution, PBS)清洗3遍。
1.4 酸性电解水的制备酸性电解水(acidic electrolyzed water,AEW)的制备参照文献[17]的方法并略做修改。将0.15%氯化钠溶液置于电解水制备仪中电解15 min,得到酸性电解水。酸性电解水的理化指标由pH/ORP测定仪和氯检测试剂盒测得。制备的酸性电解水需在制备后1 h内使用。酸性电解水和无菌自来水(sterile tap water, STW)的理化特性见表 2。
1.5 用酸性电解水对鱼鳞表面副溶血弧菌生物被膜进行浸泡处理 1.5.1 用酸性电解水对副溶血弧菌在不同温度条件下形成生物被膜进行浸泡处理将鱼鳞置于无菌6孔板中,加入5 mL酸性电解水(室温下)处理5 min后,移去酸性电解水,加入中和缓冲溶液(PBS, 0.8% Na2S2O3)反应2 min,随后弃去处理液,用PBS清洗3次。
1.5.2 用酸性电解水对副溶血弧菌在最适生长温度条件下形成的生物被膜进行不同时间浸泡处理将鱼鳞(培养60 h)置于无菌6孔板中,加入5 mL酸性电解水(室温下),分别处理1、2、5、8和10 min后,移去处理液,加入中和缓冲溶液反应2 min,随后弃去处理液,用PBS清洗3次。
1.6 生物被膜的检测 1.6.1 电子扫描显微镜观察鱼鳞表面副溶血弧菌生物被膜参照KUMAR等[18]的方法并略做修改。将鱼鳞置于无菌24孔板中,加入1 mL戊二醛溶液(4%)隔夜固定,结束后用PBS清洗3次,随后用不同浓度梯度的乙醇(30%, 50%, 70%, 90%和100%)对样品进行脱水处理各10 min (100%乙醇处理两次),随后取出鱼鳞放置室温处自然风干、喷金,用电子扫描显微镜观察生物被膜。
1.6.2 胞外聚合物分析胞外多糖(extracellular polysaccharide, EPC)与胞外蛋白(extracellular protein, EPR)的提取参照文献[19-21]的方法并略做修改。将鱼鳞置于无菌24孔板中,加入1 mL氯化钾溶液(0.01 mol/L)冲洗,取悬浮液进行超声处理(每次5 s,间隔5 s,循环5次)。将处理液转移至1.5 mL无菌离心管中,放入冷冻台式离心机(4 ℃, 4 000 g)中离心20 min,用滤膜过滤(孔径0.22 μm),保留滤液。其他步骤参照KIM等[22]的方法并略做修改。
胞外多糖的提取及测定:取滤液100 μL置于1.5 mL无菌离心管中, 加入200 μL浓硫酸(98%),室温静置30 min,加入25 μL的苯酚溶液(6%),金属浴(90 ℃)加热5 min。测定溶液在490 nm处的光吸收值(OD490 nm)。
胞外蛋白的提取及测定:取40 μL滤液于1.5 mL无菌离心管内,加入200 μL lowry reagent溶液,室温静置10 min,加入20 μL福林-酚溶液,室温静置30 min。测定溶液在750 nm处的光吸收值(OD750 nm)。
胞外多糖与胞外蛋白的相对含量分别为OD490 nm/OD595 nm和OD750 nm/OD595 nm。
1.7 数据处理采用SPSS 19.0软件对实验中获得的数据进行单因素方差分析(P < 0.05为显著性差异),用Origin 8.0作图。
2 结果与分析 2.1 副溶血弧菌在最适生长温度条件下在鱼鳞表面形成生物被膜的动态过程首先研究副溶血弧菌在最适生长温度条件下(37 ℃)在鱼鳞表面形成生物被膜的动态过程。电子扫描显微镜结果(图 1)表明,12~24 h时,副溶血弧菌以单细胞和多细胞团簇的形式随机吸附在鱼鳞表面。24~36 h时,细菌在鱼鳞表面局部区域大量聚集,形成零散的生物被膜。随着培养时间的延长(48 h),生物被膜的范围不断扩大,并与邻近区域的生物被膜连接,生物被膜在鱼鳞表面的覆盖范围进一步扩大,并初步形成三维结构。60 h时,副溶血弧菌细胞间的连接更加紧密,形成致密的具有明显三维立体网状结构的成熟生物被膜。培养72 h时,生物被膜表面出现明显的裂缝,但细菌细胞间的连接依然紧密。

|
图 1 副溶血弧菌在鱼鳞表面形成生物被膜动态过程的电子扫描显微镜图(5 000倍) Fig. 1 SEM images (5 000×magnification) of dynamic formation process of Vibrio parahaemolyticus biofilm developed on the surface of fish scale |
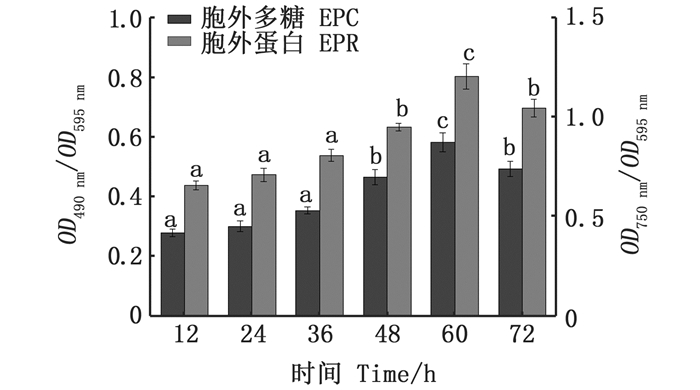
胞外聚合物分析结果(图 2)表明,副溶血弧菌生物被膜形成的动态过程中,胞外蛋白量始终多余胞外多糖的量。12~60 h时间段内,胞外多糖和胞外蛋白的量随着培养时间的增加均增加,60 h时达到最大值[胞外多糖(0.581), 胞外蛋白(1.213)],培养72 h时[胞外多糖(0.479), 胞外蛋白(1.048)],两者的量均出现轻微的减少。这与生物被膜形成的动态过程中其结构的变化结果相符。生物被膜结构最为致密时其胞外多糖和胞外蛋白的含量也最高。
|
图 2 副溶血弧菌在鱼鳞表面形成生物被膜的动态过程中胞外多糖与胞外蛋白的量的变化 Fig. 2 Changes of the amount of EPC and EPR in the dynamic formation process of Vibrio parahemolyticus biofilm formed on the surface of fish scale |
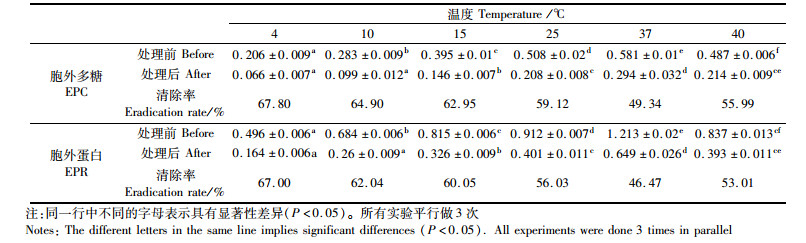
胞外聚合物分析结果表明,副溶血弧菌在本文测定的所有温度条件(4、10、15、25、37和40 ℃)下均可以形成生物被膜,且在37 ℃条件下形成的生物被膜的量最多[胞外多糖(0.581), 胞外蛋白(1.213)]。在一定温度范围(4~37 ℃)内,生物被膜的量随着培养温度的增加而增加。与最适生长温度相比,过高的温度(40 ℃)条件下副溶血弧菌形成生物被膜的量降低[胞外多糖(0.487), 胞外蛋白(0.837)]。值得注意的是,常用于冰箱储藏温度的4 ℃并没有完全抑制副溶血弧菌在鱼鳞表面形成生物被膜。综上所述,高温(25 ℃, 37 ℃和40 ℃)相较于低温(4 ℃, 10 ℃和15 ℃)更有利于副溶血弧菌在鱼鳞表面形成生物被膜,且其形成生物被膜的量由高到底低的次序是:37 ℃>25 ℃> 40 ℃>15 ℃>10 ℃ >4 ℃。见表 1。
|
表 1 副溶血弧菌在不同温度条件下在鱼鳞表面形成生物被膜的情况及酸性电解水对其清除效果 Tab.1 Efficacy of AEW in eradication of Vibrio parahaemolyticus biofilm developed at various temperatures on the surface of fish scale |
酸性电解水和无菌自来水的理化特性见表 2。

|
表 2 酸性电解水和无菌自来水的理化特性 Tab.2 Physicochemical properties of AEW and STW |
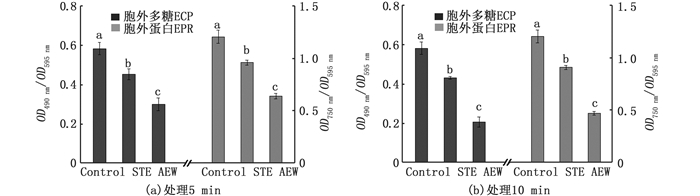
用酸性电解水分别对副溶血弧菌在不同温度条件(4、10、15、25、37和40 ℃)下形成的生物被膜进行浸泡处理5 min,结果见表 1。可以看出,酸性电解水对副溶血弧菌在4、10、15、25、37和40 ℃条件下在鱼鳞表面形成的生物被膜均具有清除效果,对生物被膜内胞外多糖与胞外蛋白的清除率分别达到67.80%, 64.90%, 62.95%, 59.12%, 49.34%, 55.99%和67.00%, 62.04%, 60.05%, 56.03%, 46.47%, 53.01%。其中对4 ℃条件下形成的生物被膜的清除率最高,对37 ℃条件下形成的生物被膜的清除率最低。用扫描电子显微镜观察37 ℃条件下形成的生物被膜经酸性电解水浸泡处理后生物被膜和细菌表面结构及形态的变化,结果(图版-2~3)表明,浸泡处理后,生物被膜变得稀薄,三维立体网状结构被破坏,大部分生物被膜被清除,此外,细菌表面变得粗糙,甚至出现破裂现象。作为对照,用无菌自来水对副溶血弧菌在37 ℃形成的生物被膜进行浸泡5 min处理,结果(图 3a)表明,其对生物被膜内胞外多糖与胞外蛋白的清除率为22.38%和21.02%。这些结果表明,酸性电解水不仅可以清除副溶血弧菌在鱼鳞表面形成的生物被膜,还可以杀伤甚至杀死生物被膜内的副溶血弧菌,且其对生物被膜的清除效果强于无菌自来水。

|
1.对照组(未处理), 放大5 000倍;2.处理5 min (放大5 000倍);3.处理5 min (放大50 000倍); 4.处理10 min (放大5 000倍);5.处理10 min (放大50 000倍) 1.SEM at 5 000×magnification; 2.Treatment (5 min):SEM at 5 000×magnification; 3.Treatment (5 min):SEM at 50 000×magnification; 4. Treatment (10 min):SEM at 5 000×magnification; 5. Treatment (10 min):SEM at 50 000×magnification 图版 酸性电解水处理副溶血弧菌生物被膜处理后的电子扫描显微镜图 Plate Plate SEM images of Vibrio parahaemolyticus biofilm after being treated with AEW |
|
相同颜色柱子上的不同字母表示具有显著性差异(P < 0.05)。所有实验做3次平行 The different letters in the same color column implies significant differences (P < 0.05). All experiments were done 3 times in parallel 图 3 酸性电解水和无菌自来水对副溶血弧菌生物被膜中胞外多糖与胞外蛋白的清除效果 Fig. 3 Amount of EPC and EPR in Vibrio parahaemolyticus biofilm after being treated with AEW and STW for different time |
由于酸性电解水对副溶血弧菌在37 ℃条件下形成的生物被膜的清除率最低,因此选择其在37 ℃条件下形成的生物被膜作为研究对象,用酸性电解水对其进行1 min, 2 min, 5 min, 8 min和10 min浸泡处理,观察连续10 min浸泡处理过程中酸性电解水对生物被膜清除效果的变化。胞外聚合物分析结果(图 4)表明,酸性电解水对生物被膜中胞外多糖和胞外蛋白的清除率随时间的增加而增加, 连续处理10 min后清除率达到最大值[胞外多糖(64.54%),胞外蛋白(61.42%)]。用电子扫描显微镜观察酸性电解水连续处理10 min后生物被膜以及细菌表面结构及形态的变化。由图版-4~5可以看出,生物被膜变得更加稀薄,绝大部分生物被膜被清除,剩余的生物被膜零散的分布在鱼鳞表面,且主要以多细胞簇的形态存在,细菌表面变得更加粗糙且细菌裂解程度进一步加剧。这表明延长浸泡时间可以增强酸性电解水对生物被膜的清除效果。作为对照,用无菌自来水对生物被膜进行10 min连续浸泡处理后,结果(图 3 b)表明,其对胞外多糖和胞外蛋白的清除率分别为26.85%和24.73%,这表明无菌自来水对生物被膜的清除效果不会随浸泡时间的延长而明显增强。

|
相同颜色线上的不同字母表示具有显著性差异(P < 0.05)。所有实验平行做3次 The different letters in the same color line implies significant differences (P < 0.05). All experiments were done 3 times in parallel 图 4 酸性电解水对副溶血弧菌生物被膜处理不同时间后胞外多糖与胞外蛋白的量的变化 Fig. 4 The amount of EPC and EPR in Vibrio parahaemolyticus biofilm after being treated with AEW for different time |
还观察了在连续10 min处理过程中酸性电解水的理化特性的变化,结果见表 3。处理5 min时,pH由2.19升高到6.26,氧化还原电位(ORP)和有效氯浓度(ACC)则分别由1 179.0 mV和45 mg/L降低到176.9 mV和8 mg/L。处理10 min时,pH升高到6.97,氧化还原电位(ORP)和有效氯浓度(ACC)则分别降低到70.7 mV和2 mg/L。

|
表 3 酸性电解水处理副溶血弧菌生物被膜的过程中其理化特性变化 Tab.3 Changes in physicochemical properties of AEW during treatment of Vibrio parahaemolyticus biofilm for different time |
生物被膜是一个由单个或者多个种群的细菌在接触表面装配的复杂过程。细菌吸附在接触面分泌胞外多糖、胞外蛋白及核酸等物质将自身包裹在其中形成生物被膜[23]。胞外多糖和胞外蛋白作为生物被膜最主要的组成成分,不仅可以促进细菌的黏附、生物被膜的形成以及维持生物被膜结构的稳定[24],同时还可以阻止各种杀菌剂中的大分子在生物被膜中的扩散从而大大降低了传统杀菌剂的杀菌效果[25-26],使得生物被膜一旦形成就难以被清除。
在对副溶血弧菌形成生物被膜的动态过程的研究中发现,这个过程大致可以分为4个阶段:第一阶段,细菌的黏附期(0~24 h);第二阶段,生物被膜的形成期(24~48 h);第三阶段,生物被膜的成熟期(48~60 h);第四阶段,生物被膜的播散期(60~72 h)。生物被膜形成的前3阶段,胞外多糖与胞外蛋白的量随着培养时间的延长不断增加,60 h时两者的量达到最大值。生物被膜的播散期,其表面出现明显的裂纹,同时胞外多糖和胞外胞外蛋白的量也出现轻微的减少,这可能是由于培养基中营养物质的消耗、群体感应系统调节以及代谢产物的产生引起的,需要进一步验证。
此外,还观察了不同温度条件(4、10、15、25、和40 ℃)下副溶血弧菌在鱼鳞表面形成生物被膜的情况。结果表明,该菌在测定的所有温度条件下均可以形成生物被膜,且在37 ℃条件下形成的生物被膜的量最多。与最适生长温度(37 ℃)相比,过高的温度(40 ℃)条件下其形成生物被膜的量降低,这可能是高温引起的细菌热休克现象导致的,后续将做进一步深入研究。
酸性电解水作为一种新型消毒剂,其不仅被用来杀灭各种细菌[27],还被用来清除非生物材料表面细菌形成的生物被膜[28]。酸性电解水对副溶血弧菌在不同温度条件(4、10、15、25、37和40 ℃)下在鱼鳞表面形成的生物被膜均表现出良好的清除效果,且适当的延长浸泡时间可以增强其清除效果。其中对37 ℃条件下形成的生物被膜清除效果最弱,这可能是由于37 ℃条件下形成的生物被膜的量最多,清除生物被膜所需要的氧化还原电位和有效氯也更多。在连续10 min处理过程中,随着反应时间的延长,酸性电解水对生物被膜的清除效果不断增强,但清除速率逐渐降低,这是由于在处理过程中氧化还原电位和有效氯不断被消耗,处理1、2、5、8和10 min时,二者分别消耗了48.05%、70.0%、85.0%、91.0%、94%和47%、69%、83%、89%、96%,这说明氧化还原电位和有效氯的消耗量与酸性电解水清除生物被膜的清除速率成反比。
综上,副溶血弧菌可以在测定的所有温度条件下在鱼鳞表面形成生物被膜。酸性电解水通过清除生物被膜内的胞外多糖和胞外蛋白,破坏生物被膜的整体结构,从而达到清除鱼鳞表面副溶血弧菌生物被膜的效果。
| [1] |
HALL-STOODLEY L, COSTERTON J W, STOODLEY P. Bacterial biofilms:from the natural environment to infectious diseases[J]. Nature Reviews Microbiology, 2004, 2(2): 95-108. DOI:10.1038/nrmicro821 |
| [2] |
KJELLEBERG S, MOLIN S. Is there a role for quorum sensing signals in bacterial biofilms?[J]. Current Opinion in Microbiology, 2002, 5(3): 254-258. DOI:10.1016/S1369-5274(02)00325-9 |
| [3] |
陈瑞英, 鲁建章, 苏意诚, 等. 食品中副溶血性弧菌的危害分析、检测与预防控制[J]. 食品科学, 2007, 28(1): 341-347. CHEN R Y, LU J Z, SU Y C, et al. Review on risk analysis, detection and control of Vibrio parahaemolyticus in food[J]. Food Science, 2007, 28(1): 341-347. DOI:10.3321/j.issn:1002-6630.2007.01.088 |
| [4] |
梁炳健, 蔡周梅, 黎柱容. 食品中副溶血性弧菌的危害分析与检验[J]. 中国保健营养, 2013, 23(6): 3371-3372. LIANG B J, CAI Z M, LI Z R. Analysis and inspection of Vibrio parahaemolyticus in food[J]. Chinese Health Nutrition, 2013, 23(6): 3371-3372. |
| [5] |
赵爱静.副溶血性弧菌生物被膜形成特性的初步研究[D].上海: 上海海洋大学, 2016. ZHAO A J. Study on formation characteristics of Vibrio parahaemolyticus biofilm[D]. Shanghai: Shanghai Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912575.htm |
| [6] |
HAN N, MIZAN M F R, JAHID I K, et al. Biofilm for-mation by Vibrio parahaemolyticus on food and food contact surfaces increases with rise in temperature[J]. Food Control, 2016, 70: 161-166. DOI:10.1016/j.foodcont.2016.05.054 |
| [7] |
代悦, 吴朝凌, 孙彤, 等. 玻璃表面疏水性能对副溶血性弧菌生物被膜形成的影响[J]. 中国食品学报, 2017, 17(8): 27-33. DAI Y, WU C L, SUN T, et al. Effect of hydrophobic properties of glass surface on formation of Vibrio parahaemolyticus biofilm[J]. Journal of Chinese Institute of Food Science and Technology, 2017, 17(8): 27-33. |
| [8] |
HØIBY N, BJARNSHOLT T, GIVSKOV M, et al. Antibiotic resistance of bacterial biofilms[J]. International Journal of Antimicrobial Agents, 2010, 35(4): 322-332. DOI:10.1016/j.ijantimicag.2009.12.011 |
| [9] |
WANG R, KALCHAYANAND N, KING D A, et al. Biofilm formation and sanitizer resistance of Escherichia coli O157:H7 strains isolated from "high event period" meat contamination[J]. Journal of Food Protection, 2014, 77(11): 1982-1987. DOI:10.4315/0362-028X.JFP-14-253 |
| [10] |
LI J B, LIN T, LU Q, et al. Changes in physicochemical properties and bactericidal efficiency of acidic electrolyzed water ice and available chlorine decay kinetics during storage[J]. LWT-Food Science and Technology, 2014, 59(1): 43-48. |
| [11] |
POSADA-IZQUIERDO G D, PÉREZ-RODRÍGUEZ F, LÓPEZ-GÁLVEZ F, et al. Modeling growth of Escherichia coli O157:H7 in fresh-cut lettuce treated with neutral electrolyzed water and under modified atmosphere packaging[J]. International Journal of Food Microbiology, 2014, 177: 1-8. DOI:10.1016/j.ijfoodmicro.2013.12.025 |
| [12] |
HAO J X, LI H Y, WAN Y F, et al. Combined effect of acidic electrolyzed water (AcEW) and alkaline electrolyzed water (AlEW) on the microbial reduction of fresh-cut cilantro[J]. Food Control, 2015, 50: 699-704. DOI:10.1016/j.foodcont.2014.09.027 |
| [13] |
余铭, 张全凯, 罗小军, 等. 酸性氧化电解水对金黄色葡萄球菌生物被膜清除效果的研究[J]. 食品与机械, 2016, 32(1): 6-10. YU M, ZHANG Q K, LUO X J, et al. Study on removal of Staphylococcus aureus biofilm by acidic electrolytic oxidation water[J]. Food and Machinery, 2016, 32(1): 6-10. |
| [14] |
林婷, 王敬敬, 潘迎捷, 等. 酸性电解水对纯培养及食品中食源性致病菌杀菌效果比较研究[J]. 食品科学, 2013, 34(15): 69-74. LIN T, WANG J J, PAN Y J, et al. Comparison of the bactericidal activity of acidic electrolyzed water against foodborne pathogenic bacteria in pure culture and foods[J]. Food Science, 2013, 34(15): 69-74. DOI:10.7506/spkx1002-6630-201315015 |
| [15] |
HRICOVA D, STEPHAN R, ZWEIFEL C. Electrolyzed water and its application in the food industry[J]. Journal of Food Protection, 2008, 71(9): 1934-1947. DOI:10.4315/0362-028X-71.9.1934 |
| [16] |
SONG X Y, MA Y J, FU J J, et al. Effect of temperature on pathogenic and non-pathogenic Vibrio parahaemolyticus biofilm formation[J]. Food Control, 2017, 73: 485-491. DOI:10.1016/j.foodcont.2016.08.041 |
| [17] |
XIE J, SUN X H, PAN Y J, et al. Physicochemical properties and bactericidal activities of acidic electrolyzed water used or stored at different temperatures on shrimp[J]. Food Research International, 2012, 47(2): 331-336. DOI:10.1016/j.foodres.2011.07.041 |
| [18] |
KUMAR A, TING Y P. Presence of Pseudomonas aeruginosa influences biofilm formation and surface protein expression of Staphylococcus aureus[J]. Environmental Microbiology, 2015, 17(11): 4459-4468. DOI:10.1111/1462-2920.12890 |
| [19] |
NAKAMURA H, TAKAKURA K I, SONE Y, et al. Biofilm formation and resistance to benzalkonium chloride in Listeria monocytogenes isolated from a fish processing plant[J]. Journal of Food Protection, 2013, 76(7): 1179-1186. DOI:10.4315/0362-028X.JFP-12-225 |
| [20] |
GONG A S, BOLSTER C H, BENAVIDES M, et al. Extraction and analysis of extracellular polymeric substances:comparison of methods and extracellular polymeric substance levels in Salmonella pullorum SA 1685[J]. Environmental Engineering Science, 2009, 26(10): 1523-1532. DOI:10.1089/ees.2008.0398 |
| [21] |
D'ABZAC P, BORDAS F, VAN HULLEBUSCH E, et al. Extraction of extracellular polymeric substances (EPS) from anaerobic granular sludges:comparison of chemical and physical extraction protocols[J]. Applied Microbiology and Biotechnology, 2010, 85(5): 1589-1599. DOI:10.1007/s00253-009-2288-x |
| [22] |
KIM H S, PARK H D. Ginger extract inhibits biofilm formation by Pseudomonas aeruginosa PA14[J]. PLoS One, 2013, 8(9): e76106. DOI:10.1371/journal.pone.0076106 |
| [23] |
MIZAN M F R, JAHID I K, HA S D. Microbial biofilms in seafood:a food-hygiene challenge[J]. Food Microbiology, 2015, 49: 41-55. DOI:10.1016/j.fm.2015.01.009 |
| [24] |
ZHANG P, GUO J S, SHEN Y, et al. Microbial communities, extracellular proteomics and polysaccharides:a comparative investigation on biofilm and suspended sludge[J]. Bioresource Technology, 2015, 190: 21-28. DOI:10.1016/j.biortech.2015.04.058 |
| [25] |
ABDALLAH M, BENOLIEL C, DRIDER D, et al. Biofilm formation and persistence on abiotic surfaces in the context of food and medical environments[J]. Archives of Microbiology, 2014, 196(7): 453-472. DOI:10.1007/s00203-014-0983-1 |
| [26] |
BONSAGLIA E C R, SILVA N C C, JU'NIOR A F, et al. Production of biofilm by Listeria monocytogenes in different materials and temperatures[J]. Food Control, 2014, 35(1): 386-391. DOI:10.1016/j.foodcont.2013.07.023 |
| [27] |
谢军, 孙晓红, 潘迎捷, 等. 酸性电解水及其在食品工业中的应用[J]. 食品工业科技, 2010(2): 366-368, 373. XIE J, SUN X H, PAN Y J, et al. Acidic electrolyzed water and its application in the food industry[J]. Science and Technology of Food Industry, 2010(2): 366-368, 373. |
| [28] |
HAN Q, SONG X Y, ZHANG Z H, et al. Removal of foodborne pathogen biofilms by acidic electrolyzed water[J]. Frontiers in Microbiology, 2017, 8: 988. DOI:10.3389/fmicb.2017.00988 |
2. Laboratory of Quality & Safety Risk Assessment for Aquatic Product on Storage and Preservation, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic Product Processing & Preservation, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


