2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国际级实验教学示范中心, 上海 201306
近年来,零交换水养殖模式迅速得到认可,养殖系统水体的零交换减少了其与外界的物质交换,从而达到减少环境污染和降低发病率的目的。随后人们提出了生物安全-零交换水系统养殖模式,生物絮凝技术成为了生物安全的基础和零换水系统养殖模式的技术支撑,同时该模式也为生物絮团技术应用奠定了工程基础[1]。
生物絮团养殖技术能降低养殖水体中的有害无机氮而净化水质,为对虾养殖提供营养物质,提高对虾的非特异性免疫能力及抗病性,已经成为世界范围内认可的对虾生态养殖技术。凡纳滨对虾(Litopenaeus vannmei)生长速度快、养殖周期短,被养殖户们大量养殖,是生物絮凝系统最常见的养殖对象。生物絮凝系统的技术核心是构建一个稳定的微生物系统,该系统通常具备以下特点:(1)能够持续不断处理养殖水体中的毒性物质TAN和NO2--N;(2)可作为养殖对象摄食的食物;(3)微生物群落的组成和结构稳定;(4)对外界具有一定的抗干扰能力。生物絮凝系统微生物群落中具有水处理能力的优势菌是异养细菌或自养硝化细菌,而异养细菌的数量及其水处理能力主要是通过C/N来调控的。在异养型生物絮凝系统中每处理1 kg CP为30%的饲料产生的TAN大约需要消耗0.465 kg的碳水化合物[2]及一定的氧气,如果仅靠异养细菌去维持系统的水处理能力,需要向系统中投入大量的碳源,必将导致系统DO降低和TSS过高,危及系统中的养殖对象,也将导致系统崩溃。硝化型生物絮凝系统构建成功后仅需添加少量碳源去维持絮团菌群的活性,明显降低生产成本,同时处理相同含量的TAN所消耗的溶解氧要比异养型系统少[3],从而减少对系统稳定性的干扰。由于硝化细菌的繁殖速度远比异养细菌要慢,硝化型生物絮凝系统构建前期需要较长的时间,直到第4至7周才能发现NO2--N浓度下降[4],因此降低构建硝化型系统所需的时间成本显得尤为重要。
参考谭洪新等[5]使用的构建硝化型生物絮凝系统的方法,将生物絮凝技术应用到凡纳滨对虾室内封闭养殖系统中,探索养殖密度对该养殖模式下凡纳滨对虾生长性能与水质的影响以及养殖的合适密度,为推广应用硝化型生物絮凝系统养殖凡纳滨对虾提供技术支撑。
1 材料与方法 1.1 实验地点及设施实验于2017年4月30日—2017年8月13日(106 d)在浙江省湖州市某室内工厂化养殖场进行。系统主体是正方形混凝土养殖池。养殖池主体尺寸为8 m×8 m×1.6 m,有效养殖水体体积约为90 m3。每个养殖池主要通过底部纳米管平均分布曝气的方式来增氧和保持水体循环流动。每个养殖大棚有以上规格的养殖池16个,4个大棚共64个养殖池连接1台罗茨鼓风机[功率18.5 kW/h,百事德机械(江苏)有限公司],用于养殖池水体的增氧和搅拌,同时每4个大棚配置1个循环水锅炉,加热后的锅炉水或者夏天的井水沿着主管道进入每个养殖池底的管道,用于冬天水体保温或夏天水体降温。
1.2 实验设计与养殖管理实验按300、600、900尾/m3投放虾苗,共设3个处理组(BFT300、BFT600和BFT900),每个处理组设3个平行组。放苗后的第2天开始进行投喂,养殖所用饲料为凡纳滨对虾配合饲料(CP≥42%,正大饲料有限公司)。
每天投喂4次,分别在5:30、10:30、15:30、20:30。当日每次投喂量均等。投喂策略如下:当体长 < 1 cm时,投饵量占体质量的10%;当体长为1~3 cm时,投饵量占体质量的8.0%;当体长为3~7 cm时,投饵量占体质量的4.0%;当体长为7~10 cm时,投饵量占体质量3.5%;当体长 > 10 cm时,投饵量占体质量的3%。为了准确掌握投饵量,每个养殖池放2个料台,每餐喂完1 h后查看料台吃食情况,全程记录投饵量,同时还需参考当天的水质情况对投喂策略进行调整。
养殖前中期需定期向系统中输入碳源(一水葡萄糖,C6H12O6·H2O,纯度≥99%,含C量36.0%,西王药业有限公司),葡萄糖添加频率为每天投加1次,时间为每天8:00,日投糖量从第10天开始根据氨氮和亚硝氮的浓度变化进行调整,养殖前期当氨氮浓度高于0.5 mg/L时,按饲料投喂量的75%添加,当氨氮浓度低于0.5 mg/L,停止添加碳源;养殖中期亚硝氮开始上升后,加糖量按5 g/m3投入系统中,直至亚硝氮开始下降,系统转化稳定后停止加糖。调节pH和碱度用小苏打(NaHCO3,总碱度:99.0~100.0%)。当pH低于7.8时,补充NaHCO3,慢慢调节pH至8.0,养殖后期pH波动较大,需采用补充NaHCO3和将体积分数为0.32的液碱稀释一定倍数再使用的两种方式共同调控。每7天补充1次Ca2+、Mg2+、K+等微量元素使Ca2+≥200 mg/L,Mg2+≥200 mg/L,K+≥250 mg/L。整个养殖期间零换水也不去除总悬浮物颗粒TSS,每3天按3 g/m3添加复合微生物制剂,其中主要成分是芽孢杆菌(浓度为104 cfu/mL诺碧清牌生物净水剂,拜耳动物保健有限公司),将菌群按盐度活化后均匀泼洒至养殖池内,直至TAN和NO2--N含量降低并稳定于较低水平,即系统转化成功后停止加菌。
1.3 养殖用水的预处理2017年4月27日—5月15日(16 d)为系统的预培养期,9个生物絮体养殖池先放自来水至池高1.3 m处(养殖有效水体为83 m3),曝气去氯24 h,加入盐卤调整水体盐度为15,同时向系统中加入粉料5 g /m3(CP≥46%,正大饲料有限公司),葡萄糖120 g/m3,经盐度活化复合微生物制剂3 g/m3,运行8 d后,放苗前1周再向系统中加入30 g/m3的葡萄糖。放苗前1天水质状况为:TAN浓度为(0.03±0.00)mg/L,NO2--N浓度为(0.006±0.000)mg/L,NO3--N浓度为(0.045±0.000)mg/L。开始投放P5虾苗,经检疫不带特定病原的虾苗购自深圳市环球联众生物科技有限公司,2017年5月16日晚放苗,虾苗规格为(0.5±0.1)cm。
1.4 样品的采集与测定 1.4.1 水样的采集和水质指标的测定实验期间,每天上午8:00使用便携式多参数水质分析仪(Multi 3430,WTW,德国)现场监测pH、溶解氧(DO)、温度(T),经0.45 μm滤膜过滤后测总氨氮(TAN)、亚硝态氮(NO2--N)、硝态氮(NO3--N)和碱度(Alkalinity),其中TAN的浓度(次溴酸钠氧化法)、亚硝态氮(NO2--N)浓度(萘乙二胺分光光度法)、硝态氮(NO3--N)浓度(锌镉还原法)和碱度(酸碱指示剂滴定法)等水质指标测定方法按照《水和废水监测分析方法》(第四版)进行。每3天测定养殖系统中总悬浮固体颗粒物(TSS)和生物絮团沉积量(FV30min),其中TSS含量的测定采用称重法[6],FV30min的测定参考AVNIMELECH等[7]使用的方法(即用英霍夫锥形管量取1 000 mL测量水体静置30 min所获得的生物絮团沉积读数)。水体中的芽孢杆菌和总菌每10天测1次,其中总菌数量的检测采用2216E涂布计数法[8],芽孢杆菌用LB培养基计数[9]。培养基成分如下:蛋白胨10 g,酵母粉5 g,琼脂18 g,NaCl 30 g,加水至1 L,调节pH为7.0~7.2,计数前将水样于80 ℃水浴锅中加热20 min。
1.4.2 凡纳滨对虾生长性能的测定实验第45天开始,每5天从3个实验组的9个养殖池中每池随机捞起凡纳滨对虾50尾,并分别测量对虾的体长和体质量。实验结束时,记录每个养殖实验组凡纳滨对虾的总产量(total production,kg/m3),成活率(survival rate,RS,%),特定生长率(specific growth rate,RSG,%)、饲料系数(feed coefficient rate,RFC)。计算公式如下:
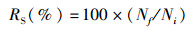 (1)
(1)
 (2)
(2)
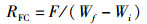 (3)
(3)
式中:Nf和Ni分别为终末存活尾数和初始投放尾数,尾;T0和T1分别为养殖第1天和最后1天;W1和W0分别为时间T1和T0的平均体质量,g;F为饲料总投喂量,g;Wf和Wi分别为终末总质量和初始总质量,g。
1.5 数据的分析与处理用Origin 8和Adobe Illustrator CS4作图,采用SPSS 19.0软件对数据进行单因素方差分析(ANOVA),以P < 0.05作为差异显著水平。
2 结果与分析 2.1 水质和生物絮体含量的变化如表 1所示,DO、pH随密度的增加而降低,除BFT900组pH在养殖后期处于6.75~7.00之间,各组DO、pH和水温均在适宜对虾生长的安全范围内。养殖前75天,碱度随着投喂量的增加缓慢下降,3组之间碱度差异不显著(P > 0.05)。第75天之后,碱度快速下降,并且养殖密度越高,碱度下降趋势越快,碱度下降速度BFT900 > BFT600 > BFT300组,碱度最低时分别是69、96和120 mg CaCO3/L。在第85天之后开始向系统中添加碳酸氢钠,调控碱度处于150 mg CaCO3/L左右,碱度一直处于上下起伏的状态(图 1a)。

|
表 1 养殖期间溶解氧、pH和温度的平均值和极值 Tab.1 Average value and extremum of dissolved oxygen, pH and temperature during culture period |

|
图 1 养殖期间碱度(a)、TAN(b)、NO2--N(c)、NO3--N(d)、FV30min(e)和TSS(f)浓度的变化(n=3) Fig. 1 Change of Alkalinity(a), TAN(b), NO2--N(c), NO3--N(d), FV30min(e) and TSS(f) concentration throughout culture period(n=3) |
如图 1b所示,3个处理组的TAN变化趋势相似,实验前16 d为养殖水体预培养期,饲料、碳源和益生菌均是一次性加入,由于前期水体透光性好,系统主要以微藻为主,此阶段TAN会有所积累,在第10天向系统中投加碳源,由于氨氧化细菌、亚硝化类菌初步成熟,氨氮会降低,亚硝基氮会逐步增加,从而出现TAN迅速降低的趋势。实验过程中,3个处理组的TAN浓度从第19天开始呈现上升趋势,3组最高TAN浓度差异显著(P < 0.05),并且养殖密度越高,上升速度越快,峰值也越大。3个实验组TAN浓度在第35天后稳定于非常低的浓度水平。
如图 1c所示,3个处理组的NO2--N浓度变化趋势相似,并且养殖密度越高,上升速度越快,峰值也越大。在0~35 d一直稳定于较低浓度水平,但是36~79 d时NO2--N浓度出现较大幅度的上升之后再下降,BFT300、BFT600和BFT900这3个处理组NO2--N的浓度峰值分别出现在第71天、73天和73天。3个处理组的最高NO2--N浓度差异显著(P < 0.05),最高峰值浓度分别为5.25、9.85和15.2 mg/L。第81~105天,3个处理组的NO2--N浓度均低于0.50 mg/L。
如图 1d所示,养殖期间,3个处理组的NO3--N浓度变化趋势相似,并随着密度升高,NO3--N浓度也升高。每个处理组的NO3--N浓度在0~60 d一直处于较低的水平,在75~105 d之间出现不同程度的升高趋势,在实验结束时BFT300、BFT600和BFT900这3个实验组的最高NO3--N浓度差异显著(P < 0.05),分别为37.55、66.55和153.7 mg/L。随着养殖密度的增加,最终的NO3--N浓度也越高。
养殖期间,在不控制TSS浓度情况下,3个处理组的FV30min和TSS的含量一直在升高(图 1e,图 1f),实验结束时,3个处理组的FV30min和TSS的浓度差异显著(P < 0.05)。随着养殖密度的升高,处理组的FV30min和TSS的浓度也越高。3个处理组的最高TSS含量范围在280~750 mg/L。终末TSS含量在280~750 mg/L时,养殖系统也能很好地控制TAN和NO2--N的积累。
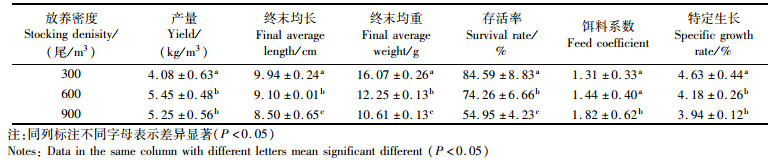
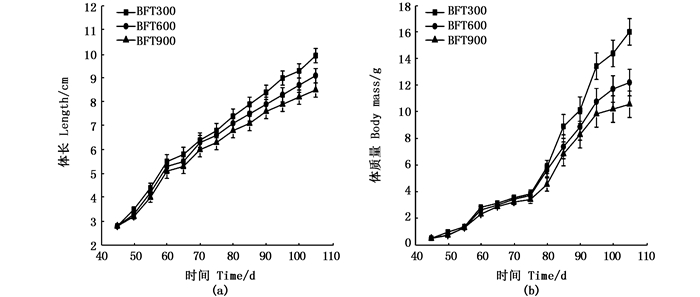
2.2 凡纳滨对虾的生长性能由表 2和图 2可知,在300、600和900尾/m3的放养密度下,对虾存活率随密度增加而下降,BFT300、BFT600和BFT900这3个处理组存活率分别为84.59%±8.83%、74.26%±6.66%和54.95%±4.23%,这3组之间差异显著(P < 0.05)。养殖结束时,对虾的平均体长和体质量随密度增加而降低,BFT300组的对虾平均体长和体质量显著高于BFT600和BFT900组(P < 0.05)。养殖产量BFT600组最高,为(5.45±0.48) kg/m3,与BFT900组差异不显著(P > 0.05),但显著高于BFT300组产量[(4.08±0.63) kg/m3]。饵料系数随密度增加而升高,其中BFT300和BFT600组差异不显著(P > 0.05),但均显著低于BFT900组[(1.82±0.62)kg/m3, P < 0.05]。结合养殖综合效果和生产效益,构建硝化型生物絮凝系统过程中海水养殖凡纳滨对虾,养殖密度可参考300~600尾/m3确定。
|
表 2 各系统凡纳滨对虾的生长性能 Tab.2 Growth performance of Litopenaeus vannameiin different system(n=3) |
|
图 2 不同密度条件下南美白对虾的体长和体质量的变化 Fig. 2 Change of Litopenaeus vannamei body length and mass at the different density |
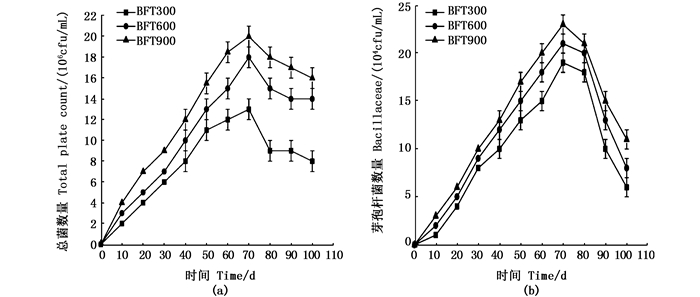
如图 3可知,在养殖0~70 d,3个实验组的水体总菌和芽孢杆菌数量都有相同上升趋势,在70~105 d都出现了相同下降趋势,分析原因主要是因为70 d以后养殖系统停止碳源和益生菌的输入。对水体总菌而言,BFT600组和BFT900组显著高于BFT300组(P < 0.05),主要原因是养殖过程中投喂量和碳源输入量的差异的。3个处理组芽孢杆菌量在数量级上差异不显著(P > 0.05),但整体芽胞杆菌数量由高到低分别是BFT900、BFT600和BFT300。结合图 1b和图 1c可知,复合芽孢杆菌的定期添加可以很好地控制TAN浓度 < 1.7 mg/L,在40~60 d可以有效地控制NO2--N浓度缓慢上升。
|
图 3 各组水体总菌和芽孢杆菌数量浓度变化情况 Fig. 3 Variation of amounts of total plate count and Bacillaceae in each group |
自养细菌和异养细菌的繁殖过程都需要消耗碱度,但相比异养细菌,自养细菌消耗的碱度更多[10]。FURTADO等[11]研究发现在零水交换的系统中,碱度在70 mg CaCO3 /L以上,pH≥7.38的条件下才能保证絮体的形成和硝化细菌的挂膜,在生物絮凝养殖系统中碱度应该保持在100 mg CaCO3/L以上[12],同时自养菌的生长增殖以及硝化能力也会随着养殖水体碱度的提高而有所增加,因此在养殖中后期的硝化型生物絮凝系统中对碱度的调控显得尤为重要。在本试验中,前75天3组碱度差异不显著,主要原因是养殖前期3个处理组需度过一个较高浓度氨氮和亚硝氮的过程,所以养殖过程中投喂量上升得较慢。第81天之后,由于硝化型生物絮凝系统的转化完成,投喂恢复正常,密度越高,投喂量也越大,系统硝化过程所需消耗碱度就越多,所以会呈现密度越高,碱度下降越快的趋势。
零换水系统的残饵和粪便的积累往往会导致养殖水体TAN和NO2--N浓度过高,从而对养殖对象有毒害作用,增加养殖风险。GAONA等[13]研究表明生物絮凝系统的养殖水体可以维持低水平的TAN和NO2--N浓度,但也有一些研究发现在高密度的零水交换养殖系统里,仅靠异养细菌的同化作用为主导的水处理方式,即使有较高浓度的絮团,系统仍然出现TAN和NO2--N积累。本研究发现,随着葡萄糖和芽孢杆菌的持续添加,促进了芽孢杆菌等异养细菌的生长,有效的降解有机物,明显降低TAN的浓度,但是对NO2--N的积累没起到很好的抑制效果,而且随着养殖密度的升高,TAN和NO2--N的浓度也升高。LIN等[14]研究发现盐度为15的凡纳滨对虾养殖系统中的NO2--N安全浓度在6.1 mg/L,本次研究中BFT600和BFT900两组的NO2--N最高浓度均大于此浓度,其主要原因是:在第36~73天时,BFT600和BFT900两组相对于BFT300组密度要高,投喂量要多,氮源负荷要高,该阶段系统主要以异养细菌为主,其次是氨氧化细菌(AOB),系统中异养细菌所不能同化的部分TAN将被AOB氧化成NO2--N,所以出现了不同程度的NO2--N积累现象,该过程会给养殖带来一定的风险。因此,构建硝化型生物絮凝系统过程中需适当降低养殖密度,同时搭配合理的控料策略和益生菌的添加策略,将养殖过程的毒害作用风险降到最低。
在零换水对虾养殖系统中,NO3--N往往都会有积累,一些研究发现,到达养殖后期,系统平均NO3--N浓度均高于200 mg/L,但本研究中3个养殖密度组在养殖后期NO3--N浓度都低于200 mg/L,同时养殖密度越高,系统的NO3--N浓度也越高。分析原因是养殖中、后期硝化型生物絮凝系统转化成功后,养殖投喂量恢复正常,此时养殖密度越高,投喂量越高,通过硝化作用转化的NO3--N量也越多,所以NO3--N浓度会越高。
综上所述,在构建硝化型生物絮凝系统过程中,前期更应注重碳源和益生菌的添加以及投喂策略的调控,将养殖中期的氮污染物的毒害风险降到最低,养殖后期系统成功转化后应更注重系统的稳定性,调控更多的偏向于系统碱度、pH、DO和TSS等影响硝化型生物絮凝系统稳定性的因素。
3.2 养殖密度对对虾生长性能的影响不同养殖密度条件下,水体的氮负荷不同,对水质的影响也不同,因此在养殖系统驯化过程中设置了低、中、高3种养殖密度梯度,旨在为硝化型生物絮凝系统在对虾养殖中的应用提供参考。COHEN等[15]发现在3 300尾/m3的密度下,控制TSS浓度低于200 mg/L时,养殖时间为50 d,对虾获得了超过97%的存活率。本次研究中密度远远低于3 300尾/m3这个标准,却获得相对较低的存活率和较高的饵料系数,同时存活率随着养殖密度的增加而降低。分析可知在构建硝化型生物絮凝系统过程中,系统在前中期会经历一个较高TAN和NO2--N的过程,并且随着密度的增加,TAN和NO2--N的含量也越高,这将影响对虾的存活和生长。有研究[17-18]指出,虾类有自残现象,且随密度增加,种群内对资源、空间竞争加剧,虾体相互接触频率、彼此撕咬和吞食程度加剧,导致残杀率提高,从而降低成活率。密度是影响同类相残程度的主要因子,对虾成活率与密度呈负相关[18-19]。可见,成活率除受水质影响外,还随密度增加而下降,也正是对虾因空间相对减小,彼此撕咬自残等攻击行为加剧的结果,是密度制约死亡率的主要反映。因此,室内高密度硝化型生物絮凝养殖系统养殖虾类时,选择合适的放养密度显得尤为重要。
3.3 密度对系统细菌群落动态变化的影响生物絮团作为一个小型生态圈,承担了细菌、原生动物等微生物和一些悬浮的有机碎屑聚集的载体,作为食物链的末端以分解者的角色存在,通过微生物作用去分解和去除生物絮凝系统中养殖对象的残饵和粪便,从而达到净化水质和稳定系统的目的,因此对生物絮团的菌群研究以及定向调控显得尤为重要。生物絮团的优势菌群决定了生物絮凝系统的性质,异养型生物絮凝养殖系统内生物絮团的细菌群落主要优势菌是异养细菌,其中异养细菌又以变形菌为主[20-22],该类系统主要通过对碳源和益生菌的添加进行调控。对于零换水养殖系统而言,异养型生物絮凝系统主要存在于驯化硝化型生物絮凝系统的前中期,是以异养细菌为优势菌群逐渐演变为以硝化细菌为优势菌群的养殖系统。在养殖过程中发现,3个实验组的水体总菌和芽孢杆菌数量都有先升高后降低的变化趋势,主要是由于人为添加碳源和益生菌调控所致。对水体总菌而言,BFT900和BFT600两组养殖密度高,系统中所输入的碳源和益生菌的量也相对较多,导致水体总菌和异养细菌的量要远远高于BFT300组。养殖系统的硝化细菌往往需要35~49 d的培养时间才能显著降低TAN和NO2--N的浓度[23-25],3个养殖密度组的TAN浓度在投苗后第19天显著降低并趋于稳定,NO2--N浓度都在投苗后第57天显著降低并趋于稳定,总菌数量在投苗后第57天后开始逐渐降低,主要受碳源和益生菌停止添加以及系统优势菌群的演替所致。
养殖前期利用碳源和复合芽孢杆菌的添加,可有效提升异养型生物絮团的含量,降低氨氮和亚硝氮的浓度,从而降低对虾顺利渡过硝化细菌缓慢增长期的养殖风险。当系统成功转为以硝化细菌为优势菌群的硝化型生物絮凝系统时,氨氮和亚硝氮浓度会处于较低的水平,之后无需再向系统中投入碳源和复合芽孢杆菌。此时通过对系统硝化型生物絮团的相关影响因素的调控,可以有效地处理水质,保持养殖系统的稳定,促进对虾的健康生长,降低投入成本和提高养殖利润,这对生物絮凝养殖系统在对虾养殖方面的应用具有重要推进作用。
| [1] |
王志杰.两株益生菌在凡纳滨对虾生物絮团养殖中的应用[D].青岛: 中国海洋大学, 2014. WANG Z J. The application of two strains probiotics in LitoPenaeus vannamei biological floccules breeding[D]. Qingdao: Ocean University of China, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014203904.htm |
| [2] |
AVNIMELECH Y. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 1999, 176(3/4): 227-235. |
| [3] |
EBELING J M, TIMMONS M B, BISOGNI J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/4): 346-358. |
| [4] |
CORREIA E S, WILKENFELD J S, MORRIS T C, et al. Intensive nursery production of the Pacific white shrimp LitoPenaeus vannamei using two commercial feeds with high and low protein content in a biofloc-dominated system[J]. Aquacultural Engineering, 2014, 59: 48-54. DOI:10.1016/j.aquaeng.2014.02.002 |
| [5] |
谭洪新, 庞云, 王潮辉, 等. 驯化硝化型生物絮体养殖南美白对虾的初步研究[J]. 上海海洋大学学报, 2017, 26(4): 490-500. TAN H X, PANG Y, WANG C H, et al. Preliminary study on domesticating nitrifying bio-flocs to rear LitoPenaeus vannamei[J]. Journal of Shanghai Ocean University, 2017, 26(4): 490-500. |
| [6] |
国家环境保护总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002. National Environmental Protection Agency. Water and wastewater monitoring and analysis methods[M]. 4th ed. Beijing: China Environmental Science Press, 2002. |
| [7] |
AVNIMELECH Y, KOCHBA M. Evaluation of nitrogen uptake and excretion by tilapia in bio floc tanks, using 15N tracing[J]. Aquaculture, 2009, 287(1/2): 163-168. |
| [8] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378.7-2007海洋监测规范第7部分: 近海污染生态调查和生物监测[S].北京: 中国标准出版社, 2008. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.7-2007 The specification for marine monitoring-Part 7: Ecological survey for offshore pollution and biological monitoring[S]. Beijing: Standards Press of China, 2008. |
| [9] |
叶建勇, 单洪伟, 王贤丰, 等. 添加甘蔗渣悬浮颗粒和芽孢杆菌对凡纳滨对虾生长和养殖环境的影响[J]. 中国海洋大学学报, 2016, 46(4): 43-49. YE J Y, SHAN H W, WANG X F, et al. Effect of addition of suspended bagasse with Bacillus sp. on growth of LitoPenaeus vannamei and environment of culture tank[J]. Periodical of Ocean University of China, 2016, 46(4): 43-49. |
| [10] |
EBELING J M, TIMMONS M B, BISOGNI J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/4): 346-358. |
| [11] |
FURTADO P S, POERSCH L H, WASIELESKY W Jr. The effect of different alkalinity levels on LitoPenaeus vannamei reared with biofloc technology (BFT)[J]. Aquaculture International, 2015, 23(1): 345-358. DOI:10.1007/s10499-014-9819-x |
| [12] |
FURTADO P S, POERSCH L H, WASIELESKY W Jr. Effect of calcium hydroxide, carbonate and sodium bicarbonate on water quality and zootechnical performance of shrimp LitoPenaeus vannamei reared in bio-flocs technology (BFT) systems[J]. Aquaculture, 2011, 321(1/2): 130-135. |
| [13] |
GAONA C A P, POERSCH L H, KRUMMENAUER D, et al. The effect of solids removal on water quality, growth and survival of LitoPenaeus vannamei in a biofloc technology culture system[J]. International Journal of Recirculating Aquaculture, 2011, 12(1): 54-73. |
| [14] |
LIN Y C, CHEN J C. Acute toxicity of nitrite on LitoPenaeus vannamei (Boone) juveniles at different salinity levels[J]. Aquaculture, 2003, 224(1/4): 193-201. |
| [15] |
COHEN J M, SAMOCHA T M, FOX J M, et al. Characterization of water quality factors during intensive raceway production of juvenile LitoPenaeus vannamei using limited discharge and biosecure management tools[J]. Aquacultural Engineering, 2005, 32(3/4): 425-442. |
| [16] |
卢静, 李德尚, 董双林. 对虾池的放养密度对浮游生物群落的影响[J]. 水产学报, 2000, 24(3): 240-246. LU J, LI D S, DONG S L. The impact of stocking density on plankton community in shrimp pond[J]. Journal of Fisheries of China, 2000, 24(3): 240-246. |
| [17] |
朱春华. 盐度对南美白对虾生长性能的影响[J]. 水产科技情报, 2002, 29(4): 166-168. ZHU C H. Effect of salinity on the growth characteristics of whiteleg shrimp Penaeus vannamei[J]. Fisheries Science & Technology Information, 2002, 29(4): 166-168. DOI:10.3969/j.issn.1001-1994.2002.04.004 |
| [18] |
张天时, 孔杰, 刘萍, 等. 饵料和养殖密度对中国对虾幼虾生长及存活率的影响[J]. 海洋水产研究, 2008, 29(3): 41-47. ZHANG T S, KONG J, LIU P, et al. Effect of diet and stocking density on growth and survivorship of juvenile shrimp Fenneropenaeus chinensis[J]. Marine Fisheries Research, 2008, 29(3): 41-47. |
| [19] |
COLLINS J P, CHEEK J E. Effect of food and density on development of typical and cannibalistic salamander larvae in Ambystoma tigrinum nebulosum[J]. American Zoologist, 1983, 23(1): 77-84. DOI:10.1093/icb/23.1.77 |
| [20] |
王娇, 马灌楠, 邓元告, 等. 葡萄糖和盐度对卤虫生长、养殖系统生物絮团形成及其微生物多样性的影响[J]. 海洋与湖沼, 2015, 46(2): 372-380. WANG J, MA G N, DENG Y G, et al. Effects of glucose and salinity on Artemia growth, biofloc formation, and microbial diversity in culture[J]. Oceanologia et Limnologia Sinica, 2015, 46(2): 372-380. |
| [21] |
夏耘, 郁二蒙, 谢骏, 等. 基于PCR-DGGE技术分析生物絮团的细菌群落结构[J]. 水产学报, 2012, 36(10): 1563-1571. XIA Y, YU E M, XIE J, et al. Analysis of bacterial community structure of bio-floc by PCR-DGGE[J]. Journal of Fisheries of China, 2012, 36(10): 1563-1571. |
| [22] |
杨章武, 杨铿, 张哲, 等. 基于宏基因组测序技术分析凡纳滨对虾育苗中生物絮团细菌群落结构[J]. 福建水产, 2015, 37(2): 91-97. YANG Z W, YANG K, ZHANG Z, et al. Research on the biofloc bacterial community structure during larval rearing of LitoPenaeus vannamei using metagenome sequencing[J]. Journal of Fujian Fisheries, 2015, 37(2): 91-97. |
| [23] |
COHEN J M, SAMOCHA T M, FOX J M, et al. Characterization of water quality factors during intensive raceway production of juvenile LitoPenaeus vannamei using limited discharge and biosecure management tools[J]. Aquacultural Engineering, 2005, 32(3/4): 425-442. |
| [24] |
ARNOLD S J, COMAN F E, JACKSON C J, et al. High-intensity, zero water-exchange production of juvenile tiger shrimp, Penaeus monodon:an evaluation of artificial substrates and stocking density[J]. Aquaculture, 2009, 293(1/2): 42-48. |
| [25] |
KUHN D D, DRAHOS D D, MARSH L, et al. Evaluation of nitrifying bacteria product to improve nitrification efficacy in recirculating aquaculture systems[J]. Aquacultural Engineering, 2010, 43(2): 78-82. DOI:10.1016/j.aquaeng.2010.07.001 |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


