2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
脊椎动物的胚胎发育中,心脏是最早形成并且行使功能的器官之一。心脏祖细胞最早起源于侧板中胚层的两侧对称区域,之后它们由两边向中间迁移,汇聚形成心管。心管由心肌层和心内膜层构成,随后经过复杂的形态发生,包括不对称发育、环化、多腔室结构以及瓣膜的形成,最终形成成熟的心脏[1]。房室间隔(atrioventricular canal, AVC)的出现,是保证腔室结构正常形成的关键[2]。在心脏生长发育这一系列复杂进程中,环化(looping)阶段最为重要的步骤之一。心脏环化的发育过程是由心管不同区域的复杂运动所共同完成,而且这些不同的心管运动区域与心脏腔室分化后的区域有关联性,例如:不同心脏区域具有特异表达的分子标记以及细胞特征[3]。
T-box编码的转录因子在器官形成中具有重要作用[4],TBX20属于T-box转录因子家族的成员之一,在果蝇到人类的早期心脏发育调控过程中具有高度的保守性[5]。Tbx20对整个心脏发育过程和维持成体心脏功能都发挥了重要的作用,心脏发育过程中Tbx20持续表达,小鼠胚胎E7.5中Tbx20在生心中胚层处表达,E8.0~8.5在新月形生心区和环化的心管处表达[6]。小鼠中Tbx20促进腔室的分化、增殖[7-9]和调控早期AVC的形成[10]。
Tbx20缺失的小鼠,妊娠中期胚胎致死,心脏发育畸形。突变表型为心脏发育异常,最初的心室减小,环化受到阻碍,胚胎发育E8.0~9.5,流出道处突变表型更加明显,至E9.5心管趋于线性[8],表明Tbx20在第一生心区(first heart field, FHF)的心脏腔室发育中起到重要作用[11]。在斑马鱼中敲降(morpholino, MO)tbx20,胚胎发育48 hpf,仍维持心管结构且没有出现明显的腔室分化[12]。而在斑马鱼ENU造成的tbx20突变体中,其心脏大小在48 hpf明显小于野生型斑马鱼心脏,且拉伸成线,出现心脏水肿导致胚胎死亡[11]。斑马鱼胚胎在发育至48 hpf,心脏的腔室结构基本分化形成,心室和心房在结构上呈现出完全不同的形态[13]。此时心室特异表达基因ventrial myosin heavy chian(vmhc)和心房特异表达基因atrial myosin heavy chian(amhc)的表达分布情况可作为心室心房表达的标志性基因,cardiac myosin light chain 2 (cmlc2)在整个心脏的心肌细胞中表达[14]。因此,vmhc、amhc和cmlc2可以作为检验tbx20是否影响心脏腔室分化的重要标志性基因。
本研究利用CRISPR/Cas9系统[15],通过显微注射技术获得斑马鱼tbx20突变鱼系,内交后代可以产生1/4纯合突变体,光镜观察突变体心脏形态变化,结果显示突变体胚胎发育至48 hpf,心包腔肿大,静脉窦瘀血,环化异常,心脏结构变形;胚胎发育至3 dpf,心脏拉伸成线状结构。通过tbx20突变体的构建,进一步发现tbx20的突变影响一些心脏早期腔室发育基因的表达,为探究tbx20基因在早期心脏腔室分化和先天性心脏病致病机理过程中发挥的作用提供模型。
1 材料与方法 1.1 菌株和质粒zCas9质粒来源于北京大学生命科学学院张博教授实验室。gRNA质粒来源于北京大学分子医学研究所熊敬维教授实验室。感受态细菌DH5α购买于TIANGEN公司。
1.2 斑马鱼的来源与养殖条件本实验所用野生斑马鱼均为AB品系,养殖水温为28.5 ℃。对斑马鱼的所有处理均以科研为目的进行养殖和使用,且按照上海海洋大学动物伦理相关规定进行(IACUC 20171009)。
1.3 gRNA靶点设计利用Ensembl (http://asia.ensembl.org/index.htmlasia.ensembl.org/index.html)网站获得斑马鱼tbx20基因序列,然后在ZiFiT (http://zifit.partners.org/ZiFiT/)网站上输入序列查找tbx20基因gRNA位点,并根据靶点设计上下游引物。靶点序列及上下游引物如表 1所示。

|
表 1 斑马鱼tbx20敲除靶点及引物 Tab.1 Target site and primers of tbx20 |
Cas9质粒菌液扩摇16 h。TIAN prep Rapid Mini plamid Kit(TIANGEN)快速质粒小提试剂盒抽提质粒(紫外分光光度计检测质粒的浓度及260/280值),15 000 marker(TaKaRa)琼脂糖凝胶电泳检测质粒质量。Xbal(NEB)线性化Cas9质粒,37 ℃反应20 min,1 %琼脂糖凝胶电泳,110 V,30 min。线性化质粒用DNA Clean & ConcentratorTM-5(Zymo Research)纯化试剂盒进行纯化,最后按照mMESSAGE mMACHINE T7 Ultra (Ambion)试剂盒进行体外转录。LiCl乙醇沉淀法纯化Cas9 mRNA,Nanodrop测浓度,取1 μL产物进行电泳检验。
gRNA质粒菌液扩摇14 h,TIAN prep Rapid Mini plamid Kit(TIANGEN)快速质粒小提试剂盒抽提质粒(紫外分光光度计检测质粒的浓度及260/280值)。以gRNA质粒为模板使用高保真酶PCR扩增目的片段,2%琼脂糖凝胶电泳120 V,30 min。用DNA Clean & ConcentratorTM-5 (Zymo Research)纯化tbx20 gRNA PCR产物,纯化产物使用MAXIscript T7(Ambion)试剂盒进行体外转录。LiCl乙醇沉淀法纯化tbx20 gRNA,测浓度,2 %琼脂糖凝胶电泳,150 V,10 min, 检验目的条带正确性。
1.5 显微注射显微注射前一天晚上,挑选若干对雌雄亲本进行配对并暗处理约12 h,次日进行产卵交配,收集鱼卵,一部分作为野生型对照,另一部分用于显微注射。gRNA浓度为80~100 ng/μL,Cas9 mRNA浓度为400 ng/μL,注射剂量为1 nL/枚,最佳注射时间为1细胞期胚胎。
1.6 T7E1酶切检测胚胎发育至48 hpf开始收集,5枚一组。碱裂法提取基因组即加50 μL 50 mmol/L NaOH,95 ℃ 10 min,振荡;95 ℃ 10 min,最后加1 mmol/L Tris HCl,15 000 r/min离心5 min,可于-20 ℃保存。以提取的基因组为模板,加入tbx20引物进行PCR扩增。体系如下:反应总体积为25 μL,内含Enzyme mix 12.5 μL、正反引物各1 μL、模板2 μL、dd H2O 8.5 μL。
2%琼脂糖凝胶电泳,120 V,30 min。随后将单一条带的PCR产物进行T7E1(NEB)酶切检测。酶切体系如下:反应总体积为9.5 μL,内含PCR产物5 μL、Buffer 2.1 μL、dd H2O 3.5 μL。
反应条件:95 ℃ 5 min,梯度降温至室温。
将T7E1酶和H2O按1: 1混合,然后取0.5 μL混合液加到上述体系,37 ℃,40 min。2%凝胶电泳,120 V,30 min。T7E1酶切检测阳性的PCR产物,选取2~3组送生物公司(上海生工)用Sanger法测序进一步确定基因是否敲除成功。将敲除成功的tbx20 F0斑马鱼养至成鱼,随后对F0成鱼和同批次养至成鱼的野生型交配,产生的胚胎在受精后48 h用T7E1酶切法检测嵌合体。在tbx20 F0成鱼中,共检测了30尾鱼,其中有11尾鱼的后代酶切显示为嵌合体。将这些后代养至成鱼,剪尾提取基因组,TA克隆测序分析基因型。计算种质遗传效率,方法为检测F0成鱼中阳性嵌合体占总检测鱼尾数的比例,本实验中为11/30=36.7%,为种质遗传效率。
1.7 qRT-PCR检测tbx20突变体中下游基因的表达将F1内交获得F2,胚胎发育3 dpf提取纯合突变体的总RNA,野生型作为对照。按照逆转录试剂盒(TaKaRa PrimeScriptTMRT reagent Kit with gDNA Eraser)说明书将RNA逆转录为cDNA,以cDNA为目的模板对目的基因进行扩增,基因引物见表 2。

|
表 2 vmhc、amhc和myl7 qRT-PCR引物 Tab.2 qRT-PCR primers of vmhc, amhc and myl7 genes |
反应体系如下:反应总体积为14 μL,内含LightCycler® 480 SYBR GreenⅠMaster 10 μL、cDNA 2 μL、F/R引物各1 μL、RNase-free water 6 μL。
反应条件:95 ℃,10 s;60 ℃,30 s;40个循环。β-actin作为内参,确定靶基因在突变体和野生型斑马鱼中的表达。其中实验样本重复6次,每次技术重复3次,后用2-ΔΔCT分析法进行数据分析,使用SPSS软件进行单因素方差的计算与分析,最终的柱形图用GraphPad Prism.5.0软件进行绘制。
1.8 地高辛标记RNA探针进行斑马鱼整体原位杂交将F1内交获得F2,收集并固定48 hpf胚胎,野生型作为对照。按照AmbionMAXIscript® Kit试剂盒的步骤合成地高辛(Digoxigenin)标记探针并执行原位杂交,主要过程如下:胚胎用4%多聚甲醛在4 ℃固定过夜后用30%、50%、70%和100%的乙醇溶液(PBST配制)进行梯度脱水,每级处理5 min。蛋白酶K(10 μg/mL,Roche)处理10 min后,将胚胎置于预杂交液65 ℃孵育3 h,加入探针,65 ℃孵育过夜。第二天,样品经洗涤之后,加入地高辛抗体,4 ℃过夜。第三天,样品用NBT-BCIP(Roche)染色后,移至3%甲基纤维素(Sigma),在显微镜(Zeiss)下观察拍照。
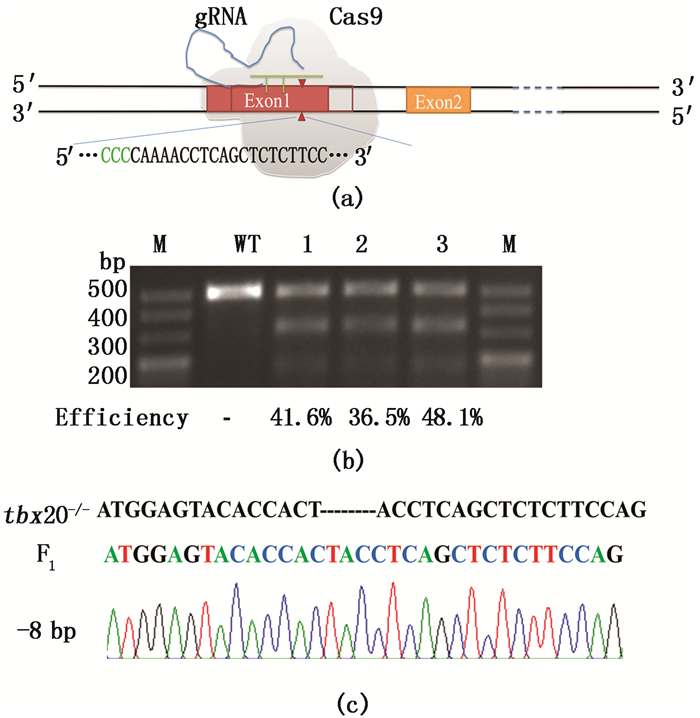
2 结果与分析 2.1 利用CRISPR/Cas9成功构建斑马鱼tbx20基因突变体tbx20基因属于T-box家族成员之一,位于16号染色体上,拥有一个转录本。tbx20共有8个外显子,本实验中gRNA设计在第一个外显子上(图 1a)。在靶点上下游设计一对检测引物,扩增片段长度为499 bp。
|
(a) tbx20基因敲除靶点示意图,靶点位于第一个外显子上; (b) tbx20 F0 T7E1酶切结果; M. Marker;WT.野生型;1、2、3为3组平行实验; (c) tbx20 F1剪尾测序结果及峰图 (a) tbx20 knockout schematic diagram, the target site is located on the first exon; (b) T7E1 assay in tbx20 F0; M. Marker; WT. wild type; 1, 2 and 3 mean three groups of parallel experiments; (c) Sequence analysis in tbx20 F1 图 1 CRISPR/Cas9介导的斑马鱼tbx20基因敲除 Fig. 1 CRISPR/Cas9-mediated tbx20 knockout in zebrafish |
用28.5 ℃的曝气灭菌水清洗受精卵,均匀分布在模具中,对一细胞期受精卵进行注射,每枚胚胎注射Cas9 mRNA和gRNA,终浓度分别为400 ng/μL和80~100 ng/μL,注射剂量为1 nL/枚。显微注射48 hpf后,随机收集3组胚胎,5枚胚胎一组,分别标号为1、2、3。T7E1酶切检测结果显示3组敲除效率分别为41.6 %、36.5%和48.1%,平均突变效率约为42.1 % (图 1b)。将敲除成功胚胎养至成鱼剪尾测序筛选F1,共剪30尾鱼,其中阳性结果为11尾,测序分析F1中突变的种质遗传效率为36.7 %。图 1c为F1剪尾筛选得到tbx20敲除成功鱼系靶位点的测序序列及峰图,序列比对结果显示,tbx20敲除鱼系的突变类型为靶点位置缺失8 bp。
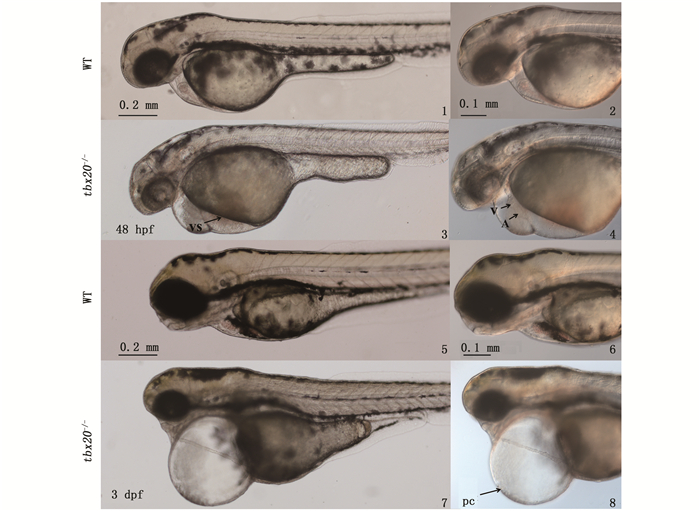
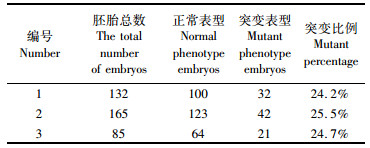
2.2 斑马鱼tbx20突变导致心脏发育异常将F1剪尾筛出的tbx20-8 bp突变携带者进行内交,观察F2中tbx20突变体表型。结果显示:受精后48 h的胚胎中,心包腔肿大,静脉窦瘀血,环化异常,心脏结构变形;3 dpf胚胎中,突变表型逐渐加深,心脏拉伸成线状结构(图版Ⅰ-8)。统计突变个体数,突变体比例约占总胚胎数量的25%(表 3),符合孟德尔遗传定律。
|
光镜观察F2突变体表型(侧面观,头向左)。胚胎发育48 hpf WT可见正常形成的心脏,而tbx20突变体中心包腔肿大,静脉窦瘀血,环化异常,心脏结构变形;3 dpf,突变表型逐渐加深,心脏拉伸成线状结构。右图(2、4、6、8)为左图(1、3、5、7)的局部放大图;WT.野生型;V.心室;A.心房;VS.静脉窦;PC.心包腔 The phenotype of F2 (lateral view, head left). Normal heart could be observed at 48 hpf during embryos development in WT, while the mutant of tbx20 displayed pericardial cavity oedema, an accumulation of blood cells in the venous sinus and then occurred malformation heart with looping defects. All the phenotypes became severer at 3 dpf and tbx20 mutant showed linear heart. 2, 4, 6, 8 were the partial enlarged view of 1, 3, 5, 7; WT. wild type; V. ventricle; A. atrium; VS. venous sinus; PC. pericardial cavity 图版 Ⅰ tbx20突变体表型 Plate Ⅰ Phenotype of tbx20 |
|
表 3 F2表型数量统计 Tab.3 Count of the F2′s phenotype |
进一步通过使用myosin, light chain 7, regulatory(myl7)EGFP标记心肌细胞对突变鱼系心脏表型进行荧光成像,结果显示突变体心脏拉伸成线状结构,环化异常(图版Ⅱ)。

|
F2突变体胚胎发育至3 dpf荧光表型图(1、2、5、6侧面观;3、4、7、8腹面观)。V.心室;A.心房 The phenotype of WT and mutant zebrafish imaged with myl7 : EGFP at 3 dpf (1, 2, 5, 6 lateral view; 3, 4, 7, 8 ventral view). V. ventricle; A. atrium 图版 Ⅱ myl7 : EGFP荧光观察tbx20突变表型 Plate Ⅱ Fluorescence and bright micrographs of WT and tbx20 mutant morphology |
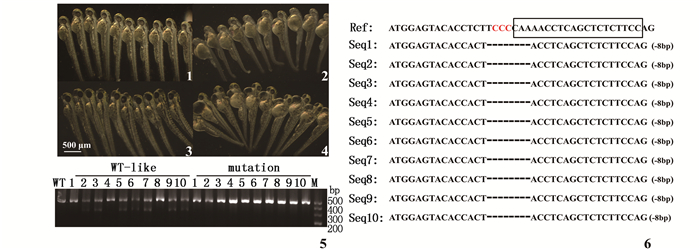
对10尾突变鱼系心脏表型进行成像,观察到突变体心脏发育异常,胚胎在发育5 dpf开始死亡。随后将这10尾鱼进行T7E1酶切检测,其中WT-like表型的有7组(2、3、5、6、7、9、10)酶切呈现3条带,将WT、WT-like、mutant三组PCR产物送测序,结果显示WT-like组中均为杂合或野生型,mutant组均缺失8 bp(图 2)。
|
F2突变体胚胎发育至48 hpf、3 dpf 10尾鱼光镜表型(1、2、3、4侧面观);1、3为野生型;2、4为突变体;5为单胚胎T7E1酶切胶图;6为对应的单胚胎测序图 The phenotype of 10 mutants at 48 hpf and 3 dpf (1,2,3,4 lateral view);1, 3. wild type;2, 4. mutant; 5. The T7E1 efficiency of single embryo; 6. single embryo sequence analysis 图 2 tbx20突变表型与基因型对应验证 Fig. 2 Validation of phenotype and genotype from wild-type and tbx20 mutant zebrafish |
tbx20杂合子内交获得F2,胚胎发育48 hpf,分别固定收集野生型和突变体表型的胚胎。此时的斑马鱼胚胎心房心室分化基本完成,此时vmhc集中在心室高表达,amhc在心房表达,myl7作为心脏的标记基因在整个心脏的心肌细胞中均有表达。原位杂交结果分析显示,与野生型相比,突变体中未检测到tbx20表达(图版Ⅲ-2),突变体中vmhc泛表达在整个心脏中(图版Ⅲ-4),且表达量增多。突变体中amhc的表达减少(图版Ⅲ-6),在线性化的心脏中,在心房的表达区域也明显缩小;而myl7的表达范围在野生型和突变体中无明显差异(图版Ⅲ-8),都在整个心脏中表达, 但突变体中myl7表达量有所降低。
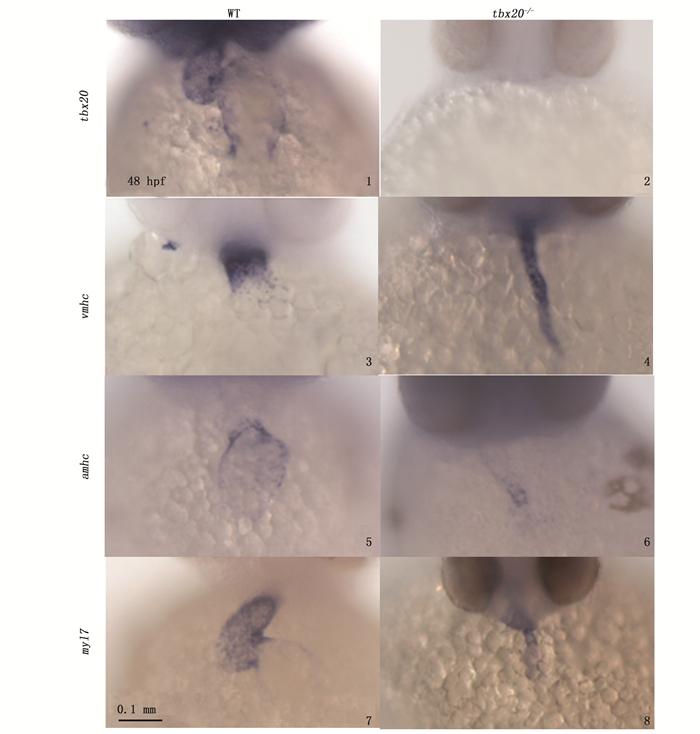
|
F2突变体胚胎发育至48 hpf原位杂交各基因表达图(腹面观,头在上)。WT.野生型; tbx20-/-.纯合突变体 In situ hybridization of target genes in the WT and mutants at 48 hpf (ventral view with head on the top; ). WT. wild type; tbx20-/-. mutant 图版 Ⅲ tbx20突变体中靶基因的表达位点检测 Plate Ⅲ Expression of tbx20, vmhc, amhc and myl7 in WT and tbx20 mutant embryos at 48 hpf was shown by in situ hybridization |
tbx20基因杂合子内交获得F2,胚胎发育3 dpf提取纯合突变体的总RNA,野生型作为对照,荧光定量PCR结果分析显示,与野生型(1.00)相比,F2纯合突变体中3个基因表达水平均有变化。在突变体中:vmhc基因表达上调了191.7%(P < 0.01),有统计学差异;amhc表达下调了0.06%(P > 0.05),无统计学差异;myl7基因表达下调了71.9%(P < 0.001),有统计学差异。见图 3。
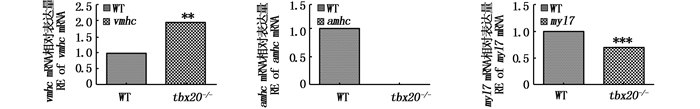
|
**为有显著统计学差异P < 0.01 ,***为有极其显著的统计学差异P < 0.001 **represents statistical significance, P < 0.01. ***represents highly statistical significance, P < 0.001 图 3 qRT-PCR检测vmhc、amhc和myl7在tbx20 F2突变斑马鱼(3 dpf)中的表达 Fig. 3 Relative level of vmhc, amhc and myl7 RNA in tbx20 mutant zebrafish (F2, 3 dpf) detected by qRT-PCR |
心脏环化是脊椎动物早期心脏发育的重要特征之一[1]。TBX20作为T-box转录因子家族中一员,其在维持心肌细胞结构和功能中起到中心调控作用[16]。Tbx20在心脏的FHF和第二生心区(second heart field, SHF)处均有表达,且作为转录因子促进腔室的分化和增殖[7-9]。
在小鼠中,Tbx20在心脏祖细胞、早期心管的心肌细胞和形成心内膜垫的内皮细胞等处高表达,其在心脏瓣膜的前体结构和正在形成的房室隔膜处皆有表达[17]。小鼠Tbx20基因敲除导致胚胎死亡同时伴随严重的心管发育不全即环化失败。Tbx20敲降的小鼠表现出流出道间隔不能正常形成和右心心室的发育不正常,其表型跟人类的先天性心脏缺损症状类似[9],表明其在瓣膜的发育和促进腔室细胞的增殖和分化中扮演关键角色。此外,非洲爪蟾tbx20的敲降表现出心脏环化失败,腔室结构不能正常形成[18]。这些模式动物中tbx20基因的敲除或者敲降,均产生心脏环化失败、房室间隔异常的相关表型,但tbx20在影响早期心脏腔室分化方面的作用并未有深入研究的报道。
本实验首次用CRISPR/Cas9对斑马鱼tbx20进行基因敲除,并成功获得纯合突变体。通过光镜分析突变体心脏形态变化,观察胚胎发育至48 hpf,心包腔肿大,静脉窦瘀血,环化异常,心脏结构变形;3 dpf,突变表型逐渐加深,心脏拉伸成线状结构;该表型与小鼠Tbx20缺失和斑马鱼MO敲降tbx20的表型吻合。目前对tbx20的研究多数定位在促进心脏祖细胞形成和心肌细胞增殖方面,而对早期心脏腔室分化影响的研究较少。已有的斑马鱼MO敲降实验只是在F0水平上对tbx20的表型进行研究,并且MO脱靶率相对较高[19]。综合以上原因,本研究采用CRISPR/Cas9技术敲除tbx20并获得突变鱼系,将有助于深入挖掘其tbx20纯合子表型和探究其在腔室分化过程中的作用机制。
斑马鱼心脏中,vmhc基因被严格地限制在心室中表达[14],小鸡心房肌球蛋白重链基因(AMHC1)的表达局限于形成心管的前心房部分[18]。地高辛原位杂交结果分析显示,tbx20敲除的F2纯合突变斑马鱼胚胎(48 hpf)中, 心房特异表达的amhc基因和心脏中胚层标记基因myl7的表达范围缩小,心室特异的vmhc基因表达与野生型个体的表达差异明显,在整个突变体心脏中都表达。LU等[11]关于斑马鱼tbx20突变体的研究结果显示:正常心脏在发育至26 hpf可逐渐形成能够推动血液循环的原始心脏管,而在斑马鱼tbx20突变体心脏祖细胞数量明显减少,且大小明显小于野生型,其功能仅支持循环,通过对突变体中tbx20的过表达实验,发现了心肌细胞的增加进而使得突变体心脏腔室形成异常的表型得到缓解补救。结合本实验中荧光定量实验[20-21]与原位杂交实验,我们发现在tbx20突变体中,腔室形成的重要标记基因表达异常。在斑马鱼已有的tbx20突变体报道中,强调了其可以通过调控心肌细胞的数量进而影响到腔室的发育,但是没有探究在突变体中心脏形成的关键区域作用机制。本实验通过原位杂交和荧光定量的方法,确定了在心脏腔室形成过程中,tbx20的缺失,导致了腔室的异常,为我们进一步探究早期心脏腔室形成及分化提供了帮助。
本研究在模式动物斑马鱼中利用CRISPR/Cas9系统,通过显微注射技术成功获得tbx20基因突变鱼系,并在突变体中观察到心脏突变表型:胚胎发育至48 hpf,心包腔肿大,静脉窦瘀血,环化异常,心脏结构变形;3 dpf,突变表型逐渐加深,心脏拉伸成线状结构。tbx20的突变影响了基因vmhc、amhc和myl7的表达。tbx20突变鱼系的成功制备,为进一步深入探究tbx20基因对早期心脏发育腔室分化过程的影响奠定基础。
| [1] |
STAINIER D Y R. Zebrafish genetics and vertebrate heart formation[J]. Nature Reviews Genetics, 2001, 2(1): 39-48. DOI:10.1038/35047564 |
| [2] |
YAMADA M, REVELLI J P, EICHELE G, et al. Expression of chick Tbx-2, Tbx-3, and Tbx-5 genes during early heart development:evidence for BMP2 induction of Tbx2[J]. Developmental Biology, 2000, 228(1): 95-105. DOI:10.1006/dbio.2000.9927 |
| [3] |
RIBEIRO I, KAWAKAMI Y, BVSCHER D, et al. Tbx2 and Tbx3 regulate the dynamics of cell proliferation during heart remodeling[J]. PLoS One, 2007, 2(4): e398. DOI:10.1371/journal.pone.0000398 |
| [4] |
NAICHE L A, HARRELSON Z, KELLY R G, et al. T-box genes in vertebrate development[J]. Annual Review of Genetics, 2005, 39: 219-239. DOI:10.1146/annurev.genet.39.073003.105925 |
| [5] |
PLAGEMAN JR T F, YUTZEY K E. T-box genes and heart development:putting the "T" in heart[J]. Developmental Dynamics, 2005, 232(1): 11-20. |
| [6] |
KRAUS F, HAENIG B, KISPERT A. Cloning and expression analysis of the mouse T-box gene Tbx20[J]. Mechanisms of Development, 2001, 100(1): 87-91. |
| [7] |
CAI C L, ZHOU W L, YANG L, et al. T-box genes coordinate regional rates of proliferation and regional specification during cardiogenesis[J]. Development, 2005, 132(10): 2475-2487. DOI:10.1242/dev.01832 |
| [8] |
STENNARD F A, COSTA M W, LAI D, et al. Murine T-box transcription factor Tbx20 acts as a repressor during heart development, and is essential for adult heart integrity, function and adaptation[J]. Development, 2005, 132(10): 2451-2462. DOI:10.1242/dev.01799 |
| [9] |
TAKEUCHI J K, MILEIKOVSKAIA M, KOSHIBA-TAKEUCHI K, et al. Tbx20 dose-dependently regulates transcription factor networks required for mouse heart and motoneuron development[J]. Development, 2005, 132(10): 2463-2474. DOI:10.1242/dev.01827 |
| [10] |
CAI X Q, NOMURA-KITABAYASHI A, CAI W B, et al. Myocardial Tbx20 regulates early atrioventricular canal formation and endocardial epithelial-mesenchymal transition via Bmp2[J]. Developmental Biology, 2011, 360(2): 381-390. DOI:10.1016/j.ydbio.2011.09.023 |
| [11] |
LU F, LANGENBACHER A, CHEN J N. Tbx20 drives cardiac progenitor formation and cardiomyocyte proliferation in zebrafish[J]. Developmental Biology, 2017, 421(2): 139-148. DOI:10.1016/j.ydbio.2016.12.009 |
| [12] |
SZETO D P, GRIFFIN K J P, KIMELMAN D. HrT is required for cardiovascular development in zebrafish[J]. Development, 2002, 129(21): 5093-5101. |
| [13] |
SATIN J, FUJⅡ S, DEHAAN R L. Development of cardiac beat rate in early chick embryos is regulated by regional cues[J]. Developmental Biology, 1988, 129(1): 103-113. DOI:10.1016/0012-1606(88)90165-0 |
| [14] |
YELON D, HORNE S A, STAINIER D Y R. Restricted expression of cardiac myosin genes reveals regulated aspects of heart tube assembly in zebrafish[J]. Developmental Biology, 1999, 214(1): 23-37. DOI:10.1006/dbio.1999.9406 |
| [15] |
XIAO A, WANG Z X, HU Y Y, et al. Chromosomal deletions and inversions mediated by TALENs and CRISPR/Cas in zebrafish[J]. Nucleic Acids Research, 2013, 41(14): e141. DOI:10.1093/nar/gkt464 |
| [16] |
QIAN L, MOHAPATRA B, AKASAKA T, et al. Transcription factor neuromancer/TBX20 is required for cardiac function in Drosophila with implications for human heart disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(50): 19833-19838. DOI:10.1073/pnas.0808705105 |
| [17] |
STENNARD F A, COSTA M W, ELLIOTT D A, et al. Cardiac T-box factor Tbx20 directly interacts with Nkx2-5, GATA4, and GATA5 in regulation of gene expression in the developing heart[J]. Developmental Biology, 2003, 262(2): 206-224. DOI:10.1016/S0012-1606(03)00385-3 |
| [18] |
BROWN D D, MARTZ S N, BINDER O, et al. Tbx5 and Tbx20 act synergistically to control vertebrate heart morphogenesis[J]. Development, 2005, 132(3): 553-563. DOI:10.1242/dev.01596 |
| [19] |
YUTZEY K E, RHEE J T, BADER D. Expression of the atrial-specific myosin heavy chain AMHC1 and the establishment of anteroposterior polarity in the developing chicken heart[J]. Development, 1994, 120(4): 871-883. |
| [20] |
宋美泽, 黎明, 李健, 等. 急性氨氮暴露对大弹涂鱼炎性反应相关基因表达的影响[J]. 水产学报, 2018, 42(11): 1704-1710. SONG M Z, LI M, LI J, et al. Effects of acute ammonia exposure on gene involved in inflammation of mudskipper[J]. Journal of Fisheries of China, 2018, 42(11): 1704-1710. |
| [21] |
朱嘉诚, 贺婵娟, 贾晓会, 等. 转基因及相关亚品系鱼腥藻的纯化[J]. 上海海洋大学学报, 2018, 27(5): 645-655. ZHU J C, HE C J, JIA X H, et al. Separation and purification for transgenic Anabaena sp. PCC 7120 and its subspecies[J]. Journal of Shanghai Ocean University, 2018, 27(5): 645-655. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


