2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室, 上海 201306;
3. 上海海洋大学 科技部海洋生物科学国际联合研究中心, 上海 201306
随着衰老的发生,生物体的机能出现衰退,其维持自身稳态和应对外界环境变化的能力不断降低,并最终走向死亡[1]。生物体衰老过程中常伴随有性腺的萎缩、繁殖能力减弱、神经功能退化和免疫系统紊乱等特征[2-4]。衰老会影响生物体的多种生理活动。在哺乳动物中,衰老会引起小鼠昼夜节律和褪黑素分泌节律的紊乱[5],人类褪黑素分泌的节律性减弱,引起睡眠-觉醒相对前移和静息-活动昼夜周期的失衡[6-7]。衰老还会使动物的呼吸代谢率下降[8],引起人类应激反应能力降低等[9]。
目前衰老对鱼类生理活动的影响研究较少。地球上的生物,因为长期受到光照、温度等环境因素的周期性影响,其行为常表现出一定的节律性。有些生物白天活动夜晚休息,为昼行性动物(diurnal animals),像人类;而另一些生物则相反,像小鼠,为夜行性动物(nocturnal animals)[10-11]。鱼类昼夜节律的控制器位于松果体(pineal gland)[12-13]中,松果体是鱼类重要的感光器官和内分泌器官,通过释放褪黑素(melatonin)来调控鱼类的昼夜行为节律[14]。昼夜节律会影响生物的多种生理活动,而衰老常会引起生物自身昼夜节律紊乱,使生物体的行为活动丧失节律性[15]。
应激是指生物体在环境因素发生改变时,对刺激所作出的一系列包括特异性和非特异性的防御反应[16]。在鱼类中,应激反应可分为短期和长期两种。长期应激反应是指鱼类持续地遭受有害因子的刺激而又无法逃脱,通常会使鱼类个体的生长发育受阻,抵抗力下降,不利于鱼类生存;而短期应激反应则对鱼类的生长和发育具有一定的积极作用。鱼类的短期应激反应表现为个体的警觉性提高、运动加快、呼吸耗氧率增加等,这些反应有利于个体获取食物,逃避捕食者,增强对环境的适应能力[17-19]。鱼类的应激反应是在神经和内分泌等系统的参与下实现的。鱼体当感受到环境刺激后,通常会从行为和代谢等方面做出应激反应,其体内的肾上腺素和皮质醇的分泌量会增加,从而增强代谢,加块体内备用能源物质的分解[20]。与代谢层面的反应相比,行为学上的反应则是更加直接而有效的,行为学上的短期应激反应有利于鱼类快速躲避危险,增加生存的机会[21]。目前,衰老对鱼类影响的研究主要集中在组织病理学和分子生物学方面,在鱼类应激反应,尤其是行为学反应上尚未有系统的研究[22-23]。
斑马鱼是一种经典的模式生物,通常情况下它的平均寿命约为3.5年,有记载的寿命最长的个体曾存活66个月[24]。在斑马鱼衰老的过程中,机体会发生一系列退行性变化,如肌肉萎缩、脊椎弯曲、体内脂肪含量上升、产卵质量下降和认知功能障碍等[25]。近年来,利用鱼类行为监测技术对斑马鱼游泳轨迹和运动行为的研究已经在鱼类病理学和药物毒理学的研究中得到广泛的应用[26-28],但衰老对斑马鱼的生理和行为学影响目前尚未见到报道。
本实验选取6月龄与30月龄斑马鱼作为研究样本,比较它们在躯体形态和繁殖能力上的差异,并通过斑马鱼行为监测系统和Loligo System泳道呼吸系统,比较衰老和年轻斑马鱼在昼夜节律、应激行为和呼吸代谢方面的差异。呼吸代谢和应激行为是鱼类重要的生理活动,通过研究衰老斑马鱼和年轻斑马鱼在上述生理活动中的差异,有助于理解衰老对鱼类机体生理功能的影响,并为进一步探究衰老影响鱼类生理功能的内在机制奠定基础。
1 材料与方法 1.1 实验材料所用斑马鱼均为TB品系(野生型tubigen),实验前饲养于上海海洋大学适应生理学实验室斑马鱼循环水系统(上海海圣生物实验设备有限公司),养殖水温度为26~28 ℃,光照强度约200 lx,光照周期为光照:黑暗= 12 h:12 h;早8:00与晚20:00各投喂一次卤虫。
1.2 实验方法 1.2.1 产卵情况统计取6月龄与30月龄斑马鱼各8组。每组雄鱼2条、雌鱼1条,在插有挡板的产卵缸里暗处理一夜(12 h)。次日早上8:00,将待测斑马鱼转移至光照条件下,拔开挡板,0.5 h后收集鱼卵,统计产卵数量;在显微镜下观察鱼卵受精情况,计算受精率(受精率为受精鱼卵数量与总鱼卵数量之比);将成功受精的鱼卵转移至28 ℃恒温培养箱中孵化,每天观察3~4次,去除死卵,72 h后统计孵化数量,计算孵化率(孵化率为孵化鱼卵数量与总鱼卵数量之比);孵化出来的幼鱼喂食草履虫,每天两次,受精后7 d统计幼鱼成活数量,计算成活率(成活率为成活鱼卵数量与总鱼卵数量之比)。
1.2.2 游泳行为分析取6月龄与30月龄斑马鱼各8组,使用Viewpoint行为监测系统记录其24 h(光照:黑暗=12 h:12 h)间的游泳距离、游泳时间等参数,并生成游泳轨迹图。实验开始前对斑马鱼连续追逐2 min,施以驱逐刺激,之后迅速将其转移至Viewpoint系统中观察;当实验进行到第12 h时,设置一个光照刺激。追逐刺激5 min后的游泳行为定义为“驱逐应激后游泳行为”;光照刺激5 min后的游泳行为定义为“光照应激后游泳行为”;施加光照前5 min,斑马鱼在经历了12 h稳定运动后的游泳行为定义为“稳定期游泳行为”。以2 cm/s速度作为快速与慢速游泳行为的临界点[29]。记录驱逐应激和光照应激后两组斑马鱼的快速游泳距离、快速游泳时间、慢速游泳距离和慢速游泳时间,并计算平均速度,与“稳定阶段游泳行为”作对比,分析两种应激条件下斑马鱼游泳行为的变化,以及不同年龄斑马鱼在两种刺激条件下应激游泳行为的差异。统计光照12 h(白天)和黑暗12 h(夜晚)状态下斑马鱼的游泳距离、游泳时间和游泳速度,分析斑马鱼游泳行为中的昼夜节律性。
1.2.3 呼吸代谢率测定取6月龄与30月龄斑马鱼各6组,使用Loligo System泳道呼吸系统测定斑马鱼的呼吸代谢率。实验参数设置为10 min一次循环,每个循环包含3个阶段:冲洗(flush)5 min;等待(wait)1 min;测量(measure)4 min。斑马鱼呼吸代谢率的测定采用“力竭追赶方案”[30]。将斑马鱼在水槽中追赶至力竭状态,用捞网将其捞出水面,空气中暴露1 min,之后将其迅速转移至呼吸室中,测量斑马鱼呼吸耗氧率(rate of oxygen consumption, MO2)。此过程中出现的MO2峰值即为斑马鱼的最大代谢率(maximal metabolic rate, MMR);之后MO2不断下降,其逐渐稳定时的MO2值即为斑马鱼的标准代谢率(standard metabolic rate, SMR);MMR与SMR之差即为斑马鱼的有氧代谢范围(metabolic range, MS)。
1.3 数据分析使用Microsoft Excel 2010对实验结果进行初步统计与计算;实验数据作图采用Graphpad prism 5.0;数据分析使用SPSS 22.0,采用独立样本t检验的方法对不同年龄组斑马鱼的繁殖、代谢和游泳行为等数据进行统计分析。所有数据以“平均值±标准差(M ± SD)”的形式来表示。显著性水平设置为P < 0.05。
2 结果与分析 2.1 不同年龄斑马鱼躯体形态和繁殖能力差异对斑马鱼日常生活习性的观察发现,6月龄斑马鱼在鱼缸中运动活跃,在喂食时反应快速,进食积极;而30月龄斑马鱼常沉于鱼缸底部,活动较少。与6月龄斑马鱼相比,30月龄斑马鱼在躯体形态上均出现了明显的脊柱弯曲,且身体条纹较6月龄斑马鱼颜色暗淡(图版Ⅰ)。这通常被认为是与衰老相关的形态特征。

|
图版 Ⅰ 斑马鱼侧面图 Plate Ⅰ Profile of zebrafish |
斑马鱼繁殖实验结果表明:30月龄斑马鱼的产卵数量低于6月龄斑马鱼,但结果差异不显著(P=0.07, 图 1a);30月龄斑马鱼的受精率、孵化率和成活率均显著低于6月龄斑马鱼(P < 0.05, 图 1b)。与6月龄斑马鱼相比,30月龄斑马鱼的繁殖能力明显下降,显示出明显衰老的特征。
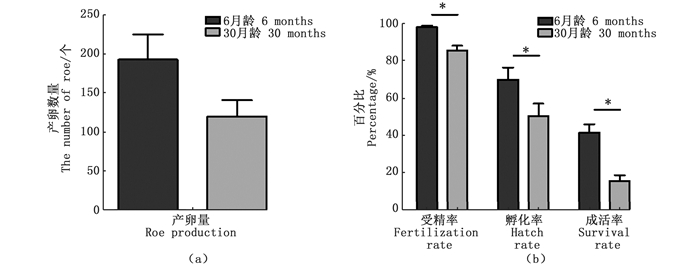
|
*表示不同年龄斑马鱼受精率、孵化率和成活率的差异显著 The asterisk indicates that there is a significant difference in fertilization rate, hatching rate and survival rate between different age zebrafish 图 1 斑马鱼繁殖能力 Fig. 1 Reprodcutive performance of zebrafish |
斑马鱼昼夜行为节律的实验结果显示,6月龄斑马鱼的游泳行为存在显著昼夜差异。其在白昼时的快速游泳距离、快速游泳时间、慢速游泳距离和平均游泳速度均显著高于黑夜时期;而慢速游泳时间则显著低于黑夜时期,其昼夜间游泳行为具有明显的节律性,白昼活动量大,黑夜活动量小,符合其昼行性特点(图 2)。相比6月龄斑马鱼,30月龄斑马鱼白昼与黑夜的各项行为学参数均未表现出显著性差异,尤其是其慢速游泳距离和慢速游泳时间,白昼与黑夜之间几乎完全相同(图 2),说明衰老的斑马鱼其游泳行为丧失了昼夜节律。
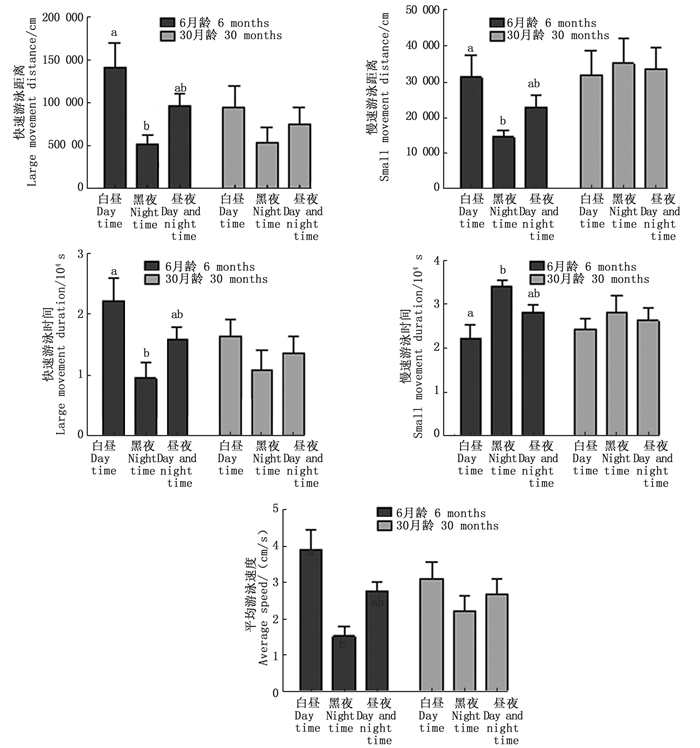
|
图中小写字母表示同一年龄组斑马鱼中白昼、黑夜与昼夜游泳行为之间存在显著性差异 Different lowercase letters in the figure indicate that there is a significant difference between daytime and night swimming behaviors in the zebrafish of the same age group 图 2 6月龄与30月龄斑马鱼的昼夜行为节律 Fig. 2 The circadian rhythms of behavior of 6 months and 30 months zebrafish |
图版Ⅱ为斑马鱼应激行为轨迹图,图中红色曲线表示快速游泳行为轨迹,绿色曲线表示慢速游泳行为轨迹。斑马鱼应激游泳行为轨迹显示:在光照应激前5 min,斑马鱼经历了12 h的稳定期,游泳路线相对稳定,以慢速游泳行为为主(图版Ⅱ-1、4);当斑马鱼受到驱逐和光照刺激后,6月龄斑马鱼的行为变为以快速游泳行为为主,游泳轨迹密集,出现频繁的转向运动(图版Ⅱ-2、3);而30月龄斑马鱼在受到驱逐和光照刺激后,其游泳轨迹未发生明显改变,依然以慢速游泳行为为主(图版Ⅱ-5、6)。应激游泳行为的差异反映了斑马鱼感受外界刺激并作出相关反应的能力,说明衰老可能使斑马鱼感知环境刺激的功能出现了障碍,其应激游泳能力也出现了衰退。

|
1、4为稳定12 h后斑马鱼行为轨迹;2、5为驱逐应激后5 min行为轨迹;3、6为光照应激后5 min行为轨迹。1、2、3为6月龄斑马鱼;4、5、6为30月龄斑马鱼 1, 4 are the 5 min behavior after 12 h stabilization; 2, 5 are the 5 min behavior after chase stress; 3, 6 are the 5 min behavior after light stress. Pictures 1, 2, 3 are the behavior of 6 months zebrafish; 4, 5, 6 are the behavior of 30 months zebrafish 图版 Ⅱ 斑马鱼应激行为轨迹图 Plate Ⅱ Track map of swimming behavior of zebrafish after stress |
斑马鱼应激游泳行为的统计结果表明:与稳定期游泳行为相比,驱逐刺激在6月龄斑马鱼中引起了明显的应激反应,其快速游泳距离、快速游泳时间和平均游泳速度均显著上升,慢速游泳时间显著下降(P < 0.05);驱逐刺激同样在30月龄斑马鱼中引起了应激反应,其应激后的快速游泳时间和平均游泳速度较平稳期显著上升(P < 0.05)。但是,对比二者的游泳行为发现,在遭受驱逐刺激后,6月龄斑马鱼的快速游泳距离、快速游泳时间和平均游泳速度均高于30月龄斑马鱼,慢速游泳时间低于30月龄斑马鱼(P < 0.05),这说明衰老和年轻斑马鱼均能感受到外界的驱逐刺激,并能对其作出反应,但衰老斑马鱼在驱逐刺激后的游泳能力明显低于年轻斑马鱼(图 3)。
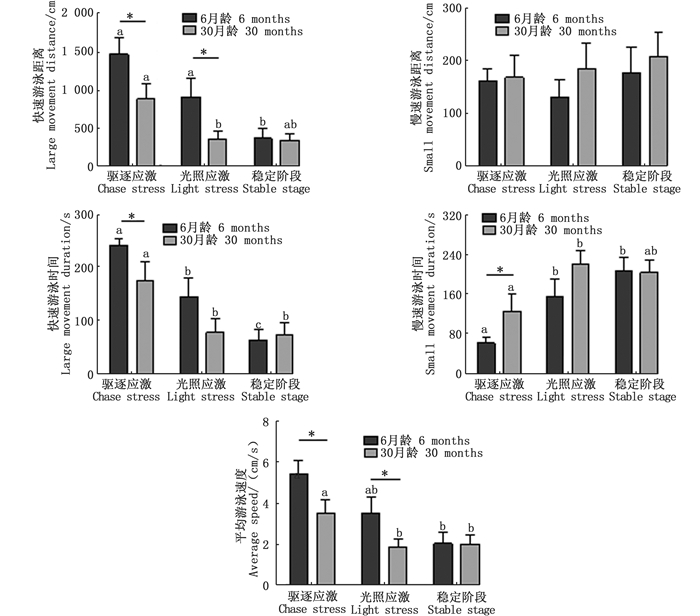
|
图中*表示不同年龄组斑马鱼应激游泳行为的差异显著;小写字母表示同一年龄组斑马鱼驱逐应激、光照应激与稳定期游泳行为之间的差异显著 The asterisk in the figure indicates a significant difference of swimming behavior of different age groups; different lowercase letters indicate the significant difference between the stable behavior and the behavior under different stress in the same age group 图 3 斑马鱼应激游泳行为统计 Fig. 3 The statistics of swimming behavior of zebrafish after stress |
与稳定期游泳行为相比,6月龄斑马鱼在光照刺激后的快速游泳距离和快速游泳时间显著上升(P < 0.05);而30月龄斑马鱼的光照应激后游泳行为与稳定期游泳行为相比无显著差异。对比二者的游泳行为发现,在遭受光照刺激后,6月龄斑马鱼的快速游泳距离和平均游泳速度均高于30月龄斑马鱼(P < 0.05),这说明衰老的斑马鱼无法有效地对光照刺激作出反应,其在光照刺激后的游泳能力也明显低于年轻斑马鱼(图 3)。
2.4 衰老对斑马鱼呼吸代谢的影响斑马鱼呼吸代谢实验结果表明:30月龄斑马鱼的标准代谢率SMR、最大代谢率MMR和有氧代谢范围MS较6月龄斑马鱼均出现显著下降(P < 0.05,图 4)。衰老使斑马鱼的代谢能力减弱。
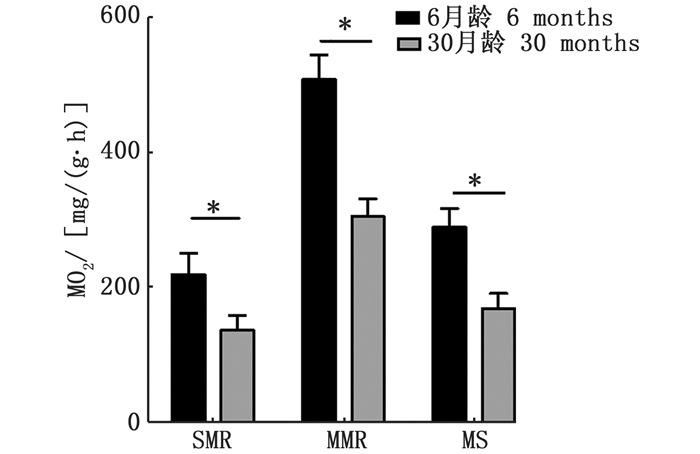
|
图中*表示不同年龄斑马鱼的SMR、MMR和MS之间差异显著 The asterisk in the figure indicates that there is a significant difference between SMR, MMR and MS in zebrafish of different age 图 4 6月龄与30月龄斑马鱼标准代谢率、最大代谢率和代谢范围的对比 Fig. 4 Comparison of SMR, MMR and MS between 6 months and 30 months zebrafish |
鱼类躯体形态的变化通常是其衰老过程中最直观也最重要的一个形态学特征[24]。实验结果表明,与6月龄斑马鱼相比,30月龄斑马鱼出现了脊柱弯曲,躯体条纹暗淡等特征(图版Ⅰ)。斑马鱼的骨骼随年龄的增加而不断发育,脊柱弯曲是其衰老过程中一个重要的形态学特征。研究人员在对衰老斑马鱼进行的影像学分析中发现:衰老的斑马鱼身体曲度的增加不是斑马鱼骨骼发育异常导致的,而是由肌肉退化引起的。在衰老的斑马鱼中,其骨骼随着年龄的增加而不断发育,但肌肉却不能像骨骼一样无限生长,反而由于肌纤维的减少而不断萎缩,导致衰老的斑马鱼脊柱曲度增加[24]。
动物生殖力与年龄密切相关。一般来说,生物体繁殖能力的下降预示着生物步入了衰老的进程[22]。实验发现,30月龄斑马鱼的受精率、孵化率和成活率等指标均低于6月龄斑马鱼(P < 0.05,图 1),证明其繁殖能力较6月龄斑马鱼出现了明显下降。斑马鱼繁殖能力的下降可能是由30月龄斑马鱼性腺退化,体内促性腺发育的激素分泌不足导致的[31]。此外,衰老的斑马鱼和孔雀鱼(P. reticulata),还常具有“卵巢炎”、“肉芽肿”和“脂褐素沉积”等病理学特征[31-32]。
斑马鱼是一种典型的昼行性鱼类,正常情况下其昼夜行为表现出明显的节律性:白天活动旺盛而夜晚主要以静息运动为主[33-34]。本实验中6月龄斑马鱼的游泳行为呈现出明显的昼夜节律:其在光照期(白天)的快速游泳距离、快速游泳时间、慢速游泳距离和平均游泳速度均显著高于黑暗期(夜晚),而慢速游泳时间则低于黑暗期(夜晚);与6月龄斑马鱼相比,30月龄斑马鱼在游泳时间、游泳距离和游泳速度上均没有表现出明显的节律性(图 2),说明衰老使斑马鱼游泳行为的昼夜节律失调。其原因可能与衰老斑马鱼体内生物钟基因表达异常有关。目前在斑马鱼中已经确定的生物钟相关基因共有16个,包括3个clock基因、3个bmal基因、4个per基因和6个cry基因[35-37],这些基因的正常表达使斑马鱼昼夜活动呈现出明显的节律性。对哺乳动物的研究发现,一些生物钟基因与动物的生殖有着密切关系,如敲除Bmal1基因会使雄性小鼠的精子发育异常[38],会抑制雌性小鼠的卵巢发育,使其无法正常妊娠[39]。此外,Per1和Per2基因的异常表达会诱导肿瘤的发生,造成DNA损伤异常修复等[40]。肿瘤的发生与繁殖能力的下降是衰老的重要生理特征之一,而斑马鱼体内的生物钟基因与哺乳动物之间存在较高的同源性[35],推测出斑马鱼中生物钟相关基因的异常表达导致其出现衰老相关的生理学特征,并使其昼夜活动失去原有的节律性。
行为学特征是表征鱼类身体状态的一类重要指标[41-42]。斑马鱼应激游泳轨迹显示:在驱逐和光照刺激后,6月龄斑马鱼的快速游泳运动明显高于30月龄斑马鱼,出现了密集的转向运动;与此相比,30月龄斑马鱼在遭受外界刺激时其游泳轨迹未发生明显变化(图版Ⅱ)。这与前人[43-44]的实验结果相似:鱼类在静息状态下运动时,游泳速度较慢,转向角度较大;当其感受到外界环境的刺激需要逃离时,其游泳速度会迅速加快,出现密集的转向运动[45-46]。鱼类的光照应激反应是由视网膜感知并由视觉神经传导的,正常斑马鱼在黑暗环境下突然受到光照刺激,会尽可能快速地逃离这一区域[47]。本实验中30月龄斑马鱼在光照刺激后游泳轨迹与静息状态下几乎没有差别,一个可能的原因是30月龄斑马鱼的视觉神经系统出现了障碍,无法有效地感知光照刺激。对应激后游泳行为的分析表明,在遭受同等强度的驱逐和光照刺激后,衰老斑马鱼的游泳能力显著低于年轻斑马鱼(图 3)。当遭遇捕食者或其他环境变化时,年轻斑马鱼能够更快地感受刺激,作出反应;当需要逃离危险区域时,年轻斑马鱼的游泳能力更强,速度更快。
鱼类的游泳行为主要依靠有氧代谢提供能量[48]。包括应激游泳行为在内的多种生理活动与其自身的呼吸代谢效率密切相关[49-50]。在对鲫鱼的研究中发现,鲫鱼SMR与MS呈显著正相关,SMR高的个体运动速度快,游泳能力强,且个体的SMR会随着年龄的增加而改变[51]。本实验中衰老斑马鱼的SMR、MMR和MS均显著低于年轻斑马鱼(图 4),代谢能力的降低使其应激游泳能力也显著低于年轻斑马鱼,这与前人[51]在鲫鱼中的实验结果一致。当斑马鱼遭受外界刺激时,较高的代谢能力可以帮助它们调动更多的能量,从而对刺激迅速地做出反应。衰老斑马鱼的代谢能力降低,当它们遭遇外界环境变化时,机体有限的代谢能力无法为剧烈的游泳行为提供足够的氧气,导致其应激游泳能力下降[50-52]。
本实验研究表明,与6月龄斑马鱼相比,30月龄斑马鱼出现了脊柱弯曲和繁殖能力下降等衰老相关的特征。衰老会引起斑马鱼的昼夜节律紊乱,应激功能障碍,呼吸代谢降低等生理学和行为学上的变化。但引起上述变化的机制,目前尚不完全清楚。衰老的斑马鱼体内生物钟基因的表达异常或许是造成这一变化的原因。有关衰老引起斑马鱼行为和代谢变化的分子机制还需要进一步研究。
| [1] |
JOHNSON F B, SINCLAIR D A, GUARENTE L. Molecular biology of aging[J]. Cell, 1999, 96(2): 291-302. DOI:10.1016/S0092-8674(00)80567-X |
| [2] |
BÄL, FARDE L. Dopamine and cognitive functioning: brain imaging findings in Huntington's disease and normal aging[J]. Scandinavian Journal of Psychology, 2001, 42(3): 287-296. DOI:10.1111/sjop.2001.42.issue-3 |
| [3] |
DUGAR A, KECK B J, MAINES L W, et al. Compensatory responses in the aging hippocampal serotonergic system following neurodegenerative injury with 5, 7‐dihydroxytryptamine[J]. Synapse, 2001, 39(2): 109-121. DOI:10.1002/(ISSN)1098-2396 |
| [4] |
TAKEDA T. Senescence-accelerated mouse (SAM): with special reference to age-associated pathology and their modulation[J]. Japanese Journal of Hygiene, 1996, 51(2): 569-578. DOI:10.1265/jjh.51.569 |
| [5] |
BEYNON A L, THOME J, COOGAN A N. Age and time of day influences on the expression of transforming growth factor-beta and phosphorylated SMAD3 in the mouse suprachiasmatic and paraventricular nuclei[J]. Neuroimmunomodulation, 2009, 16(6): 392-399. DOI:10.1159/000228914 |
| [6] |
GIBSON E M, WILLIAMS Ⅲ W P, KRIEGSFELD L J. Aging in the circadian system: considerations for health, disease prevention and longevity[J]. Experimental Gerontology, 2009, 44(1/2): 51-56. |
| [7] |
NAKAMURA T J, NAKAMURA W, YAMAZAKI S, et al. Age-related decline in circadian output[J]. Journal of Neuroscience, 2011, 31(28): 10201-10205. DOI:10.1523/JNEUROSCI.0451-11.2011 |
| [8] |
HACK M A. The effects of mass and age on standard metabolic rate in house crickets[J]. Physiological Entomology, 1997, 22(4): 325-331. DOI:10.1111/j.1365-3032.1997.tb01176.x |
| [9] |
FALI T, VALLET H, SAUCE D. Impact of stress on aged immune system compartments: Overview from fundamental to clinical data[J]. Experimental Gerontology, 2018, 105: 19-26. DOI:10.1016/j.exger.2018.02.007 |
| [10] |
BEN-SHLOMO R, KYRIACOU C P. Circadian rhythm entrainment in flies and mammals[J]. Cell Biochemistry and Biophysics, 2002, 37(2): 141-156. DOI:10.1385/CBB:37:2:141 |
| [11] |
DUNLAP J C. Molecular bases for circadian clocks[J]. Cell, 1999, 96(2): 271-290. DOI:10.1016/S0092-8674(00)80566-8 |
| [12] |
NOCHE R R, LU P N, GOLDSTEIN-KRAL L, et al. Circadian rhythms in the pineal organ persist in zebrafish larvae that lack ventral brain[J]. BMC Neuroscience, 2011, 12: 7. DOI:10.1186/1471-2202-12-7 |
| [13] |
ZHDANOVA I V. Sleep and its regulation in zebrafish[J]. Reviews in the Neurosciences, 2011, 22(1): 27-36. |
| [14] |
BEN-MOSHE L Z, ALON S, VALLONE D, et al. Genetically blocking the zebrafish pineal clock affects circadian behavior[J]. PLoS Genetics, 2016, 12(11): e1006445. DOI:10.1371/journal.pgen.1006445 |
| [15] |
HASTINGS M H, REDDY A B, MAYWOOD E S. A clockwork web: circadian timing in brain and periphery, in health and disease[J]. Nature Reviews Neuroscience, 2003, 4(8): 649-661. DOI:10.1038/nrn1177 |
| [16] |
王国强, 王雯. 应激反应对鱼类影响的研究进展[J]. 安徽农业科学, 2009, 37(24): 11579-11580. WANG G Q, WANG W. Research progress in the effect of the stress response on fish[J]. Journal of Anhui Agricultural Sciences, 2009, 37(24): 11579-11580. DOI:10.3969/j.issn.0517-6611.2009.24.099 |
| [17] |
王文博, 李爱华. 环境胁迫对鱼类免疫系统影响的研究概况[J]. 水产学报, 2002, 26(4): 368-374. WANG W B, LI A H. The effect of environmental stress to fish immune system[J]. Journal of Fisheries of China, 2002, 26(4): 368-374. |
| [18] |
PICKERING A D. Rainbow trout husbandry: management of the stress response[J]. Aquaculture, 1992, 100(1/3): 125-139. |
| [19] |
KLINGER H, DELVENTHAL H, HILGE V. Water quality and stocking density as stressors of channel catfish (Ictalurus punctatus Raf.)[J]. Aquaculture, 1983, 30(1/4): 263-272. |
| [20] |
BARTON B A, IWAMA G K. Physiological changes in fish from stress in aquaculture with emphasis on the response and effects of corticosteroids[J]. Annual Review of Fish Diseases, 1991, 1: 3-26. DOI:10.1016/0959-8030(91)90019-G |
| [21] |
洪磊, 张秀梅. 环境胁迫对鱼类生理机能的影响[J]. 海洋科学进展, 2004, 22(1): 114-121. HONG L, ZHANG X M. Effects of environmental stress on physiological function of fish[J]. Advances in Marine Science, 2004, 22(1): 114-121. DOI:10.3969/j.issn.1671-6647.2004.01.017 |
| [22] |
KISHI S, UCHIYAMA J, BAUGHMAN A M, et al. The zebrafish as a vertebrate model of functional aging and very gradual senescence[J]. Experimental Gerontology, 2003, 38(7): 777-786. DOI:10.1016/S0531-5565(03)00108-6 |
| [23] |
毋玉婷, 郭宝英, 祁鹏志, 等. 水生衰老模式动物研究进展[J]. 浙江海洋学院学报(自然科学版), 2017, 36(1): 63-71. WU Y T, GUO B Y, ZOU P Z, et al. Research progress on aquatic aging model animals[J]. Journal of Zhejiang Ocean University (Natural Science), 2017, 36(1): 63-71. DOI:10.3969/j.issn.1008-830X.2017.01.012 |
| [24] |
GERHARD G S, KAUFFMAN E J, WANG X J, et al. Life spans and senescent phenotypes in two strains of Zebrafish (Danio rerio)[J]. Experimental Gerontology, 2002, 37(8/9): 1055-1068. |
| [25] |
ZON L I, PETERSON R T. In vivo drug discovery in the zebrafish[J]. Nature Reviews Drug Discovery, 2005, 4(1): 35-44. DOI:10.1038/nrd1606 |
| [26] |
IRONS T D, MACPHAIL R C, HUNTER D L, et al. Acute neuroactive drug exposures alter locomotor activity in larval zebrafish[J]. Neurotoxicology and Teratology, 2010, 32(1): 84-90. DOI:10.1016/j.ntt.2009.04.066 |
| [27] |
CHEN T H, WANG Y H, WU Y H. Developmental exposures to ethanol or dimethylsulfoxide at low concentrations alter locomotor activity in larval zebrafish: implications for behavioral toxicity bioassays[J]. Aquatic Toxicology, 2011, 102(3/4): 162-166. |
| [28] |
MARTÍNEZ-SALES M, GARCÍA-XIMÉNEZ F, ESPINÍS F J. Zebrafish as a possible bioindicator of organic pollutants with effects on reproduction in drinking waters[J]. Journal of Environmental Sciences, 2015, 33: 254-260. DOI:10.1016/j.jes.2014.11.012 |
| [29] |
邹华锋, 冯宇红, 兰兆辉, 等. 低温处理对斑马鱼CNSS系统应激相关基因的影响[J]. 江苏农业科学, 2016, 44(8): 43-46. ZOU H F, FENG Y H, LAN Z H, et al. Effect of low temperature treatment on stress-related genes in zebrafish CNSS system[J]. Jiangsu Agricultural Sciences, 2016, 44(8): 43-46. |
| [30] |
彭姜岚, 曾令清, 曹振东, 等. 驱赶和空气暴露对南方鲇耗氧率和呼吸频率的影响[J]. 淡水渔业, 2007, 37(5): 7-10. PENG J L, ZENG L Q, CAO Z D, et al. Effects of chase and air exposure on oxygen consumption and respiration frequency in silurus meridionalis[J]. Freshwater Fisheries, 2007, 37(5): 7-10. DOI:10.3969/j.issn.1000-6907.2007.05.002 |
| [31] |
WOODHEAD A D. Aging changes in the heart of a poeciliid fish, the guppy Poecilia reticulatus[J]. Experimental Gerontology, 1984, 19(6): 383-391. DOI:10.1016/0531-5565(84)90048-2 |
| [32] |
WOODHEAD A D, POND V, DAILEY K. Aging changes in the kidneys of two poeciliid fishes, the guppy Poecilia reticulatus and the Amazon molly P. formosa[J]. Experimental Gerontology, 1983, 18(3): 211-221. DOI:10.1016/0531-5565(83)90033-5 |
| [33] |
CAHILL G M, HURD M W, BATCHELOR M. Circadian rhythmicity in the locomotor activity of larval zebrafish[J]. Neuroreport, 1998, 9(15): 3445-3449. DOI:10.1097/00001756-199810260-00020 |
| [34] |
CAHILL G M. Clock mechanisms in zebrafish[J]. Cell and Tissue Research, 2002, 309(1): 27-34. DOI:10.1007/s00441-002-0570-7 |
| [35] |
WHITÄMORE D, FOULKES N S, STRÄHLE U, et al. Zebrafish clock rhythmic expression reveals independent peripheral circadian oscillators[J]. Nature Neuroscience, 1998, 1(8): 701-707. DOI:10.1038/3703 |
| [36] |
CERMAKIAN N, WHITMORE D, FOULKES N S, et al. Asynchronous oscillations of two zebrafish clock partners reveal differential clock control and function[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(8): 4339-4344. DOI:10.1073/pnas.97.8.4339 |
| [37] |
DELAUNAY F, THISSE C, MARCHAND O, et al. An inherited functional circadian clock in zebrafish embryos[J]. Science, 2000, 289(5477): 297-300. DOI:10.1126/science.289.5477.297 |
| [38] |
FAHRENKRUG J, GEORG B, HANNIBAL J, et al. Diurnal rhythmicity of the clock genes Per1 and Per2 in the rat ovary[J]. Endocrinology, 2006, 147(8): 3769-3776. DOI:10.1210/en.2006-0305 |
| [39] |
WOOD P A, YANG X W, HRUSHESKY W J M. Clock genes and cancer[J]. Integrative Cancer Therapies, 2009, 8(4): 303-308. DOI:10.1177/1534735409355292 |
| [40] |
KENNAWAY D J. The role of circadian rhythmicity in reproduction[J]. Human Reproduction Update, 2005, 11(11): 91-101. |
| [41] |
ZHENG X Z, SEHGAL A. Probing the relative importance of molecular oscillations in the circadian clock[J]. Genetics, 2008, 178(3): 1147-1155. DOI:10.1534/genetics.107.088658 |
| [42] |
赵静, 朱祥伟, 徐挺, 等. BDE17及OH-BDE17暴露对斑马鱼幼鱼的运动行为效应[J]. 环境化学, 2015, 34(7): 1239-1245. ZHAO J, ZHU X W, XU T, et al. Locomotor behavior effect in zebrafish larvae after exposure to BDE17 and OH-BDE17[J]. Environmental Chemistry, 2015, 34(7): 1239-1245. |
| [43] |
VAN LEEUWEN J L, VOESENEK C J, MVLLER U K. How body torque and Strouhal number change with swimming speed and developmental stage in larval zebrafish[J]. Journal of the Royal Society Interface, 2015, 12(110): 0479. |
| [44] |
MVLLER U K, VAN LEEUWEN J L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development[J]. Journal of Experimental Biology, 2004, 207(5): 853-868. DOI:10.1242/jeb.00821 |
| [45] |
BUDICK S A, O'MALLEY D M. Locomotor repertoire of the larval zebrafish: swimming, turning and prey capture[J]. Journal of Experimental Biology, 2000, 203(17): 2565-2579. |
| [46] |
YAO Y Y, LI X Q, ZHANG B B, et al. Visual cue-discriminative dopaminergic control of visuomotor transformation and behavior selection[J]. Neuron, 2016, 89(3): 598-612. DOI:10.1016/j.neuron.2015.12.036 |
| [47] |
史慧勤, 张利军, 苑晓燕, 等. 氯化镉暴露对斑马鱼幼鱼神经行为毒性作用[J]. 生态毒理学报, 2013, 8(3): 374-380. SHI H Q, ZHANG L J, YUAN X Y, et al. Toxic effects of cadmium chloride exposure on neurobehavior of zebrafish larvae[J]. Asian Journal of Ecotoxicology, 2013, 8(3): 374-380. |
| [48] |
REIDY S P, KERR S R, NELSON J A. Aerobic and anaerobic swimming performance of individual Atlantic cod[J]. Journal of Experimental Biology, 2000, 203(2): 347-357. |
| [49] |
ZHANG W, CAO Z D, FU S J. The effects of dissolved oxygen levels on the metabolic interaction between digestion and locomotion in Cyprinid fishes with different locomotive and digestive performances[J]. Journal of Comparative Physiology B, 2012, 182(5): 641-650. DOI:10.1007/s00360-012-0644-0 |
| [50] |
FITZGIBBON Q P, STRAWBRIDGE A, SEYMOUR R S. Metabolic scope, swimming performance and the effects of hypoxia in the mulloway, Argyrosomus japonicus (Pisces: Sciaenidae)[J]. Aquaculture, 2007, 270(1/4): 358-368. |
| [51] |
唐国伟.温度与个体标准代谢对鲫鱼运动后过量耗氧、常规代谢及自发运动的影响[D].重庆: 重庆师范大学, 2014. TANG G W. The relationship between temperature, inter-species variation in standard metabolic rate and excess post-exhaustive exercise oxygen consumption, routine metabolic rate, spontaneous swimming in juvenile Carassius carassius[D]. Chongqing: Chongqing Normal University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10637-1014358070.htm |
| [52] |
DOMENICI P, BLAKE R. The kinematics and performance of fish fast-start swimming[J]. Journal of Experimental Biology, 1997, 200(8): 1165-1178. |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. International Research Center for Marine Biosciences, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


