2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产动物遗传育种中心上海市协同创新中心, 上海 201306;
4. 上海申漕特种水产开发公司, 上海 201516
罗氏沼虾(Macrobrachium rosenbergii)又称马来西亚大虾或泰国虾,是目前世界上养殖产量最高的三大虾种之一[1-2]。近年来,在我国一些地区罗氏沼虾养殖业已成为当地的支柱产业,但目前我国罗氏沼虾育苗技术水平尚存在一些问题,特别是种质不佳、育苗工艺不规范以及育苗用水调配不合要求等问题限制了罗氏沼虾养殖业的进一步发展与提高[3]。罗氏沼虾育苗用水多为利用河水或湖水添加化学药品调配而成的人工配制海水(简称育苗用水)。此前已有关于人工海水配方的研究报道,如潘家模等[4]与臧维玲等[5]曾研究并提出了生产应用效果良好的罗氏沼虾育苗用水配方;臧维玲等[5]提出了育苗水中钙镁含量及其比值对罗氏沼虾幼体变态发育及出苗率的影响;邓潜等[6]也发现钙、镁、钾浓度影响罗氏沼虾蚤状幼体发育。可见,幼体的变态发育与育苗水中主要离子浓度密切相关,因此科学合理地设计育苗用水配方是至关重要的。
罗氏沼虾在河口水域产出幼体并完成变态发育成仔虾。该水域化学成分含量远低于大洋水,但其水质类型仍属海水范畴[5]。H3BO3与Sr2+是大洋水的常量成分,也是河口水的必有成分。Sr2+对水生生物的影响已见报道:刘存岐等[7]对Cu2+、Mn2+、Sr2+对中国对虾糠虾幼体存活率与出苗率有过研究,发现这3种离子不同浓度对虾幼体的生长变态均有显著影响;宋洪建等[8]也发现Sr2+对大麻哈鱼稚鱼的生理有着显著的影响。但Sr2+对罗氏沼虾幼体发育影响的研究较罕见,硼酸浓度对虾类幼体的影响也鲜有报道。实验就罗氏沼虾育苗全周期内,不同浓度Sr2+和H3BO3对幼体存活率以及出苗率进行初步研究,并测定分析了对仔虾体内代谢酶的影响。碱性磷酸酶能催化磷化物的水解,与生物体的生理活动和物质代谢直接相关;Sr2+与Ca2+性质相似,可能会对Ca2+-ATP酶调节细胞内外Ca2+平衡与ATP分解产生影响;硼在动物机体内参与多种微量元素代谢进程并影响机体免疫功能[9],而SOD是重要的免疫因子,能反映机体新陈代谢过程中体内有害物质的积累程度[10]。通过对Sr2+组和H3BO3组幼体存活率、出苗率以及其仔虾代谢酶的分析,获得了罗氏沼虾育苗用水中H3BO3与Sr2+的最适质量浓度与可适质量浓度范围,以及两者对仔虾体内代谢酶的影响。研究结果可为育苗用水配方设计提供科学依据,并为其苗种培育提供实践指导。
1 材料与方法 1.1 罗氏沼虾幼体与培育容器实验所用幼体为罗氏沼虾同一品系中2尾发育状态及养殖周期大致相同的雌虾同时期所产的卵进行离体培养后孵化出的幼体。采用2 000 mL玻璃烧杯(h=17.5 cm)做幼体培育实验容器,以盛水塑料箱(80 cm×60 cm×50 cm)做恒温容器,用500 W温控玻璃加热棒控制水温。
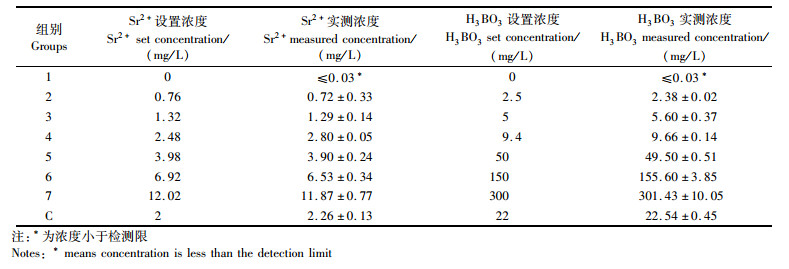
1.2 实验设计 1.2.1 设置实验用水Sr2+、H3BO3质量浓度据大洋水中Sr2+、H3BO3质量浓度[11],以大洋水与育苗水(盐度13)的盐度比例算得后者Sr2+、H3BO3的质量浓度,再按等对数间距法做些许调整算得Sr2+(S1-S7组)、H3BO3(B1-B7组)各7组不同质量浓度(表 1),每组质量浓度重复5次实验。以公司育苗水C组为对照组,C组育苗水由生产中育苗水配方配得。
|
表 1 罗氏沼虾育苗实验用水Sr2+和H3BO3质量浓度 Tab.1 Sr2+ and H3BO3 mass concentration in Macrobrachium rosenbergii seedling experiment water |
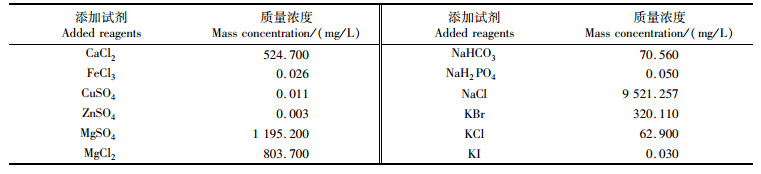
用蒸馏水作为调配基准水,以盐度35的自然海水作为参照,各组中育苗水除Sr2+和H3BO3外,其余离子依据李其才等[12]和臧维玲等[5]罗氏沼虾育苗用水调配原则,分别准确称量所需添加化学试剂并溶解后加入,见表 2。再按实验设计要求加入Sr2+和H3BO3调节两者水平,各Sr2+实验组水体中H3BO3质量浓度和各H3BO3实验组水体中Sr2+质量浓度均为以大洋水与育苗水的盐度比例换算得到,分别为9.4 mg/L和2.48 mg/L,最终实验质量浓度以检测数据为准。Sr2+以SrCl2的形式加入,所有化学试剂均为分析纯,各组盐度均为13。
|
表 2 罗氏沼虾育苗实验用水添加化学试剂 Tab.2 Macrobrachium rosenbergii seedlings added with chemical reagents |
烧杯中幼体培育水量为1 500 mL,各杯以逐尾计数的方式放入健康幼体60尾。烧杯分别置于4个均以塑料板分隔为上下两层的盛水塑料箱,上层放置烧杯,下层放3根加热棒进行水浴加热,控制烧杯中水体温度为(29.0±0.5) ℃。培育期间投喂卤虫无节幼体,日投喂3~4次,每次每毫升水体投喂5~10个卤虫,每天排污。连续用规格为3 cm的小气石充气增氧。每天换同浓度新水300 mL。
每天观察并记录幼体的死亡数。25 d后,幼体基本经11次蜕皮成为仔虾。记录并计算育苗全周期内幼体存活率和幼体的出苗率。实验至25 d时,每个浓度组随机取10尾存活仔虾,置于-80 ℃冰箱中,用于之后酶活性的检测。
1.4 实验指标的测定 1.4.1 实验用水Sr2+和H3BO3质量浓度的测定Sr2+和H3BO3浓度测定方法:育苗水Sr2+用原子吸收分光光度计法[13],H3BO3含量采用分光光度计[14]测定;卤虫体内Sr2+用电感耦合等离子体质谱法(ICP-MS),H3BO3用食品安全国家标准法(GB 5009.275—2016)。卤虫体内Sr2+和H3BO3质量浓度的测定由青岛横立检测中心代测,检测限均为30 μg/kg。
1.4.2 幼体存活率和出苗率的测定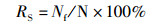 (1)
(1)
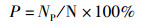 (2)
(2)
式中:RS为幼体存活率;P为出苗率;Nf与NP为25 d时幼体存活尾数与仔虾数;N为初始放入幼体量60尾。
1.4.3 实验仔虾体内酶活性的检测每实验组随机取2尾解冻仔虾样品用以检测酶活性。Sr2+组检测碱性磷酸酶和Ca2+-ATP酶的活性,H3BO3组检测碱性磷酸酶和SOD酶的活性。酶活性的测定均用南京建成生物工程研究所的检测试剂盒完成,单位为U/mg。
1.5 数据处理实验数据采用SPSS 20.0软件进行单因素方差分析,Duncan氏法均值多重比较,显著水平为P < 0.05。图采用Excel 2010完成。
2 结果与分析 2.1 Sr2+和H3BO3对罗氏沼虾幼体存活和变态的影响图 1和2显示,Sr2+组与H3BO3组幼体存活率随培育天数基本都呈S型递减变化,分别在15~20 d与10~20 d急剧陡降30.3%~47.5%和55.1%~64.7%。但Sr2+组中无Sr2+(S1)组,自第5天即呈急剧下降趋势,至20 d时,存活率共下降58.0%;H3BO3组中B7(301.43 mg/L)下降幅度最大,20 d存活率共下降76.5%。20 d后,两组存活率均转为缓慢下降,特别是H3BO3各质量浓度组存活率随培养天数几乎以平行于横坐标的特点极缓慢变化,20~25 d成活率仅降1.4%~5.3%。说明到育苗后期,幼体对环境适应力随发育期而增强。实验周期内,Sr2+组仅S3(40.5%)、S4(45.3%)存活率大于C组(40.0%),其余(24.7%~38.7%)均小于C组。H3BO3组存活率均低于对照组。实验结束时,Sr2+与H3BO3不同浓度组与C组幼体存活率大小顺序分别为Sr2+组:S4>S3>C>S2>S5=S1>S6>S7; H3BO3组:C>B4>B5>B2>B3>B6>B1>B7。可见,育苗水两者的高、低浓度组,即第1、6、7组均严重影响幼体存活率,高浓度影响强于低浓度,均不宜用作育苗。
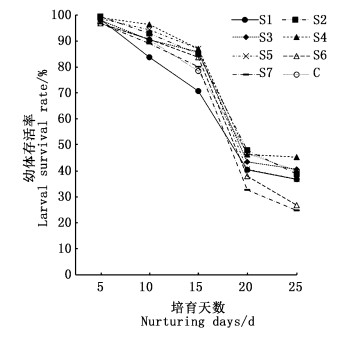
|
图 1 罗氏沼虾育苗实验用水锶离子浓度对实验幼体存活率的影响 Fig. 1 Effect of the concentration of lanthanum ions on the survival rate of test larvae of experimental Macrobrachium rosenbergii |

|
图 2 罗氏沼虾育苗实验用水硼酸浓度对实验幼体存活率的影响 Fig. 2 Effect of boric acid concentration on the survival rate of experimental larvae of Macrobrachium rosenbergii |
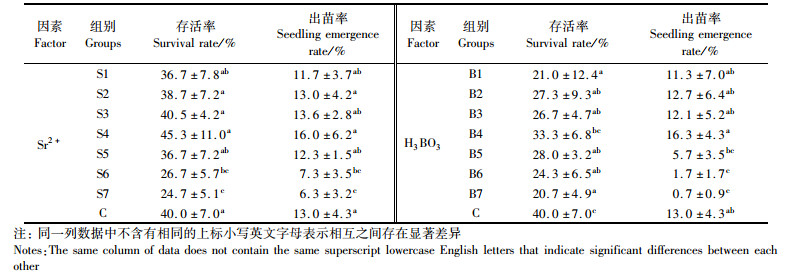
表 3表明,Sr2+和H3BO3各浓度组间幼体存活率和出苗率具有不同程度的差异性:Sr2+组存活率与出苗率方差分析结果基本一致,均在S4组达到最高值(45.3%±11.0%和16.0%±6.2%),分别高于C组13.3%与23.1%,但S1-S5与C组差异均不显著(P>0.05),高浓度组S6、S7存活率(26.7%、24.7%)与出苗率(7.3%、6.3%)极低,与C有显著性差异(P < 0.05),且S7组数据显著低于其他组(P < 0.05)。可见Sr2+过高浓度对幼体发育变态具严重影响,致使存活率与出苗率均极低。H3BO3组存活率和出苗率的峰值均出现在B4组,分别为C组的83.3%与125.4%,存活率显著高于B1(P < 0.05)。除B4外,其余浓度组存活率与C组均有显著差异(P < 0.05),B6、B7出苗率极低(1.7%与0.7%),仅为C组的13.1%与5.4%,显著低于C组(13.0%,P < 0.05)。无H3BO3组(B1)存活率(21.0%)与出苗率(11.3%)均较低。实验结束时,Sr2+与H3BO3不同质量浓度组与C组出苗率大小顺序分别为Sr2+组:S4>S3>C=S2>S5>S1>S6>S7,H3BO3组:B4>C>B2>B3>B1>B5>B6>B7。鉴于育苗容器为小水体,据试验结果,选出苗率达12%为可适浓度范围,则两者可适质量浓度范围分别为(0.72~3.90) mg/L与(2.38~9.66) mg/L,其中两者最适质量浓度分别为(2.80±0.05) mg/L与(9.66±0.14) mg/L。
|
表 3 育苗实验周期内Sr2+和H3BO3实验组罗氏沼虾幼体存活率和出苗率平均值 Tab.3 The average survival rate and emergence rate of Macrobrachium rosenbergii in Sr2+ and H3BO3 experimental groups during the experiment period |
育苗实验用水中Sr2+对罗氏沼虾体内AKP和Ca2+-ATP酶的影响见图 3。由方差分析可知:Sr2+在浓度为0时,AKP活力最低,为12.18 U/mg;随着浓度升高,AKP活力逐渐增加,S5组达到最大值28.67 U/mg,基本呈抛物线趋势。其中,S1与S4和S5有显著性差异(P < 0.05)。Sr2+各质量浓度组Ca2+-ATP的活力无显著性差异(P>0.05),Sr2+质量浓度为0时Ca2+-ATP活力最低,为2.61 U/mg;随着浓度升高酶活逐渐增加,在S3组达到峰值;Sr2+质量浓度高于1.29 mg/L时,Ca2+-ATP活力缓慢降低。C组的AKP和Ca2+-ATP酶活略低于S3组,与S2较为接近。Sr2+对AKP和Ca2+-ATP酶的影响与Sr2+对幼体存活和变态的影响基本一致。
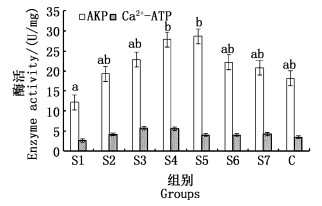
|
图 3 Sr2+组AKP和Ca2+-ATP的酶活 Fig. 3 Sr2+ group AKP and Ca2+-ATP enzyme activity |
育苗实验用水中H3BO3对罗氏沼虾碱性磷酸酶(AKP)和SOD的影响见图 4。由方差分析可知,H3BO3质量浓度对AKP活力具有显著影响(P < 0.05)。H3BO3质量浓度最低组(B1)和质量浓度最高组(B7)均显著低于C组(P < 0.05),B2、B4、B5这3组酶活性较大,且与C组均无显著差异(P>0.05)。H3BO3质量浓度对SOD活力也具有显著影响(P < 0.05)。SOD在B2达到第一个峰值;从B3开始,SOD随H3BO3质量浓度递增,尤其在B4后,即H3BO3大于9.66 mg/L时,SOD大幅度增加,直到B7达到最大值6.95 U/mg。B2、B5、B6、B7与C组均有显著性差异(P < 0.05)。
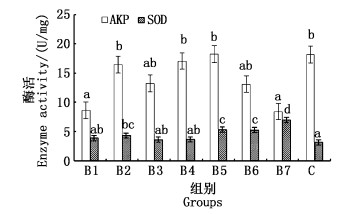
|
图 4 H3BO3组AKP和SOD的酶活 Fig. 4 H3BO3 group AKP and SOD enzyme activity |
图 1和图 2显示,在育苗进行到10~20 d时,Sr2+组和H3BO3组的存活率都大幅度下降,因卤虫幼体内未检测出Sr2+和H3BO3(检出限30 μg/kg),可见实验幼体存活率与出苗率主要受制于育苗实验水中Sr2+和H3BO3浓度。
3.1 Sr2+对罗氏沼虾幼体发育及仔虾体内代谢酶的影响Sr2+可能存在于所有的生物体中,且是生物体中的重要元素,许多研究证明锶元素在一些生物体中发挥着有益的作用,但它是否为生物体所必需的元素还没得到证实。李晓明等[15]研究发现,Sr2+质量浓度为1~10 mg/L时,可以促进梨形四膜虫S1细胞生长和分裂。刘存岐等[7]研究认为,低质量浓度的Sr2+明显地促进了中国对虾糠虾的成活与变态。王建梅等[16]研究发现,海水中含40~60 μg/L的Sr2+时对卤虫的孵化和变态发育有一定的促进作用。本实验结果显示,Sr2+质量浓度为(2.80±0.05) mg/L(S4组)时,实验幼体存活率与出苗率均最大,分别高于对照组5.3%与3.0%。可见此质量浓度对罗氏沼虾幼体生长发育具良好促进作用,故可作为生产采用的罗氏沼虾育苗用水最适质量浓度,0.72~3.90 mg/L可作育苗用水可适质量浓度范围。推测可能当Sr2+为(2.80±0.05) mg/L时,利于激活脂酶,促进体内的代谢过程,从而增强幼体的发育和变态。Sr2+质量浓度为0时,出苗率为11.7%接近12%,说明Sr2+不是育苗水中的必需元素,这与潘家模等[4]和臧维玲等[5]对罗氏沼虾育苗水配方的研究结果相符。
碱性磷酸酶广泛存在于各种生物体内, 对钙质吸取、骨骼形成、磷酸钙化、甲壳素的分泌形成等都具有重要作用[17]。它对各种磷化合物的水解起到催化作用, 是生物磷代谢的重要酶类。LATIF等[18]研究证实蜕皮后的罗氏沼虾碱性磷酸酶活性显著高于蜕皮间期以增加钙镁的吸收。Ca2+-ATP酶催化质膜内侧的ATP水解,释放出能量,驱动细胞内的钙离子泵出细胞或者泵入内质网腔中储存起来,以维持细胞内低质量浓度的游离Ca2+。锶与钙同为第二主族的碱土金属元素,二者在化学性质和离子半径具有相似性。有研究已经证实在生理过程中锶可以代替钙。在哺乳动物模型的试验中已经发现,钙转运蛋白与锶的运输有关[19-21],鱼体内也存在这种转运蛋白。两种酶的酶活性随Sr2+质量浓度变化趋势相似。Sr2+质量浓度为1.29~3.90 mg/L时,AKP与Ca2+-ATP酶活力均达到较高水平,这与幼体的存活率和出苗率结果相匹配。可能在一定范围内的Sr2+质量浓度能够弥补幼体内钙的不足,激活Ca2+-ATP酶;但Sr2+质量浓度为0时的AKP酶活显著低于其他组(P < 0.05),这与幼体的存活率及出苗率的变化规律不一致,其原因尚需再做研究,但也说明了适量的Sr2+能够有效提高罗氏沼虾幼体内的AKP酶活性。
3.2 H3BO3对罗氏沼虾幼体发育及仔虾体内代谢酶的影响硼及其化合物对于工农业生产及动植物的生长繁育均具有重要的作用[22-24],但过量的硼又会对机体产生危害[25]。有研究[26]表明,过量的硼对雄性的生殖系统有阻碍作用。硼无游离态,主要形态之一是分子化合物正硼酸(H3BO3),实验结果显示,H3BO3质量浓度为0时,出苗率较低为11.3%,说明H3BO3对幼体的发育有一定作用,故生产实践中的育苗水配方都会添加硼。H3BO3质量浓度为9.66 mg/L(S4组)时,最近于C组质量浓度(22.54 mg/L),存活率和出苗率均最高,分别为C组的83.3%与125.4%,H3BO3质量浓度过高或过低时,存活率和出苗率均显著下降,尤其当质量浓度达到301.43 mg/L时,出苗率几乎为零,过高质量浓度H3BO3可能对幼体产生毒性作用,严重抑制其发育变态。据实验结果,可获得与Sr2+类似结果:出苗率达12%或以上,H3BO3质量浓度2.38~9.66 mg/L(B2~B4组)可作为罗氏沼虾育苗水可适质量浓度范围,其中9.66 mg/L为最适质量浓度。
实验结果显示,H3BO3对AKP活力有显著影响(P < 0.05),当质量浓度为9.66~49.50 mg/L时,AKP活力处于较高水平。有报道[27]显示,硼的添加可以有效地促使血钙和血磷的含量升高,实验结果与其相似。适当的硼酸有利于提高AKP活力,加速各种磷化合物的水解。从实验中可看出,B1~B4组SOD活力无明显变化,B4~B7组SOD活力逐增,此不同于H3BO3对存活率和出苗率的影响变化规律。SOD是体液防御系统中的重要免疫因子,是细胞内最有效的抗氧化酶之一,是生物体内清除活性氧从而保护机体组织的第1道防线[28]。推测很有可能是因为机体遇到不良环境胁迫会做出应激反应,调动机体免疫因子,如促使SOD活性急剧增加以清除体内胁迫产生的O2-·[29]。有研究报道[10]称,SOD活力可反映动物新陈代谢过程中体内有害物质的积累程度,这与本实验结果相符合。
综上所述,Sr2+和H3BO3对罗氏沼虾幼体的存活变态以及其体内的代谢酶均有显著影响。Sr2+和H3BO3虽在育苗水中的含量都较少,但对整个育苗过程都起着不可忽视的作用,在育苗水中加入适量的Sr2+和H3BO3,可提高罗氏沼虾的育苗水平。而且,实验结果所得到的育苗水中Sr2+和H3BO3的合适质量浓度为完善和调整人工育苗水配方提供了科学依据。
| [1] |
刘恩生, 万全. 罗氏沼虾的养殖现状与发展前景(综述)[J]. 安徽农业大学学报, 1997, 24(2): 189-192. LIU E S, WAN Q. Farming status and development prospect of Macrobrachium rosenbergii[J]. Journal of Anhui Agricultural University, 1997, 24(2): 189-192. |
| [2] |
刘波, 明俊超, 谢骏, 等. 大黄蒽醌提取物对罗氏沼虾高温下抗氧化能力与热应激蛋白70基因表达的影响[J]. 水产学报, 2010, 34(6): 792-800. LIU B, MING J C, XIE J, et al. Effects of anthraquinones extract from Rheum officinale Baill on the hepatopancreas antioxidative capacity and HSP70 gene expresssion under high temperature of Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 2010, 34(6): 792-800. |
| [3] |
李明云, 张海琪, 朱俊杰, 等. 罗氏沼虾浙江养殖群体与缅甸自然群体遗传差异的RAPD分析[J]. 水产学报, 2004, 28(4): 360-364. LI M Y, ZHANG H Q, ZHU J J, et al. Genetic variation between cultured population from Zhejiang province and natural population from Burma of Macrobrachium rosenbergii revealed by RAPD method[J]. Journal of Fisheries of China, 2004, 28(4): 360-364. |
| [4] |
潘家模, 孙祖荣, 周国良, 等. 罗氏沼虾养殖技术[M]. 上海: 上海科学技术出版社, 1997: 63-65. PAN J M, SUN Z R, ZHOU G L, et al. Macrobrachium prawn breeding technology[M]. Shanghai: Shanghai Science and Technology Press, 1997: 63-65. |
| [5] |
臧维玲, 戴习林, 张建达, 等. 罗氏沼虾育苗用水中Mg2+与Ca2+含量及Mg2+/Ca2+对出苗率的影响[J]. 海洋与湖沼, 1995, 26(5): 552-557. ZANG W L, DAI X L, ZHANG J D, et al. Effects of Mg2+, Ca2+ and Mg2+/Ca2+ contents on survival rates of Macrobrachium rosenbergii larvae reared in mixed water[J]. Oceanologia et Limnologia Sinica, 1995, 26(5): 552-557. DOI:10.3321/j.issn:0029-814X.1995.05.015 |
| [6] |
邓潜, 江林源, 黄光华. 调整人工海水配方中钙镁钾离子浓度对罗氏沼虾蚤状幼体的影响研究[J]. 农业与技术, 2012, 32(7): 105-106. DENG Q, JIANG L Y, HUANG G H. Effects of adjusting calcium, magnesium and potassium ions concentrations in artificial seawater formulations on Macrozoic larvae of Macrobrachium rosenbergii[J]. Agriculture & Technology, 2012, 32(7): 105-106. DOI:10.3969/j.issn.1671-962X.2012.07.079 |
| [7] |
刘存岐, 王安利, 王维娜, 等. 海水中Cu2+, Mn2+和Sr2+对中国对虾糠虾幼体成活率与变态率的影响[J]. 中山大学学报, 2000, 39(s1): 132-134. LIU C Q, WANG A L, WANG W N, et al. The effects of Cu2+, Mn2+ and Sr2+ in seawater on the survival and metamorphosis of Penaeus chinensis mysis[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2000, 39(s1): 132-134. |
| [8] |
宋洪建, 刘伟, 王继隆, 等. 锶对大麻哈鱼稚鱼生长发育及肌肉ATP酶活性的影响[J]. 水产学杂志, 2013, 26(4): 23-28. SONG H J, LIU W, WANG J L, et al. Effects of strontium ion on growth and Atpase activity in muscle of chum salmon (Oncorhynchus keta) juveniles[J]. Chinese Journal of Fisheries, 2013, 26(4): 23-28. DOI:10.3969/j.issn.1005-3832.2013.04.006 |
| [9] |
卢岩, 宿英英, 冯景阳, 等. 大鼠急性脑缺血时肺脏病理改变及内皮素-1含量变化[J]. 中华老年心脑血管病杂志, 2002, 4(5): 337-340. LU Y, SU Y Y, FENG J Y, et al. The pathomorphological changes of lung and the changes in endothelin-1 contents in plasma and bronchoalveolar lavage fluid in rats with acute cerebral ischemia[J]. Chinese Journal of Geriatric Cardiovascular and Cerebrovascular Diseases, 2002, 4(5): 337-340. DOI:10.3969/j.issn.1009-0126.2002.05.015 |
| [10] |
王卓, 么宗利, 林听听, 等. 碳酸盐碱度对青海湖裸鲤幼鱼肝和肾SOD、ACP和AKP酶活性的影响[J]. 中国水产科学, 2013, 20(6): 1212-1218. WANG Z, YAO Z L, LIN T T, et al. Effects of carbonate alkalinity stress on SOD, ACP, and AKP activities in the liver and kidney of juvenile Gymnocypris przewalskii[J]. Journal of Fishery Sciences of China, 2013, 20(6): 1212-1218. |
| [11] |
汪蕴璞, 王翠霞. 大洋水物质模型及其理论解释[J]. 水文地质工程地质, 1991, 18(6): 33-36. WANG Y P, WANG C X. Ocean-water material model and its theoretical inerpretation[J]. Hydrogeology and Engineering Geology, 1991, 18(6): 33-36. |
| [12] |
李其才, 王振龙, 徐延震, 等. 罗氏沼虾人工海水育苗试验[J]. 水利渔业, 1996(2): 11-14. LI Q C, WANG Z L, XU Y Z, et al. Experiment on artificial seawater breeding of Macrobrachium rosenbergii[J]. Water Fishery, 1996(2): 11-14. |
| [13] |
段光顺, 曹慧婕. 原子吸收分光光度法测定矿泉水中的锶[J]. 中国卫生检验杂志, 2006, 16(9): 1138. DUAN G S, CAO H J. Atomic absorption spectrophotometer for determination of thallium in mineral water[J]. China Health Inspection Magazine, 2006, 16(9): 1138, 1146. |
| [14] |
王卫成, 由波. 分光光度法测定水溶液中硼酸的含量[J]. 黑龙江环境通报, 2005, 29(2): 27-28. WANG W C, YOU B. Spectrophotometric determination of boric acid in aqueous solution[J]. Heilongjiang Environmental Journal, 2005, 29(2): 27-28. |
| [15] |
李晓明, 唐任寰, 张庆熹, 等. 钕、铯、锶、钡及银对梨形四膜虫的营养作用和毒性[J]. 微量元素, 1985(4): 7-12. LI X M, TANG R H, ZHANG Q X, et al. Nutritional effects and toxicity of earthworms, cockroaches, earthworms, earthworms and silver on tetrahymena piriformis[J]. Trace Elements and Health Research, 1985(4): 7-12. |
| [16] |
王建梅, 王维娜, 刘存歧, 等. 海水中Zn2+(锌离子)和Sr2+(锶离子)对卤虫卵孵化率和幼体变态率的影响[J]. 水产科技情报, 2003, 30(2): 51-55. WANG J M, WANG W N, LIU C Q, et al. The effects of Zn2+ and Sr2+ in seawater on the hatchability and metamorphosis rate of Artemia saline[J]. Fisheries Science & Technology Information, 2003, 30(2): 51-55. DOI:10.3969/j.issn.1001-1994.2003.02.002 |
| [17] |
顾德平, 方卫星, 叶维明. 刀额新对虾淡水驯化存活率的观察[J]. 水产科技情报, 1998, 25(1): 35-36. GU D P, FANG W X, YE W M. Observation on the domestication survival rate of shrimp[J]. Fisheries Science & Technology Information, 1998, 25(1): 35-36. |
| [18] |
LATIF M A, BROWN J H, WICKINS J F. Effects of environmental alkalinity on calcium-stimulated dephosphorylating enzyme activity in the gills of postmoult and intermoult giant freshwater prawns Macrobrachium rosenbergii (de Man)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1994, 107(4): 597-601. DOI:10.1016/0300-9629(94)90357-3 |
| [19] |
WASSERMAN R H. Strontium as a tracer for calcium in biological and clinical research[J]. Clinical Chemistry, 1998, 44(3): 437-439. |
| [20] |
ATSDR. Toxicological profile for strontium[M]. Atlanta: U S Department of Health and Human Services, 2004.
|
| [21] |
HOENDEROP J G J, NILIUS B, BINDELS R J M. Calcium absorption across epithelia[J]. Physiological Reviews, 2005, 85(1): 373-422. DOI:10.1152/physrev.00003.2004 |
| [22] |
FLIK G, VERBOST P M, BONGA S E W. Calcium transport processes in fishes[M]//WOOD C M, SHUTTLEWORTH T J. Fish Physiology. New York: Academic Press, 1995: 317-343.
|
| [23] |
BUSANI G, TIMELLINI G. Boron removal in wastewater from ceramic tile factories[M]//WACHTMAN Jr J B. Materials & Equipment/Whitewares Manufacturing. The American Ceramic Society, 1993: 457-467.
|
| [24] |
RISTI  M D, RAJAKOVI M D, RAJAKOVI L V. Boron removal by anion exchangers impregnated with citric and tartaric acids[J]. Separation Science and Technology, 1996, 31(20): 2805-2814. http://www.researchgate.net/publication/233350786_Boron_Removal_by_Anion_Exchangers_Impregnated_with_Citric_and_Tartaric_Acids L V. Boron removal by anion exchangers impregnated with citric and tartaric acids[J]. Separation Science and Technology, 1996, 31(20): 2805-2814. http://www.researchgate.net/publication/233350786_Boron_Removal_by_Anion_Exchangers_Impregnated_with_Citric_and_Tartaric_Acids
|
| [25] |
ÖZTÜRK N, KAVAK D. Boron removal from aqueous solutions by adsorption on waste sepiolite and activated waste sepiolite using full factorial design[J]. Adsorption, 2004, 10(3): 245-257. DOI:10.1023/B:ADSO.0000046361.62180.c6 |
| [26] |
刘艳辉, 潘献辉, 葛云红. 反渗透海水淡化脱硼技术研究现状[J]. 中国给水排水, 2008, 24(24): 91-93. LIU Y H, PAN X H, GE Y H. Present status of research on boron removal in RO seawater desalination[J]. China Water & Wastewater, 2008, 24(24): 91-93. DOI:10.3321/j.issn:1000-4602.2008.24.026 |
| [27] |
PRATS D, CHILLON-ARIAS M F, RODRIGUEZ-PASTOR M. Analysis of the influence of pH and pressure on the elimination of boron in reverse osmosis[J]. Desalination, 2000, 128(3): 269-273. DOI:10.1016/S0011-9164(00)00041-2 |
| [28] |
孙金艳, 刘大森, 潘玉武, 等. 硼对绵羊血液生化指标的影响[J]. 东北农业大学学报, 2004, 35(2): 154-158. SUN J Y, LIU D S, PAN Y W, et al. Effects of dietary boron on serum biochemistry indexes in sheep[J]. Journal of Northeast Agricultural University, 2004, 35(2): 154-158. DOI:10.3969/j.issn.1005-9369.2004.02.007 |
| [29] |
黄旭雄, 周洪琪. 甲壳动物免疫机能的衡量指标及科学评价[J]. 海洋科学, 2007, 31(7): 90-96. HUANG X X, ZHOU H Q. The parameters reflecting immune state of crustacea and its scientific evaluation[J]. Marine Sciences, 2007, 31(7): 90-96. DOI:10.3969/j.issn.1000-3096.2007.07.018 |
2. Key Laboratory of Freshwater Aquatic Germplasm Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. Aquatic Animal Genetic Breeding Center, Shanghai Collaborative Innovation Center, Shanghai Ocean University, Shanghai 201306, China;
4. Shanghai Shen Cao Special Aquatic Development Company, Shanghai 201516, China
 2019,
Vol. 28
2019,
Vol. 28


