2. 上海海洋大学 科技部海洋生物科学国际联合研究中心, 上海 201306;
3. 上海海洋大学 水产种质资源发展与利用教学重点实验室, 上海 201306
生物节律广泛存在于生物体内,这是生物长期以来应对外界多变环境出现的一种适应性的能力,对生物体的生理和行为有重要的调控作用。生物节律可以影响生物的生理和行为,对于生物的摄食、发育、生殖和行为具有重要作用,而生物界存在最普遍的生物节律就是以地球自转形成的24 h的昼夜节律[1-4]。
在昼夜循环的条件下,鱼类的活动模式可以分为几种类型:昼行性、夜行性、昏暗行性以及以上3种的混合模式[5-6]。相比其他鱼类而言,硬骨鱼类的活动模式是不确定的,并且同一物种的不同个体之间也会存在很大差异[7]。可以通过持续性的光照和黑暗的条件、相位移动和短期脉冲的形式去证明内源性生物节律的存在[8]。
对鱼类而言,除了光照可以影响其生物节律外,摄食也可以影响生物节律。即当在固定的时间喂食鱼类时,在喂食之前鱼类的生理和行为将会产生变化,这被称为摄食期望(food anticipatory activity,FAA)[9-11]。
尼罗罗非鱼(Oreochromis niloticus)为外来物种,属于鲈形目(Perciformes)、丽鱼科(Cichlidae)、罗非鱼属(Oreochromis),在世界范围内被广泛养殖[12]。MIGUAD等[13]通过对尼罗罗非鱼等5种硬骨鱼的眼球摘除实验发现在硬骨鱼类中至少存在3种不同的产生褪黑激素的模式,并且尼罗罗非鱼和鲶鱼的松果体对光照不敏感,证明尼罗罗非鱼可能具有内源性的生物节律,随后VERA等[14]在对尼罗罗非鱼昼夜节律的研究中发现尼罗罗非鱼成鱼具有内源性昼夜节律。虽然VERA等每隔两天在白天随机时间段去投喂以避免喂食会对其昼夜节律产生影响,但这仍然无法避免摄食带来的节律影响,并且COSTA等[15]研究了摄食对尼罗罗非鱼昼夜节律的影响,发现摄食会对其昼夜节律产生影响,所以本实验的目的是研究在不喂食的条件下尼罗罗非鱼幼鱼内源性的日钟与外源性的光周期对其昼夜节律的调控作用。
1 材料与方法 1.1 材料实验在上海海洋大学适应生理实验室进行。在一个循环水养殖系统中,将尼罗罗非鱼幼鱼(2个月大,体质量10~20 g)放入两个1 000 L的圆柱形塑料桶中,温度保持在28 ℃。在实验开始之前的15 d内,每天8:00开灯,在20:00关灯以保持12L:12D的光照循环。光照强度控制在200 lx,光暗周期通过计时器控制。喂食时间随机(避免规律的摄食对尼罗罗非鱼的节律产生影响)。在实验过程中,鱼被放置在10 L矩形塑料箱中,光照强度为200 lx。暂养和实验的温度保持在25~30 ℃之间。
1.2 运动监控尼罗罗非鱼昼夜的运动行为通过Big Brother(ACTIMETRICS节律生物学系统,Actimetrics公司,美国)软件进行记录。
Big Brother使用摄像机跟踪每个监控下动物的运动距离,每分钟报告每只动物的运动距离。生成的数据可以通过Big Brother分析程序进行分析和查看,也可以将运动记录导入其他分析软件。
1.3 实验方法在实验开始之前所有实验用鱼全部暂养在光周期为L:D = 12 h:12 h的环境中1周,1周后随机选择9条幼鱼,不喂食暂养1 d后, 放入10 L水体的不透明矩形盒中,水面高为10 cm,实验过程中不喂食。每次实验开始之前重复该步骤。
12L:12D光照周期的实验进行4 d。在整个测试过程中,灯光通过计时器控制在8:00开启,并在20:00关闭。12L:12D光照循环的实验进行两次。
在持续黑暗条件下实验进行6 d。前3天是12 L:12D的循环(获得尼罗罗非鱼的昼夜节律,判断运动模式),第4天实验环境变成了连续黑暗(第3天20:00关灯后不再开灯)。
持续光照的实验同上,第4天实验环境变为持续的光照(第4天8点开灯后不再关灯)。
6L:6D光照循环的实验持续5 d。前3天为12L:12D循环,然后光暗循环变为6L:6D。
2L:2D循环的实验持续84 h(3天半)。最后的12 h内采取2L:2D的光照循环,在此之前是12L:12D的循环。
1.4 数据分析将数据从Big Brother中以Excel的格式输出,然后将数据输入到cosinor和LSP分析昼夜节律。数据和图片通过OriginPro 9.1进行分析与进行绘制。
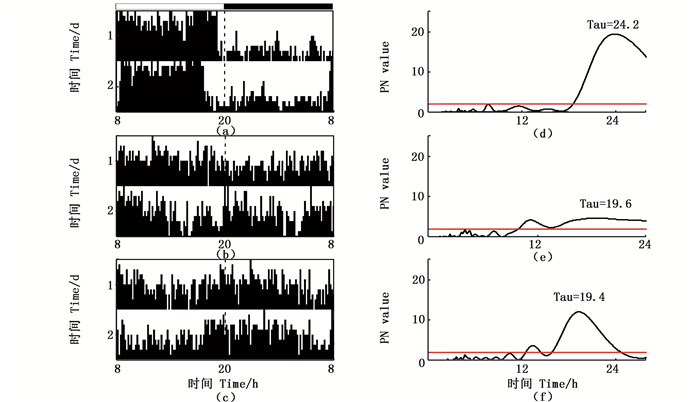
2 结果 2.1 光照周期为L:D = 12 h:12 h、DD和LL在L:D = 12 h:12 h的光照周期内,尼罗罗非鱼只有3种活动模式:具有正常的昼夜节律,没有规律性的节律和昼夜节律颠倒(图 1)。在LD循环的条件下,18条尼罗罗非鱼中12条具有正常的昼夜节律,白天的平均运动速度大于夜晚,其昼夜节律的周期为(24.3 ± 0.2) h,图 2d表示其中1条幼鱼的昼夜节律为24.2 h;4条昼夜节律无规律,白天的平均运动速度和夜晚相比没有明显规律;2条昼夜节律颠倒,白天的平均运动速度比夜晚小,昼夜节律周期分别为19.4 h和25.8 h(图 2)。

|
横坐标是授时时间,(a)、(d)是昼行性的,(b)、(e)是无规律的,(c)、(f)是夜行性的。(a)、(b)和(c)是尼罗罗非鱼每10 min的平均运动速度,红线是6个单位的移动平均。(d)、(e)和(f)表示两天内每12 h的平均运动速度,图形顶部的白色和黑色条带分别代表有光照和无光照。 Diurnal (a, d), arrhythmic (b, e) and nocturnal (c, f). The abscissa is the time of zeitgeber. (a, b, c) The dark bar indicates average speed of per 10 minutes in two days, and the red line indicates a calculated moving average of 6 bins. (d, e, f) The spot indicates average speed of per 12 h in two days. The white and black bars at the top of each graph indicate the light and dark periods. 图 1 尼罗罗非鱼在12L:12D的光照条件下3种运动模式 Fig. 1 The Nile tilapia housed in 12L:12D photoperiod has three patterns of locomotor activity |
|
昼夜节律(tau)的周期显示在周期图上方。红线上方的最大值表示其昼夜节律 The period of the free-running rhythm (tau) is indicated above the periodograms. The maximum value above the red line indicates the circadian rhythm 图 2 12L:12D条件下来自3条罗非鱼的自发活动图(左图)及其相应的周期图(右图) Fig. 2 Locomotor actograms (left graphs) and their corresponding periodogram analysis (right graphs)from three tilapia subjected to 12L:12D conditions |
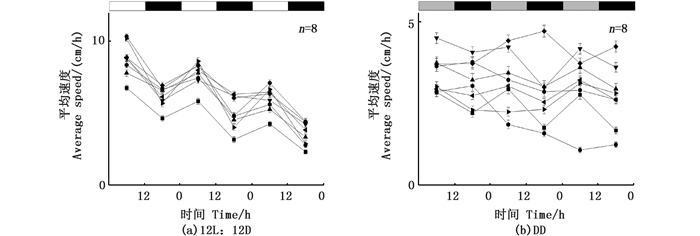
在DD的循环条件下,9条尼罗罗非鱼的运动情况:7条鱼有正常的昼夜节律,昼夜节律为(25.1 ± 1.1) h,其中1条罗非鱼在正常光照条件下,昼夜节律为24.3 h,当在DD条件下时,昼夜节律为24.91 h;1条鱼昼夜节律无规律,1条鱼的数据缺失(图 3-4)。
|
灰色的部分表示原本光照的阶段变成黑暗 The gray part indicates that the stage of light becomes dark 图 3 在DD实验中3天内每12 h的平均速度 Fig. 3 The spot indicates average speed of per 12 h in three days |

|
(a)、(d)6天的自发活动;(b)、(e)12L:12D的周期图;(c)、(f)DD的周期图 (a), (d)Locomotor activity of six days; (b), (e)periodogram of 12L:12D; (c), (f) periodogram of DD 图 4 6天中在DD条件下昼行性和节律失常尼罗罗非鱼的运动和周期图分析 Fig. 4 The Nile tilapia of diurnal and arrhythmic locomotor activity and periodogram analysis under the condition of DD |
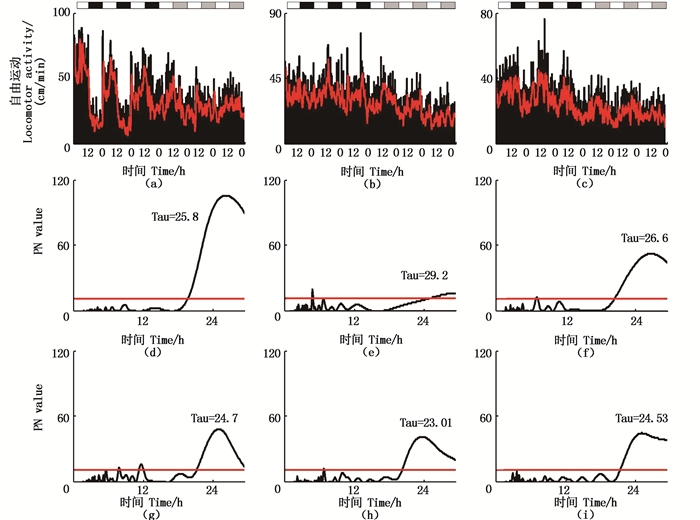
在LL的循环条件下,6条鱼具有正常的昼夜节律,其昼夜节律为(25.6 ± 1.0) h,其中1条幼鱼在正常光照循环条件下的昼夜节律为25.8 h,在LL条件下,昼夜节律变为24.7 h;2条鱼昼夜节律无规律;1条鱼的昼夜节律出现颠倒昼夜节律为26.6 h(图 5-6)。

|
灰色的部分表示原本黑暗的阶段变为光照 The gray part indicates that the dark stage turned to light 图 5 在LL实验中3天内每12 h的平均速度 Fig. 5 The spot indicates average speed of per 12 h in three days |
|
(a)、(b)、(c)6天的自发活动;(d)、(e)、(f)12L:12D的周期图;(g)、(h)、(i)LL的周期图 (a), (b), (c)Locomotor activity of six days; (d), (e), (f)periodogram of 12L:12D; (g), (h), (i)periodogram of LL 图 6 在LL条件下昼行性(a),无节律(b)和夜行性(c)尼罗罗非鱼的运动和周期图 Fig. 6 The Nile tilapia of diurnal (a), arrhythmic (b) and nocturnal (c) locomotor activity and periodogram analysis under the condition of LL |
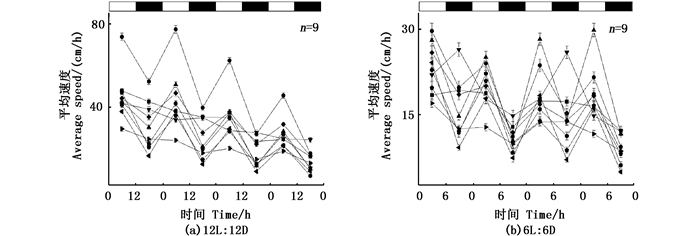
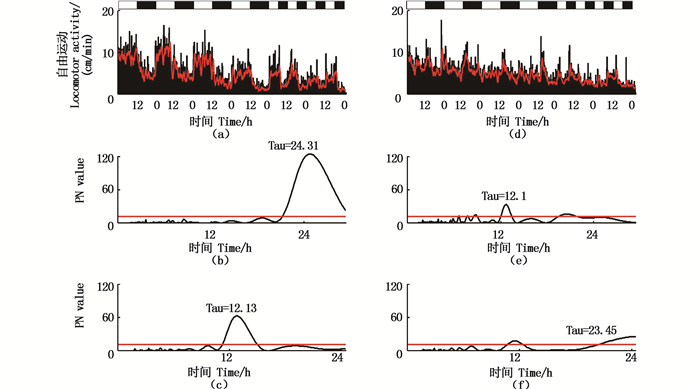
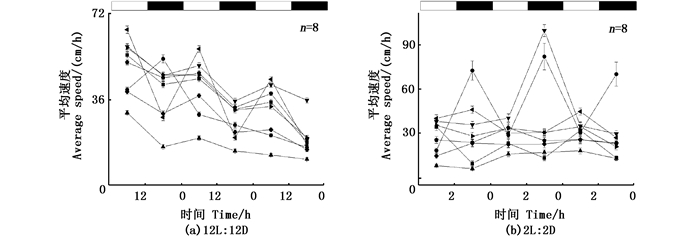
在L:D=6 h:6 h的条件下,6条鱼在正常光照条件(12L:12D)下具有明显昼夜节律,在循环周期变为L:D=6 h:6 h时仍然具有明显的昼夜节律,昼夜节律为(12.6±0.5) h,其中:1条幼鱼在正常光照条件下昼夜节律为24.31 h;当光周期变为12 h时,罗非鱼的昼夜节律发生改变为12.13 h;正常情况下无规律的3条罗非鱼在L:D=6 h:6 h的情况下昼夜节律仍然无规律(图 7-8)。
|
图 7 在6L:6D时光照和黑暗条件下的平均运动速度 Fig. 7 The spot indicates average speed of light and dark in four phases |
|
(a)、(d)6天自发活动;(b)、(e)12L:12D的周期图;(c)、(f)6L:6D的周期图 (a), (d)Locomotor activity of six days; (b), (e) periodogram of 12L:12D; (c), (f) periodogram of 6L:6D 图 8 在6L:6D条件下昼行性(a)和无节律性(d)尼罗罗非鱼的运动和周期图分析 Fig. 8 The Nile tilapia of diurnal (a) and arrhythmic (d) locomotor activity and periodogram analysis under the condition of 6L:6D |
在L:D = 2 h:2 h的条件下,9条尼罗罗非鱼在正常的昼夜循环下有5条具有明显的昼夜节律,3条无规律,1条数据缺失。在2 h的循环条件下根据8条尼罗罗非鱼的2 h内平均运动速度发现其没有明显的昼夜变化,但是对其进行节律分析时发现其具有昼夜节律为(4.0±2.0)h,其中1条罗非鱼在正常条件下昼夜的平均运动速度有明显的差别,但是当光照条件变为2 h时,该罗非鱼在光照和黑暗条件下的平均速度无规律,但其运动行为仍然具有节律,节律为3.3 h(图 9-10)。
|
图 9 在2L:2D时光照和黑暗条件下的平均运动速度 Fig. 9 The spot indicates average speed of light and dark in every phase |

|
(a)、(d)自发运动; (b)、(e)12L:12D的周期图; (c)、(f)2L:2D的周期图 (a), (d)Locomotor activity; (b), (e) periodogram of 12L:12D; (c), (f) periodogram of 2L:2D 图 10 在DD时昼行性(a)和无节律(b)尼罗罗非鱼的运动和周期图分析 Fig. 10 The Nile tilapia of diurnal (a) and arrhythmic (b) locomotor activity and periodogram analysis under the condition of 2L:2D |
我们的研究表明,尼罗罗非鱼幼鱼具有明显昼夜活动节律,但其内源性日钟调控的昼夜节律较弱,环境光照周期(年钟)是调控尼罗罗非鱼幼鱼昼夜活动节律的主要因素。
以往的研究发现鱼类的活动模式可以分为昼行性、夜行性和昏暗行性[5-6]。我们的研究发现尼罗罗非鱼幼鱼在L:D = 12 h:12 h的循环光照条件下主要的活动模式为昼行性,即白天的平均运动速度大于夜晚,这与斑马鱼的昼夜节律相似,有报道[14, 16-17]显示尼罗罗非鱼成鱼与幼鱼相似也有明显的昼夜节律。
以往的研究发现鱼类的昼夜节律相对较复杂,既有像斑马鱼这样昼夜节律分明的生物,它们在LL、DD的情况下也能保持明显的昼夜节律,既斑马鱼的昼夜节律有极强的日钟调控[16-18],也有像金鱼这样个体间昼夜节律差异较大的,一部分金鱼在白天运动较快,一部分在夜晚运动较快[19]。我们研究的尼罗罗非鱼幼鱼在DD和LL的情况下,原本白天时间段的平均运动速度与夜晚阶段的相比没有明显的规律性,幼鱼的昼夜节律日钟调控较弱。这与VERA的研究结果不同,研究发现尼罗罗非鱼成鱼的昼夜节律在DD情况下依然与其在L:D = 12 h:12 h的光周期下相同,说明尼罗罗非鱼成鱼昼夜活动节律有明显的日钟调控[14],这可能与罗非鱼的发育阶段相关。
鱼类的昼夜节律系统具有很强的可塑性,当光照循环周期发生改变时,金鱼、泥鳅等调整后会随着新的昼夜循环产生新的昼夜节律[19-20],而鲈鱼则可以通过改变投喂的时间,改变昼夜节律[21]。在高纬度地区光周期是在极度变化的,生活在高纬度地区生物的生长和繁殖有着严格的季节调节模式。北极驯鹿是生活在北极圈地区的一种生物,全年生活环境中光照周期可从全黑暗到全光照,研究发现北极驯鹿为适应极端光照环境发展出没有日钟调控其行为活动的昼夜节律,只依赖一年中变化的光信号来调节其生长繁殖和活动节律[22]。在我们的实验中,尼罗罗非鱼幼鱼内源性的昼夜节律较弱:当光照条件从L:D=12 h:12 h变为L:D = 6 h:6 h时,尼罗罗非鱼幼鱼并没有表现出明显的24 h的昼夜节律,在原本白天和夜晚的阶段其6 h内的光照和黑暗条件下的平均运动速度仍然具有节律性,光照下的平均运动速度要大于黑暗,并且光照和黑暗的行为节律符合12 h的规律;可是当光照条件变为L:D = 2 h:2 h时,在原本白天阶段2 h光照和黑暗的平均运动速度无规律,个体出现差异,当我们计算尼罗罗非鱼幼鱼在L:D=2 h:2 h情况下的昼夜行为节律时,发现尼罗罗非鱼幼鱼仍然具有明暗节律,其节律的时间为(4.0±2.0) h左右。因此, 光照是调控尼罗罗非鱼幼鱼昼夜行为节律的主要因素,这与北极驯鹿的模式相同。虽然尼罗罗非鱼生活在低纬度地区,本该具有较强的内源性的昼夜节律,但与成鱼不同,在尼罗罗非鱼幼鱼中内源性日钟调控的昼夜节律较弱,外源性的光照因素在调控尼罗罗非鱼幼鱼的昼夜节律上具有更加重要的作用,光照可以更加有效地调控尼罗罗非鱼幼鱼的昼夜节律,但从L:D=2 h:2 h的实验结果中我们可以推测:尼罗罗非鱼的运动行为对光有一定的响应时间阈值。
当生存环境发生变化时,改变自身行为是动物个体采取的第一反应。尼罗罗非鱼是一种广盐性、耐高温、不耐低温的鱼类[23-24],本次研究主要集中在光照对尼罗罗非鱼的影响,没有考虑温度和盐度。以往的研究发现温度和盐度会对鱼类的生理和行为产生影响。FANTA等[25]发现温度和盐度会改变虾虎鱼的昼夜节律。鱼类作为水生变温动物,其体温随外界水温变化而变化,而体温的高低会对生物体内化学反应率和生理活动强度产生直接影响,进而显著影响鱼类的生长、代谢和游泳运动能力等生理功能[26],有研究[27-28]表明温度降低会影响尼罗罗非鱼肌肉中有氧代谢酶的活性,也会导致鱼类的游泳能力下降。以后的研究可以进一步了解温度和盐度对尼罗罗非鱼昼夜节律的影响。
总之,根据目前的研究,尼罗罗非鱼幼鱼具有内源性的昼夜节律,但内源性的节律较弱,外界的光照可以很快改变尼罗罗非鱼的昼夜节律,但作用的过程需要一定时间。
| [1] |
DUNLAP J C, LOROS J J, DECOURSEY P J. Chronobiology: biological timekeeping[M]. Sunderland, Massachusetts, USA: Sinauer Associates, Inc., 2004: 927-929.
|
| [2] |
GOLDMAN B D. Mammalian photoperiodic system: formal properties and neuroendocrine mechanisms of photoperiodic time measurement[J]. Journal of Biological Rhythms, 2001, 16(4): 283-301. DOI:10.1177/074873001129001980 |
| [3] |
王明勇, 黄国栋, 王晗. 斑马鱼生物钟研究进展[J]. 遗传, 2012, 34(9): 1133-1143. WANG M Y, HUANG G D, WANG H. Advances in the zebrafish circadian clock mechanisms[J]. Hereditas, 2012, 34(9): 1133-1143. |
| [4] |
郭金虎, 徐璎, 张二荃, 等. 生物钟研究进展及重要前沿科学问题[J]. 中国科学基金, 2014, 28(3): 179-186. GUO J H, XU Y, ZHANG E Q, et al. Advances and key scientific issues of biological rhythms research-summary of the 104th Shuangqing forum[J]. Bulletin of National Natural Science Foundation of China, 2014, 28(3): 179-186. |
| [5] |
HERRERO M J, MADRID J A, SÁNCHEZ-VÁZQUEZ F J. Entrainment to light of circadian activity rhythms in tench (Tinca tinca)[J]. Chronobiology International, 2003, 20(6): 1001-1017. DOI:10.1081/CBI-120025246 |
| [6] |
SCHULZ U H, LEUCHTENBERGER C. Activity patterns of south American silver catfish (Rhamdia quelen)[J]. Brazilian Journal of Biology, 2006, 66(2A): 565-574. DOI:10.1590/S1519-69842006000300024 |
| [7] |
HELFMAN G S. Fish behaviour by day, night and twilight[M]//PITCHER T J. The Behaviour of Teleost Fishes. Boston, MA: Springer, 1986: 366-387.
|
| [8] |
REEBS S G. Plasticity of diel and circadian activity rhythms in fishes[J]. Reviews in Fish Biology and Fisheries, 2002, 12(4): 349-371. DOI:10.1023/A:1025371804611 |
| [9] |
LÓPEZ-OLMEDA J F, SÁNCHEZ-VÁZQUEZ F J. Feeding rhythms in fish: from behavioral to molecular approach[M]//KULCZYKOWSKA E. Biological Clock in Fish. Enfield, NH: Science Publishers, 2010: 155-184.
|
| [10] |
MISTLBERGER R E. Circadian food-anticipatory activity: formal models and physiological mechanisms[J]. Neuroscience & Biobehavioral Reviews, 1994, 18(2): 171-195. |
| [11] |
REEBS S G, LAGUE M. Daily food-anticipatory activity in golden shiners: a test of endogenous timing mechanisms[J]. Physiology & Behavior, 2000, 70(1/2): 35-43. |
| [12] |
PAYNE A I, COLLINSON R I. A comparison of the biological characteristics of Sarotherodon niloticus (L.) with those of S. aureus (Steindachner) and other tilapia of the delta and lower nile[J]. Aquaculture, 1983, 30(1/4): 335-351. |
| [13] |
MIGAUD H, DAVIE A, MARTINEZ CHAVEZ C C, et al. Evidence for differential photic regulation of pineal melatonin synthesis in teleosts[J]. Journal of Pineal Research, 2007, 43(4): 327-335. DOI:10.1111/jpi.2007.43.issue-4 |
| [14] |
VERA L M, CAIRNS L, SÁNCHEZ-VÁZQUEZ F J, et al. Circadian rhythms of locomotor activity in the nile tilapia Oreochromis niloticus[J]. Chronobiology International, 2009, 26(4): 666-681. DOI:10.1080/07420520902926017 |
| [15] |
COSTA L S, SERRANO I, SÁNCHEZ-VÁZQUEZ F J, et al. Circadian rhythms of clock gene expression in nile tilapia (Oreochromis niloticus) central and peripheral tissues: influence of different lighting and feeding conditions[J]. Journal of Comparative Physiology B, 2016, 186(6): 775-785. DOI:10.1007/s00360-016-0989-x |
| [16] |
CAHILL G M. Circadian regulation of melatonin production in cultured zebrafish pineal and retina[J]. Brain Research, 1996, 708(1/2): 177-181. |
| [17] |
CAHILL G M, HURD M W, BATCHELOR M M. Circadian rhythmicity in the locomotor activity of larval zebrafish[J]. Neuroreport, 1998, 9(15): 3445-3449. DOI:10.1097/00001756-199810260-00020 |
| [18] |
VATINE G, VALLONE D, GOTHILF Y, et al. It's time to swim! Zebrafish and the circadian clock[J]. FEBS Letters, 2011, 585(10): 1485-1494. DOI:10.1016/j.febslet.2011.04.007 |
| [19] |
SÁNCHEZ-VÁZQUEZ F J, MADRID J A, ZAMORA S, et al. Demand feeding and locomotor circadian rhythms in the goldfish, Carassius auratus: dual and independent phasing[J]. Physiology & Behavior, 1996, 60(2): 665-674. |
| [20] |
NARUSE M, OISHI T. Effects of light and food as Zeitgebers on locomotor activity rhythms in the loach, Misgurnus anguillicaudatus[J]. Zoological Science, 1994, 11(1): 113-119. |
| [21] |
SÁNCHEZ-VÁZQUEZ F J, MADRID J A, ZAMORA S. Circadian rhythms of feeding activity in sea bass, Dicentrarchus labrax L.: Dual phasing capacity of diel demand-feeding pattern[J]. Journal of Biological Rhythms, 1995, 10(3): 256-266. DOI:10.1177/074873049501000308 |
| [22] |
LU W Q, MENG Q J, TYLER N J C, et al. A circadian clock is not required in an arctic mammal[J]. Current Biology, 2010, 20(6): 533-537. DOI:10.1016/j.cub.2010.01.042 |
| [23] |
朱华平, 刘玉姣, 刘志刚, 等. 低温胁迫对尼罗罗非鱼水通道蛋白基因(AQP1)表达的影响[J]. 中国水产科学, 2014, 21(6): 1181-1189. ZHU H P, LIU Y J, LIU Z G, et al. Effects of cold stress on Aquaporin gene (AQP1) expression in tilapia Oreochromis niloticus[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1181-1189. |
| [24] |
赵丽慧, 赵金良, JEERAWATT, 等. 盐碱胁迫对尼罗罗非鱼血清渗透压、离子浓度及离子转运酶基因表达的影响[J]. 水产学报, 2014, 38(10): 1696-1704. ZHAO L H, ZHAO J L, JEERAWAT T, et al. Effects of salinity-alkalinity on serum osmolality, ion concentration and mRNA expression of ion transport enzymes of Oreochromis niloticus[J]. Journal of Fisheries of China, 2014, 38(10): 1696-1704. |
| [25] |
FANTA E. Behaviour and orcadian rhythm of the fish Bathygobius soporator valenciennes (Gobiidae) under the influence of environmental salinity and temperature[J]. Revista Brasileira de Zoologia, 1997, 14(1): 221-244. DOI:10.1590/S0101-81751997000100021 |
| [26] |
吕为群, 袁明哲. 温度变化对鱼类行为影响的研究进展[J]. 上海海洋大学学报, 2017, 26(6): 828-835. LÜ W Q, YUAN M Z. The literature review of temperature change effect on fish behavior[J]. Journal of Shanghai Ocean University, 2017, 26(6): 828-835. |
| [27] |
PENGHAN L Y, CAO Z D, FU S J. Effect of temperature and dissolved oxygen on swimming performance in crucian carp[J]. Aquatic Biology, 2014, 21(1): 57-65. DOI:10.3354/ab00571 |
| [28] |
RENSING L, RUOFF P. Temperature effect on entrainment, phase shifting, and amplitude of circadian clocks and its molecular bases[J]. Chronobiology International, 2002, 19(5): 807-864. DOI:10.1081/CBI-120014569 |
2. International Research Center for Marine Biosciences, Ministry of Science and Technology, Shanghai Ocean University, Shanghai 201306, China;
3. Key Laboratory of Exploration and Utilization of Aquatic Genetic Researces, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


