2. 中国水产科学研究院淡水渔业研究中心 农业部淡水渔业和种质资源利用重点实验室, 江苏 无锡 214081
β-连环蛋白基因(β-catenin)是经典Wnt信号传导途径的关键基因,且在进化过程中是高度保守的[1]。在雄性小鼠(Mus musculus)性腺细胞中β-catenin过表达可阻断睾丸维持雄性性征[2],敲除胎儿小鼠卵巢中的β-catenin后导致卵巢出现形态学上的缺陷[3]。β-catenin基因在鱼类发育过程中也有重要作用,斑马鱼(Danio rerio) β-catenin1和β-catenin2对其发育有重要作用[4],尼罗罗非鱼(Oreochromis niloticus)卵巢中β-catenin1和β-catenin2在Wnt信号通路中协同作用,雌性罗非鱼中敲除β-catenin1和β-catenin2导致卵巢分化延缓[5],另外β-catenin1对福瑞鲤(Cyprinus carpio)性腺早期发育起着重要作用[6]。
性激素在性别调节、生殖行为和性腺发育中起重要作用[7]。天然或者合成的性激素也会影响硬骨鱼的性腺发育[8-12]。外源性17β-雌二醇可使芳香化酶基因cyp19a1表达量增加[13],17α-甲基睾酮(17α-Methyl testosterone,MT)可抑制斑马鱼卵巢中cyp19a1的表达,MT也抑制了Wnt信号通路中的基因[14],这可能预示着MT对斑马鱼卵巢中β-catenin基因的表达有影响。还有研究显示睾丸甾酮(Testosterone,T)能够促使未成熟虹鳟(Oncorhynchus mykiss)的性腺发育[15]。雌激素和孕激素都能激活Wnt信号通路,进而影响β-catenin的表达水平[16]。
福瑞鲤是本实验室以建鲤(C.carpio var. jian)和黄河鲤(C.capio haematopterus Temminck et Schlegel)为原始亲本,通过1代群体选育和连续4代最佳线性无偏预测法(Best Linear Unbiased Prediction, BLUP)家系选育而得到的新品种,与其亲本相比具有很多生长性状优势[17-18]。但是选育提高其生长性状的分子机制尚不清楚。本实验室前期已经进行了不同生长速度福瑞鲤肌肉组织的转录组测序,并对β-catenin1、igf3基因在其性腺中的功能进行了研究[6, 19]。在此基础上,本研究将进一步对福瑞鲤性腺发育有重要作用的β-catenin2基因进行克隆和表达特性研究,为鱼类新品种优良性状的遗传分子机制解析奠定基础。
1 材料与方法 1.1 实验动物与样品采集本实验所用的福瑞鲤均来自于中国水产科学研究院淡水渔业研究中心宜兴屺亭科研实验基地。挑选健康、大小均一的福瑞鲤暂养于温室循环水养殖系统,投喂配合饲料,实验过程中水温为(28±1)℃。
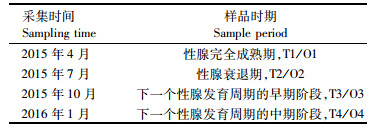
采集实验样品时先用丁香油(湛云化学有限公司,上海)轻微麻醉,取其卵巢(Ovary OV)、精巢(Testis TT)、肾脏(Kidney KN)、心脏(Heart HE)、肌肉(Muscle MU)、肝脏(Liver LV)、脾脏(Spleen SP)、肠(Intestine IN)、血(Blood BL)、皮(Skin SK)、脑(Head HD);性腺各期的样品采集信息如表 1所示。将采集到的样品分别置于1.5 mL微量离心管中,液氮速冻后储存于-80 ℃冰箱待用。性激素处理后性腺组织的采集方法同上。
|
表 1 性腺发育各期组织样品的采集信息 Tab.1 Collection of tissue samples from various stages of gonadal development |
使用EASY组织/细胞超纯RNA提取试剂盒(原平皓生物科技有限公司,天津)从福瑞鲤性腺组织中提取总RNA,总RNA浓度通过UV-分光光度计(NanoDrop2000,Thermo,Wilmington,DE,USA)测量,根据光密度OD260/280检测其纯度,1%琼脂糖凝胶电泳检查总RNA的质量和完整性。只选取OD260/280(> 1.80)显示有效吸光度的样品用于cDNA合成。cDNA的合成采用Prime Script RT Master Mix(TaKaRa, Otsu, Japan)试剂盒进行,反应程序为37 ℃ 15 min反转录,85 ℃ 5 s灭活反转录酶。
1.3 β-catenin2 cDNA全长克隆和序列分析从卵巢中提取总RNA用于5′和3′末端(5′和3′RACE)第一链cDNA合成,具体步骤根据SMARTer RACE 5′/3′试剂盒(Clontech, Mountain View, CA, USA)进行,然后将第一链反应产物通过Tricine-EDTA缓冲液稀释至90 μL。将所有cDNA样品储存于-20 ℃冰箱备用。
根据福瑞鲤转录组文库(NCBI SRA数据库SRP078896)的原始表达序列(EST)设计SMARTer RACE-PCR反应的引物(表 2)用于RACE扩增。采用SMARTer RACE 5′/3′Kit(Clontech, Mountain View, CA, USA)进行5′和3′RACE扩增。PCR反应程序如下:94 ℃ 30 s,64 ℃ 30 s,72 ℃ 3 min,25个循环。PCR产物用1%琼脂糖凝胶电泳检测纯度后,用一次性碳钢手术刀切除目标条带,然后用E.Z.N.A.凝胶提取试剂盒(Omega Bio-Tek, Norcross, GA, USA)将cDNA连接到载体pMD18-T(TaKaRa)中,转化到大肠杆菌DH5-α感受态细胞中,送至上海生工生物公司测序。

|
表 2 实验用到的引物序列 Tab.2 Primer sequences uesd in the study |
测序结果使用搜索工具(BLAST)、BLASTx和BLASTn(http://blast.ncbi.nlm.nih.gov)分析得到核苷酸和对应的氨基酸(Amino acids, aa)序列,再通过开放阅读框(ORF)查找工具确定该序列的开放阅读框(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)。通过ClustalW2进行多个序列比对(http://www.ebi.ac.uk/Tools/msa/clustalo/)。使用SMART(http://smart.embl-heidelberg.de)预测信号肽的切割位点;通过MEGA 5.0构建N-J系统发育树,通过自展法进行1 000次重复检验分析评估可靠性。
1.4 性激素处理将第一年4月份孵育出来的福瑞鲤饲养至第二年1月,挑出体态良好、体质量大小均匀的福瑞鲤进行性激素注射实验。实验鱼初始体质量(75±5)g/尾。处理组1、2、3的注射浓度分别为1 μg/g(10雄+10雌)、10 μg/g(10雄+10雌)、50 μg/g(10雄+10雌)以及对照组0 μg/g(10雄+10雌)。将睾丸甾酮(Testosterone, Medchem Express,USA)溶于等体积的纯乙醇中,并用0.6%的生理盐水稀释至实验浓度,进行腹腔注射,对照组实验鱼注射与实验组等浓度的乙醇与生理盐水混合液。E2(17β-estradiol,Dr. EhrenstorferGmbH,Augsburg,Germany)的处理方法同雄激素。
1.5 实时荧光定量PCR(qRT-PCR)通过qRT-PCR分析β-catenin2 mRNA在各组织、性腺发育过程和性激素处理的表达情况。根据获得的福瑞鲤β-catenin2 cDNA全长序列(GeneBank编号MF491393)设计特异性引物(表 2),PCR产物102 bp。使用CFX96实时PCR(Bio-Rad, Hercules, CA, USA),具体检测根据SYBR Premix Ex TaqⅡ(TaKaRa, Otsu, Japan)试剂盒说明书操作。qRT-PCR反应的最终体积为25 μL,其中包含12.5 μL 2×SYBR Premix Ex Taq(TaKaRa,Otsu,Japan),1.0 μL稀释后的cDNA模板(100 ng RNA),9.5 μL PCR级水和1.0 μL引物(10 μmol/L)。PCR条件为95 ℃ 30 s,40个循环包括95 ℃ 5 s,62 ℃ 30 s。每个样品3个平行,内参基因选择福瑞鲤的β-actin(M24113.1)。根据序列设计引物(表 2),β-actin的引物产生85 bp的PCR产物。
1.6 统计与分析根据2-ΔΔCT的方法计算β-catenin2的表达量,根据每个样品的3个平行值计算得出均值和标准差,β-catenin2基因的表达量由相对于内参基因β-actin表达倍数的差异而定。先用单因素方差分析然后进行邓肯检验(SPSS Inc.Chicago, IL, USA),以计算实验组之间的差异显著性。使用t检验比较处理组和对照组之间的结果,P < 0.05则有显著性,并以平均值±标准误(M±SEM, n=3)作为最终结果。
2 结果 2.1 β-catenin2 cDNA全长克隆和序列分析根据RACE-PCR克隆得到福瑞鲤β-catenin2 cDNA全长为3 411 bp(GeneBank:MF491393),开放阅读框(Open reading frame,ORF)2 343 bp,编码780个氨基酸,推测蛋白质大小为85.52 ku,等电点(Isoelectric point,pI)为5.53。序列分析表明,β-catenin2的中心区域含有12个Armadillo(ARM)。另外,根据预测β-catenin2编码的蛋白含有脂蛋白N-末端结构域(Lipoprotein N-terminal domain, LDP-N),此结构域出现在脂质转运蛋白中,如卵黄蛋白原、微粒体甘油三酯转运蛋白和载脂蛋白,且在脊椎动物和无脊椎动物中都是高度保守的(图 1)。

|
图 1 福瑞鲤β-catenin2核苷酸及其预测的氨基酸序列
Fig. 1 The nucleotide and deduced amino acid sequences of β-catenin2 in C.carpio
灰色区域表示重复的ARM结构域,方框中的区域为脂蛋白N-末端结构域(LDP-N)
The gray area shows a repeating ARM domain, the area in the box is the lipoprotein N-terminal domain (LDP-N) |
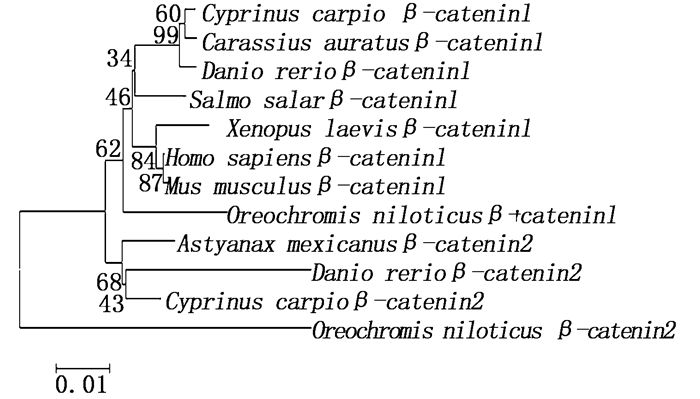
根据Clustal X多重序列比对研究福瑞鲤β-catenin2与其他物种的β-catenin2和β-catenin1的同源性。结果显示,福瑞鲤β-catenin2与斑马鱼β-catenin2 (Danio rerio BC056276.1)、墨西哥脂鲤β-catenin2 (Astyanax mexicanus ENSAMXT000 00002995)、尼罗罗非鱼β-catenin2 (Oreochromis niloticus ENSONIT00000002594)的同源性分别为97.1%、96.8%、91.4%;福瑞鲤β-catenin2与鲫鱼β-catenin1 (Carassius auratus ACI02123.1)、人β-catenin 1 (Homo sapiens NP_001895.1)、福瑞鲤β-catenin1 (Cyprinus carpio KX426572.1)、小家鼠β-catenin1 (Mus musculus NP_031640.1)、大西洋鲑β-catenin1 (Salmo salar NP_001167409.1)、尼罗罗非鱼β-catenin1 (Oreochromis niloticus ENSONIT00000009116)的同源性分别为97.4%、97.4%、97.3%、97.3%、96.5%、95.1%。
2.3 β-catenin2的系统发育分析通过MEGE 6.0软件进行遗传距离分析,并根据Neighbour-joining法构建系统发育树,构建发育树时选取了已经公布的一些鱼类、哺乳动物、以及两栖类的β-catenin基因的氨基酸序列(图 2)。鱼类β-catenin1基因的氨基酸序列有:斑马鱼(Danio rerio-1 ENSDART00000148379)、鲤(Cyprinus carpio KX426572)、尼罗罗非鱼(Oreochromis niloticus ENSONIT00000009116)、鲫(Carassius auratus ACI02123.1)、大西洋鲑(Salmo salar NP_001167409.1);鱼类β-catenin2基因的氨基酸序列有:斑马鱼(Danio rerio-2 BC056276.1)、鲤(Cyprinus carpio MF491393)、尼罗罗非鱼(Oreochromis niloticus ENSONIT00000002594)、墨西哥脂鲤(Astyanax mexicanus ENSAMXT00000002995);哺乳类β-catenin基因的氨基酸序列有:人(Homo sapiens NP_001895.1)、小家鼠(Mus musculus NP_031640.1);两栖类β-catenin基因的氨基酸序列选择非洲爪蟾(Xenopus sapiens NP_001084045.1)。
|
图 2 N-J法构建的福瑞鲤与其他物种β-catenin蛋白系统进化树
Fig. 2 Neighbor-joining phylogenetic tree of the β-catenin protein using the deduced amino acids sequences of C.carpio and other species
|
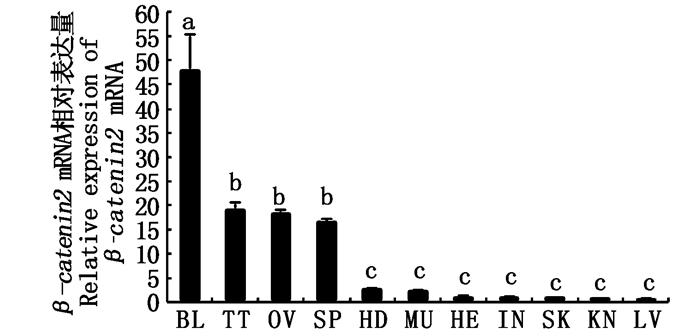
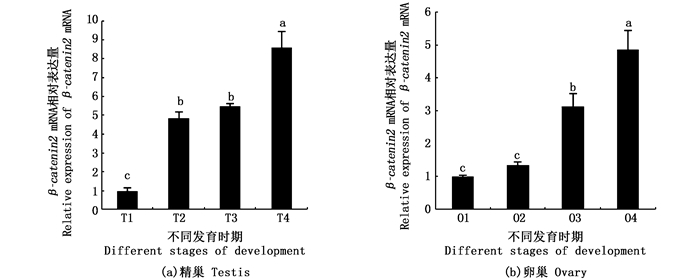
β-catenin 2基因在血液中的表达量最高,其次是精巢、卵巢以及脾脏,在心脏、肌肉、脑、皮、肾、肠、肝中的表达量都比较低(图 3)。在性腺发育过程中,β-catenin2 mRNA表达水平在性腺发育早期阶段,随着性腺发育而升高。在精巢中(图 4a),β-catenin2 mRNA表达水平在其发育完全成熟期(T1)呈最低水平,在其发育的衰退期(T2)和发育早期(T3)呈中等水平,在其发育的中期(T4)达到最高水平;在卵巢中(图 4b),β-catenin2 mRNA表达水平在其发育的完全成熟期(O1)和衰退期(O2)呈最低水平,在其发育的早期(O3)呈中等水平,在其发育的中期(O4)达到最高水平。
|
图 3 福瑞鲤β-catenin2 mRNA在各组织中的表达量
Fig. 3 Tissue-dependent β-catenin2 mRNA levels in C.carpio
各组织中上标的不同小写字母(a, b, c)表示差异显著(P < 0.05)
Different lowercase letters (a, b, c) of the superscripts in each organization indicate significant differences(P < 0.05) |
|
图 4 福瑞鲤β-catenin2 mRNA在性腺各期相对表达量
Fig. 4 The level of β-catenin2 mRNA in different stages of gonadal development in C.carpio
同一组织不同时期中标记的不同小写字母(a, b, c)表示差异显著(P < 0.05)
Different lowercase letters (a, b, c) marked in different periods of the same organization indicate significant differences(P < 0.05) |
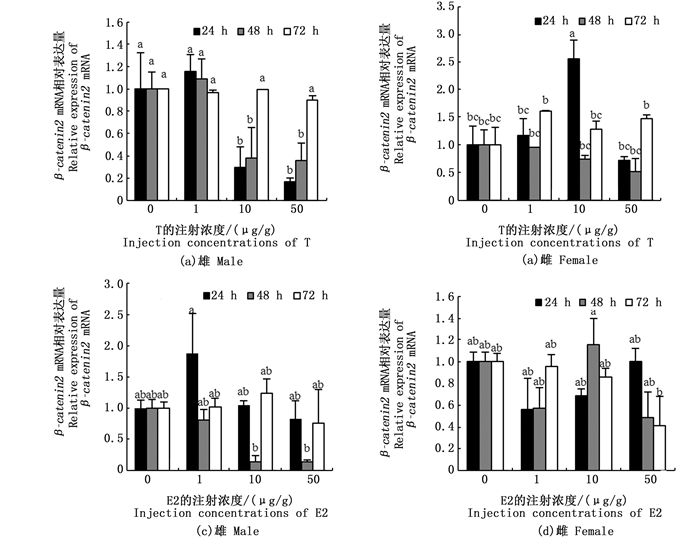
通过qRT-PCR检测了腹腔注射雄激素T和E2后在24、48和72 h性腺中β-catenin2 mRNA表达水平。10和50 μg/g T处理组和对照组相比,在处理24 h和48 h后精巢中β-catenin2 mRNA的表达水平显著下降(P < 0.05),而处理72 h后β-catenin2 mRNA表达水平没有显著变化(P > 0.05),与对照组相比处理组1的T处理24、48、72 h后β-catenin2 mRNA在精巢中表达水平均无显著变化(P > 0.05,图 5a);与对照组相比,1 μg/g处理组在72 h、10 μg/g处理组在24 h后卵巢中β-catenin2 mRNA表达水平显著升高(P < 0.05),其他均无显著变化(图 5b)。相较于对照组,E2处理后精巢中β-catenin2 mRNA表达水平无显著变化(P > 0.05,图 5c);与对照组相比, 卵巢中β-catenin2 mRNA表达水平无显著变化(P > 0.05,图 5d)。
|
图 5 性激素处理后β-catenin2 mRNA在精巢和卵巢中的表达量
Fig. 5 Effect of sex hormone on β-catenin2 mRNA expression levels in testis and ovary of C.carpio
同一处理时间下不同浓度处理组中标记的不同小写字母(a, b, c)表示差异显著(P < 0.05)
Different lowercase letters (a, b, c) marked in different concentration treatment groups at the same treatment time indicate significant differences(P < 0.05) |
本研究首次克隆了福瑞鲤β-catenin2基因全长,其含有12个重复的ARM保守结构。系统发育树结果显示,福瑞鲤β-catenin2基因首先与斑马鱼和墨西哥脂鲤(Astyanax mexicanus)等鱼类的β-catenin2相聚,然后与β-catenin1聚集,且遗传距离由近及远依次为鱼类、两栖类、哺乳类,但尼罗罗非鱼β-catenin2基因的氨基酸序列独立形成一个分支且与其他物种β-catenin基因的遗传距离较远,这与序列比对的结果一致。本研究发现β-catenin2基因的氨基酸序列中含有脂蛋白N-末端结构域(LDP-N),WANG等[10]的研究表明福瑞鲤β-catenin1基因的氨基酸序列N-末端含有糖原合酶激酶-3(Glycogen synthase kinase-3, GSK-3)结构域,这可能预示着福瑞鲤β-catenin1和β-catenin2功能方面有差异性,福瑞鲤β-catenin1和β-catenin2的C末端结构不同,这可能是导致福瑞鲤β-catenin1和β-catenin2遗传距离较远的原因。另外,尼罗罗非鱼β-catenin2单独聚集的原因可能是β-catenin的C末端包含能够激活与其关联基因所需要的结构域[20],而WU等[5]发现尼罗罗非鱼β-catenin2氨基酸的C-末端有98个氨基酸与鱼类和四足动物的存在明显差异。
β-catenin2 mRNA在福瑞鲤各组织中均有表达,且在血液中表达量最高,其次是精巢、脾脏和卵巢组织。β-catenin2在福瑞鲤血液中高表达的原因可能是其编码的蛋白属于分泌蛋白,通过血液运输实现,且其在免疫方面有重要作用。另外,β-catenin2基因广泛存在于很多生物的各个组织中,如斑马鱼的β-catenin2在组织中广泛表达,且对其胚胎发育有重要作用[4],在神经系统和背腹轴发育中也有重要作用。作为β-catenin基因的亚型之一的β-catenin1也分布于福瑞鲤各种组织并在精巢和血液中表达量最高[6],除此之外,尼罗罗非鱼中β-catenin2 mRNA在肝、精巢和肾脏中表达水平高[5]。β-catenin mRNA在尼罗罗非鱼和福瑞鲤性腺中的表达水平都相对较高,表明β-catenin1和β-catenin2在鱼类性腺发育中具有重要作用。
在福瑞鲤性腺发育过程中,β-catenin2 mRNA表达量在性腺发育早期,随着性腺发育的成熟逐渐升高,随着性腺衰退期逐渐降低。福瑞鲤β-catenin1 mRNA的表达水平也是随着性腺发育逐渐升高[6],此外WU等[5, 21]研究发现尼罗罗非鱼卵巢发育过程中β-catenin1和β-catenin2具有相似的表达模式,β-catenin1 mRNA在孵化后20、60和90 d的卵巢中表达水平逐渐上升,β-catenin2 mRNA的表达水平在孵化后20和90 d的卵巢显著升高,而此时正是尼罗罗非鱼卵母细胞发生减数分裂的关健时刻[22]。这些研究结果表明β-catenin2也很可能与福瑞鲤性腺发育相关,且在性腺发育过程中福瑞鲤β-catenin1和β-catenin2具有相似的表达模式。
本研究中不同浓度T处理福瑞鲤后对精巢中β-catenin2表达量有抑制作用。有研究表明雄激素受体在精巢、卵巢中大量表达,且精巢表达量显著高于卵巢[23],精巢对雄激素刺激更敏感,因此可能精巢中的β-catenin2 mRNA表达水平变化较明显。该研究中不同浓度T处理后福瑞鲤卵巢中β-catenin2 mRNA表达水平显著上升。研究表明硬骨鱼类精巢和卵巢中都存在cyp19基因[24-25],而其编码的蛋白细胞色素P450芳香酶能够将雄激素转化为雌激素[15],WANG等[16]的研究表明雌激素对福瑞鲤卵巢中β-catenin的表达影响既有促进也有抑制,与雌激素的剂量无直接关系。此外精巢与卵巢发育不同步,这也可能是导致T处理后卵巢中β-catenin2 mRNA表达水平有显著变化的原因[6]。
不同浓度E2处理福瑞鲤后,精巢和卵巢中β-catenin2 mRNA表达水平无显著影响。WANG等[6]的研究表明E2处理后对卵巢中β-catenin1 mRNA的表达水平有影响,而各浓度E2对精巢中β-catenin1 mRNA表达水平没有显著影响。也有研究表明很多类固醇类激素既可引起基因组反应也可引起非基因组反应,因此雌激素也可能引起细胞的非基因组效应,即不通过经典的核受体做出反应,而在质膜通过表面受体来调节[26]。还有研究表明E2参与早期阶段卵巢发育,促进卵黄发生和卵泡生长[27],而该研究进行时是福瑞鲤性腺发育即将成熟的1月份,这可能导致性腺对性激素刺激不敏感,以上因素均可能是导致E2处理后福瑞鲤性腺中β-catenin2 mRNA表达水平无显著变化的原因。
综上所述,本研究克隆了福瑞鲤β-catenin2 cDNA全长序列,进行了序列分析,并研究了其在各种组织分布和性腺发育不同阶段的表达模式。研究发现随着福瑞鲤性腺早期发育,β-catenin2基因的表达量增加。T处理后主要对精巢中的β-catenin2基因的表达量有影响。这些结果表明, β-catenin2是福瑞鲤性腺发育所需的重要蛋白质,可能参与了福瑞鲤的性腺早期发育。
| [1] |
VALENTA T, HAUSMANN G, BASLER K. The many faces and functions of β-catenin[J]. The EMBO Journal, 2012, 31(12): 2714-2736. DOI:10.1038/emboj.2012.150 |
| [2] |
MAATOUK D M, DINAPOLI L, ALVERS A, et al. Stabilization of β-catenin in XY gonads causes male-to-female sex-reversal[J]. Human Molecular Genetics, 2008, 17(19): 2949-2955. DOI:10.1093/hmg/ddn193 |
| [3] |
LIU C F, BINGHAM N, PARKER K, et al. Sex-specific roles of β-catenin in mouse gonadal development[J]. Human Molecular Genetics, 2009, 18(3): 405-417. |
| [4] |
VARGA M. The role of β-catenin in early zebrafish development[D]. Pennsylvania: University of Pennsylvania, 2006.
|
| [5] |
WU L M, WU F R, XIE L, et al. Synergistic role of β-catenin 1 and 2 in ovarian differentiation and maintenance of female pathway in Nile tilapia[J]. Molecular and Cellular Endocrinology, 2016, 427: 33-44. DOI:10.1016/j.mce.2016.03.002 |
| [6] |
WANG L M, SONG F B, DONG J J, et al. Characterization of β- catenin 1 during the gonad development in the common carp (Cyprinus carpio)[J]. Aquaculture Research, 2017, 48(10): 5402-5410. DOI:10.1111/are.2017.48.issue-10 |
| [7] |
VAINIO S, HEIKKILÄ M, KISPERT A, et al. Female development in mammals is regulated by Wnt-4 signalling[J]. Nature, 1999, 397(6718): 405-409. DOI:10.1038/17068 |
| [8] |
SEGNER H, CASANOVA-NAKAYAMA A, KASE R, et al. Impact of environmental estrogens on Yfish considering the diversity of estrogen signaling[J]. General and Comparative Endocrinology, 2013, 191: 190-201. DOI:10.1016/j.ygcen.2013.05.015 |
| [9] |
DENSLOW N, SÉPULVEDA M. Ecotoxicological effectsof endocrine disrupting compounds on fish reproduction[M]//BABIN P J, CERDÀ J, LUBZENS E. The Fish Oocyte: From Basic Studies to Biotechnological Applications. Dordrecht: Springer, 2007.
|
| [10] |
LEET J K, GALL H E, SEPÚLVEDA M S. A review of studies on androgen and estrogen exposure in fish early life stages: effects on gene and hormonal control of sexual differentiation[J]. Journal of Applied Toxicology, 2011, 31(5): 379-398. DOI:10.1002/jat.v31.5 |
| [11] |
BORG B. Androgens in teleost fishes[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 1994, 109(3): 219-245. DOI:10.1016/0742-8413(94)00063-G |
| [12] |
GUIGUEN Y, FOSTIER A, PIFERRER F, et al. Ovarian aromatase and estrogens: a pivotal role for gonadal sex differentiation and sex change in fish[J]. General and Comparative Endocrinology, 2010, 165(3): 352-366. DOI:10.1016/j.ygcen.2009.03.002 |
| [13] |
CIESIÓŁKA S, BUDNA J, JOPEK K, et al. Time- and dose-dependent effects of 17 Beta-estradiol on short-term, real-time proliferation and gene expression in porcine granulosa cells[J]. BioMed Research International, 2017(4): 9738640. |
| [14] |
KAZETO Y, IJIRI S, PLACE A R, et al. The 5'-flanking regions of CYP19A1 and CYP19A2 in zebrafish[J]. Biochemical and Biophysical Research Communications, 2001, 288(3): 503-508. DOI:10.1006/bbrc.2001.5796 |
| [15] |
CRIM L W, EVANS D M. Influence of testosterone and/or luteinizing hormone releasing hormone analogue on precocious sexual development in the juvenile rainbow trout[J]. Biology of Reproduction, 1983, 29(1): 137-142. DOI:10.1095/biolreprod29.1.137 |
| [16] |
WANG Y Y, VAN DER ZEE M, FODDE R, et al. Wnt/Β-catenin and sex hormone signaling in endometrial homeostasis and cancer[J]. Oncotarget, 2010, 1(7): 674-684. |
| [17] |
DONG Z J, NGUYEN N H, ZHU W B. Genetic evaluation of a selective breeding program for common carp Cyprinus carpio conducted from 2004 to 2014[J]. BMC Genetics, 2015, 16: 94. |
| [18] |
阎明信.福瑞鲤新品系形态差异分析及选育效果评价[D].南京: 南京农业大学, 2014. YAN M X. Morphological differences analysis on new strain of FFRC strain common carp and breeding results evaluation[D]. Nanjing: Nanjing Agricultural University, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Y2975942 |
| [19] |
SONG F B, WANG L M, ZHU W B, et al. A novel igf3 gene in common carp (Cyprinus carpio): evidence for its role in regulating gonadal development[J]. PLoS One, 2016, 11(12): e0168874. DOI:10.1371/journal.pone.0168874 |
| [20] |
AKIYAMA T. Wnt/β-catenin signaling[J]. Cytokine & Growth Factor Reviews, 2000, 11(4): 273-282. |
| [21] |
吴利敏. Rspo1和β-catenin在罗非鱼卵巢分化、维持过程中的功能研究[D].重庆: 西南大学, 2016. WU L M. Roles of Rspo1, β-catenin in ovarian differentiation and maintenance in Nile tilapia[D]. Chongqing: Southwest University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10635-1016908987.htm |
| [22] |
KOBAYASHI T, NAGAHAMA Y. Molecular aspects of gonadal differentiation in a teleost fish, the Nile tilapia[J]. Sexual Development, 2009, 3(2/3): 108-117. |
| [23] |
MIYOSHI K, HENNIGHAUSEN L. β-catenin: a transforming actor on many stages[J]. Breast Cancer Research, 2003, 5(2): 63-68. DOI:10.1186/bcr566 |
| [24] |
IJIRI S, KAZETO Y, TAKEDA N, et al. Changes in serum steroid hormones and steroidogenic ability of ovarian follicles during artificial maturation of cultivated Japanese eel, Anguilla japonica[J]. Aquaculture, 1995, 135(1/3): 3-16. |
| [25] |
KAZETO Y, IJIRI S, MATSUBARA H, et al. Cloning of 17β-Hydroxysteroid dehydrogenase-Ⅰ cDNAs from Japanese eel ovary[J]. Biochemical and Biophysical Research Communications, 2000, 279(2): 451-456. DOI:10.1006/bbrc.2000.3974 |
| [26] |
蒲鲁鲁, 张子平, 王艺磊, 等. 硬骨鱼类雄激素受体研究进展[J]. 动物学杂志, 2011, 46(4): 150-160. PU L L, ZHANG Z P, WANG Y L, et al. Androgen receptor in teleosts[J]. Chinese Journal of Zoology, 2011, 46(4): 150-160. |
| [27] |
NELSON S N, VAN DER KRAAK G. Characterizationand regulation of the insulin-like growth factor (IGF) system in the zebrafish (Danio rerio) ovary[J]. General and Comparative Endocrinology, 2010, 168(1): 111-120. DOI:10.1016/j.ygcen.2010.04.020 |
2. Key Laboratory ofFreshwater Fisheries and Germplasm Resources Utilization, Ministry ofAgriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, Jiangsu, China
 2018,
Vol. 27
2018,
Vol. 27


