2. 上海海洋大学 港航生态安全研究中心, 上海 201306
为保障船舶航行安全和作业效率,自19世纪80年代起全球普遍采用压载水作为船舶压载物[1]。压载舱黑暗、缺氧、复杂的特殊环境会对压载水内生物的生长以及存活造成巨大影响,但经过长期压载后仍有微生物、浮游动物、浮游植物及其卵、幼体或孢子(孢囊)能存活[2-3],因而船舶压载水的排放可导致外来生物入侵港口及邻近海域,从而影响当地海域的生物多样性,严重时引发生态灾难[4-5]。因此,船舶压载水已成为海洋外来生物入侵的重要途径[6-7]。浮游动物是压载水生物的重要组成成分[8-9],压载水中浮游动物的排放会威胁目的港及邻近海域的生态安全[10-11],压载水浮游动物的研究已成为压载水生态研究的重要方面,在压载水中浮游动物的种类组成[12-15]、浮游动物存活与压载时间(压载水龄)的相关性[16]以及换水对浮游动物的影响[17]等方面都有相关报道。由于压载舱处于封闭、黑暗的环境中,浮游动物随压载水进入这一特殊环境后,随着压载时间的延长,丰度不断下降,但仍有浮游动物能够生存[18-19],成为潜在的外来生物入侵种。本文应用模拟压载舱,连续跟踪研究了压载后浮游动物的动态变化规律,以期阐明压载水浮游动物种类组成和群落结构随压载时间的动态变化及存活种类的适应机制,为我国压载水的港口国监测提供参考依据。
1 材料与方法 1.1 实验设计2016年7月,于上海海洋大学船舶压载水检测实验室岸基试验基地开展岸基模拟实验。实验舱舱容600 m3,为全封闭钢筋混凝土结构,仅在舱体上部开有直径100 cm的人孔供进出和采样,舱体内壁刷有船舱专用防腐漆,舱体壁不透光且隔热性较好,受外界气温变化的影响小。同时设置自然条件下的开放式舱体为对照。对照舱为600 m3全开放式钢筋混凝土结构舱体。实验前对实验舱和对照舱进行彻底清洗。通过模拟压载水加载操作过程,由潜水泵引洋山港海域海水,经管道输送注满舱体。加载完成后,分别于第0、1、5、10、15、30天进行样品T0、T1、T5、T10、T15、T30的采集,第0天为压载当天,记为样品T0,作为实验起始。同时进行对照舱样本C0、C1、C5、C10、C15、C30的采集。
1.2 样本采集与处理于舱顶的开口处,使用10 L有机玻璃采水器定量采集水样30 L,经过网孔斜径为50 μm的浓缩网过滤后收集于50 mL标本瓶中,每次采集3个平行样。现场进行样本中活体浮游动物分析,将样品定容至50 mL,采用差减法[20]计数。用多通道参数探测仪WTW(Multi 3430)测定pH、盐度(Sal)、温度(T)和溶解氧(DO)。用1 L的聚乙烯瓶采集水质样品,在实验室内按照《海洋监测规范》[21]测定浊度、悬浮物(TSS)、溶解性有机碳(DOC)、亚硝酸盐(NO2-N)、铵盐(NH4-N)、硝酸盐(NH3-N)、磷酸盐(PO4-P)、总氮(TN)和总磷(TP)等水质指标。
1.3 数据分析以各压载时间段浮游动物物种和各物种密度为原始矩阵,为降低数据间极差将原始矩阵进行log(x+1)转换,利用PAST软件[22],采用Bray-Curtis相似性系数,进行多维分析(Multidimensional Scaling,MDS)。典范相关分析(CCA)使用CANONO 4.5软件。其他作图软件采用GraphPad Prism 5.0。
2 结果 2.1 浮游动物种类组成变化压载期间,实验舱内共采集到浮游动物19种,其中浮游动物成体12种、幼体7种(图 1),成体包括原生动物1种、轮虫4种、环节动物和软体动物各1种以及桡足类5种;幼体包括无节幼体、桡足幼体、双壳幼虫、面盘幼虫、帚毛虫、牟勒氏幼虫、帽状幼虫各1种。压载初始共采集到11种浮游动物,压载结束时仅采集到5种,分别为臂尾轮虫(Brachionus sp.)、狭甲轮虫(Colurella sp.)、明螺(Atlana sp.)、面盘幼虫(Veliger larva)和纺锤水蚤(Acartiidae sp.),其中臂尾轮虫和面盘幼虫于压载初始和实验结束时均有采集。狭甲轮属(Colurella sp.)、疣毛轮属(Synchaeta sp.)、寡毛类(Oligochaete)、中华哲水蚤(Calanus sinicus)和帽状幼虫(Pilidium)在压载过程中出现,在实验结束前相继消失。对照舱内共采集到浮游动物19种,包括浮游动物成体13种,幼体6种(图 1)。其中成体包括原生动物1种、轮虫3种、软体动物1种、桡足类8种;幼体包括蔓足类无节幼虫、帚毛虫幼虫、面盘幼虫、双壳幼虫、无节幼体和桡足幼体各1种。实验初始和结束时均采集到浮游动物8种,但种类组成有明显差异(图 1)。
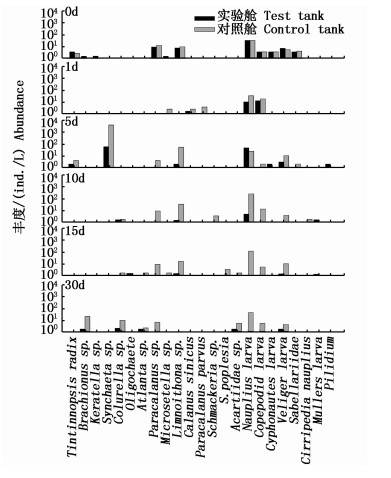
|
图 1 实验舱和对照舱各水龄浮游动物种类组成
Fig. 1 Species composition of zooplankton of each water age in test tank and control tank
|
洋山港海域海水经过30 d模拟压载后,实验舱内浮游动物丰度呈明显下降趋势(图 2)。实验舱浮游动物丰度在第1天显著降低(P < 0.05,F=7.978),低于初始丰度的50%。第5天时,实验舱内浮游动物丰度显著增加(P < 0.05,F=6.719)至(109.05±15.22) ind./L,高于实验舱浮游动物初始丰度。在此之后,浮游动物丰度连续下降,当压载至第30天时,实验舱内浮游动物丰度为(2.65±0.63) ind./L。对照舱内浮游动物丰度在第1天时保持稳定,第5天时达到(4.1×103±6.4×102) ind./L,此时数量级大小远高于初始丰度。随后,实验舱浮游动物丰度逐渐下降,30 d时仍高于初始丰度。
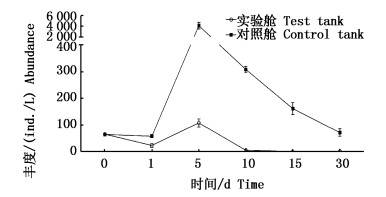
|
图 2 实验舱和对照舱浮游动物丰度
Fig. 2 Number of zooplankton abundance in test tank and control tank
|
模拟压载过程中,造成浮游动物丰度变化的主要类群包括轮虫、浮游幼虫以及桡足类。实验起始时,浮游幼虫和桡足类为优势类群。桡足类在压载过程中组成比例不断降低。5 d时实验舱浮游动物丰度大幅回升,以浮游幼虫(45.61%)和轮虫(52.63%)为主要丰度组成。此时,对照舱中轮虫的优势更为突出,占整体丰度的97.64 %。除5 d外,轮虫在30 d时的丰度优势同样明显。两舱体浮游动物丰度变化过程中,浮游幼虫的丰度优势最为显著(图 3),始终是浮游动物丰度的主要组成类群。
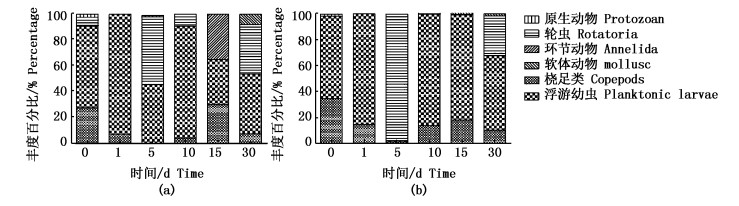
|
图 3 实验舱(a)和对照舱(b)各水龄浮游动物不同类群变化
Fig. 3 The variation of each group species numbers in test tank (a) and control tank (b)
|
MDS分析显示压载水浮游动物群落结构随水龄期而变化。实验舱各实验点在二维空间上分布离散,连线所形成的封闭区域面积远大于对照舱,说明压载环境下水体中浮游动物群落结构具有更大的变化范围。MDS分析图(图 4)的Stress为0.215 4>0.2,表明两舱体各水龄阶段的相似性较差,反映出不同环境下浮游动物群落结构变化的差异性。实验舱第1天的群落结构变化情况处于对照舱所形成的封闭区域边缘,表明压载第1天的变化情况仍接近自然条件下群落演变特征;第5、10、15和30天则远离该区域,表明压载5 d之后的群落结构特征已经完全不同于自然环境下浮游动物群落结构。
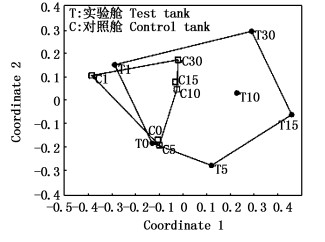
|
图 4 浮游动物群落的MDS分析图
Fig. 4 MDS analysis for zooplankton in test tank and control tank
|
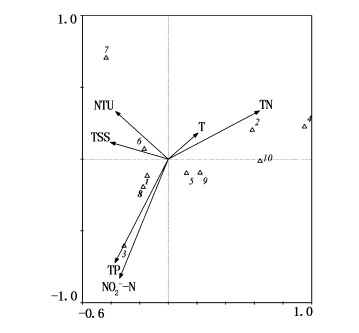
自然海域海水进入压载舱后,水体环境因子发生一系列的变化(另文待刊)。为探讨压载条件下环境因子与浮游动物结构的关系,根据实验舱中浮游动物的出现频率和相对丰度,选用10种浮游动物用于CCA分析,浮游动物编码见表 1。共选取温度、浊度、悬浮物、亚硝酸盐、总氮和总磷共6个水质参数与浮游动物进行CCA分析。经蒙特卡罗检验(Monte Carlo Test),第1轴和全部轴均呈极显著差异(P < 0.01),因此CCA分析排序结果可信。由图 5可知,分布在排序轴左上方的物种有无节幼体和桡足幼体,与悬浮物和浊度有较大相关性。根状拟玲虫、疣毛轮属和双壳幼虫位于排序轴左下方,与总磷和亚硝酸盐有很大的相关性。臂尾轮属、狭甲轮属和牟勒氏幼虫(Mullers larva)与温度和总氮呈正相关。
|
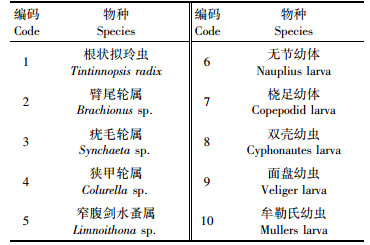
表 1 实验舱浮游动物物种编码 Tab.1 Codes of zooplankton species in test tank |
|
图 5 实验舱浮游动物物种与环境因子之间的典范对应分析(CCA)排序图
Fig. 5 Canonical correspondence analysis (CCA) biplot of zooplankton species and environmental variables in test tank.
|
压载实验期间,浮游动物群落结构组成随压载时间发生变化。压载舱舱内水体区别于天然海域流动的水体,水体静止,浊度和悬浮物随时间不断下降,部分浮游桡足类以及浮游幼虫运动能力弱,依附于悬浮颗粒物,随之不断沉降后,水体中出现的种类数减少。然而,对于轮虫而言,较高的悬浮物容易堵塞滤食器官,很大程度上制约摄食与种群丰度增长[23]。当大颗粒无机物在压载初期沉降以后,水体中存在的小型颗粒物为轮虫提供了良好的摄食环境。其中疣毛轮属种类的习性为广温、广盐,个体大且耐受能力强,当生境改变后呈现出较强的适应能力。轮虫种类前后发生变化,前期以臂尾轮属、疣毛轮属、龟甲轮属(Keratella sp.)为主,后期以狭甲轮属和臂尾轮属为主。臂尾轮属和狭甲轮属能够以浮游细菌、单细胞藻类和腐质为食,且相对于疣毛轮属个体较小,对于食物的竞争压力较小。因此当饵料逐渐消耗,并且密闭的压载舱条件下无法得到外界的补充,使得它们成为压载后期轮虫的主要种类组成。
浮游幼虫在实验后期的适应性较前期而言有所减弱,种类数明显减少。无节幼体和桡足幼体是实验舱内浮游幼虫主要组成成分,10 d前实验舱中存在大量无节幼体和桡足幼体。密闭的压载环境中食物贫乏,小个体类群往往占据优势[24],浮游幼虫在整个模拟压载过程中始终保持种群优势,经过30 d压载后仍存活。
桡足类种类数减少情况明显,但窄腹剑水蚤属(Limnoithona sp.)持续出现时间长,表现出较强的适应性,纺锤水蚤属(Acartiidae sp.)为压载至30 d时仅存的桡足类浮游动物。相关调查发现,窄腹剑水蚤属和纺锤水蚤属个体小、繁殖快、存活率高,在到港船舶压载水的浮游动物调查结果中优势明显[12, 15]。浮游动物对压载环境的适应性决定了它们在压载舱存活的可能性,不同种类浮游动物对压载环境的适应性不同,从而导致不同压载水排放造成的生物入侵情况不尽相同[25-26]。
3.2 压载后浮游动物丰度的变化浮游动物丰度在压载起始时显著降低,5 d时丰度迅速回升至高于初始丰度,此后压载过程中呈不断下降趋势,压载至30 d仍有浮游动物存活。自然海域海水经加载进入压载舱的过程会对浮游生物个体造成一定的损伤,温度等生存环境的突然改变亦会给浮游生物带来巨大的生存压力[8, 27],影响浮游动物的代谢强度、生长和发育的速度以及繁殖等其他行为,是压载初期浮游动物丰度减少的主要原因。疣毛轮属对水质具有广适应性,且繁殖能力强,其5 d时大量增殖,是两舱体浮游动物丰度发生显著增加的主要原因。结合以往研究发现,压载舱内浮游生物丰度会在短时间内暂时性显著增加[28]。在BRISKI [29]和GRAY[30]的研究结果中,水体中大量幼虫在短时间内迅速生长,以及某些浮游动物雌体所携带卵体的孵化发育,使得浮游动物的丰度出现暂时性的增加。但压载舱是一个完全封闭的载体,饵料无法得到外来的补充,在压载后期浮游动物的丰度呈大幅度下降的趋势。
天然海水加载至压载舱后,水体中浮游动物丰度并非呈现完全下降趋势,压载条件下浮游动物丰度仍存在上升的可能性。对比对照舱的丰度变化发现,压载环境在极大程度上限制了浮游动物丰度的增加范围。因此,长时间的压载能够在极大程度上降低活体浮游动物丰度,对于压载水处理以及排放起到积极作用。但经过30 d压载后,实验舱中仍有浮游动物存活,若跨海域排放仍然可能造成生物入侵。通过本次岸基模拟实验,建议公约对压载水压载时长以及压载水排放生物体的具体种类及其数量做出详细规定。
| [1] |
李迪阳, 姜仕倩, 王俊英. 船舶压载水中有害生物的管理与控制[J]. 海岸工程, 2001, 20(3): 47-53. LI D Y, JIANG S Q, WANG J Y. Management and control of harmful organizms in ship ballast water[J]. Coastal Engineering, 2001, 20(3): 47-53. |
| [2] |
HALLEGRAEFF G M, BOLCH C J. Transport of diatom and dinoflagellate resting spores in ship's ballast water:implications for plankton biogeography and aquaculture[J]. Journal of Plankton Research, 1992, 14(8): 1067-1084. DOI:10.1093/plankt/14.8.1067 |
| [3] |
DAVID M, PERKOVIČ M. Ballast water sampling as a critical component of biological invasions risk management[J]. Marine Pollution Bulletin, 2004, 49(4): 313-318. DOI:10.1016/j.marpolbul.2004.02.022 |
| [4] |
RUIZ G M, RAWLINGS T K, DOBBS F C, et al. Global spread of microorganisms by ships[J]. Nature, 2000, 408(6808): 49-50. DOI:10.1038/35040695 |
| [5] |
DAVID M, GOLLASCH S, PAVLIHA M. Global ballast water management and the "same location" concept:a clear term or a clear issue?[J]. Ecological Applications, 2013, 23(2): 331-338. DOI:10.1890/12-0992.1 |
| [6] |
胡承兵. 阻止"搭乘"于压载水中的外来生物入侵者[J]. 交通环保, 1999, 20(4): 35-39. HU C B. Alien Invaders-putting a Stop to the Ballast Water Hitch -hikers[J]. Environmental protection in transportation, 1999, 20(4): 35-39. |
| [7] |
LAVOIE D M, SMITH L D, Ruiz G M. The potential for intracoastal transfer of non-indigenous species in the ballast water of ships[J]. Estuarine, Coastal and Shelf Science, 1999, 48(5): 551-564. DOI:10.1006/ecss.1999.0467 |
| [8] |
薛俊增, 刘艳, 王金辉, 等. 洋山深水港入境船舶压载水浮游动物种类组成分析[J]. 海洋学报, 2011, 33(1): 138-145. XUE J Z, LIU Y, WANG J H, et al. A biological survey of zooplankton taken from ballast water of the international navigation ships entering the Shanghai Yangshan Deep-water Port in China[J]. Acta Oceanologica Sinica, 2011, 33(1): 138-145. |
| [9] |
周淑辉, 白章红, 田桢干, 等. 上海港外来船舶压舱水中浮游动物的调查及风险分析[J]. 检验检疫学刊, 2015, 25(5): 28-31. ZHOU S H, BAI Z H, TIAN Z G, et al. The Investigation and Risk Analysis of Zooplankton in Ballast Waters of Foreign Ships Harboring in Shanghai Port[J]. Journal of Inspection and Quarantine, 2015, 25(5): 28-31. |
| [10] |
CORDELL J R, LAWRENCE D J, FERM N C, et al. Factors influencing densities of non-indigenous species in the ballast water of ships arriving at ports in Puget Sound, Washington, United States[J]. Aquatic Conservation:Marine and Freshwater Ecosystems, 2010, 19(3): 322-343. |
| [11] |
DAVID M, GOLLASCH S. EU Shipping in the dawn of managing the ballast water issue[J]. Marine Pollution Bulletin, 2008, 56(12): 1966-1972. DOI:10.1016/j.marpolbul.2008.09.027 |
| [12] |
郑剑宁, 裘炯良, 薛新春. 宁波港入境船舶压舱水中携带浮游生物的调查与分析[J]. 中国国境卫生检疫杂志, 2006, 29(6): 358-360. ZHENG J N, QIU J L, XUE X C. Study on Planktons Taken by Ballast Water of International Navigation Ships[J]. Chinese Frontier Health Quarantine, 2006, 29(6): 358-360. |
| [13] |
王爱民, 许炳芬, 陈宗辉, 等. 国际航行船舶压舱水外来有害生物研究[J]. 检验检疫科学, 2007, 17(3): 9-11. WANG A M, XU B F, CHEN Z H, et al. External harmful living beings in ballast water on cross border vessel[J]. Inspection and quarantine science, 2007, 17(3): 9-11. |
| [14] |
杨清良, 蔡良候, 高亚辉, 等. 福建主要港口外轮压舱水生物的分布及其潜在入侵威胁[J]. 海洋湖沼通报, 2009(4): 25-38. YANG Q L, CAI L H, GAO Y H, et al. Study on distributional characteristics of organisms in ballast water of exotic ships entering major ports of Fujian and its potential invasion threat[J]. Transactions of Oceanology and Limnology, 2009(4): 25-38. |
| [15] |
杨清良, 蔡良候, 高亚辉, 等. 中国东南沿海港口外轮压舱水生物的调查[J]. 海洋科学, 2011, 35(1): 22-28. YANG Q L, CAI L H, GAO Y H, et al. Plankton found in ballast waters of foreign ships harboring in ports of Southeast China[J]. Marine Sciences, 2011, 35(1): 22-28. |
| [16] |
GOLLASCH S, LENZ J, DAMMER M, et al. Survival of tropical ballast water organisms during a cruise from the Indian Ocean to the North Sea[J]. Journal of Plankton Research, 2000, 22(5): 923-937. DOI:10.1093/plankt/22.5.923 |
| [17] |
MCCOLLIN T, SHANKS A M, DUNN J. Changes in zooplankton abundance and diversity after ballast water exchange in regional seas[J]. Marine Pollution Bulletin, 2008, 56(5): 834-844. DOI:10.1016/j.marpolbul.2008.02.004 |
| [18] |
CHAN F T, BRISKI E, BAILEY S A, et al. Richness-abundance relationships for zooplankton in ballast water:temperate versus Arctic Comparisons[J]. ICES Journal of Marine Science, 2014, 71(7): 1876-1884. DOI:10.1093/icesjms/fsu020 |
| [19] |
GOLLASH S, ROSENTHAL H, BOTNET H, et al. Fluctuations of zooplankton taxa in ballast water during short-term and long-term ocean-going voyages[J]. International Review of Hydrobiology, 2000, 85(5/6): 597-608. |
| [20] |
WU H, CHEN C, WANG Q, et al. The biological content of ballast water in China:A review[J]. Aquaculture & Fisheries, 2017, 2(6): 241-246. |
| [21] |
林汝榕, 李少菁. 重金属对桡足类的急性毒性及其对排粪的生理效应[J]. 海洋环境科学, 1988, 7(3): 7-15. LIN R R, LI S J. Acute toxic effects of heavy metals on Copepoda and the physiogical effects on defecation[J]. Marine Environmental Science, 1988, 7(3): 7-15. |
| [22] |
国家质量技术监督局. GB17378, 海洋监测规范[S]. 北京: 中国标准出版社, 2007. The Quality and Technology Supervision Bureau. GB17378, The specification for marine monitoring[S]. Beijing: China Standards Press, 2007. |
| [23] |
HAMMER Ø, HARPER D A T, RYAN P D. Past:paleontological statistics software package for education and data analysis[J]. Palaeontologia Electronica, 2001, 4(1): 4. |
| [24] |
卢亚芳, 黄永春, 周立红. 杏林湾水库环境因子对浮游轮虫密度的影响[J]. 上海水产大学学报, 2002, 11(3): 225-229. LU Y F, HUANG Y C, ZHOU L H. Effects of Environmental factors on density of the planktonic rotifer in Xinlin Bay reservoir[J]. Journal of Shanghai Fisheries University, 2002, 11(3): 225-229. |
| [25] |
STEINER C F, ROY A H. Seasonal succession in fishless ponds:effects of enrichment and invertebrate predators on zooplankton community structure[J]. Hydrobiologia, 2003, 490(1/3): 125-134. DOI:10.1023/A:1023470730397 |
| [26] |
GHABOOLI S, ZHAN A B, PAOLUCCI E, et al. Population attenuation in zooplankton communities during transoceanic transfer in ballast water[J]. Ecology and Evolution, 2016, 6(17): 6170-6177. DOI:10.1002/ece3.2016.6.issue-17 |
| [27] |
BRISKI E, CHAN F T, MacIsaac H J, et al. A conceptual model of community dynamics during the transport stage of the invasion process:a case study of ships' ballast[J]. Diversity and Distributions, 2014, 20(2): 236-244. DOI:10.1111/ddi.2014.20.issue-2 |
| [28] |
DEVREKER D, SOUISSI S, SEURONT L. Effects of chloropHyll concentration and temperature variation on the reproduction and survival of Temora longicornis (Copepoda, Calanoida) in The Eastern English Channel[J]. Journal of Experimental Marine Biology and Ecology, 2005, 318(2): 145-162. DOI:10.1016/j.jembe.2004.12.011 |
| [29] |
BRISKI E, BAILEY S A, Cristescu M E, et al. Effecacy of 'salt water flushing' in protecting the Great Lakes from biological invasions by invertebrate eggs in ships' ballast sediment[J]. Freshwater Biology, 2010, 55(11): 2414-2424. DOI:10.1111/j.1365-2427.2010.02449.x |
| [30] |
GRAY D K, MACISAAC H J. Diapausing zooplankton eggs remain viable despite exposure to open-ocean ballast water exchange:evidence from in situ exposure experiments[J]. Canadian Journey of Fisheries and Aquatic Sciences, 2010, 67(2): 417-426. DOI:10.1139/F09-192 |
2. Centre for Research on the Ecological Security of Ports and Shipping, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


