2. 上海海洋大学 上海市水产养殖工程技术研究中心, 上海 201306
日本鳗鲡(Anguilla japonica),属鳗鲡目(Anguilliformes)、鳗鲡科(Anguillidae)、鳗鲡属(Anguilla),是一种长距离降海洄游性鱼类。因为日本鳗鲡的负趋光性,我国鳗鲡养殖工厂基本都在室内水泥池中养殖,屋顶进行遮光处理,但对其摄食和活动过程中是否都偏好暗光环境仍无定论,尤其是生长的最适光照条件目前仍没有相关研究报道。光照影响鱼类的生长在国内外研究中已经得到证实,例如:光照因素影响鱼类的生长和成活率,TRIPPEL等发现黑线鳕在24 h连续光照下的重量比自然光照下重53%~60%,在24 h周期下光照强度从100 lx减少到30 lx时,鱼的体重增长了11%[1]。李艳秋等[2]和李修峰等[3]分别研究了光照强度对太平洋鳕仔和大眼鳜鱼幼鱼摄食的影响,试验中鳕仔在500 lx时摄食强度最大,其次为700、300 lx,摄食率在500 lx时最高;大眼鳜鱼的幼鱼摄食强度在全黑暗状况下最大。鱼类通过视网膜和松果体中的光感受器接收“光信息”,影响激素的分泌[4];黑暗条件,抑制革胡子鲶的新陈代谢,用于运动活动的能量比例下降[5]。HONRYO等发现太平洋蓝鳍金枪鱼幼体在孵化后30~50 d内在夜间增大光照强度(≥150 lx)有利于减少应激反应;王涛等发现石斑鱼最适光照强度是320~1 150 lx[6],体内超氧化物歧化酶(SOD)、酸性磷酸活性酶、多不饱和脂肪酸等处于最优状态,皮质醇水平低,机体应激小[7]。因此,光照强度成为养殖过程中不可忽视的一个重要因素;同时,光周期对鱼类的生长也有多方面的影响,如肌肉形成过程中蛋白质的合成、食物摄取、消化酶和激素的生成等[8]。有研究表明延长光照周期(18L:6D)可以促进鱼类的生长,如真鲷(Pagrosomus major)[9]、太平洋黑鲔(Thunnus orientalis) [10]。
动物福利由5个基本要素组成,即生理福利、环境福利、卫生福利、行为福利、心理福利[11],是一个复杂且目前具有争议的论题,传统水产养殖模式下鱼类的环境福利条件往往无法得到保证,尤其在光照条件方面。目前对鱼类福利的评价尚无统一指标,分析鱼类的血液参数是评价鱼类福利条件的重要依据[12]。皮质醇作为血液参数之一,常作为一种重要应激激素。王帅[13]等研究表明,不同光照强度下,无论是刺激30 min或者7 d,皆为10 lx时褐牙鲆血浆中皮质醇含量最低,应激最小,能更快适应环境,恢复平稳代谢,维持机体稳态,10 lx是褐牙鲆环境福利中的最佳光照需求。有人提出,压力与福利之间的关系并不是负相关的(即压力增加导致福利减少),压力反应并不一定会导致福利不足,而是遵循一种拮抗平衡,即压力太小或太多都会损害福利[14]。鱼类生长的环境,包括水质、放养密度和光周期等都会影响鱼类的福利条件。
本实验在借鉴前人研究的基础上,参考其他亲缘关系近的鱼类的光照条件及研究方法,在循环水系统可控条件下,设置不同梯度光照强度和周期,探究其对日本鳗鲡生长和福利的影响,旨在探明适合日本鳗鲡的最佳光照,增加日本鳗鲡福利条件,提升品质;同时也为日本鳗人工繁殖的鳗苗生长和优化循环水养殖日本鳗鲡的生态条件提供参考依据。
1 材料与方法 1.1 实验材料与条件实验所用的日本鳗鲡野生玻璃鳗于2017年2月底购于江苏省启东市,鳗苗规格的平均大小约0.1 g。将日本鳗苗放置于循环水系统中暂养,完成淡化及驯食过程,5月底挑选健康活泼的日本鳗鲡于改造后的循环水系统中进行光照实验。实验循环水系统每个养殖水槽体积约为1.5 m3,共10个单元,水温保持在(28±1)℃,保持溶氧量在5 mg/L以上,pH为7.5~8.0。实验所用LED灯具由飞利浦公司生产。光照强度使用TES 1332A(上海康华生化仪器制造有限公司)测量,测量时统一在未加水的循环水桶内距离灯源80 cm处,光照周期通过设置时间继电器自动控制。循环水系统示意简图如下图 1所示。
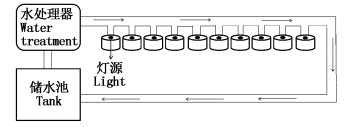
|
图 1 循环水系统
Fig. 1 Recirculating aquaculture system
|
随机挑选规格整齐、健康活力的日本鳗鲡饲养于10个循环水系统的水槽中,平均体重(5.8±0.5) g,每桶放置125尾,连续饲养114 d。实验采用双因素交叉分组无重复的设计方法,即将光照强度A(10 lx、100 lx、300 lx)和光照周期B(12L:12D、18L:6D、24L:0D)按照A1B1,A1B2,A1B3,A2B1,A2B2,A2B3,A3B1,A3B2,A3B3进行分组,两两相互对照,全程使用商业鳗鱼黑仔料(福建高农饲料有限公司),每日上午8点和下午5点按鱼体质量的5%投喂商品饲料,半小时后及时清除水中的残饵、粪便,记录投饵量。
1.3 生长指标测定实验结束后通过测定以下生长指标比较各实验组之间的差异,具体公式如下:
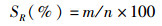 (1)
(1)
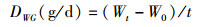 (2)
(2)
 (3)
(3)
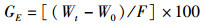 (4)
(4)
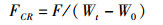 (5)
(5)
式中:SR为存活率; DWG为日增重; SGR为特定生长率; GE为饲料转化效率; FCR为饲料系数; m为试验末尾数; n为试验初尾数; Wt为试验末总体重(g); W0为试验初总体重(g); t为培育天数(d); F为试验阶段总摄食量(g)。
1.4 样品采集和处理实验结束前24 h停止喂食,记录每个实验组中鳗鱼的数量,称量其总体重。从每个实验组中随机捞取10尾鳗鱼,采用断尾取血收集血液,于4 ℃冰箱静置过夜(12 h),离心后获取血清(3 500 r/min,15 min),保存于-80 ℃备用。
1.5 血液样本的检测采用贝克曼全自动生化分析仪AU-480(美国贝克曼库尔特有限公司)分析血清中谷草转氨酶(AST)、谷丙转氨酶(ALT)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(BUN)、肌酐(SCR)、葡萄糖(GLU)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)的含量。血清中的丙二醛(MDA)采用南京建成生物工程研究所试剂盒进行分析测定。血清皮质醇(COR)采用酶联免疫吸附测定法(ELISA)测定,试剂盒购于南京建成生物工程研究所。
1.6 数据处理实验数据用SPSS 19.0软件进行双因素方差分析(Two-Way ANOVA),如果出现显著交互影响作用,则固定其中一个因素水平,对另一因素进行单因素方差分析(One-Way ANOVA),用Student-Neuman-Keuls多重比较法进行组间差异比较,以P < 0.05表示显著差异,统计值均用平均值±标准差(Mean±SE)表示。
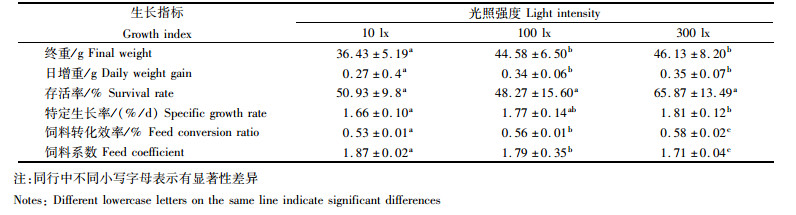
2 结果与分析 2.1 生长指标从表 1发现随着光照强度的增加,日本鳗鲡的生长与光照强度正相关,而饲料系数与其成负相关。实验结果显示在100 lx和300 lx光照条件下日本鳗鲡的终重和日增重显著高于10 lx (P < 0.05),而100 lx与300 lx实验组之间并无显著差异。此外,300 lx条件下的日本鳗鲡的特定生长率显著高于10 lx组(P < 0.05),300 lx条件下日本鳗鲡的饲料转化效率和饲料系数也明显优于10 lx和100 lx实验组。不同光照强度下各组的存活率无显著性差异。
|
表 1 不同光照强度实验组中日本鳗鲡的生长数据 Tab.1 The growth indicators of Japanese eel under different light intensity |
不同的光照周期下日本鳗鲡的生长情况见表 2。随着光照周期的延长,日本鳗的终重和日增重呈现先下降后上升的趋势,24L:0D条件下终重、日增长和特定生长率显著高于12L:12和18L:6D (P < 0.05)。不同光照周期下的饲料转化效率、饲料系数及存活率无显著性差异。

|
表 2 不同光照周期下日本鳗鲡的生长数据 Tab.2 The growth indicators of Japanese eel for different photoperiods |
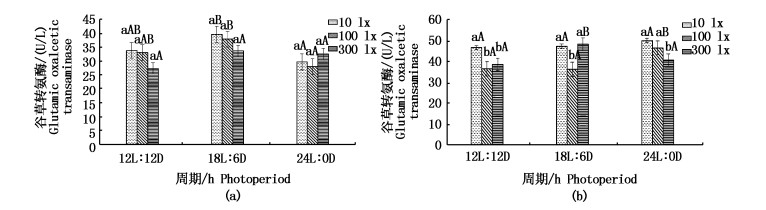
图 2显示光照周期对谷草转氨酶活性有显著性影响,随着光照周期的延长,谷草转氨酶先上升后下降,光照强度在10 lx、100 lx时,24L:0D光周期与18L:6D有显著性差异(P < 0.05);随着光照强度增强,谷丙转氨酶呈下降趋势,10 lx与100 lx有显著性差异(P < 0.05);100 lx条件下18L:6D显著低于24L:0D(P < 0.05),在300 lx条件下与此相反。
|
图 2 光照周期对日本鳗鲡血清谷草转氨酶和谷丙转氨酶活性的影响
Fig. 2 Effect of photoperiod on serum glutamic oxalacetic transaminase and glutamic-pyruvic transaminase activities of Japanese eel
图中标注的大写字母表示同一光照强度下不同周期间存在的显著差异(P < 0.05);小写字母表示同一周期不同光照强度下存在的差异(P < 0.05);图 3-7同 Different capital letters indicate significant differences(P < 0.05)at different photoperiods of the same light intensity and different lowercase letters indicate significant differences(P < 0.05)under different light intensity of the same photoperiod, the same in fig 3-7 |
由图 3可见,光照强度和光周期对日本鳗鲡的总胆固醇、高密度脂蛋白、低密度脂蛋白无显著性影响;光照强度对甘油三脂水平无显著性影响,随着光周期的延长,甘油三酯的含量整体呈下降趋势,在10 lx和100 lx光照强度条件下,12L:12D实验组中日本鳗鲡的甘油三酯含量显著高于全光照实验组(P < 0.05)。

|
图 3 光照周期对鳗鲡血清总胆固醇、甘油三脂、高密度脂蛋白、低密度脂蛋白水平的影响
Fig. 3 Effects of photoperiod on total cholesterol, triglyceride, high density lipoprotein and low density lipoprotein levels in serum of Japanese eel
|
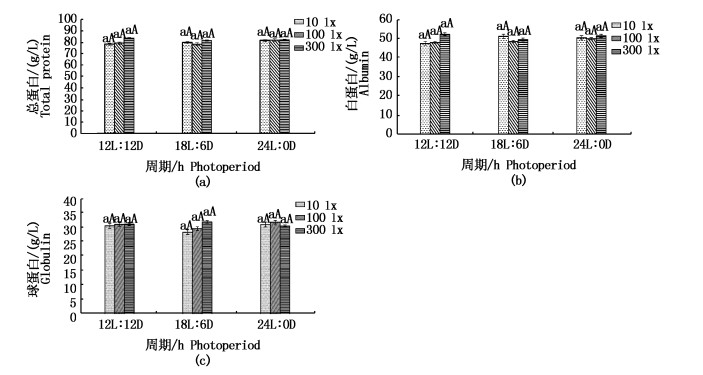
从图 4中可以看出,光照强度和光周期对日本鳗鲡的总蛋白、白蛋白和球蛋白水平无显著影响,在不同的光照周期和强度下各个处理组的蛋白水平均在相应的范围内波动,没有出现显著性升高或者降低的趋势。
|
图 4 光照周期对血清总蛋白、白蛋白、球蛋白水平的影响
Fig. 4 Effects of photoperiod on total protein, albumin and globulin levels in serum of Japanese eel
|
光照强度和周期对日本鳗鲡的尿素氮没有显著性影响,但不同光周期下10 lx的尿素氮水平都低于100 lx和300 lx(图 5)。光照强度和周期对各处理组的肌酐水平没有显著影响。
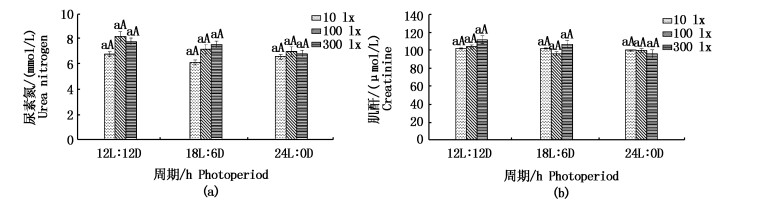
|
图 5 光照周期对日本鳗鲡血清肌酐和尿素氮水平的影响
Fig. 5 Effect of photoperiod on serum creatinine and urea nitrogen levels in Japanese eel
|
18L:6D与12L:12D条件下SOD活性有显著性差异(P < 0.05),随着周期的延长,SOD活性先增后减,300 lx条件下CAT的活性18L:6D显著低于12L:12D(P < 0.05)。不同光照强度和周期下日本鳗鲡丙二醛(MDA)无显著性差异(图 6)。
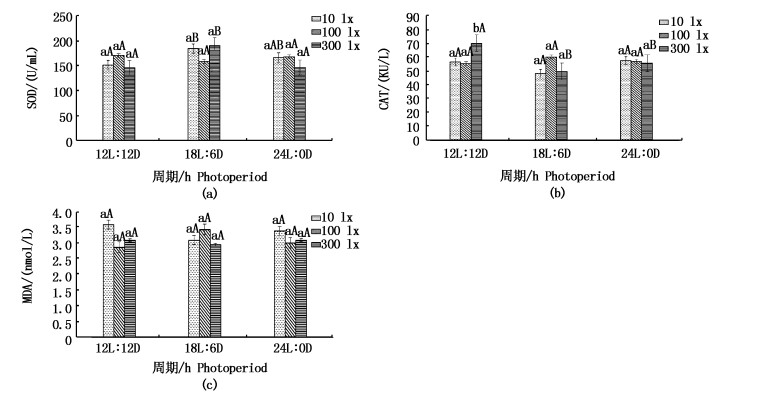
|
图 6 光照周期对日本鳗鲡血清SOD、CAT、MDA活性的影响
Fig. 6 Effects of photoperiod on serum SOD, CAT and MDA activities in Japanese eel
|
光照强度和光照周期对日本鳗鲡血糖含量无显著性差异,但随着光周期和光照强度的变大,血糖的变化趋势都是先减后增(图 7)。日本鳗鲡在12L:12D、10 lx组皮质醇含量最低,10 lx光照强度皮质醇水平与100 lx有显著性差异(P < 0.05),但与300 lx无显著性差异;光照周期对血清皮质醇有极显著差异(P < 0.01),24L:0D与12L:12D有极显著性差异(P < 0.01)。
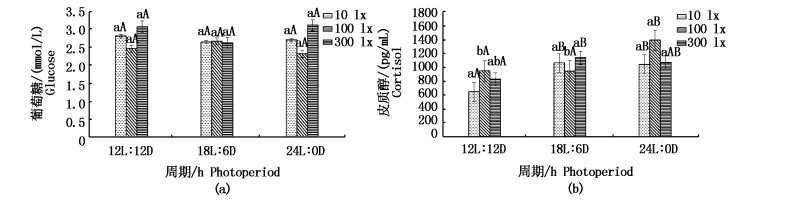
|
图 7 光照周期对日本鳗鲡血清葡萄糖和皮质醇水平的影响
Fig. 7 Effects of photoperiod on serum glucose and cortisol levels in Japanese eel
|
在本实验中,10 lx条件下日本鳗鲡的终重和日增重与100 lx和300 lx有显著性差异(P < 0.05), 可见日本鳗鲡虽属于弱光性鱼类,但10 lx低光强下却不利于日本鳗鲡的增长。据相关研究表明,日本鳗鲡苗喜好的光强在5~10 lx,主要是为了躲避敌害,避免被捕食,顺利溯河进入淡水流域育肥[15]。而随着个体不同的发育阶段,适宜的光照强度会有相应的变化[16]。光照强度过高或过低也会导致鱼类的死亡[17],本实验结果显示在10~300 lx范围内光照强度对各组成活率都没有显著影响,但特定生长率在10 lx条件下与300 lx条件下有显著性差异(P < 0.05);并且10 lx、100 lx、300 lx状态下日本鳗鲡的饲料转化效率,饲料系数均表现出显著性差异。随着光照强度的升高,日本鳗鲡的特定生长率、饲料转化效率增高,饲料系数降低。光照强度过大时,鱼类会活力旺盛,增加游泳运动[1],导致用于生长的能量减少[18]。本次实验结果与TIAN等[19]研究结果一致。从实验结果看,100 lx和300 lx在体重增长方面无显著性差异,但300 lx条件下日本鳗鲡的各项生长指标更优。
3.1.2 光周期对日本鳗鲡生长的影响光周期对鱼功能和生长的影响有很大的差异,一些物种对光周期的变化没有反应,例如BANI等发现不同的光照周期(0L:24D、12L:12D、18L:6D、24L:0D)对鲟鱼的生长没有显著性差异[20]。相比之下,有些鱼类在没有光或低光下生长更好。例如鲶鱼具有夜间活动的习惯,在光周期为0L:24D和6L:18D下生长更好[21]。本实验中,12L:12D和18L:6D条件下终重和日增长与24L:0D有显著性差异(P < 0.05),我们发现,日本鳗鲡的生长随着光照时间的增长呈现先降低后增加的趋势。不同光照周期条件下存活率无显著性差异;但18L:6D条件下特定生长率与12L:12D和24L:0D有显著性差异。一般来说:光照时间的延长,增加了鱼类的摄食量,同时也增加了鱼类的游泳活动量,摄食所获得的能量与游泳活动消耗的能量的比例大小影响了鱼类的生长状况。从实验结果的体重和日增重数据,我们可以得出24L:0D条件下最佳,但综合考虑存活率、特定增长率、饲料系数,同时结合生理数据,12L:12D条件下日本鳗鲡反而有优势。在所有实验组中存活率最高,身体应激状态最小。
3.2 光照强度和光周期对日本鳗鲡动物福利的影响 3.2.1 光照强度和光周期对血清转氨酶和脂类的影响谷草转氨酶(GOT)和谷丙转氨酶(GPT)是重要的氨基转氨酶,广泛分布在细胞膜、细胞质和线粒体中,经常用作虾的肝胰腺功能评估因子[22]。正常条件下血清中两种酶的活性都不高,但当组织细胞,特别是肝脏和心脏细胞受损时,血清中两种酶的活性显著升高。因此,血清GOT和GPT活性可以反映鱼类生理功能的损害[23]。本实验中,24L:0D、12L:12D条件下与18L:6D的GOT有显著性差异(P < 0.05), 随着光周期的延长,GOT活性先升高后降低,100 lx状态下GPT活性显著小于10 lx与300 lx。这说明光照周期为18L:6D,强度为10 lx时鳗鲡机体损伤最大,这也与前面生长指标的表现一致。在日本鳗鲡血清脂类中,只有光照周期24L:0D下甘油三酯水平低于12L:12D,并有显著性差异(P < 0.05),而18L:6D与24L:0D、12L:12D无显著性差异,光照强度对甘油三脂无显著性影响。血清TC和TG水平可能反映了身体脂质代谢的状况,肝脏内相对高的脂质摄入或活性内源脂质合成导致血清TC和TG水平升高,这说明鱼的能量摄入量足够[24]。甘油三酯主要参与体内能量的产生与储存,是重要的能源物质,血液中TG含量的降低可能是胆汁分泌异常或肝功能障碍所致。在人类血液中,TG的升降往往伴随着胆固醇的升降[25],这也与本实验结果一致。说明24L:0D条件下可能会使日本鳗鲡肝功能受损。综上所述,12L:12D,100 lx条件是日本鳗血清转氨酶和脂类的最佳福利条件。
3.2.2 光照强度和光周期对SOD、CAT、MDA的影响机体防御系统抗氧化能力的强弱与机体的身体健康密切相关,需要多种类型的抗氧化剂(如CAT,SOD和MDA)来维持鱼的复杂免疫系统。SOD将氧自由基转化成过氧化氢,防止细胞功能受损。CAT催化过氧化氢分解为水和分子氧,从而清除自由基以减少脂质超氧化物的损伤;MDA的产生是由细胞膜上多不饱和脂肪酸过氧化所产生的一个脂质超氧化过程,影响细胞膜流动性以及生物分子的完整性,是脂质过氧化反应的重要指标[26]。本实验中:在10 lx和300 lx条件下SOD的活性都随着光照时间的延长呈现先升后降,而100 lx条件下变化基本无显著差异。说明随着光照时间的延长,日本鳗鲡的机体中抗氧化酶活性提高且存在一个阈值,合理控制光照周期是抗氧化酶活性高低的关键,不同的光照强度对日本鳗鲡的SOD活性无显著性差异。我们发现在12L:12D、300 lx条件下CAT的活性是所有处理组最高的,且12L:12D条件下CAT活性显著高于其他两个周期组。说明此周期下,日本鳗鲡抗氧化能力最强,细胞损伤最小。机体的损伤程度不仅与SOD、CAT有关,同时MDA的含量是机体损伤最直接的反应。在实验组中,虽然各组MDA含量无显著性区别,但12L:12D、100 lx时MDA含量最低。这个结果进一步说明了12L:12D、100 lx日本鳗处于应激最小状态,这也与SOD、CAT活性变化相一致。因此12L:12D、100 lx是日本鳗最适条件。
3.2.3 光照强度和光周期对血糖、皮质醇的影响血糖作为机体的主要功能物质,在体内的含量一般情况下均相当稳定,但在采样时间不同的条件下,葡萄糖可以类似皮质醇用作应激指标[27]。在本实验中,不同处理组的日本鳗鲡血糖含量无显著性差异,这与KITAGAWA等的研究结果一致[8],即不同光照周期处理组鲶鱼的血糖水平没有显著影响。皮质醇浓度可以视为鱼类中的应激敏感制剂[28],DUSTON [29]等指出皮质醇调动能量,促进蛋白质分解,脂肪和肝葡萄糖释放,从而影响动物发育。当鱼类受到外界环境条件刺激时,下丘脑-垂体-肾间组织轴(HPI)被激活,促进促肾上腺皮质激素(ACTH)的释放,从而引起皮质醇激素的合成与释放。在不同的光周期条件下,皮质醇浓度显示出明显的波动模式[30]。实验发现光照周期对血清皮质醇有极显著差异(P < 0.01),12L:12D条件下小于18L:6D、24L:0D且有极显著差异(P < 0.01),10 lx条件下与100 lx有显著性差异。随着光照周期和强度的增长,日本鳗鲡血清皮质醇含量有也增长。在10 lx,12L:12D条件下,日本鳗鲡皮质醇浓度最低,应激最小。但在12L:12D, 10 lx与300 lx条件下皮质醇无显著性差异。
综合考虑实验中日本鳗鲡的各项生长数据和生理指标及其皮质醇的含量,12L:12D,300 lx条件下日本鳗鲡生长良好,鱼体应激小,是日本鳗鲡生长的最佳环境福利条件。
| [1] |
TRIPPEL E A, NEIL S R E. Effects of photoperiod and light intensity on growth and activity of juvenile haddock (Melanogrammus aeglefinus)[J]. Aquaculture, 2003, 217(1/4): 633-645. |
| [2] |
李艳秋, 吴洪, 孙阳, 等. 不同光照强度对太平洋鳕仔鱼摄食的影响[J]. 现代农业科技, 2013(4): 272-273, 277. LI Y Q, WU H, SUN Y, et al. The influences of light intensity on feeding of Gadus macrocephalus larvae[J]. Modern Agricultural Science and Technology, 2013(4): 272-273, 277. DOI:10.3969/j.issn.1007-5739.2013.04.173 |
| [3] |
李修峰, 黄道明, 杨汉运. 光照对大眼鳜鱼幼鱼摄食强度的影响[J]. 湖南农业大学学报(自然科学版), 2005, 31(2): 187-190. LI X F, HUANG D M, YANG H Y. Effect of light on young Siniperca kneri Garman's ingested amount[J]. Journal of Hunan Agricultural University (Natural Sciences), 2005, 31(2): 187-190. |
| [4] |
BOEUF G, LE BAIL P Y. Does light have an influence on fish growth?[J]. Aquaculture, 1999, 177(1/4): 129-152. |
| [5] |
APPELBAUM S, KAMLER E. Survival, growth, metabolism and behaviour of Clarias gariepinus (Burchell 1822) early stages under different light conditions[J]. Aquacultural Engineering, 2000, 22(4): 269-287. DOI:10.1016/S0144-8609(00)00054-6 |
| [6] |
HONRYO T, KURATA M, OKADA T, et al. Effects of night-time light intensity on the survival rate and stress responses in juvenile Pacific Bluefin tuna Thunnus orientalis (Temminck and Schlegel)[J]. Aquaculture Research, 2013, 44(7): 1058-1065. DOI:10.1111/are.2013.44.issue-7 |
| [7] |
TAO W, CHENG Y Z, LIU Z P, et al. Effects of light intensity on growth, immune response, plasma cortisol and fatty acid composition of juvenile Epinephelus coioides reared in artificial seawater[J]. Aquaculture, 2013, 414-415: 135-139. DOI:10.1016/j.aquaculture.2013.08.004 |
| [8] |
KITAGAWA A T, COSTA L S, PAULINO R R, et al. Feeding behavior and the effect of photoperiod on the performance and hematological parameters of the pacamã catfish (Lophiosilurus alexandri)[J]. Applied Animal Behaviour Science, 2015, 171: 211-218. DOI:10.1016/j.applanim.2015.08.025 |
| [9] |
BISWAS A, SEOKA M, INAGAKI H, et al. Reproduction, growth and stress response in adult red sea bream, Pagrus major (Temminck & Schlegel) exposed to different photoperiods at spawning season[J]. Aquaculture Research, 2010, 41(4): 519-527. DOI:10.1111/are.2010.41.issue-4 |
| [10] |
HONRYO T, OKADA T, KURATA M, et al. Optimal periods of night-time lighting in the sea cage culture of Pacific bluefin tuna, Thunnus orientalis, juvenile (Temminck and Schlegel)[J]. Aquaculture Research, 2014, 45(7): 1109-1115. DOI:10.1111/are.2014.45.issue-7 |
| [11] |
蒋志刚. 中国动物园[M]. 北京: 中国环境出版社, 2014. JIANG Z G. Chinese zoo[M]. Beijing: China Environmental Science Press, 2014. |
| [12] |
LEONARDI M O, KLEMPAU A E. Artificial photoperiod influence on the immune system of juvenile rainbow trout (Oncorhynchus mykiss) in the Southern Hemisphere[J]. Aquaculture, 2003, 221(1/4): 581-591. |
| [13] |
王帅, 陈阿琴, 吕为群. 光照强度对褐牙鲆血浆皮质醇、渗透压和生化指标的影响[J]. 广东农业科学, 2014, 41(11): 131-135, 144. WANG S, CHEN A Q, LYU W Q. Effects of light intensity on plasma cortisol, osmolality and biochemical indices of Japanese flounder (Paralichthys olivaceus)[J]. Guangdong Agricultural Sciences, 2014, 41(11): 131-135, 144. DOI:10.3969/j.issn.1004-874X.2014.11.029 |
| [14] |
MCEWEN B S, WINGFIELD J C. The concept of allostasis in biology and biomedicine[J]. Hormones and Behavior, 2003, 43(1): 2-15. DOI:10.1016/S0018-506X(02)00024-7 |
| [15] |
龚盼, 侯俊利, 庄平, 等. 长江口日本鳗鲡鳗苗对底质颜色和光照强度的选择行为[J]. 海洋渔业, 2015, 37(6): 510-516. GONG P, HOU J L, ZHUANG P, et al. Selective behavior of Anguilla japonica glass eel on substrate color and light intensity in the Yangtze Estuary[J]. Marine Fisheries, 2015, 37(6): 510-516. DOI:10.3969/j.issn.1004-2490.2015.06.005 |
| [16] |
PETERSEN J H, GADOMSKI D M. Light-mediated predation by northern squawfish on juvenile chinook salmon[J]. Journal of Fish Biology, 1994, 45(sA): 227-242. DOI:10.1111/jfb.1994.45.issue-sa |
| [17] |
COPELAND K A, WATANABE W O. Light intensity effects on early life stages of black sea bass, Centropristis striata (Linnaeus 1758)[J]. Aquaculture Research, 2006, 37(14): 1458-1463. DOI:10.1111/are.2006.37.issue-14 |
| [18] |
STAFFAN F. Food competition and its relation to aquaculture in Perca fluviatilis[J]. Acta Universitatis Agriculturae Sueciae, 2004, 329. |
| [19] |
TIAN H Y, ZHANG D D, XU C, et al. Effects of light intensity on growth, immune responses, antioxidant capability and disease resistance of juvenile blunt snout bream Megalobrama amblycephala[J]. Fish & Shellfish Immunology, 2015, 47(2): 674-680. |
| [20] |
BANI A, TABARSA M, FALAHATKAR B, et al. Effects of different photoperiods on growth, stress and haematological parameters in juvenile great sturgeon Huso huso[J]. Aquaculture Research, 2009, 40(16): 1899-1907. DOI:10.1111/are.2009.40.issue-16 |
| [21] |
ALMAZáN-RUEDA P, VAN HELMOND A T M, VERRETH J A J, et al. Photoperiod affects growth, behaviour and stress variables in Clarias gariepinus[J]. Journal of Fish Biology, 2005, 67(4): 1029-1039. DOI:10.1111/jfb.2005.67.issue-4 |
| [22] |
LIN L, ZENG X L, ZHANG J. Effect of profenofos poisoning on liver lipid peroxidation and liver function in rabbits[J]. Chinese Journal of Clinical Rehabilitation, 2004, 8(21): 4380-4381. |
| [23] |
DU Y S, YI M M, XIAO P, et al. The impact of Aeromonas salmonicida infection on innate immune parameters of Atlantic salmon (Salmo salar L)[J]. Fish & Shellfish Immunology, 2015, 44(1): 307-315. |
| [24] |
ZHU W H, LIU M M, CHEN C, et al. Quantifying the dietary potassium requirement of juvenile grass carp (Ctenopharyngodon idellus)[J]. Aquaculture, 2014, 430: 218-223. DOI:10.1016/j.aquaculture.2014.04.014 |
| [25] |
宋理平, 冒树泉, 马国红, 等. 饲料脂肪水平对许氏平鲉脂肪沉积、血液生化指标及脂肪代谢酶活性的影响[J]. 水产学报, 2014, 38(11): 1879-1888. SONG L P, MAO S Q, MA G H, et al. Effects of dietary lipid level on lipid deposition, blood biochemistry indices and lipid metabolic enzyme activities of Sebastes schlegeli[J]. Journal of Fisheries of China, 2014, 38(11): 1879-1888. |
| [26] |
ZHOU C P, GE X P, LIN H Z, et al. Effect of dietary carbohydrate on non-specific immune response, hepatic antioxidative abilities and disease resistance of juvenile golden pompano (Trachinotus ovatus)[J]. Fish & Shellfish Immunology, 2014, 41(2): 183-190. |
| [27] |
LÓPEZ-OLMEDA J F, LÓPEZ-GARCÍA I, SÁNCHEZ-MUROS M J, et al. Daily rhythms of digestive physiology, metabolism and behaviour in the European eel (Anguilla anguilla)[J]. Aquaculture International, 2012, 20(6): 1085-1096. DOI:10.1007/s10499-012-9547-z |
| [28] |
MIGAUD H, COWAN M, TAYLOR J, et al. The effect of spectral composition and light intensity on melatonin, stress and retinal damage in post-smolt Atlantic salmon, Salmo salar[J]. Aquaculture, 2007, 270(1/4): 390-404. |
| [29] |
DUSTON J, ASTATKIE T, MACISAAC P F. Long-to-short photoperiod in winter halves the incidence of sexual maturity among Arctic charr[J]. Aquaculture, 2003, 221(1/4): 567-580. |
| [30] |
EBBESSON L O E, BJORNSSON B T, EKSTROM P, et al. Daily endocrine profiles in parr and smolt Atlantic salmon[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2008, 151(4): 698-704. |
2. Shanghai Engineering Research Center of aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


