2. 农业部水产品储藏保鲜质量安全风险评估实验室, 上海 201306;
3. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
随着工业的发展,冶炼、电镀、皮革和采矿等行业在生产过程中不断向自然环境排放含有大量重金属的污水,致使重金属污染问题愈演愈烈[1-2]。由于重金属存在强毒性、体内易富集且难排除等问题,一旦进入人体将对健康造成不同程度的危害[3]。因此,含有重金属的天然水体修复和治理成为科学家、政客及媒体关注的热点[4-9]。传统重金属离子处理方法有化学沉淀法、混凝法、离子交换法、磁性纳米吸附法及生物吸附法等[10-14]。其中,化学沉淀法和混凝法由于其操作简单、吸附速度较快,在工业废水处理中得以广泛应用,但吸附剂使用后难回收,对环境造成二次污染,引发其他污染问题[15-18]。离子交换法对于重金属离子具有较高的吸附率,但吸附剂的使用受限于水体pH、重金属初始浓度、吸附温度和处理时间[19-20]。磁性纳米吸附法,通过使用如聚合物包裹磁性四氧化三铁粒子的纳米材料,如聚丙烯酸(PAA)和二乙酰胺(DETA)包裹的磁性微粒,由于其比表面积大及无内部扩散电阻,可快速吸附重金属并在外加磁场的作用下对吸附剂进行回收,具有良好的应用前景[21]。然而,常用的PAA和DETA具有毒性,二次污染问题限制其进一步应用[22]。基于磁性四氧化三铁纳米的吸附特点,研制新型高效、无毒、经济有效的重金属磁性吸附剂,对于含有重金属离子的天然水体的处理及修复具有潜在应用价值[20]。
壳聚糖(CS)是一种从甲壳中提取的具有生物相容性、生物降解性和无毒性的低成本材料[2, 20-25]。壳聚糖中含有大量带有正电荷的氨基,可与多聚磷酸钠(TPP)中带有负电的磷酸基进行交联形成微球[26]。由于该技术操作简便、可控性强,且对重金属具有吸附能力的特点,因此受到重金属吸附研究领域的广泛关注,如使用壳聚糖材料对水体中重金属进行吸附[6, 27]。但由于壳聚糖吸附重金属后难于从体系中分离,其应用受到一定限制[22]。因此,本文基于壳聚糖和磁性四氧化三铁的吸附特性,制备得到磁性壳聚糖重金属吸附剂[28]。
本文使用多聚磷酸钠作为交联剂,通过离子交联法制备纳米磁性壳聚糖微球(MCNs),并对其表面结构和化学性能进行表征。将纳米磁性壳聚糖微球(MCNs)、微米磁性壳聚糖微球(MCMs)、纳米壳聚糖微球(CNs)和微米壳聚糖微球(CMs)应用于不同重金属溶液的吸附,对其吸附性差异和吸附动力学特征进行研究。此外,通过其与细胞共培养对其生物相容性进行评估。
1 材料与方法 1.1 主要试剂壳聚糖(分子量620 ku,脱乙酰度~95%)购于国药集团化学试剂有限公司; 纳米四氧化三铁(20 nm)、多聚磷酸钠及铜(Ⅱ)、镉(Ⅱ)和锌(Ⅱ)标准溶液(1 000 μg/mL)采购于Sigma Chemical Co.(美国);冰醋酸购于天津科密欧化学试剂有限公司;去离子水购于杭州娃哈哈有限公司; 人乳腺癌MCF-7细胞由本实验室保存,细胞培养基为DMEMF12及胎牛血清购于Gibco(美国)。其他试剂均为国产分析纯或分析纯以上纯度。
1.2 壳聚糖微球的制备壳聚糖溶解于1%的醋酸溶液,制备0.5 mg/mL的壳聚糖溶液,调节溶液pH至4.6并用0.25 μm的滤膜进行过滤。用机械搅拌器保持1 500 r/min对溶液持续搅拌,分别将与壳聚糖质量比为4:1和4:3(CS/TPP)的多聚磷酸钠溶液(0.5 mg/mL)缓慢滴加到壳聚糖溶液中[28]。持续搅拌15 min后离心,使用冷冻干燥机(LABCONCO 7948030,美国)将沉淀冷冻干燥,得到纳米及微米壳聚糖微球(CNs/CMs)。
1.3 磁性壳聚糖微球的制备壳聚糖溶解于1%的醋酸溶液,制备0.5 mg/mL的壳聚糖溶液,调节溶液pH至4.6并用0.25 μm的滤膜进行过滤。用机械搅拌器保持1 500 r/min对溶液持续搅拌,将一定量纳米四氧化三铁悬浮液(0.5 mg/mL)缓慢加入壳聚糖溶液中,持续搅拌10 min。持续搅拌情况下,将与壳聚糖质量比为4:1和4:3(CS/TPP)的多聚磷酸钠溶液(0.5 mg/mL)缓慢加入。持续搅拌15 min后离心,将沉淀冷冻干燥后,制备得到纳米及微米磁性壳聚糖微球(MCNs/MCMs)。
1.4 粒径及Zeta电位测量取适量冷冻干燥后的材料在去离子水中超声分散,使用激光粒度仪(PCS, Nano-ZS90, Malvern Instruments Corp, 英国)测量其粒径分布及Zeta电位。
1.5 形貌表征取适量冷冻干燥后的材料在去离子水中超声分散,滴加至双面铜网(北京中镜科仪技术有限责任公司,北京),使用透射电子显微镜(TecnaiG2F20, FEI, 美国)观察合成材料的形貌特征(100 kV) [29]。
1.6 化学性能表征取适量冷冻干燥后的材料与溴化钾粉末充分混合,并用傅里叶红外光谱仪(Nicolet iS5, Thermo Scientific, 美国)对其红外谱图进行表征。谱图扫描区域介于4 000和400 cm-1之间,所有样品扫描16次[30]。
使用粉末X射线衍射光谱仪(D8 ADVANCE, Bruker, 德国)对合成样品进行表征。循环扫描3次,2θ角度介于5至60°之间[31]。
1.7 材料吸附性能研究将铜(Ⅱ)、镉(Ⅱ)及锌(Ⅱ)标准溶液(1 000 μg/mL)分别滴加至烧杯中,调节pH至5.0。将0.02 g的合成材料(CNs, CMs, MCNs, MCMs)分别加入至上述溶液中,室温下震荡吸附2 h。每隔一定时间吸取2 mL溶液,离心取上清液。通过原子吸收光谱仪(TAS-990F, PERSEE, 中国)测试各样品中重金属离子浓度。
1.8 生物相容性评估将吸附剂(CNs, CMs, MCNs, MCMs)分别分散在含有10% FBS和1%双抗的DMEM/F12 (1:1)的培养基中,配置含有吸附剂的DMEM/F12培养基。将MCF-7细胞种在96孔板中(104 cell/孔),贴壁生长12 h后,将培养基替换为含有吸附剂的培养基继续培养24 h (37 ℃,二氧化碳5%,相对湿度95%)。移除培养基,并替换为含10%普鲁士蓝(Thermo Fisher Scientific, 美国)的细胞培养基继续培养30 min。使用酶标仪(BioTek, 美国)测量570 nm处吸光度,验证合成材料的毒性。含有细胞和不含有细胞的细胞培养基分别作为阳性及阴性对照。
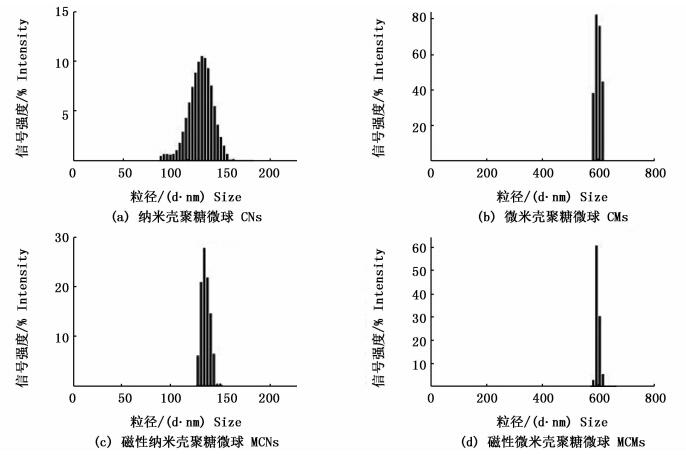
2 结果与讨论 2.1 性能和表征合成吸附剂(即CNs, CMs, MCNs, MCMs)的粒径分布及Zeta电位结果见表 1及图 1。如表 1所示,壳聚糖微球的粒径分布介于120.80~629.21 nm,磁性壳聚糖微球的粒径分布介于164.05~768.69 nm。相较于壳聚糖/多聚磷酸钠(质量分数比=4:3)的微球粒径而言,壳聚糖/多聚磷酸钠(质量分数比=4:1)的微球粒径分布更加广泛(图 1)。这是因为多聚磷酸钠中含有大量带有负电荷的磷酸基与壳聚糖中带有正电荷的氨基作用,较高比例的交联剂使壳聚糖交联形成大尺寸微球,且粘度较大易于团聚[21, 29-30]。

|
表 1 吸附剂的粒径和Zeta电位 Tab.1 Particle size and Zeta-potential of adsorbents |
|
图 1 吸附剂粒径分布图
Fig. 1 Particle size distribution of adsorbents
|
壳聚糖微球及磁性壳聚糖微球大部分成球形,经TecnaiG2F20透射电子显微镜观察,大部分微球形态完整,CNs和MCNs粒径介于100~200 nm之间[图 2(a)和图 2(d)],CMs和MCMs粒径介于500~600 nm之间[图 2(b)和图 2(e)], 显微镜结果与激光粒度仪测量粒径相符。磁性壳聚糖微球内部颜色相对壳聚糖微球较深,通过能量色散X射线光谱(EDX)分析, MCNs和MCMs谱图中[图 2(c)和图 2(f)]出现明显的含铁峰,表明磁性壳聚糖微球中包裹纳米四氧化三铁。

|
图 2 吸附剂TEM及EDX分析
Fig. 2 TEM and EDX analysis of adsorbents
|
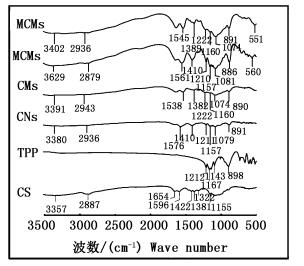
FT-IR结果表明(图 3),对于壳聚糖(CS),它在3 357 cm-1处的吸收峰归属于-OH和-NH伸缩振动,2 887 cm-1处的特征吸收峰可归属于C-H伸缩振动,1 596及1 422 cm-1的吸收峰可归属于酰胺Ⅱ带和-CH3的对称变角振动[31];对于纳米四氧化三铁,已知其在550~580 cm-1处的吸收峰归属为Fe-O键的伸缩振动[32];壳聚糖微球和磁性壳聚糖微球,与壳聚糖的谱图对比,其酰胺Ⅱ带的吸收峰变弱,且发生红移,其可能与多聚磷酸钠交联壳聚糖生成的P=O键作用有关[33];而与多聚磷酸钠的红外谱图对照1 201~1 221 cm-1出现P=O伸缩振动峰,这说明多聚磷酸钠与壳聚糖成功交联[34];此外,磁性壳聚糖微球的红外谱图(即MCNs和MCMs)在560和551 cm-1出现特征峰,这都说明纳米四氧化三铁成功包埋进壳聚糖微球中。
|
图 3 壳聚糖、多聚磷酸钠及合成吸附材料红外光谱图
Fig. 3 FT-IR spectrum of CS, TPP and adsorbents
|
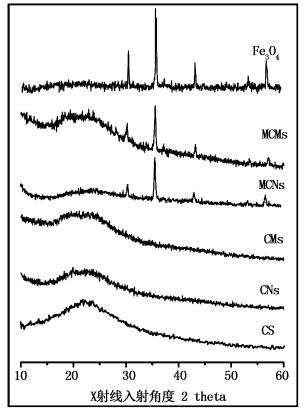
合成原料及合成吸附剂的X射线衍射谱图见图 4。合成的吸附材料谱图(即CNs、CMs、MCNs和MCMs)与壳聚糖谱图对比,22°附近出现特征峰;此外,磁性壳聚糖微球(即MCNs和MCMs)的谱图与四氧化三铁谱图对比,衍射图中出现5个主要衍射峰,分别为30.1°,35.4°,43.1°以及53.4°,软件分析衍射峰可归属于磁铁矿晶型[35];以上说明通过多聚磷酸钠的交联作用,成功地合成了壳聚糖微球及磁性壳聚糖微球。
|
图 4 壳聚糖、四氧化三铁及合成吸附材料粉末X射线衍射光谱图
Fig. 4 XRD spectrum of CS, Fe3O4 and adsorbents
|
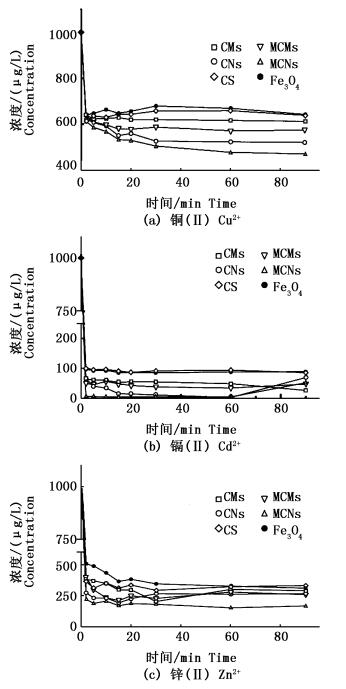
吸附性能与吸附材料的结合位点、比表面积大小、环境温度及溶液pH等相关[36]。在吸附剂对于重金属离子吸附实验中,铜(Ⅱ)、镉(Ⅱ)及锌(Ⅱ)离子浓度随吸附时间变化如图 5所示。在2 min内,重金属离子浓度急剧降低,20 min全部达到吸附动态平衡状态。从图 5中可知,对于同种重金属离子不同吸附剂的吸附效率存在差异(即MCNs>CNs>MCMs>CMs)。其原因为磁性壳聚糖微球中包裹带有负电的磁性四氧化三铁纳米颗粒,纳米四氧化三铁与带正电的重金属离子具有强配位能力[37];CNs及MCNs相较于CMs及MCMs具有更大的比表面积,比表面积越大与金属离子结合的位点越多,吸附能力则越强[38];MCMs吸附量cy CNs吸附量,其原因可能为随着粒径的增大,MCMs外层包裹的壳聚糖阻碍重金属离子与带有负电的磁性四氧化三铁结合,吸附能力受限于比表面积[39]。以上说明较小的粒径通过比表面积的提高使得吸附位点增多,从而提高吸附剂的吸附效率。
|
图 5 合成重金属吸附剂对Cu2+、Cd2+以及Zn2+的等温吸附曲线
Fig. 5 Isothermal adsorption curve of Cu2+, Cd2+ and Zn2+absorbed by adsorbents
|
对于不同重金属离子,吸附剂的吸附效率及最大吸附量存在差异,结果如表 2所示。结果表明,壳聚糖微球及MCMs对于不同种类的重金属吸附能力不同,具体吸附效率表现为:吸附镉(Ⅱ)>吸附锌(Ⅱ)>吸附铜(Ⅱ) (P < 0.05)。镉(Ⅱ)的离子强度强于锌(Ⅱ),促使镉(Ⅱ)更容易向吸附剂表面迁移并被吸附[40];此外,铜(Ⅱ)的吸附量较低,可能因为该pH下,H+抑制铜(Ⅱ)与吸附剂吸附位点结合[41]。此外,通过计算可知,磁性纳米吸附剂的最大吸附量相比于壳聚糖微球具有显著提高,其最大吸附剂量分别为铜(Ⅱ) (516.6 g/g),镉(Ⅱ) (955.7 g/g)以及锌(Ⅱ) (832.3 g/g), 与传统壳聚糖吸附材料相比,最大吸附剂量提高6.99%~16.81%。以上说明本文合成的吸附剂对于镉及锌具有良好的吸附效果。
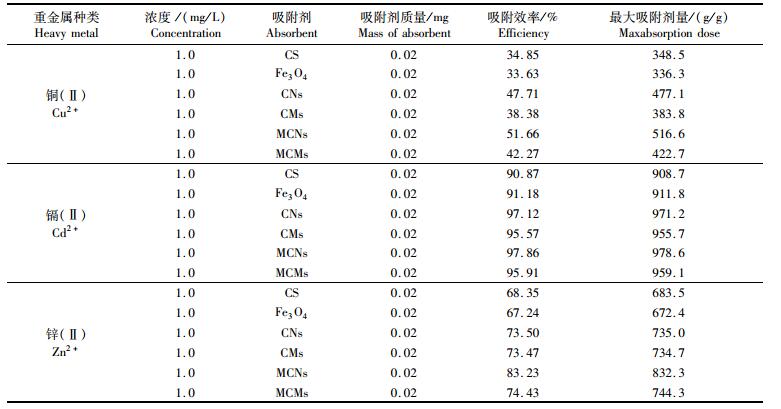
|
表 2 壳聚糖、四氧化三铁及吸附剂对铜(Ⅱ)、镉(Ⅱ)和锌(Ⅱ)的吸附效率 Tab.2 Cu2+, Cd2+, Zn2+ removing efficiencies by CS, Fe3O4 and adsorbents |
为了研究吸附的动力学特征,用拟一级和拟二级动力学模型对吸附数据进行拟合[41]。拟一级动力学方程(1)和拟二级动力学方程(2)如下:
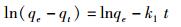 (1)
(1)
 (2)
(2)
式中:qt和qe分别为t时间和平衡状态时对重金属的吸附量(mg/g),k1(min-1)和k2 [g/(mg·min)]分别为拟一级动力学吸附方程和拟二级动力学吸附方程常数。
据表 3所示,同一种金属离子的吸附相关系数R22>R12,说明实验数据对拟二级动力学模型的拟合程度较高,且该吸附剂对于重金属的吸附过程属于化学吸附[42]。
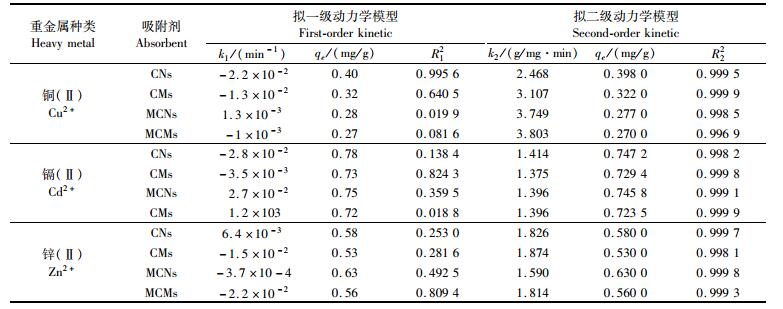
|
表 3 吸附剂对铜(Ⅱ)、镉(Ⅱ)和锌(Ⅱ)的吸附动力学特征 Tab.3 kinetics parameters for Cu(Ⅱ), Cd(Ⅱ) and Zn(Ⅱ) adsorption by adsorbents |
使用人乳腺癌MCF-7细胞系作为细胞模型对吸附剂的生物相容性进行验证。实验过程中,使用含有不同浓度的CNs和MCNs(25~200 μg/mL)的培养基培养MCF-7细胞24 h,使用普鲁士蓝细胞活性染剂及酶标仪(Biotek)测量吸光度,并用公式(3)计算其细胞活性,其结果如图 6所示。

|
图 6 不同浓度纳米壳聚糖微球和磁性纳米壳聚糖微球生物活性
Fig. 6 Viability of CNs and MCNs adsorbents with various concentrations
|
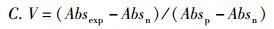 (3)
(3)
式中:C.V为细胞活性,Absexp为实验组吸光度,Absp为阳性对照组吸光度,Absn为阴性对照组吸光度。
结果表明,与CNs及MCNs共培养的细胞24 h后仍能保持接近100%的活性。这一结果证实了CMs和MCMs具有良好的生物相容性,是一种无毒的吸附材料,适用于自然环境中重金属的吸附,且不会导致其他二次污染问题[43]。
2.4 成本分析由于壳聚糖的来源广泛,可从海洋贝壳类生物提取制得,因此其价格低廉。多聚磷酸钠是化工产业常用的离子交联剂,而四氧化三铁纳米颗粒也为常见的磁性材料,其均具有成熟的制备工艺。因此,本文介绍的磁性纳米壳聚糖重金属吸附剂是一种低成本的重金属吸附材料(0.99美元/g),其成本如表 4所示。

|
表 4 实验试剂价格分析 Tab.4 The cost of the reagents used in this study |
本文采用离子交联法制备得到的纳米磁性壳聚糖吸附剂,在溶液pH为5时对于铜(Ⅱ)、镉(Ⅱ)及锌(Ⅱ)具有良好的吸附效率,最大吸附效率分别达到51.66%、97.86%及82.24%,吸附速度快,20 min可达吸附平衡。磁性壳聚糖微球吸附剂对于重金属的吸附效率高于壳聚糖微球吸附剂,其主要原因是带有负电的四氧化三铁增强了吸附剂对于重金属离子的配位能力;纳米磁性壳聚糖微球吸附剂的吸附效率高于微米磁性壳聚糖微球吸附剂,其主要原因是纳米吸附剂的比表面积大,表面与重金属结合位点比微米吸附剂多。磁性壳聚糖吸附剂与MCF-7细胞共培养时细胞活性接近100%,表现出良好的生物相容性。本文使用的试剂价格低廉,制备得到的纳米磁性壳聚糖的价格仅为0.99美元/g。综上,纳米磁性壳聚糖吸附剂可作为一种低成本、吸附效率高及无毒性的重金属吸附剂,可用于含有重金属离子的天然水体的处理及修复。
| [1] |
WHITACRE D M. Preface. role of reviews. environmental contamination and toxicology[J]. Reviews of Environmental Contamination and Toxicology, 2014, 230: Ⅶ-Ⅸ. |
| [2] |
ANITHA T, KUMAR P S, KUMAR K S, et al. Adsorptive removal of Pb(Ⅱ) ions from polluted water by newly synthesized chitosan-polyacrylonitrile blend:equilibrium, kinetic, mechanism and thermodynamic approach[J]. Process Safety and Environmental Protection, 2015, 98: 187-197. DOI:10.1016/j.psep.2015.07.012 |
| [3] |
KUMAR P S, RAMAKRISHNAN K, KIRUPHA S D, et al. Thermodynamic and kinetic studies of cadmium adsorption from aqueous solution onto rice husk[J]. Brazilian Journal of Chemical Engineering, 2010, 27(2): 247-355. |
| [4] |
张聪, 张弦. 土壤重金属污染修复技术研究进展[J]. 环境与发展, 2018, 30(2): 87, 89. ZHANG C, ZHANG X. Research progress on remediation technology of heavy metal pollution in soil[J]. Inner Mongolia Environmental Sciences, 2018, 30(2): 87, 89. |
| [5] |
AHMAD T, DANISH M, RAFATULLAH M, et al. The use of date palm as a potential adsorbent for wastewater treatment:a review[J]. Environmental Science and Pollution Research, 2012, 19(5): 1464-1484. DOI:10.1007/s11356-011-0709-8 |
| [6] |
ZHU W J, WANG J X, WU D, et al. Investigating the heavy metal adsorption of mesoporous silica materials prepared by microwave synthesis[J]. Nanoscale Research Letters, 2017, 12(1): 323. DOI:10.1186/s11671-017-2070-4 |
| [7] |
LAKOURAJ M M, NOROUZIAN R S, BALO S. Preparation and cationic dye adsorption of novel Fe3O4 supermagnetic/thiacalix[4] arene tetrasulfonate self-doped/polyaniline nanocomposite:kinetics, isotherms, and thermodynamic study[J]. Journal of Chemical & Engineering Data, 2015, 60(8): 2262-2272. |
| [8] |
ZHOU D, LIU D, GAO F X, et al. Effects of biochar-derived sewage sludge on heavy metal adsorption and immobilization in soils[J]. International Journal of Environmental Research and Public Health, 2017, 14(7): 681. DOI:10.3390/ijerph14070681 |
| [9] |
程爱华, 钱大鹏, 药萌瑶. Ca2+印迹交联改性壳聚糖的制备及对Cd2+的吸附[J]. 精细化工, 2018, 35(3): 482-488. CHENG A H, QIAN D P, YAO M Y. Preparation of Ca2+ imprinted cross-linked modified chitosan and its adsorption properties for Cd2+[J]. Fine Chemicals, 2018, 35(3): 482-488. |
| [10] |
LUO Y, ZHOU Z K, YUE T L. Synthesis and characterization of nontoxic chitosan-coated Fe3O4 particles for patulin adsorption in a juice-pH simulation aqueous[J]. Food Chemistry, 2017, 221: 317-323. DOI:10.1016/j.foodchem.2016.09.008 |
| [11] |
MERAZ K A S, VARGAS S M P, MALDONADO J T L, et al. Eco-friendly innovation for nejayote coagulation-flocculation process using chitosan:evaluation through zeta potential measurements[J]. Chemical Engineering Journal, 2016, 284: 536-542. DOI:10.1016/j.cej.2015.09.026 |
| [12] |
SIU P C C, KOONG L F, SALEEM J, et al. Equilibrium and kinetics of copper ions removal from wastewater by ion exchange[J]. Chinese Journal of Chemical Engineering, 2016, 24(1): 94-100. DOI:10.1016/j.cjche.2015.06.017 |
| [13] |
REN Y, ABBOOD H A, HE F B, et al. Magnetic EDTA-modified chitosan/SiO2/Fe3O4 adsorbent:preparation, characterization, and application in heavy metal adsorption[J]. Chemical Engineering Journal, 2013, 226: 300-311. DOI:10.1016/j.cej.2013.04.059 |
| [14] |
AHMAD T, RAFATULLAH M, GHAZALI A, et al. Oil palm biomass-based adsorbents for the removal of water pollutants-a review[J]. Journal of Environmental Science and Health, Part C, 2011, 29(3): 177-222. DOI:10.1080/10590501.2011.601847 |
| [15] |
KU Y, JUNG I L. Photocatalytic reduction of Cr(Ⅵ) in aqueous solutions by UV irradiation with the presence of titanium dioxide[J]. Water Research, 2001, 35(1): 135-142. DOI:10.1016/S0043-1354(00)00098-1 |
| [16] |
FU F L, WANG Q. Removal of heavy metal ions from wastewaters:a review[J]. Journal of Environmental Management, 2011, 92(3): 407-418. DOI:10.1016/j.jenvman.2010.11.011 |
| [17] |
孙德尧, 臧淑英, 孙华杰, 等. 近150年呼伦湖重金属污染历史及潜在生态风险[J]. 农业环境科学学报, 2018, 37(1): 137-147. SUN D Y, ZANG S Y, SUN H J, et al. Pollution history and potential ecological risk assessment of heavy metals in core sediments in Hulun Lake during the past 150 years[J]. Journal of Agro-Environment Science, 2018, 37(1): 137-147. |
| [18] |
陈诚. 重金属污染土壤修复技术及其修复实践[J]. 农家参谋, 2017(10): 20. CHEN C. Soil heavy metal pollution repair technology and its repair practice[J]. Farm Staff, 2017(10): 20. |
| [19] |
KANG S Y, LEE J U, MOON S H, et al. Competitive adsorption characteristics of Co2+, Ni2+, and Cr3+ by IRN-77 cation exchange resin in synthesized wastewater[J]. Chemosphere, 2004, 56(2): 141-147. DOI:10.1016/j.chemosphere.2004.02.004 |
| [20] |
GODE F, PEHLIVAN E. Removal of chromium(Ⅲ) from aqueous solutions using Lewatit S 100:the effect of pH, time, metal concentration and temperature[J]. Journal of Hazardous Materials, 2006, 136(2): 330-337. DOI:10.1016/j.jhazmat.2005.12.021 |
| [21] |
ALIMOHAMMADI N, SHADIZADEH S R, KAZEMINEZHAD I. Removal of cadmium from drilling fluid using nano-adsorbent[J]. Fuel, 2013, 111: 505-509. DOI:10.1016/j.fuel.2013.03.023 |
| [22] |
HUANG S H, CHEN D H. Rapid removal of heavy metal cations and anions from aqueous solutions by an amino-functionalized magnetic nano-adsorbent[J]. Journal of Hazardous Materials, 2009, 163(1): 174-179. DOI:10.1016/j.jhazmat.2008.06.075 |
| [23] |
FENG L Y, CAO M H, MA X Y, et al. Superparamagnetic high-surface-area Fe3O4 nanoparticles as adsorbents for arsenic removal[J]. Journal of Hazardous Materials, 2012, 217-218: 439-446. DOI:10.1016/j.jhazmat.2012.03.073 |
| [24] |
余劲聪, 侯昌萍, 何舒雅, 等. 壳聚糖修复重金属污染土壤的研究进展[J]. 土壤通报, 2017, 48(1): 250-256. YU J C, HOU C P, HE S Y, et al. Remediation of heavy metal contaminated soils by chitosan[J]. Chinese Journal of Soil Science, 2017, 48(1): 250-256. |
| [25] |
GOY R C, DE BRITTO D, ASSIS O B G. A review of the antimicrobial activity of chitosan[J]. Polímeros, 2009, 19(3): 241-247. DOI:10.1590/S0104-14282009000300013 |
| [26] |
YADI M G, BENGUELLA B, GAOUAR-BENYELLES N, et al. Adsorption of ammonia from wastewater using low-cost bentonite/chitosan beads[J]. Desalination and Water Treatment, 2016, 57(45): 21444-21454. DOI:10.1080/19443994.2015.1119747 |
| [27] |
FAN H L, ZHOU S F, JIAO W Z, et al. Removal of heavy metal ions by magnetic chitosan nanoparticles prepared continuously via high-gravity reactive precipitation method[J]. Carbohydrate Polymers, 2017, 174: 1192-1200. DOI:10.1016/j.carbpol.2017.07.050 |
| [28] |
ZHANG H C, JUNG J, ZHAO Y Y. Preparation, characterization and evaluation of antibacterial activity of catechins and catechins-Zn complex loaded β-chitosan nanoparticles of different particle sizes[J]. Carbohydrate Polymers, 2016, 137: 82-91. DOI:10.1016/j.carbpol.2015.10.036 |
| [29] |
CHEN Y W, WANG J L. Preparation and characterization of magnetic chitosan nanoparticles and its application for Cu(Ⅱ) removal[J]. Chemical Engineering Journal, 2011, 168(1): 286-292. DOI:10.1016/j.cej.2011.01.006 |
| [30] |
ZHOU L M, LIU J H, LIU Z R. Adsorption of platinum(Ⅳ) and palladium(Ⅱ) from aqueous solution by thiourea-modified chitosan microspheres[J]. Journal of Hazardous Materials, 2009, 172(1): 439-446. DOI:10.1016/j.jhazmat.2009.07.030 |
| [31] |
WANG C X, WANG L X, YANG W L. Preparation and characterization of functional inorganic/organic composite microspheres via electrostatic interaction[J]. Journal of Colloid and Interface Science, 2009, 333(2): 749-756. DOI:10.1016/j.jcis.2009.02.008 |
| [32] |
ZHANG H C, ZHAO Y Y. Preparation, characterization and evaluation of tea polyphenol-Zn complex loaded β-chitosan nanoparticles[J]. Food Hydrocolloids, 2015, 48: 260-273. DOI:10.1016/j.foodhyd.2015.02.015 |
| [33] |
SOUZA M P, VAZ A F M, CORREIA M T S, et al. Quercetin-loaded lecithin/chitosan nanoparticles for functional food applications[J]. Food and Bioprocess Technology, 2014, 7(4): 1149-1159. DOI:10.1007/s11947-013-1160-2 |
| [34] |
CHEN T, HUANG T, DAI H. Synthesis of light-controlled superparamagnetic core-shell structured nanocomposite for drug delivery[J]. Journal of Nanoscience and Nanotechnology, 2017, 17(7): 4524-4531. DOI:10.1166/jnn.2017.13749 |
| [35] |
SANKARARAMAKRISHNAN N, SANGHI R. Preparation and characterization of a novel xanthated chitosan[J]. Carbohydrate Polymers, 2006, 66(2): 160-167. DOI:10.1016/j.carbpol.2006.02.035 |
| [36] |
SHARIFUL M I, SHARIF S B, LEE J J L, et al. Adsorption of divalent heavy metal ion by mesoporous-high surface area chitosan/poly (ethylene oxide) nanofibrous membrane[J]. Carbohydrate Polymers, 2017, 157: 57-64. DOI:10.1016/j.carbpol.2016.09.063 |
| [37] |
ZHANG J, HAN J, WANG M G, et al. Fe3O4/PANI/MnO2 core-shell hybrids as advanced adsorbents for heavy metal ions[J]. Journal of Materials Chemistry A, 2017, 5(8): 4058-4066. DOI:10.1039/C6TA10499A |
| [38] |
KALSI P K, TOMAR B S, RAMAKUMAR K L, et al. Studies on recovery of uranium from fluoride matrix employing sonochemistry[J]. Journal of Radioanalytical and Nuclear Chemistry, 2012, 293(3): 863-867. DOI:10.1007/s10967-012-1767-1 |
| [39] |
LI X L, LI Y F, YE Z F. Preparation of macroporous bead adsorbents based on poly(vinyl alcohol)/chitosan and their adsorption properties for heavy metals from aqueous solution[J]. Chemical Engineering Journal, 2011, 178: 60-68. DOI:10.1016/j.cej.2011.10.012 |
| [40] |
VASCONCELOS H L, GUIBAL E, LAUS R, et al. Competitive adsorption of Cu(Ⅱ) and Cd(Ⅱ) ions on spray-dried chitosan loaded with reactive orange 16[J]. Materials Science and Engineering:C, 2009, 29(2): 613-618. |
| [41] |
LIN J X, WANG L. Comparison between linear and non-linear forms of pseudo-first-order and pseudo-second-order adsorption kinetic models for the removal of methylene blue by activated carbon[J]. Frontiers of Environmental Science & Engineering in China, 2009, 3(3): 320-324. |
| [42] |
SARI A, TUZEN M, KOCAL I. Application of chitosan-modified pumice for antimony adsorption from aqueous solution[J]. Environmental Progress & Sustainable Energy, 2017, 36(6): 1587-1596. |
| [43] |
RAHIMI M, SAFA K D, ALIZADEH E, et al. Dendritic chitosan as a magnetic and biocompatible nanocarrier for the simultaneous delivery of doxorubicin and methotrexate to MCF-7 cell line[J]. New Journal of Chemistry, 2017, 41(8): 3177-3189. DOI:10.1039/C6NJ04107H |
2. Laboratory of Quality & Safety Risk Assessment for Aquatic Products on Storage and Preservation, Ministry of Agriculture, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


