2. 上海海洋大学 农业部鱼类营养与环境生态研究中心, 上海 201306;
3. 上海海洋大学 上海水产养殖工程技术研究中心, 上海 201306
近年来,鱼粉资源的缺乏推动了动植物蛋白源的研究与开发。植物蛋白由于价格低廉、易于获得等优点受到水生动物营养研究者们的关注。豆粕、棉粕及花生粕等植物蛋白在水生动物饲料中的适宜添加量[1],以及它们对水生动物的生长[2]、消化率[3]、肌肉成分[4]等的影响已有报道。植物蛋白改变水生动物消化生理的研究,如豆粕、菜粕对青鱼(Mylopharyngodon piceus)消化酶活性的影响[5]、酶解植物蛋白对建鲤(Cyprinus carpio Var. Jian)消化酶活性的影响[6]、玉米蛋白粉替代鱼粉对异育银鲫(Carassius auratus gibelio)消化酶活性影响[7]等为不同食性的鱼类利用植物蛋白提供了参考。消化酶在鱼类的消化过程中起到重要的调节作用,研究者们常根据植物蛋白对水生动物消化酶活力的影响来评判水生动物应用植物蛋白的能力,消化酶活性决定鱼类对营养物质消化和吸收的能力,酶活性越强表明消化能力越强[8]。
暗纹东方鲀(Takifugu obscurus),属于鲀形目(Tetraodontidormes),鲀科(Tetraodontidae),东方鲀属(Takifugu),食性偏肉食性,生长速度快,经济价值高,现在食品药品监督局已经放开对其食用管制,开发前景广阔。人工养殖常用鳗鱼饲料饲养,饲料开发相对缓慢。玉米蛋白粉在肉食性鱼类饲料中的应用研究相对较少,而玉米蛋白粉对暗纹东方鲀消化酶活力的影响,特别是对胰蛋白酶、胰凝乳蛋白酶、羧肽酶、氨肽酶等蛋白酶的系统研究还未见报道。
本实验研究暗纹东方鲀消化酶在主要消化器官中的分布,并在基础饲料中用玉米蛋白粉替代部分鱼粉,研究玉米蛋白粉对暗纹东方鲀蛋白酶、脂肪酶和淀粉酶活性的影响,探讨暗纹东方鲀对玉米蛋白粉的消化能力,为合理选择饲料原料、配制优质的暗纹东方鲀人工饲料提供理论基础。
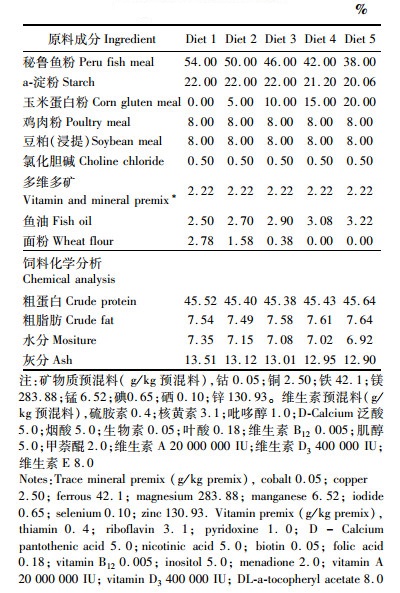
1 材料与方法 1.1 实验鱼的饲养暗纹东方鲀购于上海水产研究所水产试验良种场,玉米蛋白粉由常州亚源生化科技有限公司提供。鱼饲养于本校水产动物营养与饲料实验室的室内循环水族箱(0.7 m×0.6 m×0.5 m)内,选择规格一致的鱼随机将分成5组,每组设3个重复,每个重复11尾鱼。先用商品饲料驯养2周后开始饲养试验,鱼的初始体质量为(41.26±1.09)g,体长为(12.94土0.22)cm。分别饲喂玉米蛋白粉用量为0%、5%、10%、15%和20%的等氮、等能配合饲料(表 1),替代鱼粉的水平分别为0%、7.4%、14.8%、22.2%和29.6%,不替代鱼粉的饲料组为对照组,共饲养60 d。饲料为粉料,投喂时加水和油制成团状饲料。采用饱食法进行投饵,以1 h内不再摄食为准,每天投饵2次(8:30,16:00)。投食后1 h用小捞网捞取残饵,记录残饵量。实验期间,温度为(25±1) ℃,24 h连续充气,每天吸污一次、换水1/3,养殖期间pH在7.8~8.5之间,DO>7 mg/L, NH3-N < 0.5 mg/L。
|
表 1 实验饲料的组成和主要营养成分 Tab.1 Formulation and proximate chemical composition of tested diets |
生长实验开始前随机取9条鱼,用MS-222(100 mg/L)麻醉后,于冰盘上解剖,取出胃、肝胰脏和肠,剔除脂肪组织和肠系膜,用4 ℃0.65%生理盐水反复冲洗,彻底清除胃及肠道内容物后,用滤纸吸干水分,每条鱼的胃、肝胰脏和肠作为1个样品,放入-20 ℃冰箱中保存。实验结束时,鱼平均体质量为(98.54±4.19)g,先停食24 h,每组随机取9条鱼(每个重复3条),与实验开始时取样一样,先用MS-222(100 mg/L)麻醉再取样,放入-20 ℃冰箱中保存。
1.3 酶活测定 1.3.1 酶液的制备将全肠、胃和肝胰脏样品,剔除附着的肠系膜,用去离子水清洗肠道内容物,以每尾鱼的胃、肠或肝胰脏作为1个样本。取湿重100 mg左右的样品(肠、胃、肝组织),加入10倍体积预冷重蒸水(0~4 ℃)在冰浴中匀浆15 min。将匀浆液在Sigma 1215 K型高速冷冻离心机(0~4 ℃)以10 000 r/min离心15 min,取上清液作为酶液,在0~4 ℃低温下保存,24 h内测定完毕。
1.3.2 消化酶活性的测定胰蛋白酶活性用施韦尔特法[9]稍加改进测定。酶单位的定义:在pH 8.0、37 ℃条件下,每毫克蛋白中含有的胰蛋白酶每分钟使吸光度变化0.003即为一个酶活力单位。
胰凝乳蛋白酶活性根据胡梅尔法《酶的测定方法》[9]稍加改进测定,以苯甲酰-L-酪氨酸乙酯为底物,酶活力定义为pH为7.8,温度为25 ℃时,每分钟水解1 μmol苯甲酰-L-酪氨酸乙酯所需要的酶量。
羧肽酶A活性根据CARCIA-CARRENO等[10]的方法稍加改进测定, 以马尿酰苯丙氨酸为底物,酶活力单位定义为每分钟释放1 μmol/L的产物时所需要的酶量。
羧肽酶B活性的测定:参照CARCIA-CARRENO等[10]的方法稍加修正, 以N-马尿酰-L-精氨酸为底物, 在25 ℃恒温下,酶活力单位定义为每分钟释放1 μmol/L的产物时所需要的酶量。
亮氨酸-氨肽酶活力参照MAROUX等[11]和KOTZAMANIS等[12]的方法并加以改动测定。酶活力定义:在37 ℃恒温下,每分钟释放1 nmol的产物时所需要的酶量。
胃蛋白酶活性按南京建成胃蛋白试剂盒说明书测定。酶比活力定义:每毫克组织蛋白37 ℃每分钟分解蛋白生成1 μg氨基酸相当于1个酶活力单位。
淀粉酶活性的测定按南京建成淀粉酶试剂盒说明书操作,酶单位定义:组织中每毫克蛋白在37 ℃与底物作用30 min,水解10 mg淀粉定义为1个淀粉酶活力单位。
脂肪酶活性的测定按南京建成脂肪酶试剂盒说明书操作,酶单位定义:在37 ℃条件下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位。
蛋白质含量用考马斯亮兰法测定。
1.4 数据处理采用SPSS 17.5 for Windows和Excel进行one-way ANOVA分析和LSD比较。结果以平均数±标准差(M±SD)表示。
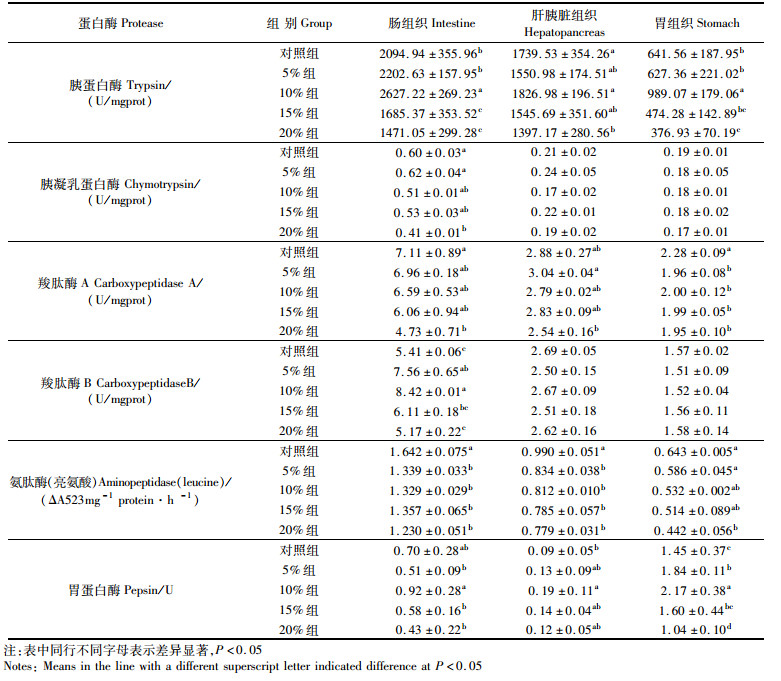
2 结果 2.1 实验开始前暗纹东方鲀胃、肠和肝胰脏组织中消化酶比活力测定由表 2可知,实验开始前暗纹东方鲀肠组织中除胃蛋白酶以外各种消化酶的比活力都比肝胰脏组织和胃组织中的高,并且差异显著(P < 0.05)。肝胰脏中羧肽酶A、胰凝乳蛋白酶的比活力与胃组织无显著性差异,胰蛋白酶、羧肽酶B、亮氨酸-氨肽酶、脂肪酶和淀粉酶的比活力显著高于胃组织(P < 0.05)。胃组织中胃蛋白酶比活力显著高于肝胰脏和肠组织(P < 0.05)。

|
表 2 暗纹东方鲀肠、肝胰脏和胃组织各种消化酶活性 Tab.2 The digestive enzyme activities in the intestine, hepatopancreas and stomach of Takifugu obscurus |
由表 3可知,胰蛋白酶比活力在组织分布上与实验开始前类似,都以肠组织的活力最高。随着玉米蛋白粉替代鱼粉量的增加肝胰脏、肠、胃组织的胰蛋白酶比活力变化显著,呈现先增加再下降的趋势,10%玉米蛋白组胰蛋白酶比活力最高。
|
表 3 玉米蛋白粉对暗纹东方鲀肠、肝胰脏和胃组织蛋白酶比活力的影响 Tab.3 The effects of corn gluten meal on protease activities in the intestine, hepatopancreas and stomach of Takifugu obscurus |
随着玉米蛋白粉使用量的增加,肝胰脏、肠、胃组织3种组织中胰凝乳蛋白酶的活力除5%组之外总体上都表现为下降的趋势(表 3)。20%组肠组织中胰凝乳蛋白酶酶活力比对照组下降了31.67%,显著低于对照组(P < 0.05)。肝胰脏组织和胃组织中胰凝乳蛋白酶比活力与玉米蛋白粉的添加量相关性不明显。
羧肽酶比活力除5%组肝胰脏中比活力有所升高外,其他都有不同程度的下降(表 3)。肠组织中20%实验组出现显著性差异(P < 0.05);肝胰脏组织中各实验组与对照组没有出现显著性差异,但5%组显著高于20%组;胃组织中各实验组羧肽酶比活力均显著小于对照组(P < 0.05)。
肠组织中玉米蛋白粉对羧肽酶B比活力影响最大,除20%组比活力比对照组下降以外,其他各实验组均高于对照组,5%组和10%分别比对照组提高了39.74%和55.64%,出现显著性差异(P < 0.05);肝胰脏组织和胃组织中羧肽酶B的比活力与对照组无显著性差异。
饲料中玉米蛋白粉添加量的增加会引起肠、和肝胰脏组织中亮氨酸-氨肽酶比活力逐渐降低(表 3),且都显著低于对照组(P < 0.05)。胃组织中,随着饲料中玉米蛋白粉添加量的增加也呈下降趋势,但只有20%实验组比活力显著低于对照组(P < 0.05)。
肠组织中胃蛋白酶比活力除10%组上升之外,其余各组均有所下降,但差异不显著(P>0.05);肝胰脏组织中胃蛋白酶比活力比各实验组均有提高,10%组显著高于对照组(P < 0.05);胃组织中5%和10%组胃蛋白酶比活力比对照组分别提高了26.89%和49.66%,显著高于对照组(P < 0.05),15%与对照组之间没有差异,而20%组胃蛋白酶比活力比对照组下降了28.27%,显著低于对照组(P < 0.05)。
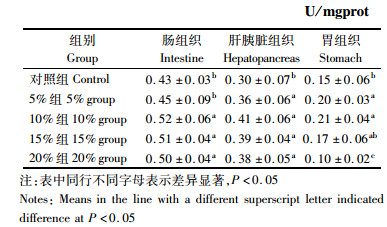
2.3 玉米蛋白粉对暗纹东方鲀淀粉酶比活力的影响由表 4可知,肠组织中淀粉酶比活力5%组与对照组没有差异,10%、15%和20%组则显著高于对照组(P < 0.05);肝胰脏组织中各实验组淀粉酶比活力均显著高于对照组(P < 0.05);胃组织中5%和10%组淀粉酶比活力分别提高了33.3%和40%,显著高于对照组(P < 0.05),15%组虽有提高,但没有显著性差异,而20%组则比对照组下降了33.3%,显著低于对照组(P < 0.05)。
|
表 4 玉米蛋白粉对暗纹东方鲀肠、肝胰脏和胃组织中淀粉酶比活力的影响 Tab.4 The effects of corn gluten meal on amylase activities in the intestine, hepatopancreas and stomach of Takifugu obscurus |
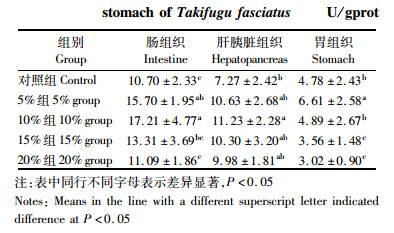
由表 5可知,玉米蛋白粉对脂肪酶比活力影响显著。肠组织中各实验组脂肪酶比活力都有提高,5%和10%组脂肪酶比活力分别比对照组提高了46.73%和60.84%,显著高于对照组(P < 0.05),15%和20%组与对照组没有显著性差异;肝胰脏组织中脂肪酶的比活力也有不同程度的提高,其中10%组比对照组提高了54.47%,显著高于对照组(P < 0.05)。胃组织中5%和10%组脂肪酶比活力比对照组高,5%组比对照组提高了38.28%,差异显著(P < 0.05),而15%和20%组分别比对照组下降了25.52%和36.82%,显著低于对照组(P < 0.05)。
|
表 5 玉米蛋白粉对暗纹东方鲀肠、肝胰脏和胃组织中脂肪酶比活力的影响 Tab.5 The effects of corn gluten meal on lipase activities in the intestine, hepatopancreas and stomach of Takifugu fasciatus |
鱼类消化器官的结构和功能是相适应的,消化酶活性的分布模式与鱼的食性、种类、消化器官的结构等密切相关,不同的消化器官有不同的消化机能,消化酶的分布会出现差异。由实验结果可知,暗纹东方鲀消化酶活性也因消化器官的不同而出现显著差异,除胃蛋白酶外, 暗纹东方鲀其他蛋白质消化酶、淀粉酶和脂肪酶的活性大小的顺序依次为肠组织>肝胰脏组织>胃组织,与肉食性鲇鱼(Silurus asotus)的消化酶分布模式相似[13],但与沈文英等[14]对澳洲宝石鱼(Scortum barcoo)、吴婷婷[15]对鳜鱼(Siniperca chuatsi)的研究结果不一致。食性相同而鱼种类不同,消化酶活性的分布模式也不同,如澳洲宝石鱼淀粉酶、蛋白酶比活力大小均为肠道>胃>肝胰脏[14],而黄颡鱼(Pelteobagrus fulvidraco )则为胃>肠>肝胰脏[16],都与本实验结果有差异,这主要是因为暗纹东方鲀的胃在组织分化过程中逐渐退化,这是鱼类消化器官结构和功能相适应的结果[17-18]。即使是同一种鱼,同一种组织的不同部位消化酶的活性也有差别,王桂芹等[19]对翘嘴红鲌(Erythroculter ilishaeformis),倪寿文等[20]对草鱼(Ctenopharyngodon idellus)、鲤(Cyprinus carpio)和鲢(Hypophthalmichthys molitrix)的研究发现在肠组织中各段消化酶的活性也存在差异。从本实验结果来看,可以推测暗纹东方鲀营养物质主要在肠组织进行消化吸收,而黄颡鱼等的蛋白质等营养物质主要在胃组织进行消化吸收[16]。
鱼类蛋白质消化酶种类较多,有胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、羧肽酶和氨肽酶等,大多数鱼类肠道蛋白酶的活性显著高于肝胰脏,主要是因为鱼类蛋白酶分泌与酶发挥消化作用的场所不一致,如胰腺分泌的无活性的酶原随消化液进入肠组织中被激活后才起作用,而且肠壁也能分泌消化酶[21],因此,消化酶在肠组织中的活性较高。胃蛋白酶是鱼胃腺分泌的无活性的胃蛋白酶原,在胃酸的激活下成为有活性的胃蛋白酶,一般有胃鱼类都有胃蛋白酶[22],河鲀鱼虽然有胃,但在组织发育过程中退化成囊状,壁薄、粘膜褶皱少,黏膜层和黏膜下层不发达[23-24],无典型的胃腺[25],因此,河鲀鱼胃中除胃蛋白酶以外其他消化酶的活性较低。
鱼类产生淀粉酶的消化器官有肝脏和肠组织。本实验结果可知暗纹东方鲀肠道组织中淀粉酶的活性显著高于肝胰脏和胃组织,说明肠道是淀粉酶分泌的主要器官,银鲫[26]、翘嘴红鲌[19]淀粉酶也是肠道分泌的。本实验暗纹东方鲀脂肪酶活性是在中性条件下测定的,以肠组织与肝胰脏中的最高,而胃组织中的脂肪酶活性相对较低,暗纹东方鲀脂肪酶可能也与鳜鱼[15]、黑鲷(Acanthopagrus schlegelii)[27]类似主要在肝脏和小肠中分泌。
3.2 玉米蛋白粉部分替代鱼粉对暗纹东方鲀蛋白酶活性的影响鱼类消化酶与饲料性质之间可以相互适应,蛋白酶活性与所摄取食物的性质主要与蛋白质的来源有重要关系,饲料蛋白源种类是影响鱼类蛋白酶活性的重要原因之一,LEE等[28]研究认为饲料中蛋白源的种类对凡纳滨对虾(Litopenaeus vannamei)蛋白酶活力的影响大于蛋白质含量所造成的影响。植物蛋白除含有抗营养因子如胰蛋白酶抑制因子[29]、皂苷[30]和植物凝聚素[31]等会影响鱼类蛋白酶的分泌。此外,氨基酸不平衡也是植物蛋白影响蛋白酶活性的主要原因之一[32]。研究认为,投喂含有大豆蛋白的饲料会引起建鲤[33]、虹鳟(Oncorhynchus mykiss)[34]肠道胰蛋白酶和凝乳蛋白酶活性下降。在大西洋蛙鱼(Salmo salar L)[35]、虹鳟[36-37]饲料中添加一定量的大豆蛋白,导致胰腺肿大、后肠产生肠黏膜炎症反应,从而使得刷状缘的碱性磷酸酶和肠肽酶的活性降低。本实验结果发现饲料中添加玉米蛋白粉对暗纹东方鲀蛋白酶活性的影响还因蛋白酶的种类而异,胰蛋白酶、羧肽酶B和胃蛋白酶随玉米蛋白粉的增加先升高再下降,胰凝乳蛋白酶、羧肽酶A和氨肽酶则随玉米蛋白粉的增加其活性呈线性下降的趋势。这可能是玉米蛋白粉替代部分鱼粉后饲料的氨基酸组成发生了变化,被暗纹东方鲀摄食后导致各种蛋白酶作用的底物浓度产生了变化,最终使得蛋白酶活性的变化出现差异。
3.3 玉米蛋白粉部分替代鱼粉对暗纹东方鲀淀粉酶活性的影响鱼类淀粉酶活性与食性有关,AGRAWAL等[38]研究了肉食性、杂食性和草食性鱼类淀粉酶的差异,认为草食性鱼类具有较强的淀粉酶的活性,肉食性鱼类最弱。饲料中植物蛋白含量增加会提高水产动物淀粉酶的活性,DAS等[39]对草鱼、李芹等[40-41]对黄颡鱼幼鱼、黄峰等[42]对斑点叉尾鮰(Ietalurus punetaus)淀粉酶活性的研究都得到了相似的结果。王重刚等[43]对真鲷(Pagrosomus major)稚鱼的研究发现淀粉酶活性与饵料中的淀粉含量呈正相关。李瑾等[44]研究认为摄食天然饵料的黄鳝(Monopterus albus)幼鱼淀粉酶活性明显低于摄食配合饲料组,王海英等[45]研究认为大菱鲆(Scophthalmus maximus)淀粉酶活力随豆粕质量分数的增多而升高。本实验随着玉米蛋白粉的用量增加淀粉酶活性都相应比对照组增强,表明暗纹东方鲀对实验组饲料有较强的适应性。
3.4 玉米蛋白粉部分替代鱼粉对暗纹东方鲀脂肪酶活性的影响TENGJAROENKUL等[46]认为一般肉食性的鱼类脂肪酶活性要高于草食性和杂食性鱼类,但吴婷婷等[15]研究认为鱼类脂肪酶活性与食性相关性不明显。脂肪酶是一种可诱导的胞外酶[22],其活性与摄食饲料的脂肪含量有关系,席峰等[47]研究发现大黄鱼(Larimichthys crocea)在发育过程中消化道内的脂肪酶活力一直处于较低水平, 推测是摄食饵料主要是脂肪含量很低的小杂鱼等鲜活饵料和部分配合饲料所致。李芹[40]认为瓦氏黄颡鱼稚鱼饲料组和驯化组的脂肪酶比活力普遍高于活饵料组, 其脂肪酶活性与饵料中的脂肪呈正相关。但也有实验证明, 饵料中的脂肪含量高的, 脂肪酶活力反而会降低, 如真鲷稚鱼[43]。本实验中随着玉米蛋白粉用量的增加脂肪酶的活性表现为先上升再下降趋势,由于实验饲料脂肪含量没有差异,因此,脂肪酶活性的差异可能是各组饲料中脂肪来源不尽相同所致,但其是否为主要原因还需要进一步证实。
4 结论本实验条件下,暗纹东方鲀消化酶的组织分布模式为肠组织>肝胰脏组织>胃组织。饲料中用玉米蛋白粉替代部分鱼粉对暗纹东方鲀消化酶的活性有显著影响,玉米蛋白粉的使用能提高暗纹东方鲀淀粉酶和脂肪酶的活性,但对蛋白酶的影响因蛋白酶的种类而异,胰蛋白酶、羧肽酶B和胃蛋白酶总体上随玉米蛋白粉的增加先升高再下降,胰凝乳蛋白酶、羧肽酶A和氨肽酶则随玉米蛋白粉的增加其活性呈线性下降的趋势。
| [1] |
钱曦, 王桂芹, 周洪琪, 等. 饲料蛋白水平及豆粕替代鱼粉比例对翘嘴红鲌消化酶活性的影响[J]. 动物营养学报, 2007, 19(2): 182-187. QIAN X, WANG G Q, ZHOU H Q, et al. Effect of dietary protein on the activities of digestive enzymes of Topmouth Culter (Erythroculter Ilishaeformis Bleeker)[J]. Chinese Journal of Animal Nutrition, 2007, 19(2): 182-187. DOI:10.3969/j.issn.1006-267X.2007.02.017 |
| [2] |
艾庆辉, 谢小军. 南方鲇的营养学研究:饲料中大豆蛋白水平对生长的影响[J]. 水生生物学报, 2002, 26(1): 57-65. AI Q H, XIE X J. The nutrition of Silurus meridionalis: effects of different levels of dietary soybean protein on growth[J]. Acta Hydrobiologica Sinica, 2002, 26(1): 57-65. |
| [3] |
SULLIVAN J A, REIGH R C. Apparent digestibility of selected feedstuffs in diets for hybrid striped bass (Morone saxatilis♀×Morone chrysops ♂)[J]. Aquaculture, 1995, 138(1/4): 313-322. |
| [4] |
苏时萍, 施培松, 杨启超, 等. 饲料蛋白质水平对克氏原螯虾幼体消化酶活性和肌肉成分的影响[J]. 安徽农业大学学报, 2009, 36(2): 231-235. SU S P, SHI P S, YANG Q C, et al. Effects of dietary protein levels on the activities of digestive enzymes and the muscle compositon of juvenile red swamp crayfish Procambarus clarkii Girard[J]. Journal of Anhui Agricultural University, 2009, 36(2): 231-235. |
| [5] |
孙盛明, 叶金云, 陈建明, 等. 配合饲料中豆粕、菜粕替代鱼粉对青鱼消化酶活力和表观消化率的影响[J]. 浙江海洋学院学报(自然科学版), 2008, 27(4): 395-400. SUN S M, YE J Y, CHEN J M, et al. Effects of fishmeal replacement by mixture of soybean meal and rapeseed meal on digestive enzyme activities and apparent digestibility of the Black Carp (Mylopharyngodon piceus)[J]. Journal of Zhejiang Ocean University (Natural Science), 2008, 27(4): 395-400. |
| [6] |
冯琳, 杨义, 周小秋, 等. 酶解植物蛋白对建鲤生长、肝胰脏和肠道发育及消化酶活性的影响[J]. 水产学报, 2008, 32(4): 608-613. FENG L, YANG Y, ZHOU X Q, et al. Effects of vegetable protein enzymatic hydrolysates on growth, hepatopancreas and intestine development, digestive enzymes of Jian carp (Cyprinus carpio Var. Jian)[J]. Journal of Fisheries of China, 2008, 32(4): 608-613. |
| [7] |
陈然, 华雪铭, 黄旭雄, 等. 玉米蛋白粉替代鱼粉对异育银鲫生长蛋白酶活性及表观消化率的影响[J]. 上海交通大学学报(农业科学版), 2009, 27(4): 358-362, 367. CHEN R, HUA X M, HUANG X X, et al. Effects of replacement of fish meal by corn gluten meal in diets on growth, protease activities and apparent digestibilities of Allogynogenetic Silver Crucian carp[J]. Journal of Shanghai Jiaotong University (Agricultural Science), 2009, 27(4): 358-362, 367. |
| [8] |
KUMULU M, JONES D A. The effect of live and artificial diets on growth, survival, and trypsin activity in larvae of Penaeus indicus[J]. Journal of the World Aquaculture Society, 1995, 26(4): 406-415. DOI:10.1111/jwas.1995.26.issue-4 |
| [9] |
施特尔马赫.酶的测定方法[M].钱嘉渊, 译.北京: 中国轻工业出版社, 1992: 122-123. STELLMACH B. Bestimmungsmethoden enzyme[M]. QIAN J Y, trans. Beijing: China Light Industry Press, 1992: 122-133. |
| [10] |
CARCIA-CARRENO F, HERNANDEZ-COTES M P, HAARD N F. Enzymes with peptidase and proteinase activity from the digestive systems of a freshwater and a marine decapod[J]. Journal of Agricultural and Food Chemistry, 1994, 42(7): 1456-1461. DOI:10.1021/jf00043a013 |
| [11] |
MAROUX S, LOUVARD D, BARATH J. The aminopeptidase from hog intestinal brush border[J]. Biochimica et Biophysica Acta (BBA)-Enzymology, 1973, 321(1): 282-295. DOI:10.1016/0005-2744(73)90083-1 |
| [12] |
KOTZAMANIS Y P, GISBERT E, GATESOUPE F J, et al. Effects of different dietary levels of fish protein hydrolysates on growth, digestive enzymes, gut microbiota, and resistance to Vibrio anguillarum in European sea bass (Dicentrarchus labrax) larvae[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 2007, 147: 205-214. |
| [13] |
向枭, 叶元土, 周兴华, 等. 鲇消化性能的研究[J]. 饲料工业, 2005, 26(20): 24-27. XIANG X, YE Y T, ZHOU X H, et al. Study of digestive function for Silurus asotuslinnaeus[J]. Feed Industry, 2005, 26(20): 24-27. |
| [14] |
沈文英, 祝尧荣, 钱科亮, 等. 澳洲宝石鱼营养成分和消化酶活性的研究[J]. 水产科学, 2005, 24(5): 23-25. SHEN W Y, ZHU Y R, QIAN K L, et al. Approximate compositions and activities of digestive enzymes in Jade Perch (Scortum barcoo)from Australia[J]. Fisheries Science, 2005, 24(5): 23-25. |
| [15] |
吴婷婷, 朱晓明. 鳜鱼、青鱼、草鱼、鲤、鲫、鲢消化酶活性的研究[J]. 中国水产科学, 1994, 1(2): 10-17. WU T T, ZHU X M. Studies on the activity of digestive enzymes in mandarin fish, black carp, grass carp, common carp, crucian carp and silver carp[J]. Journal of Fishery Sciences of China, 1994, 1(2): 10-17. |
| [16] |
周兴华, 向枭, 叶元土. 三种名优鱼类消化酶活性的比较[J]. 广东饲料, 2003, 12(6): 19-21. ZHOU X H, XIANG X, YE Y T. Compare of digestive enzyme's activity of three famous kinds of fishes[J]. Guangdong Feed, 2003, 12(6): 19-21. |
| [17] |
陈舒泛, 任亚兰, 华元渝. 暗纹东方鲀仔鱼期消化系统的组织学研究[J]. 水利渔业, 2004, 26(6): 11-13. CHEN S F, REN Y L, HUA Y Y. The histologic study about the digestive system in the larvae of Takifugu obscurus[J]. Reservoir Fisheries, 2004, 26(6): 11-13. |
| [18] |
顾曙余, 蔡原. 暗纹东方鲀幼鱼消化道的形态学和组织学研究[J]. 水利渔业, 2007, 27(6): 12-14. GU S Y, CAI Y. Studies on the morphology and histology of the alimentary tract of the young Takifugu obscurus[J]. Reservoir Fisheries, 2007, 27(6): 12-14. |
| [19] |
王桂芹, 周洪琪, 杨建光, 等. 翘嘴鲌消化酶特性的研究[J]. 吉林农业大学学报, 2006, 28(2): 213-216, 221. WANG G Q, ZHOU H Q, YANG J G, et al. Study on digestive enzyme activity of Culter alburnus Juveniles[J]. Journal of Jilin Agricultural University, 2006, 28(2): 213-216, 221. |
| [20] |
倪寿文, 桂元明, 刘焕亮. 草鱼、鲤、鲢、鳙和尼罗罗非鱼肝胰脏和肠道蛋白酶活性的初步探讨[J]. 动物学报, 1993, 39(2): 160-168. NI S W, GUA Y M, LIU H L. Investigation on the comparison of protease activities in grass carp, common carp, silver carp, big head carp and tilapia nilotica[J]. Acta Zoologica Sinica, 1993, 39(2): 160-168. |
| [21] |
周景祥, 张东明, 黄权, 等. 大眼鰤鲈蛋白酶活性的研究[J]. 吉林农业大学学报, 2000, 22(3): 107-110. ZHOU J X, ZHANG D M, HUANG Q. Protease activites in digestive organs of walleye[J]. Journal of Jilin Agricultural University, 2000, 22(3): 107-110. |
| [22] |
尾崎九雄.鱼类消化生理(上、下册)[M].吴尚忠, 译.上海: 上海科学技术出版社, 1983: 45-56. OZAKI K X. Digestive physiology of fish[M]. WU S Z, trans. Shanghai: Shanghai Science and Technology Press, 1983: 45-56. |
| [23] |
WAN Z Z, GAO T X, ZHANG X M, et al. Histological study on the digestive system development of Takifugu rubripes Larvae and Juvenile[J]. Journal of Ocean University of China, 2006, 5(1): 39-44. DOI:10.1007/BF02919371 |
| [24] |
陈舒泛, 任亚兰, 华元渝. 暗纹东方鲀仔鱼期消化系统的组织学研究[J]. 水利渔业, 2004, 24(6): 11-13. CHEN S F, REN Y L, HUA Y Y. Histological study on the digestive system development of Fugu obscurus Juvenile[J]. Reservoir Fisheries, 2004, 24(6): 11-13. |
| [25] |
丛娇日, 张朝晖, 姚善成. 红鳍东方鲀幼鱼消化道的组织学和形态学研究[J]. 论文研究, 1998(4): 53-58. CONG J R, ZHANG Z H, YAO S C. A study of the histology and morphology of the digestive tract of the juvenile globe fish, Fugu rubripes[J]. Article, 1998(4): 53-58. |
| [26] |
沈文英, 寿建昕, 金叶飞, 等. 银鲫消化酶的研究[J]. 上海水产大学学报, 2002, 11(3): 193-198. SHEN W Y, SHOU J X, JIN Y F, et al. Study on digestive enzymes of Carassius auratus glibelio[J]. Journal of Shanghai Fisheries University, 2002, 11(3): 193-198. |
| [27] |
马燕梅, 梅景良, 林树根, 等. 黑鲷消化酶活性的初步研究[J]. 福建农林大学学报(自然科学版), 2004, 33(2): 219-222. MA Y M, MEI J L, LIN S G, et al. Preliminary study on the activities of digestive enzymes in black seabream, Sparus macrocep[J]. Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2004, 33(2): 219-222. |
| [28] |
LEE P G, SMITH L L, LAWRENCE A L. Digestive proteases of Penaeus vannamei Boone: relationship between enzyme activity, size and diet[J]. Aquaculture, 1984, 42(3/4): 225-239. |
| [29] |
KROGDAHI A, BERG T, OLLI J J. Soybean proteinase inhibitors affect intestinal trypsin activities and amino acid digestibilities in rainbow trout (Oncorhynchus mykiss)[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1994, 107(1): 215-219. DOI:10.1016/0300-9629(94)90296-8 |
| [30] |
BUREAU D P, HARRIS A M, CHO C Y. The effects of purified alcohol extracts from soy products on feed intake and growth of Chinook salmon (Oncorhynchus tshawytscha) and rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1998, 161(1/4): 27-43. |
| [31] |
BUTTLE L G, BURRELLS A C, GOOD J E, et al. the binding of soybean agglutinin (SBA) to the intestinal epithelium of Atlantic salmon, Salmo salar and rainbow trout, Oncorhynchus mykiss, fed high levels of soybean meal[J]. Veterinary Immunology and Immunopathology, 2001, 80(3/4): 237-244. |
| [32] |
向枭, 周兴华, 陈建, 等. 动植物蛋白比对鲤鱼消化酶活性的影响[J]. 粮食与饲料工业, 2008(7): 37-39. XIANG X, ZHOU X H, CHEN J, et al. Effects of animal and vegetable protein ratio on activity of digestive enzymes in common carp[J]. Cereal & Feed Industry, 2008(7): 37-39. |
| [33] |
姜光丽, 周小秋. 大豆分离蛋白对幼建鲤肝胰脏发育及消化道蛋白酶活力的影响[J]. 大连水产学院学报, 2005, 20(3): 198-202. JIANG G L, ZHOU X Q. The effects of soybean protein isolate on hepatopancreas weight and intestinal proteinase activity of juvenile Jian carp (Cyprinus carpio Var. Jian)[J]. Journal of Dalian Fisheries University, 2005, 20(3): 198-202. |
| [34] |
DIMES L E, GARCIA-CARRENO F L, HAARD N F. Esti-mation of protein digestibility-Ⅲ: Studies on the digestive enzymes from the pyloric ceca of rainbow trout and salmon[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1994, 109(2): 349-360. DOI:10.1016/0300-9629(94)90138-4 |
| [35] |
KROGDAHL A M, BAKKE-MCKELLEP A M, BAEVERFJORD G. Effects of graded levels of standard soybean meal on intestinal structure, mucosal enzyme activities, and pancreatic response in Atlantic salmon (Salmos alar L.)[J]. Aquaculture Nutrition, 2003, 9(6): 361-371. DOI:10.1046/j.1365-2095.2003.00264.x |
| [36] |
BURRELLS C, WILLIAMS P D, SOUTHGATE P J, et al. Immunological, Physiological and pathological responses of rainbow trout (Oncorhynchus mykiss) to increasing dietary concentrations of soybean proteins[J]. Veterinary Immunology and Immunopathology, 1999, 72(3/4): 277-288. |
| [37] |
GRISDALE-HELLAND B, HELLAND S J, BAEVERFJORD G, et al. Full-fat soybean meal in diets for Atlantic halibut: growth, metabolism and intestinal histology[J]. Aquaculture Nutrition, 2002, 8(4): 265-270. DOI:10.1046/j.1365-2095.2002.00216.x |
| [38] |
AGRAWAL V P, SASTRY K V, KAUSHAB S K S. Digestive enzymes of three teleost fish[J]. Acta Physiologica Academiae Scientiarum Hungaricae, 1975, 46(2): 93-98. |
| [39] |
DAS K M, TRIPATHI S D. Studies on the digestive enzymes of grass carp, Ctenopharyngodon idella (Val.)[J]. Aquaculture, 1991, 92: 21-32. DOI:10.1016/0044-8486(91)90005-R |
| [40] |
李芹.瓦氏黄颡鱼消化系统发育的研究[D].重庆: 西南农业大学, 2005. LI Q. Study on digestive system development of Pelteobagrus vachelli[D]. Chongqing: Southwest Agricultural University, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10625-2005089877.htm |
| [41] |
李芹, 刁晓明. 不同饵料对瓦氏黄颡鱼稚鱼生长和消化酶活性的影响[J]. 水生态学杂志, 2009, 2(1): 98-102. LI Q, DIAO X M. Growth and digestive enzyme activities of Pelteobagrus vachelli juvenile fed on different diets[J]. Journal of Hydroecology, 2009, 2(1): 98-102. |
| [42] |
黄峰, 李惠, 刘军, 等. 发酵豆粕替代鱼粉对斑点叉尾鮰消化酶活性的影响[J]. 水利渔业, 2008, 28(4): 38-40. HUANG F, LI H, LIU J, et al. Effects of replacement of fish meal by fermented soybean meal on catfish digestive enzymes[J]. Reservoir Fisheries, 2008, 28(4): 38-40. |
| [43] |
王重刚, 陈品健, 顾勇, 等. 不同饵料对真鲷稚鱼消化酶活性的影响[J]. 海洋学报, 1998, 20(4): 103-106. WANG C G, CHEN P J, GU Y, et al. Effect of different diets on digestive enzymes activity of Pagrosomus major juvenile[J]. Acta Oceanologica Sinica, 1998, 20(4): 103-106. |
| [44] |
李瑾, 何瑞国, 张世萍, 等. 不同饵料对幼鳝消化系统内淀粉酶活性的影响[J]. 饲料工业, 2002, 23(12): 48-50. LI J, HE R G, ZHANG S P, et al. The effect of different feed on the amylase activity in the digestive system of young zuiew[J]. Feed Industry, 2002, 23(12): 48-50. |
| [45] |
王海英, 孙谧, 薛长湖, 等. 大菱鲆配合饲料中植物蛋白替代鱼粉的可行性研究[J]. 海洋科学, 2008, 32(6): 9-12. WANG H Y, SUN M, XUE C H, et al. The feasibility of partial or total replacement of fish meal by soybean meal in diet for turbot[J]. Marine Sciences, 2008, 32(6): 9-12. |
| [46] |
TENGJAROENKUL B, SMITH B J, CACECI T, et al. Dis-tribution of intestinal enzyme activities along the intestinal tract of cultured Nile tilapia, Oreochromis niloticus L.[J]. Aquaculture, 2000, 82(3/4): 317-327. |
| [47] |
席峰, 林利民, 王志勇. 大黄鱼发育进程中消化酶的活力变化[J]. 中国水产科学, 2003, 10(4): 301-304. XI F, LIN L M, WANG Z Y. Activities of digestive enzymes during development period in Pseudosciaena crocea[J]. Journal of Fishery Sciences of China, 2003, 10(4): 301-304. |
2. Centre for Research on Environmental Ecology and Fish Nutrition of the Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. Shanghai Engineering Research Center of Aquaculture, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


