2. 上海海洋大学 上海高校水域环境生态工程研究中心, 上海 201306
海三棱藨草(Scirpus mariqueter)是长三角区域一种重要的本土湿地植物,广泛分布于上海东南部海滨和崇明、长兴、横沙等几大岛屿的中潮滩,是长江口滨岸带主要的植物群落类型[1]。海三棱藨草具有耐盐、耐厌氧环境的特点,是长三角滨海区域重要的先锋植物群落[2]。21世纪以来,上海市加大了围垦工程力度,围垦改变了生态系统的自然发展模式,加快了海岸线自然环境的沉积速度。泥沙淤积使海三棱藨草球茎处于深埋状态,而适宜较高高程潮滩的芦苇占据竞争优势并形成芦苇群落,挤压海三棱藨草向低高程潮滩展开[2],而在低潮滩,海三棱藨草生态位与外来入侵种互花米草(Spatina alterniflora)的生态位发生重叠和竞争排斥,使海三棱藨草的面积进一步加速缩减[3]。
目前国内外对海三棱藨草的研究大多在种子重建、碳氮影响及潮汐作用上[4-6],对土壤微生物的微观作用研究较少,而土壤微生物几乎参与土壤中一切生物化学反应,在有机质分解与养分循环等过程中发挥着关键作用。在某一特定地理区域内,生活在同一环境下的不同微生物种群在组成、结构、功能方面均表现出较大的差异[7]。另外,国内外研究认为季节变化对土壤微生物群落结构和多样性有显著影响,而微生物生物量的季节波动受植被生长和土壤有机质的影响[8-10],海三棱藨草的生长也随着季节变化,从春天开始萌发,夏季旺盛生长,到秋季开花结果,冬季死亡腐烂,整个生长周期根际土壤环境发生改变,从而影响微生物的代谢活性。因此土壤微生物的多样性与植物生长有着密切的关系。
高通量测序已广泛应用于土壤微生物多样性的研究[11-14],该测序技术相对于传统的多样性研究方法,具有测序通量高,实验过程简化,速度快,准确率高等极大的优势,实验结果更能全面地反映环境中群落的特点[15]。目前使用较多的是Illumina公司于2011年新开发的第二代测序平台MiSeq测序,主要原理是通过将提取的目标基因组DNA剪切成片段,然后将这些DNA片段结合到固相表面,进行单分子的PCR扩增,得到测序数据,进行计算机分析对比获得完整的DNA序列信息[16]。本文运用高通量测序技术分析海三棱藨草密集区与光滩区土壤微生物的群落特征和季节变化规律,结合环境因子与微生物群落组成的相互关系,以期找出海三棱藨草土壤微生物群落结构的影响因素,从而为海三棱藨草群落的快速修复提供理论依据。
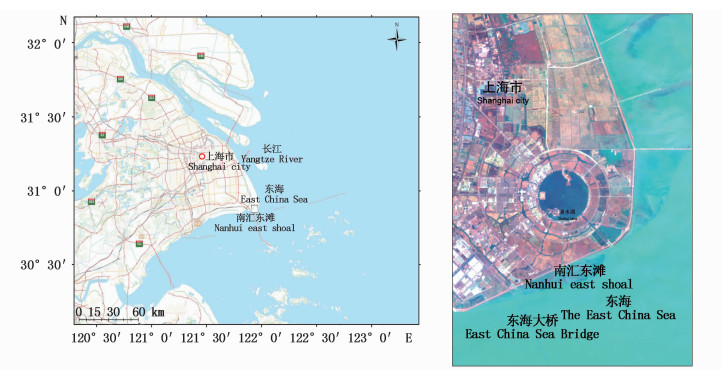
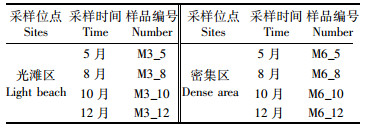
1 材料与方法 1.1 样品采集及处理研究区域位于上海浦东新区南汇嘴围垦区滩涂湿地,30°51′-30°52′N和122°55′-122°56′E的范围内(图 1)。10月份海三棱藨草生物量达到最大值[17],因此于2015年9月至10月进行第一次采样,根据该研究结果[18],从藨草生长初期开始,每个季度进行1次采样[19],分别于2016年5月(春季)、8月(夏季)、10月(秋季)、12月(冬季)采集藨草茂盛区及光滩区的土壤样品,每个采样地采用5点取样法随机取样[20],用铁锹采集20 cm × 20 cm样方中0~20 cm深度的土样,混合后装袋,每个样地3个重复,共24个样品,将采集的样品放入无菌袋,做好标记(表 1),带回实验室。将样品分出1份放在-80℃冰箱保存,1份送到美吉生物公司进行测序,其余样品测干湿比后放于室内自然风干,过100目筛,放入密封袋做好标记,测试理化性质。
|
图 1 研究区地理位置及遥感图像
Fig. 1 Site of the study area
|
|
表 1 样品编号 Tab.1 Sample number |
完成基因组DNA抽提后,利用1%琼脂糖凝胶电泳检测抽提的基因组DNA。PCR扩增采用TransGen AP221-02:TransStartFastpfu DNA Polymerase;20 μL反应体系:PCR仪为ABI GeneAmp® 9700型;每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM -ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。Miseq文库构建,Miseq测序。以上实验均由商业测序公司完成(美吉生物,上海)。
1.3 环境因子分析方法新鲜的土壤样品带回实验室后,取一小烧杯(100 mL)土样称重,放在100 ℃烘箱里完全烘干,测量其含水率;剩余部分土样置于室内自然风干,研磨后过100目筛装入塑封袋,做好标记,放入冰箱冷藏室待测其理化性质。根据陶燕东[18]的研究结果,影响海三棱藨草群落空间分布的主要土壤理化因子有:总氮、总磷、电导率、硝酸盐氮、含水率。采用凯氏定氮法测定土壤总氮,碱熔-钼锑抗分光光度计法测定总磷含量,硝酸盐氮、亚硝酸盐氮采用氯化钾浸出液-分光光度计法进行测定,分光光度计型号为UV-1800(岛津公司)。采用便携式多参数水质测定仪测定水土比5:1的土壤浸出液的电导率[21]。
1.4 数据分析MiSeq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,用Flash软件将成对的reads拼接(merge)成1条序列,同时用Trimmomatic软件对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向,即为优化数据;用Usearch(vesion 7.0)软件对优化序列提取非重复序列,按照97%相似性对非重复序列进行OTU聚类,生成OTU表格;采用Qiime软件根据RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析;利用mothur计算不同随机抽样下的多样性指数,用Chao指数和ACE指数表示物种丰度,用Simpson和Shannon指数表示物种多样性[15],用R语言对多样性指数进行student’s T检验,用R语言vegan包中RDA对环境因子、样本、菌群两两之间的关系进行分析和作图。
2 结果与分析 2.1 OTU聚类及注释结果通过Miseq高通量测序并优化后,6个样地共获得2 669 658条序列,总碱基数1 056 068 304 bp,优化序列长度主要集中在381~400 bp之间,平均碱基长度为395.58 bp。由于序列长度是将序列匹配到数据库从而产生基因注释的关键,因此根据这些优质序列分析得到的物种多样性结果科学、真实,具有重要的参考价值[22]。
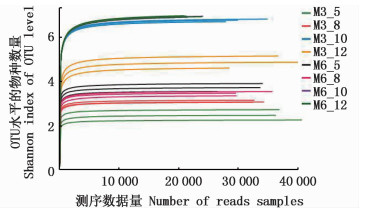
Shannon-Wiener指数是反映样本中微生物多样性的指数,利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性[23]。从图 2可以看出Shannon曲线趋向平坦,说明测序数据量足够大,可以反映样本中绝大多数的微生物信息,其微生物群落具有丰富的多样性。
|
图 2 不同土壤样本中的微生物Shannon曲线
Fig. 2 Shannon curves of different soil samples
|
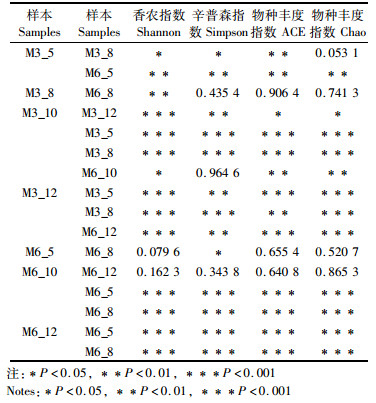
综合样本Alpha多样性指数(表 2),可以判断出藨草密集区物种群落丰富度和多样性远高于光滩区(M6 >M3)。Shannon值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低[24-26],两个样本春季和夏季的Shannon指数均小于秋季和冬季的Shannon指数,春季和夏季的Simpson指数均大于秋季和冬季的Simpson指数,说明样本多样性有季节的变化。T检验表明,同一地点不同季节物种丰富度和多样性均有显著性差异(P < 0.01, 表 3)。国内外研究认为,微生物生物量和多样性受季节变化影响显著[26],不同季节温度、湿度及降水量均有所不同,春季气温低,湿度低,抑制了微生物的生长,代谢活性减弱,微生物丰富度和多样性较低;夏秋两季适宜的温度和湿度为微生物提供了良好的代谢环境;冬季植物腐烂,有机质增加,有助于微生物的生长和繁殖。春夏两季微生物多样性和丰富度始终低于秋冬两季,可能是由于春夏季植物生长吸收了土壤中大量的碳,微生物可利用的有机质减少,植物摄取与微生物之间发生了竞争[13]。T检验显示,藨草密集区与光滩区同一季节物种多样性及丰富度也有显著差异(P < 0.01)。藨草密集区植物茂盛,根系发达,退潮后留存大量浮游动物和无脊椎生物,这些生物在藨草根际土壤中觅食、繁殖、代谢[27],根际土壤微生物活动频繁,数量增多,物种丰富度和多样性较高。

|
表 2 不同土壤样品中微生物的多样性指数表 Tab.2 Alpha Index of microbial of different soil samples |
|
表 3 样本间土壤微生物多样性指数差异T检验(同一季节不同地点) Tab.3 T test of soil microbial diversity index between samples (Same season at different sites) |
综合分析4组多样性指数所提供的物种丰富度与物种多样性信息表明,秋季和冬季样本中微生物群落丰富度较大,群落多样性较高;而不同区域样本丰富度和多样性有明显差异,样本季节性变化显著。
2.3 物种群落结构分析对不同季节各样本中微生物的物种种类进行鉴定后,做多样品物种分布图(门水平),图中每种颜色区域表示一类物种(门水平),而该颜色区域的面积大小表示该物种在整个物种中的相对百分比。从图 3可以看出,24个样本中共存的物种主要包括Proteobacteria(变形菌门)、Bacteroidetes(拟杆菌门)、Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Planctomycetes(浮霉菌门)、Actinobacteria(放线菌门)、Cyanobacteria(蓝藻菌门)、Gemmatimonadetes(牙单胞菌门)、Nitrospirae(硝化螺旋菌门)、Bacteria_unclassified(未分类的细菌)、Ignavibacteriae、Firmicutes(厚壁菌门)、Latescibacteria、Verrucomicrobia(疣微菌门)、Spirochaetae(螺旋菌门)、Deferribacteres(脱铁杆菌门)等,其中丰度最高的是Proteobacteria(变形菌门),其次是Bacteroidetes(拟杆菌门),这2种菌门在各样本中合计占比高于40%,在春季和夏季合计占比达到80%以上,随后是Acidobacteria(酸杆菌门)、Chloroflexi(绿弯菌门)、Planctomycetes(浮霉菌门)、Actinobacteria(放线菌门)、Cyanobacteria(蓝藻菌门),在秋季和冬季的处理样本中合计占比约40%。

|
图 3 不同季节各样本物种分布(门水平)
Fig. 3 Species distribution in different seasons of the samples (phylum)
|
对不同季节样本中占比较高的菌门进行分析(图 4),可以看出,不同样本的物种组成基本一致,各季节不同样本物种百分比变化趋势有所不同。变形菌门在各样本中占比变化趋势基本一致,随着季节先升高后降低,但一直远高于其他菌门占比,夏季时,变形菌门占比上升到最大值,大约占物种数量的70%,秋季处于最低值,也有30%左右的占比;拟杆菌门的占比随季节变化逐渐降低,且降幅较大,由春季的25%~45%降至冬季的1%~7%。变形菌门是海洋环境和海洋沉积物中的主要类群,拟杆菌门是各种水体环境碳循环的主要参与者,因此在各样本中普遍存在且数量较高[28]。各样本中的酸杆菌门、绿弯菌门、浮霉菌门、放线菌门和蓝藻菌门在秋季和冬季迅速升高,合计占比达到40%;光滩区(M3)样本中蓝藻菌门一直处于含量很低的状态(0.05%~0.3%),藨草密集区(M6)样本中的蓝藻菌门在秋季增势明显,从春季的0.06%迅速增至秋季的8.5%。春季和夏季雨水充沛,湿度较大,温度较高,土壤氧气含量较少,变形菌门是兼性或严格厌氧菌,菌种数量远高于好氧菌,秋季气候干燥,海三棱藨草长出球茎被湿地水鸟翻捡食用[29],冬季凋零腐烂的植物碎屑被根际的浮游动物和底栖无脊椎动物食用[17],这些频繁的生物活动使土壤孔隙变大,氧气充分,各种好氧菌含量迅速增长。

|
图 4 不同季节样本优势菌柱状图
Fig. 4 Histogram of dominant bacteria in different seasons
|
选用R语言vegan包中RDA(Redundancy Analysis)或者CCA(Canonical Correlation Analysis)分析菌群与环境因子之间关系。RDA是基于线性模型,CCA是基于单峰模型。分析可以检测环境因子、样本、菌群三者间的关系或者两两之间的关系。RDA或CCA模型的选择原则:先用species-sample数据(97%相似性的样本OTU表)做DCA分析,看分析结果中Lengths of gradient第一轴的大小,如果大于4.0,就应该选CCA,如果3.0~4.0之间,选RDA和CCA均可,如果小于3.0,RDA的结果要好于CCA。这里软件分析选择了CCA。
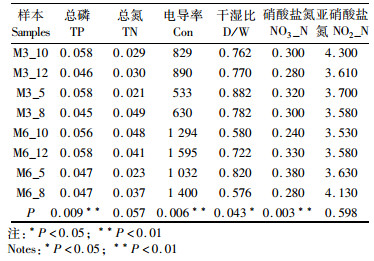
图 5表示土壤样本群落结构(OTU组成)与环境因子的冗余分析,样本点的空间距离表示样本间群落结构的距离,样本点到环境因子向量的投影距离表示样本受该环境因子的影响程度,排序轴中心点到箭头的距离越长表示该环境因子的影响越大,环境因子之间的夹角表明环境因子之间的相关性[30]。结合图 5和表 5可以看出,影响样品OTU组成的环境因子主要是总磷、电导率、干湿比和硝态氮。电导率与样品物种组成显著相关(P < 0.01),说明电导率是影响藨草根际土壤微生物群落结构的主要因素。有研究表明土壤溶液电导率与含盐量在一定浓度范围内呈正相关[31],也就是说土壤盐分含量越高[12],电导率越大,根据这种关系,国内外研究中通常用溶液电导率大小来间接测定土壤的含盐量,在此基础上,本文利用电导率来表征土壤盐分的空间差异。电导率与微生物多样性显著相关可能是因为电导率表征的盐分对微生物细胞的影响较大,国内外的一些研究也证明对于盐沼植物来说,其分布规律与土壤盐分密切相关,盐分决定了其根系细胞的渗透压,影响种子的萌发、光合作用等生理过程[32]。陈秀芝研究结果也表明海三棱藨草的生长分布随着土壤盐分浓度的增加而增加[22]。其耐盐度范围也是一定的,当盐度达到1.6%,海三棱藨草趋于死亡[33]。在微生物生长过程中,土壤盐分决定其细胞渗透压,盐分过低,微生物细胞外部含水量大,细胞吸水过多破裂死亡,相反,盐分过高,微生物细胞失水死亡。这也就是沿海滩涂微生物实验室研究通常选用氯化钾溶液进行培养的原因。

|
图 5 土壤样品OTU组成与环境因子的冗余分析
Fig. 5 Redundancy analysis of OTU composition and environmental factors in soil samples
Con. conductivity,电导率;TN. Total nitrogen,总氮;TP. Total phosphorus,总磷;D/W. dry/wet,干湿比 |

|
表 4 冗余分析的累积解释率 Tab.4 Proportion of variance of redundant analysis |
|
表 5 样品土壤理化因子(均值)及T检验 Tab.5 Physical and chemical factors (mean) and T test in soil samples |
干湿比和硝态氮与样品物种组成也表现出显著相关性(P < 0.01),这可能跟潮水的冲刷作用有关,藨草密集区植物茂盛,根系发达,潮水冲刷的作用力被消弱,泥沙沉积明显,土壤表层颗粒组成及地上植被的生长改善了土壤的表层结构,增加了土壤持水和保肥能力,潮湿的环境为微生物的生长繁殖和分解植物碎屑提供了良好的条件[34],湿度对于碳、氮元素的损失或积累同样有着十分重要的作用,微生物活动活跃,则有利于其对氮的固定,而硝态氮等养分则能有效促进湿地植物的生长[35]。王江等研究表明土壤硝态氮影响微生物多样性[36],薛萐等[37]的研究土壤硝态氮属于土壤微生物生物量的主要影响因素,土壤含水量和硝态氮是微生物生物量的主要决定因素[19]。
综合以上结果可知,影响海三棱藨草根际土壤微生物的主要环境因子有土壤盐分、含水率及硝态氮,根据陶燕东[18]的研究结果显示,这些因素同样也是影响海三棱藨草群落分布的主要环境因子。由此可以得知,土壤盐分、含水率及硝态氮共同作用于海三棱藨草及其根际土壤微生物,海三棱藨草和微生物之间相互作用,共同促进,形成稳定的生长和代谢环境。物种多样性分析显示,海三棱藨草密集区土壤微生物多样性及丰富度均明显高于光滩区,且同一样本微生物群落结构组成季节性差异较大;物种群落结构分析显示,样本微生物优势菌群季节变化明显,在两个区域样本微生物菌群数量差异较大的秋冬季,蓝藻菌门差异变化最大,后续实验我们可以根据各季节环境因子影响程度的不同,结合该季节主要微生物,配比合适的盐度、含水率和pH,制定出各季节海三棱藨草最优的培养条件,为湿地植被的修复提供理论依据。
因此,如何采取人工干预的手段,干预潮滩微地形的沉积过程,从而促进海三棱藨草湿地的快速修复,是值得深思的重点课题。本研究表明,土壤微生物在海三棱藨草湿地的修复过程中具有显著的空间分异,藨草湿地修复过程中的土壤生理生化微观机制动态是藨草湿地修复机理研究的下一步重要方向。
3 结论围垦后的南汇东滩湿地生态系统逐渐恢复,海三棱藨草从无到有,从稀疏到密集,滩涂土壤微生物群落特征的变化是评价影响海三棱藨草生长分布的重要特征。
在本研究中发现,24个样本中共存在15种细菌门分类,其中变形菌门、拟杆菌门、酸杆菌门、绿弯菌门、浮霉菌门、放线菌门、蓝藻菌门、牙单胞菌门、硝化螺旋菌门为24个样本中的主要菌门,而这9个菌门在2个样本4个季度中相对丰度存在显著性差异,样本优势菌季节性变化明显,在藨草生长茂盛期的秋季微生物数量迅速增长,在藨草凋落腐烂的冬季达到最高值。
多样性分析ACE指数表明样品微生物群落多样性为:藨草密集区>光滩区,Chao指数表明各样地细菌的物种总数为:藨草密集区>光滩区,两区域样本之间物种丰富度差异显著。根据Shannon指数和Simpson指数,可以看出各样地细菌群落的多样性为:藨草密集区>光滩区,且微生物多样性差异显著(P < 0.001)。同一样本的物种多样性及丰富度季节变化显著(P < 0.001),春夏2季与秋冬2季差异显著(P < 0.001)。
RDA冗余分析表明,样品微生物群落结构与土壤盐分、干湿比、硝态氮显著相关(P < 0.01), 其中土壤盐分和硝态氮与土壤样品群落结构呈显著正相关,干湿比与土壤样品群落结构呈显著负相关。
| [1] |
陈家宽. 上海九段沙湿地自然保护区科学考察集[M]. 北京: 科学出版社, 2003. CHEN J K. Scientific expedition of the Jiuduansha wetland nature reserve of Shanghai[M]. Beijing: Science Press, 2003. |
| [2] |
张利权, 雍学葵. 海三棱藨草种群的物候与分布格局研究[J]. 植物生态学与地植物学学报, 1992, 16(1): 43-51. ZHANG L Q, YONG X K. Studies on phenology and spatial distribution pattern of Scirpus mariqueter population[J]. Chinese Journal of Plant Ecology, 1992, 16(1): 43-51. |
| [3] |
黄华梅, 张利权, 袁琳. 崇明东滩自然保护区盐沼植被的时空动态[J]. 生态学报, 2007, 27(10): 4166-4172. HUANG H M, ZHANG L Q, YUAN L. The spatio-temporal dynamics of salt marsh vegetation for Chongming Dongtan National Nature Reserve, Shanghai[J]. Acta Ecologica Sinica, 2007, 27(10): 4166-4172. DOI:10.3321/j.issn:1000-0933.2007.10.025 |
| [4] |
张骞, 李秀珍, 张运清, 等. 长江口湿地氮施加对海三棱蔗草生长及生理特性的影响[J]. 草地学报, 2017, 25(1): 115-121. ZHANG Q, LI X Z, ZHANG Y Q, et al. Effects of nitrogen addition on growth and physiological characters of Scirpus mariqueter in the Yangtze river estuary[J]. Acta Agrestia Sinica, 2017, 25(1): 115-121. |
| [5] |
曹浩冰, 葛振鸣, 祝振昌, 等. 崇明东滩盐沼植被扩散格局及其形成机制[J]. 生态学报, 2014, 34(14): 3944-3952. CAO H B, GE Z M, ZHU Z C, et al. The expansion pattern of saltmarshes at Chongming Dongtan and its underlying mechanism[J]. Acta Ecologica Sinica, 2014, 34(14): 3944-3952. |
| [6] |
CHEN H, WANG D Q, CHEN Z K, et al. The variation of sediments organic carbon content in Chongming east tidal flat during Scirpus mariqueter growing stage[J]. Journal of Geographical Sciences, 2005, 15(4): 500-508. DOI:10.1007/BF02892158 |
| [7] |
BÖHME L, LANGER U, BÖHME F. Microbial biomass, enzyme activities and microbial community structure in two European long-term field experiments[J]. Agriculture, Ecosystems & Environment, 2005, 109(1/2): 141-152. |
| [8] |
吴艺雪, 杨效东, 余广彬. 两种热带雨林土壤微生物生物量碳季节动态及其影响因素[J]. 生态环境学报, 2009, 18(2): 658-663. WU Y X, YANG X D, YU G B. Seasonal fluctuation of soil microbial biomass carbon and its influence factors in two types of tropical rainforests[J]. Ecology and Environmental Sciences, 2009, 18(2): 658-663. DOI:10.3969/j.issn.1674-5906.2009.02.049 |
| [9] |
PIAO H C, HONG Y T, YUAN Z Y. Seasonal changes of microbial biomass carbon related to climatic factors in soils from karst areas of southwest China[J]. Biology and Fertility of Soils, 2000, 30(4): 294-297. DOI:10.1007/s003740050006 |
| [10] |
彭艳, 李心清, 程建中, 等. 贵阳喀斯特地区植被类型与季节变化对土壤微生物生物量和微生物呼吸的影响[J]. 地球化学, 2010, 39(3): 266-273. PENG Y, LI X Q, CHENG J Z, et al. Influence of vegetation types and seasonal variation on soil microbial biomass and microbial respiration in Karst region of Guiyang, southwest China[J]. Geochimica, 2010, 39(3): 266-273. |
| [11] |
王鹏, 陈波, 张华. 基于高通量测序的鄱阳湖典型湿地土壤细菌群落特征分析[J]. 生态学报, 2017, 37(5): 1650-1658. WANG P, CHEN B, ZHANG H. High throughput sequencing analysis of bacterial communities in soils of a typical Poyang Lake wetland[J]. Acta Ecologica Sinica, 2017, 37(5): 1650-1658. |
| [12] |
WANG B, PENG Y Z, GUO Y Y, et al. Illumina MiSeq sequencing reveals the key microorganisms involved in partial nitritation followed by simultaneous sludge fermentation, denitrification and anammox process[J]. Bioresource Technology, 2016, 207: 118-125. DOI:10.1016/j.biortech.2016.01.072 |
| [13] |
SUN F L, FAN L L, XIE G J. Effect of copper on the performance and bacterial communities of activated sludge using Illumina MiSeq platforms[J]. Chemosphere, 2016, 156: 212-219. DOI:10.1016/j.chemosphere.2016.04.117 |
| [14] |
曹波, 杨红, 许强华, 等. 基于16SrRNA技术的长江口微生物分子生物学鉴定与分析[J]. 上海海洋大学学报, 2011, 20(2): 191-197. CAO B, YANG H, XU Q H, et al. A study of the microorganism using bio-molecular technology from the Yangtze Estuary based on the technology of 16S rRNA[J]. Journal of Shanghai Ocean University, 2011, 20(2): 191-197. |
| [15] |
李国强.应用高通量测序技术分析青藏高原湖水中微生物多样性[D].兰州: 兰州交通大学, 2016. LI G Q. Analysis of the microbial diversity in lake water of Qinghai-Tibet Plateau by using the technology of high throughput sequencing[D]. Lanzhou: Lanzhou Jiaotong University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10732-1016275205.htm |
| [16] |
王绍祥, 杨洲祥, 孙真, 等. 高通量测序技术在水环境微生物群落多样性中的应用[J]. 化学通报, 2014, 77(3): 196-203. WANG S X, YANG Z X, SUN Z, et al. Application of high throughput sequencing in the diversity of water microbial communities[J]. Chemistry, 2014, 77(3): 196-203. |
| [17] |
梅雪英, 张修峰. 长江口湿地海三棱藨草(Scirpus mariqueter)的储碳、固碳功能研究——以崇明东滩为例[J]. 农业环境科学学报, 2007, 26(1): 360-363. MEI X Y, ZHANG X F. Carbon storage and fixation function of Scirpus mariqueter in changjiang river estuary:a case study of chongming dongtan wetland[J]. Journal of Agro-Environment Science, 2007, 26(1): 360-363. DOI:10.3321/j.issn:1672-2043.2007.01.073 |
| [18] |
陶燕东, 于克锋, 何培民, 等. 围垦后南汇东滩海三棱藨草的空间分布及其影响因子研究[J]. 长江流域资源与环境, 2017, 26(7): 1032-1041. TAO Y D, YU K F, HE P M, et al. Distribution of Scirpus mariqueter on nanhui coasts after reclamation and the associated affecting factors[J]. Resources and Environment in the Yangtze Basin, 2017, 26(7): 1032-1041. DOI:10.11870/cjlyzyyhj201707009 |
| [19] |
胡婵娟, 刘国华, 陈利顶, 等. 黄土丘陵沟壑区坡面上土壤微生物生物量碳、氮的季节变化[J]. 生态学杂志, 2011, 30(10): 2227-2232. HU C J, LIU G H, CHEN L D, et al. Seasonal variations of soil microbial biomass carbon and nitrogen on the hill slope in hilly areas of Loess Plateau[J]. Chinese Journal of Ecology, 2011, 30(10): 2227-2232. |
| [20] |
TIAN B, ZHANG L Q, WANG X R, et al. Forecasting the effects of sea-level rise at Chongming Dongtan Nature Reserve in the Yangtze Delta, Shanghai, China[J]. Ecological Engineering, 2010, 36(10): 1383-1388. DOI:10.1016/j.ecoleng.2010.06.016 |
| [21] |
鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2002: 25-188. BAO S D. Soil and agricultural chemistry analysis[M]. 3rd ed. Beijing: China Agriculture Press, 2002: 25-188. |
| [22] |
杨浩, 张国珍, 杨晓妮, 等. 16S rRNA高通量测序研究集雨窖水中微生物群落结构及多样性[J]. 环境科学, 2017, 38(4): 1704-1716. YANG H, ZHANG G Z, YANG X N, et al. Microbial community structure and diversity in cellar water by 16S rRNA high-throughput sequencing[J]. Environmental Science, 2017, 38(4): 1704-1716. |
| [23] |
ALLEN D E, DALAL R C, RENNENBERG H, et al. Spatial and temporal variation of nitrous oxide and methane flux between subtropical mangrove sediments and the atmosphere[J]. Soil Biology and Biochemistry, 2007, 39(2): 622-631. DOI:10.1016/j.soilbio.2006.09.013 |
| [24] |
车建锋, 李志斐, 王广军, 等. 混养池塘生物膜微生物群落功能多样性特征分析[J]. 上海海洋大学学报, 2017, 26(6): 862-871. CHE J F, LI Z F, WANG G J, et al. Microbial metabolic characteristics of biofilm communities in polyculture pond[J]. Journal of Shanghai Ocean University, 2017, 26(6): 862-871. |
| [25] |
朱云昊, 谭洪新, 孙大川, 等. Biolog-ECO解析循环水鳗鲡养殖系统中不同生物降解工艺下的滤料微生物群落功能多样性特征[J]. 上海海洋大学学报, 2017, 26(1): 64-74. ZHU Y H, TAN H X, SUN D C, et al. Analysis of carbon metabolism diversity characters of moving bed biofilm reactor at different biodegradation process in recirculating aquaculture systems using Biolog-ECO method[J]. Journal of Shanghai Ocean University, 2017, 26(1): 64-74. |
| [26] |
刘纯, 刘延坤, 金光泽. 小兴安岭6种森林类型土壤微生物量的季节变化特征[J]. 生态学报, 2014, 34(2): 451-459. LIU C, LIU Y K, JIN G Z. Seasonal dynamics of soil microbial biomass in six forest types in Xiaoxing'an Mountains, China[J]. Acta Ecologica Sinica, 2014, 34(2): 451-459. |
| [27] |
童春富, 章飞军, 陆健健. 长江口海三棱藨草带生长季大型底栖动物群落变化特征[J]. 动物学研究, 2007, 28(6): 640-646. TONG C F, ZHANG F J, LU J J. Variation characteristics of the macrobenthic fauna community in the Scirpus mariqueter zone of the Yangtze estuary during the growing seasons[J]. Zoological Research, 2007, 28(6): 640-646. DOI:10.3321/j.issn:0254-5853.2007.06.009 |
| [28] |
赵晓伟, 丁君, 窦妍, 等. 基于MiSeq测序技术分析红鳍东方纯养殖环境菌群多样性[J]. 生态学杂志, 2015, 34(10): 2965-2970. ZHAO X W, DING J, DOU Y, et al. Bacterial diversity in the breeding environment of Takifugu rubripes revealed by MiSeq sequencing[J]. Chinese Journal of Ecology, 2015, 34(10): 2965-2970. |
| [29] |
赵雨云, 马志军, 李博, 等. 鸭类摄食对海三棱藨草种子萌发的影响[J]. 生态学杂志, 2003, 22(4): 82-85. ZHAO Y Y, MA Z J, LI B, et al. Effects of ducks' ingestion on seed germination of bulrush (Scirpus mariqueter)[J]. Chinese Journal of Ecology, 2003, 22(4): 82-85. DOI:10.3321/j.issn:1000-4890.2003.04.017 |
| [30] |
张金屯. 数量生态学[M]. 2版. 北京: 科学出版社, 2011. ZHANG J T. Quantitative ecology[M]. 2nd ed. Beijing: Science Press, 2011. |
| [31] |
郭彩华. 土壤溶液常规分析中离子含量和电导率之间的关系[J]. 科技情报开发与经济, 2006, 16(14): 153-154, 165. GUO C H. The relationship between the ion content and the electric conductivity in the routine analysis of the soil solution[J]. Sci-Tech Information Development & Economy, 2006, 16(14): 153-154, 165. DOI:10.3969/j.issn.1005-6033.2006.14.089 |
| [32] |
WIESKI K, GUO H Y, CRAFT C B, et al. Ecosystem functions of tidal fresh, brackish, and salt marshes on the georgia coast[J]. Estuaries and Coasts, 2010, 33(1): 161-169. DOI:10.1007/s12237-009-9230-4 |
| [33] |
陈中义, 李博, 陈家宽. 长江口崇明东滩土壤盐度和潮间带高程对外来种互花米草生长的影响[J]. 长江大学学报(自科版), 2005, 2(2): 6-9. CHEN Z Y, LI B, CHEN J K. Effects of salt stress and elevation of tideland on the growth of introduced Spartina alterniflora at Dongtan of Chongming, the Yangtze river estuary[J]. Journal of Yangtze University (Natural Science Edition), 2005, 2(2): 6-9. DOI:10.3969/j.issn.1673-1409-C.2005.02.002 |
| [34] |
周俊丽, 吴莹, 张经, 等. 长江口潮滩先锋植物藨草腐烂分解过程研究[J]. 海洋科学进展, 2006, 24(1): 44-50. ZHOU J L, WU Y, ZHANG J, et al. Study on putrefaction and decomposition process of Scirpus triqueter on the Changjiang estuary tidal flat[J]. Advances in Marine Science, 2006, 24(1): 44-50. DOI:10.3969/j.issn.1671-6647.2006.01.006 |
| [35] |
庞学勇, 刘世全, 刘庆, 等. 川西亚高山针叶林植物群落演替对土壤性质的影响[J]. 水土保持学报, 2003, 17(4): 42-45, 50. PANG X Y, LIU S Q, LIU Q, et al. Influence of plant community succession on soil physical properties during subalpine coniferous plantation rehabilitation in western sichuan[J]. Journal of Soil and Water Conservation, 2003, 17(4): 42-43, 50. DOI:10.3321/j.issn:1009-2242.2003.04.011 |
| [36] |
王江, 张崇邦, 常杰, 等. 五节芒对重金属污染土壤微生物生物量和呼吸的影响[J]. 应用生态学报, 2008, 19(8): 1835-1840. WANG J, ZHANG C B, CHANG J, et al. Effects of Miscanthus floridulus on microbial biomass and basal respiration in heavy metals polluted soils[J]. Chinese Journal of Applied Ecology, 2008, 19(8): 1835-1840. |
| [37] |
薛萐, 刘国彬, 戴全厚, 等. 侵蚀环境生态恢复过程中人工刺槐林(Robinia pseudoacacia)土壤微生物量演变特征[J]. 生态学报, 2007, 27(3): 909-917. XU S, LIU G B, DAI Q H, et al. Evolution of soil microbial biomass in the restoration process of artificial Robinia Pseudoacacia under erosion environment[J]. Acta Ecologica Sinica, 2007, 27(3): 909-917. DOI:10.3321/j.issn:1000-0933.2007.03.010 |
2. Shanghai Research Center of Universities for Water Environment & Ecology Engineering, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


