2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
生物絮凝技术(bioflocs technology, BFT)通过添加有机碳源的方式调节养殖水体碳氮比(C/N),促进异养细菌的优势生长,利用养殖水体中的粪便、残饵重新形成生物絮体,从而达到提高饲料蛋白的利用率和净化养殖水环境的目的[1]。在生物絮凝养殖系统的情况下,C/N>20是絮体形成的最佳条件[2]。一般地,粗蛋白含量为30%~35%的饲料中C/N约为9~10[3],达不到异养同化氨氮的需求。需要额外添加有机碳源来促进水体中异养细菌的大量繁殖。
在新的生物絮凝养殖系统中,异养同化细菌和自养硝化细菌的生长以及生物絮体的形成通常需要几周时间来完成[3]。众多研究[4-6]表明,高盐度水体BFT系统的构建时间通常比淡水BFT系统的构建时间要长,并且在构建过程中,常常会伴随氨氮(TAN)和亚硝酸氮(NO2--N)的积累。除此之外,微生物的大量生长及絮体的形成会导致水体浑浊,在碳源大量添加时导致水体溶解氧急剧降低,这些都将给养殖对象带来负面影响[7]。新的生物絮凝系统需构建稳定的微生物群落,这决定了生物絮凝系统的运行效率,并且能够防止养殖对象因水质不稳而产生的应激[8]。但较长的生物絮凝系统启动时间不利于实际生产,因此需要探究出快速构建生物絮凝养殖系统的方法。
碳源的添加对生物絮凝系统中微生物群落的构建至关重要[9],如何添加碳源影响着生物絮凝系统的形成以及转化氮素的途径。KRUMMENAUER等[10]在利用生物絮凝技术养殖凡纳滨对虾过程中,按水体中每产生1 g TAN添加6 g C的比例添加糖蜜能够有效降低水体中的TAN和NO2--N。这说明合理的碳源添加方式能够促使生物絮凝系统更有效率地去除水体中有害氮素。通过调控碳源的添加方式,或许能够成为快速稳定水质,缩短生物絮凝启动时间的有效方法。
本实验在海水生物絮凝养殖系统启动阶段,以葡萄糖作为碳源,在前人研究的基础上总结了3种不同的添加方式,旨在探究不同添加碳源方式对海水生物絮凝系统启动效率的影响,从而总结出能够缩短启动时间的碳源添加方式。
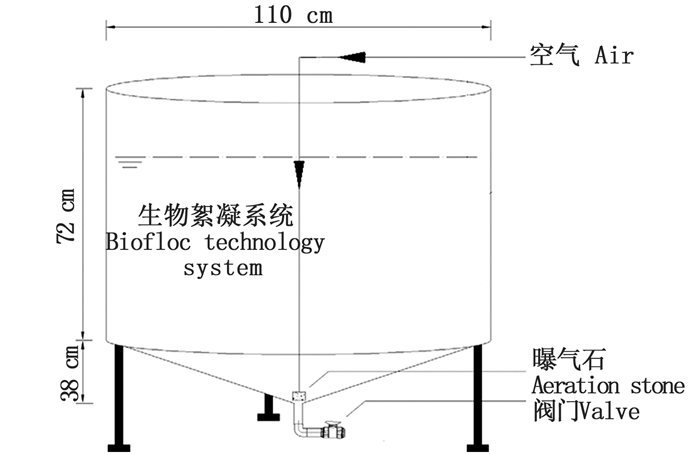
1 材料与方法 1.1 实验装置及材料本实验在上海海洋大学循环水养殖工程研发平台内的养殖水槽(图 1)中进行,容器上部为圆柱体,下部为圆锥体,直径110 cm,锥体高38 cm,总高度110 cm,其工作体积为500 L,共9个。用于培养生物絮凝系统的原料为凡纳滨对虾饲料(常熟泉兴营养添加剂有限公司,江苏),其主要成分:粗蛋白≥42%,粗纤维≤12%,粗脂肪≥ 4%,粗灰分≤18%,赖氨酸≥2.2%,水分≤12%,钙≤5%,总磷≥1.0%(数据由厂家提供)。添加食品级葡萄糖(古阜丰生物科技有限公司,内蒙古)调节C/N。
|
图 1 生物絮凝系统养殖水槽的示意图 Fig. 1 Schematic diagram of the culture tanks with bioflocs technology |
实验开始前在9个养殖水槽中各蓄盐度为30的海水500 L,分别投入500 g磨碎后的对虾饲料(此后不再添加),初始总固体悬浮颗粒物(total suspended solids, TSS)为1 000 mg/L。通过添加NaHCO3调控碱度保持在100 mg CaCO3/L。实验期间除了补充因蒸发而损失的水分,不换水。1台750 W罗茨鼓风机供氧,采用间歇式曝气方式(曝气8 h停止16 h)将系统进行闷曝72 h后开始添加碳源[11]。
按照不同的碳源添加策略将9个水槽分为A、B、C组,每组3个平行。A组添加策略为实验开始时一次性投入足够的葡萄糖,使系统中C/TN(系统中的总氮)为15。B组添加策略为系统运行的第1~10天每天加入A组所添加葡萄糖总量的10%,此后若氨氮(TAN)上升至1 mg/L以上,则按照C/TAN为6来添加碳源。C组添加策略为每天按照C/TAN为6来添加葡萄糖。
1.3 实验指标与测定方法 1.3.1 水质指标的测定每隔1 d检测水体的温度(T)、pH、溶解氧(DO)、氧化还原电位(ORP) (WTW Multi 3430,德国),并测定总氮(TN)、氨氮(TAN)、亚硝酸氮(NO2--N)、硝酸氮(NO3--N)和溶解性有机碳(dissolved organic carbon,DOC)。TN采用过硫酸钾氧化—紫外分光光度法(型号UV 2000,上海尤尼柯)测定。水样经0.45 μm滤膜抽滤后测定三态氮及DOC。NO2--N含量采用重氮-偶氮法测定,NO3--N含量采用锌隔还原法测定,TAN含量测定采用次溴酸钠氧化法,DOC含量使用多功能C/N分析仪(Multi N/C 2100,德国)测定。每周测1次碱度(酸碱滴定指示法)。
1.3.2 絮体成分指标的测定每7 d进行生物絮体指标测定。TSS采用沉重法测定,5 min内絮体沉降体积(floc volume,FV)使用英霍夫式锥形管取1 L水样静置5 min后读数。絮体经65 ℃烘干后使用碳元氮素分析仪测定粗蛋白。胞外聚合物(extracellular polymeric substances, EPS)采用超声波破碎法提取;EPS中多糖采用蒽酮-硫酸比色法测定(标准物为葡萄糖),蛋白质(标准物为牛血清蛋白)和腐殖质(标准物为腐殖酸)采用改良型Lowry法测定(试剂盒购自南京建成生物公司)。
1.3.3 生物絮体微生物样品的采集与测序系统运行第60天时,分别在各个处理组取50 mL水样,于-80 ℃冰箱保存,实验结束后送至上海安诺优达生物科技有限公司进行高通量测序。
使用E. Z. N. A.Soil DNA Kit (Omega, 美国)试剂盒对各处理组样品进行DNA提取;1%的琼脂糖电泳检测DNA样品是否有降解以及杂质;NanoPhotometer分光光度计检测样品纯度;Qubit 2.0 Flurometer检测DNA样品浓度。取用10 ng的DNA模板,对目的区域进行扩增:根据测序区域的不同,选择对应区域的扩增引物:V3区引物为338F-533R,V3+V4区引物为341F-805R,V6区引物为967F-1046R;使用TaKaRa的EXTaq酶,确保扩增效率和准确性。继而对扩增出的目的片段进行富集,同时加入特异index序列。文库构建完成后,先使用Qubit 2.0进行初步定量,稀释文库至1 ng/μL,随后使用Agilent 2100对文库的insert size进行检测,insert size符合预期后,使用Bio-RAD CFX 96荧光定量PCR仪,Bio-RAD KIT iQ SYBR GRN进行QPCR,对文库的有效浓度进行准确定量,以保证文库质量。检测合格的文库后,采用Miseq进行测序,测序策略为PE250。
1.4 数据分析实验数据采用Excel软件进行结果统计,由Origin软件进行相关图表的绘制。实验数值用平均值±标准差(Mean±SD)形式表示,采用SPSS 19.0统计软件对数据进行ANOVA单因素方差分析,P < 0.05为差异性显著。
2 结果 2.1 氨氮、亚硝酸氮和硝酸氮的动态变化实验期间,pH、DO、T、ORP等水质指标如表 1所示,各组水温(T)为22~30 ℃。A组pH和DO在实验第3天到第5天时低至4.4和2.8 mg/L左右,之后A组与其余2个处理组pH均在7.1~8.6波动,组间差异不显著(P > 0.05)。各组溶解氧(DO)为6~8 mg/L。pH和DO均无明显变化规律。3个处理组的碱度均维持在100 mg/L以上,A组和B组碱度最高均至250 mg/L左右,C组碱度最高至194.3 mg/L,显著低于前两组(P < 0.05)。

|
表 1 实验期间3个处理组中各水质指标的平均值、最小值和最大值 Tab.1 Mean, min and max values of the important water quality parameters in the 3 different biofloc treatment groups during the experimental period (n=3;x±SD) |
如图 2所示,整个实验期间一次性添加碳源的处理组(A)和每天添加碳源的处理组(C)的TAN浓度都维持在较低水平,并且都在第25天时达到峰值(5.01±0.09) mg/L和(5.69±0.06) mg/L。均匀添加碳源的处理组B的TAN浓度在第31天时达到峰值(16.36±3.02) mg/L,显著高于A组和C组(P < 0.05)。A组和B组的NO2--N在第41天时达到峰值,分别是(33.08±5.28)mg/L和(28.17±5.61)mg/L。C组NO2--N在第31天达到峰值(33.58±1.44)mg/L,明显早于其他两组。但是3个处理组的NO2--N均在第55天时降至最低水平。3个处理组的NO3--N在系统运行的第25天时开始积累,上升至20 mg/L左右后起伏不定,在第50至60天内降至较低水平(5 mg/L以下)。

|
图 2 3个处理组中氨氮(a)、亚硝酸氮(b)、硝酸氮(c)及总氮(d)的动态变化 Fig. 2 Dynamics of total ammonium-N(a), nitrite-N(b), nitrate-N (c)and total nitrogen(d) in the 3 different groups |
由图 3a可知,在系统运行前10天内,3个处理组的DOC浓度表现出显著差异(P < 0.05)。A组在一次性添加大量葡萄糖后DOC浓度升至(935.50±31.93)mg/L;B组在持续添加葡萄糖过程中,DOC浓度先升高至(182.29±17.12)mg/L,然后迅速降低;C组因为TAN浓度较低,因此添加的葡萄糖较少,DOC在50 mg/L以下。但是在系统运行第10天之后直至结束,3组DOC变化趋于一致,均在20 mg/L左右浮动。从图 3b和3c可以看出,DOC与溶解性无机氮(DIN)的比值在系统运行的前20天处于较高水平(15以上),第55~60天内B、C两组的DOC/DIN迅速升高又降低,A组波动幅度较小,除此之外3组DOC/DIN均保持极低水平;整个实验期间3组的DOC/TN均处于较低水平,只有A组在第3天时,DOC/TN达到15以上。

|
图 3 3个处理组中溶解性有机碳含量(a)及其与溶解性无机氮(b)和总氮(c)比值的动态变化 Fig. 3 Variations s of DOC(a), DOC/ DIN(b), and DOC/ TN(c) in the 3 different groups |
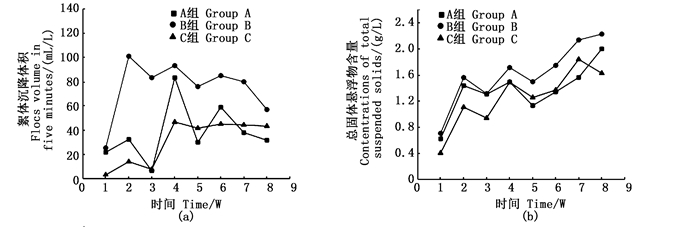
由图 4a可知,系统运行的前4周,3组絮体沉降体积FV-5 min波动幅度较大;在实验中后期,A、B两组变化趋势较为一致,沉降体积比分别从(83.3±14.4)mL/L和(93.3±17.8) mL/L降低至(17.7±14.4) mL/L和(35.0±10.0) mL/L;C组絮体沉降体积比在这一期间较为稳定,维持在43.4 mL/L左右。整个实验期间,B组FV-5普遍高于其他两组。由图 4b可知,3组TSS变化规律较为一致,总体呈上升趋势;A、B、C 3组的TSS含量分别从(0.625±0.089)g/L、(0.708±0.078)g/L和(0.406±0.073)g/L增长至(1.905±0.054)g/L、(2.334±0.02)g/L和(1.8±0.074) g/L。整体上看,B组TSS普遍高于A组和C组。
|
图 4 絮体沉降体积(5 min)(a)与总固体悬浮物含量(b)的动态变化 Fig. 4 Dynamic changes of flocs volume (FV-5 min, a), total suspended solids(TSS, b) in the 3 different groups |
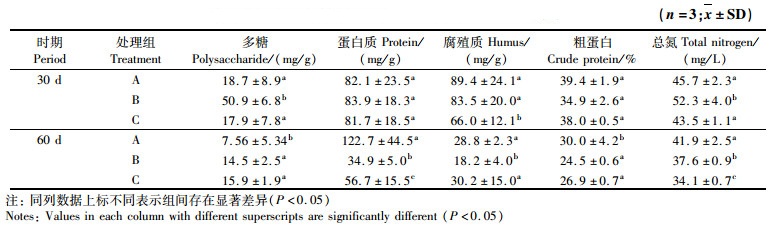
本实验分别在系统运行的第30天、60天时测定了各处理组絮体的胞外聚合物和粗蛋白成分。由表 2可以看出,本实验3个处理组的生物絮体胞外聚合物中蛋白质和腐殖质含量占较大比例,在实验第30天时,蛋白质和腐殖质的含量达到80 mg/L以上,远高于同组的多糖含量。由表 2可观察到,随着系统运行时间越久,生物絮体中粗蛋白含量和胞外聚合物各组分含量均呈现下降趋势。
|
表 2 实验第30天、60天时絮体的胞外聚合物组分、粗蛋白和水体中总氮含量 Tab.2 The content of EPS component and crude protein in biofloc and total nitrogen in water on the 30th and 60th days of the experiment |
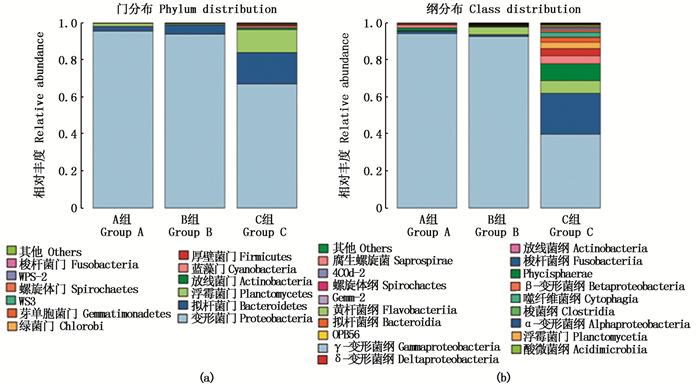
由图 5可知,在门水平(phylum level)上,3组生物絮凝系统中优势菌群均为变形菌门(Proteobacteria),其丰度在A组占95%,B组为94%,C组为67%。C组菌群结构相对于A组和B组较为丰富,拟杆菌门(Bacteroidetes)和浮霉菌门(Planctomycetes)在C组也是优势菌群,其丰度分别占16%和13%。在纲的水平(class level)上,A组和B组中优势菌群都以γ-变形菌纲(Gammaproteobacteria)为主,其丰度在A组和B组中分别占94%和92%。C组中优势菌群为γ-变形菌纲和α-变形菌纲(Alphaproteobacteria),其次还有黄杆菌纲(Flavobacteria)和Phycisphaerae纲等都在C组中被明显观察到。B组中黄杆菌纲也占有4%左右。由表 3可以看出,3组生物絮凝系统在科水平(family level)上相对丰度大于5%的物种仅有4种,其中弧菌科(Vibrionaceae)在A组和B组中占绝对优势地位,而C组因物种较为丰富,没有相对丰度超过20%的菌群;鱼立克次体科(Piscirickettsiaceae)占比最多,接近20%,弧菌科(Vibrionaceae)仅占3.3%,黄单胞菌科(Xanthomonadaceae)和黄杆菌科(Flavobacteriaceae)均占6.8%左右。
|
图 5 实验第60天时3个处理组的生物絮凝系统优势菌群在门和纲水平上的分布 Fig. 5 Predominant bacterial community at phylum and class levels in 3 different treatments BFT system of the 60th day |

|
表 3 科水平3组样品中物种(相对丰度 > 5%)的优势度指数 Tab.3 The dominance index of species(relative abundance > 5%) at family level in the samples of 3 groups |
本研究处理组A是根据AVNIMELECH[9]提出的养殖水体内C/N对养殖系统水质调控作用的理论而设计的,即同时向水槽中添加葡萄糖和凡纳滨对虾饲料(CP≥42%),使系统中C/N达到15。理论上,系统运行后若不再添加氮源,也就不需再添加碳源。A组水体中溶解氧(DO)和pH在实验开始后第3~5天内处于较低的水平,可能是因为一次性投入充足甚至过量的葡萄糖,系统中微生物在短时间内密集增殖,EBELING等[12]的研究表明,异养细菌利用有机碳源进行增殖的过程中需要消耗养殖水体中大量的溶解氧和碱度。B处理组的碳源添加方式基于A处理组,即将A组所投入的碳源总质量平均分10次进行添加。有研究[13]表明,C/N不同会影响到异养细菌与氨氧化菌竞争底物和溶解氧,通常高有机物负荷会使氨氧化效率下降。通过系统运行中期的水质变化可知,A组和B组在TAN水平上有显著差异(P < 0.05)。C处理组是根据饲料在水体中降解后积累的TAN浓度来添加葡萄糖。由异样细菌同化作用公式:NH4++1.18 C6H12O6+HCO3-+2.06O2→C5H7O2N+6.06 H2O+3.07CO2可知,同化1 g氨氮,需要消耗6.07 g有机碳[12],换算成葡萄糖质量即需要消耗15 g葡萄糖。C组的碳源添加方式是为了充分满足异样细菌的生长需求,从而快速构建完成生物絮凝系统。
整体上看,3个处理组的TAN浓度均处于低水平,而NO2--N在系统运行20~40天内迅速上升,说明生物絮凝系统中C/N的调控能迅速降低TAN浓度,但不能很快处理NO2--N,这与ARNOLD等[14]研究的结果相似。在系统运行后期(50~60天内),NO2--N浓度很快降至较低水平。这可能是在生物絮凝系统形成过程中,异养细菌对TAN的利用效率远比NO2--N要快,而且亚硝酸盐氧化细菌比氨氧化细菌的生长速率要慢[14],导致NO2--N积累到一定时期后才能很快被处理掉。本实验中3个处理组均有NO3--N积累,这一现象与AZIM等[15]在有限光照的生物絮凝养殖系统中的发现是一致的。这表明生物絮凝系统中存在硝化类细菌,系统水体中同时进行了异养吸收和自养硝化的氨氮转化过程。在实验中期,A、B两个处理组的NO3--N浓度在一定范围内波动,C处理组的NO3--N浓度则呈下降趋势,这表明在生物絮凝系统中持续添加碳源会抑制硝化作用;实验后期3个处理组中NO3--N急剧降低,可能是因为在这期间按照DOC/DIN为15的比例向系统中添加葡萄糖,在碳源充足条件下,NO3--N也被异养细菌利用。JORGENSEN等[16]研究发现,异养细菌对可溶性氮素的利用中,TAN占吸收总氮的55%~99%,NO3--N最高占吸收氮源的23%。此现象同时也说明在3个处理组的生物絮凝系统转化氮素均以同化作用为主。
3.2 不同碳源添加策略下生物絮凝系统启动过程中C/N的变化本实验3个处理组的DOC浓度在系统运行前期的差异是因碳源的添加量不同,但在系统运行的中后期,3组的DOC浓度趋于一致,且较为稳定。C组虽然持续添加葡萄糖,但很快被利用,其DOC才会与其他两组无显著差异(P > 0.05)。但3组DOC在整个实验期间始终保持一定浓度,且DOC/TAN远大于15,说明水体中有部分DOC可能不被异养细菌利用,LIM等[17]研究认为该部分DOC可能是很难被细菌降解的腐殖酸,也有研究认为是一些烷烃类有机碳[18]。实际上,在水产养殖水体的碳源和氮源是以多种形态共存的,而且这些不同形态的碳或氮会互相转化,如果仅用总碳和总氮的比值去调控水体中C/N,是无法准确投入适量的碳源来满足微生物的生长需求的。因此,本实验将DOC与DIN和TN进行比较,发现DOC/DIN和DOC/TN的变化规律与DOC的浓度变化较为相似。这是因为系统中DIN和TN浓度相对较为稳定,因此不能作为一个C/N是否满足异养细菌生长的判断标准。此外,由于整个实验期间TAN浓度都处于相对较低水平,因此3组系统中DOC/TAN在大多数时间都处于极高状态,且后续碳源的添加,导致DOC/TAN波动极大。通过实时监测发现,DOC/TAN甚至出现高达数万的情况,且毫无变化规律,这是由于某些时间内TAN浓度极低甚至接近于零,即使水体中DOC浓度不高,也会造成极高比值。由此说明,不能通过某一时刻监测的DOC/TAN来推断水体中C/N是否满足异养细菌的生长需求。
3.3 不同碳源添加策略对启动过程中生物絮体的影响生物絮凝系统在添加有机碳源的过程中会促进其有机颗粒物和生物絮体的积累[19]。可以看出本实验中3个处理组的TSS在系统运行前期增长较为迅速。B组TSS在整体水平上高于A组和C组,可能是由于在实验前期持续投入较为适量的碳源使系统中的异样细菌快速增长,而在实验中期由于B组TAN有所积累,因此得到碳源的补充,从而进一步增长TSS含量。与此相对应,B组FV-5 min也高于另外两组,赵霞等[20]研究证明充足碳源的添加,会使生物絮体更加膨胀。在系统运行的中后期,A组和B组的FV-5 min略微有所下降,C组则保持稳定状态,而A、B和C 3组的TSS均呈上升趋势,这表明3个处理组的絮体沉降性能在上升。
在生物絮凝系统中,胞外聚合物(EPS)对絮体的凝聚性、沉降性和脱水性有重要的影响[21]。一般认为,EPS的主要组分为糖类和蛋白质[22]。在本实验中,提取3个处理组絮体中的EPS后,经检测发现腐殖质的含量十分接近蛋白质的含量,甚至高于多糖的含量,LIU等[23]研究也表明腐殖质在EPS中占有较高比例,因此EPS中的腐殖质成分不能被忽略。从整体上看,EPS随着系统运行时间越长,其总体含量越低。SHENG等[24]认为,EPS的含量在细菌处于对数生长期时会迅速增加,而在稳定期内则迅速降低。由其他指标可以判断:本实验在前30 d时异养细菌繁殖迅速,因此EPS的含量在系统运行第30天时处于较高的状态;而实验中后期,系统逐渐稳定,因此EPS含量有所下降。EPS的变化趋势与絮体沉降性能相反,可能是因为EPS含量的降低,絮体的沉降性得到提升。ERIKSSON等[25]的研究也表明EPS不利于絮体的沉降。
3.4 不同碳源添加策略对生物絮凝系统启动过程中微生物菌群结构的影响MICHAUD等[26]研究发现碳源的添加量会影响生物絮体的细菌群落结构。本实验在结束时对系统微生物高通量测序,结果显示3个处理组中的优势菌群都属于变形菌门(Proteobacteria),但持续添加碳源的系统中,微生物种类明显较多,由此可见,碳源的添加可以增加生物絮凝系统中菌群的丰度。在科水平上,A组和B组中弧菌科(Vibrionaceae)占90%以上,而在C组中弧菌科所占比例则较少,可能是因为弧菌在C/N为5和10的基质中生长较好[27], C组由于持续添加碳源,抑制了它的生长。从微生物群落的发展角度来看,持续而少量地添加碳源对于生物絮凝系统的构建更为合理。
| [1] |
AVNIMELECH Y. Bio-filters:the need for an new comprehensive approach[J]. Aquacultural Engineering, 2006, 34(3): 172-178. DOI:10.1016/j.aquaeng.2005.04.001 |
| [2] |
GOLDMAN J C, CARON D A, DENNETT M R. Regulation of gross growth efficiency and ammonium regeneration in bacteria by substrate C:N ratio[J]. Limnology and Oceanography, 1987, 32(6): 1239-1252. DOI:10.4319/lo.1987.32.6.1239 |
| [3] |
AVNIMELECH Y. Biofloc Technology:A Practical Guide Book[M]. Baton Rouge, LA: World Aquaculture Society, 2012: 182.
|
| [4] |
邓应能, 赵培, 孙运忠, 等. 生物絮团在凡纳滨对虾封闭养殖试验中的形成条件及作用效果[J]. 渔业科学进展, 2012, 33(2): 69-75. DENG Y N, ZHAO P, SUN Y Z, et al. Conditions for biofloc formation and its effects in closed culture system of Litopenaeus vannamei[J]. Progress in Fishery Sciences, 2012, 33(2): 69-75. DOI:10.3969/j.issn.1000-7075.2012.02.011 |
| [5] |
CORREIA E S, WILKENFELD J S, MORRIS T C, et al. Intensive nursery production of the Pacific white shrimp Litopenaeus vannamei using two commercial feeds with high and low protein content in a biofloc-dominated system[J]. Aquacultural Engineering, 2014, 59: 48-54. DOI:10.1016/j.aquaeng.2014.02.002 |
| [6] |
LUO G Z, LI W Q, TAN H X, et al. Comparing salinities of 0, 10 and 20 in biofloc genetically improved farmed tilapia (Oreochromis niloticus) production systems[J]. Aquaculture and Fisheries, 2017, 2(5): 220-226. DOI:10.1016/j.aaf.2017.10.002 |
| [7] |
DE SCHRYVER P, CRAB R, DEFOIRDT T, et al. The basics of bio-flocs technology:The added value for aquaculture[J]. Aquaculture, 2008, 277(3/4): 125-137. |
| [8] |
LUO G Z, AVNIMELECH Y, PAN Y F, et al. Inorganic nitrogen dynamics in sequencing batch reactors using biofloc technology to treat aquaculture sludge[J]. Aquacultural Engineering, 2013, 52: 73-79. DOI:10.1016/j.aquaeng.2012.09.003 |
| [9] |
AVNIMELECH Y. Carbon/nitrogen ratio as a control element in aquaculture systems[J]. Aquaculture, 1999, 176(3/4): 227-235. |
| [10] |
KRUMMENAUER D, POERSCH L H, FÓES G, et al. Survival and growth of Litopenaeus vannamei reared in BFT System under different water depths[J]. Aquaculture, 2016, 465: 94-99. DOI:10.1016/j.aquaculture.2016.09.002 |
| [11] |
LUO G Z, LIANG W Y, TAN H X, et al. Effects of calcium and magnesium addition on the start-up of sequencing batch reactor using biofloc technology treating solid aquaculture waste[J]. Aquacultural Engineering, 2013, 57: 32-37. DOI:10.1016/j.aquaeng.2013.06.004 |
| [12] |
EBELING J M, TIMMONS M B, BISOGNI J J. Engineering analysis of the stoichiometry of photoautotrophic, autotrophic, and heterotrophic removal of ammonia-nitrogen in aquaculture systems[J]. Aquaculture, 2006, 257(1/4): 346-358. |
| [13] |
SATOH H, OKABE S, NORIMATSU N, et al. Significance of substrate C/N ratio on structure and activity of nitrifying biofilms determined by in situ hybridization and the use of microelectrodes[J]. Water Science and Technology, 2000, 41(4/5): 317-321. |
| [14] |
ARNOLD S J, COMAN F E, JACKSON C J, et al. High-intensity, zero water-exchange production of juvenile tiger shrimp, Penaeus monodon:An evaluation of artificial substrates and stocking density[J]. Aquaculture, 2009, 293(1/2): 42-48. |
| [15] |
AZIM M E, LITTLE D C. The biofloc technology (BFT) in indoor tanks:Water quality, biofloc composition, and growth and welfare of Nile tilapia (Oreochromis niloticus)[J]. Aquaculture, 2008, 283(1/4): 29-35. |
| [16] |
JØRGENSEN N, KROER N, COFFIN R B, et al. Relations between bacterial nitrogen metabolism and growth efficiency in an estuarine and an open-water ecosystem[J]. Aquatic Microbial Ecology, 1999, 18(3): 247-261. |
| [17] |
LIM M H, SNYDER S A, SEDLAK D L. Use of biodegradable dissolved organic carbon (BDOC) to assess the potential for transformation of wastewater-derived contaminants in surface waters[J]. Water Research, 2008, 42(12): 2943-2952. DOI:10.1016/j.watres.2008.03.008 |
| [18] |
SIMSEK H, KASI M, OHM J B, et al. Impact of solids retention time on dissolved organic nitrogen and its biodegradability in treated wastewater[J]. Water Research, 2016, 92: 44-51. DOI:10.1016/j.watres.2016.01.041 |
| [19] |
BURFORD M A, LORENZEN K. Modeling nitrogen dynamics in intensive shrimp ponds:the role of sediment remineralization[J]. Aquaculture, 2004, 229(1/4): 129-145. |
| [20] |
赵霞, 赵阳丽, 陈忠林, 等. 好氧颗粒污泥发生丝状菌污泥膨胀的控制措施[J]. 中国给水排水, 2012, 28(3): 15-19. ZHAO X, ZHAO Y L, CHEN Z L, et al. Control of filamentous sludge bulking in aerobic granular sludge SBR process[J]. China Water & Wastewater, 2012, 28(3): 15-19. DOI:10.3969/j.issn.1000-4602.2012.03.004 |
| [21] |
WILÉN B M, JIN B, LANT P. The influence of key chemical constituents in activated sludge on surface and flocculating properties[J]. Water Research, 2003, 37(9): 2127-2139. DOI:10.1016/S0043-1354(02)00629-2 |
| [22] |
FRØLUND B, PALMGREN R, KEIDING K, et al. Extraction of extracellular polymers from activated sludge using a cation exchange resin[J]. Water Research, 1996, 30(8): 1749-1758. DOI:10.1016/0043-1354(95)00323-1 |
| [23] |
LIU H, FANG H H P. Extraction of extracellular polymeric substances(EPS) of sludge[J]. Journal of Biotechnology, 2002, 95(3): 249-256. DOI:10.1016/S0168-1656(02)00025-1 |
| [24] |
SHENG G P, YU H Q, WANG C M. FTIR-spectral analysis of two photosynthetic H2-producing strains and their extracellular polymeric substances[J]. Applied Microbiology and Biotechnology, 2006, 73(1): 204-210. DOI:10.1007/s00253-006-0442-2 |
| [25] |
ERIKSSON L, ALM B. Study of flocculation mechanisms by observing effects of complexing agent on activated sludge properties[J]. Water Science & Technology, 1991, 24(7): 21-28. |
| [26] |
MICHAUD L, LO GIUDICE A, INTERDONATO F, et al. C/N ratio-induced structural shift of bacterial communities inside lab-scale aquaculture biofilters[J]. Aquacultural Engineering, 2014, 58: 77-87. DOI:10.1016/j.aquaeng.2013.11.002 |
| [27] |
高磊, 包卫洋, 张天文, 等. 水体碳氮比对芽孢杆菌、乳酸菌与弧菌生长、拮抗作用及菌体碳氮比的影响[J]. 中国海洋大学学报, 2013, 43(1): 34-40. GAO L, BAO W Y, ZHANG T W, et al. Effect of water C:N ratio on the growth, antagonism and C:N Ratio of bacillus, lactic acid Bacteria and vibrio[J]. Periodical of Ocean University of China, 2013, 43(1): 34-40. |
2. Key Laboratory of Freshwater Aquatic Genetic Resources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
 2019,
Vol. 28
2019,
Vol. 28


