2. 上海海洋大学 水产与生命学院, 上海 201306;
3. 国际铜业协会, 上海 200000
铜(Cu)是甲壳动物体内重要的金属元素之一。由铜和蛋白或抗氧化酶等活性物质组成的含铜蛋白或含铜酶在电子转移、氧气输送、底物的氧化还原、调节物质吸收等过程中都起着重要的生理功能,甲壳动物在生长、免疫过程中以铜为中心原子的血蓝蛋白至关重要[1-2],生物体内或环境中过高或过低的铜都会对生物体形成胁迫或造成缺乏症[3]。可见研究铜对甲壳动物生长代谢以及免疫生理的影响,在生产过程中对于指导铜的规范使用具有实际意义。
铜作为重要的工业原料,在许多领域中都有着广泛的应用。目前铜合金也被运用于水产养殖中,例如,用于散热或船舶制造的LC6911型耐腐蚀铜合金,目前已经有研究者将这种铜合金板放置在养殖池底部,利用铜合金板本身存在的电位差来抑制或杀灭细菌和原生动物[4-5]。+2价是铜在自然环境中以离子形式存在的主要形式,在海水弱碱性条件下,铜会与OH-、CO32-、S2-等形成多种络合物以及螯合物。铜合金在海水中可以通过电离、氧化还原反应来释放铜离子,而海水中会通过络合反应使铜离子保持在一个相对稳定的范围内[6]。当络合物不足时,则海水中会出现过量的铜离子。多项研究表明,虽然铜对生命活动必不可少,但过量的离子铜容易引起代谢失衡,进而引发中毒[7],相比之下络合铜不仅能够维持甲壳类生命活动且安全可控。将LC6911型铜板放置在海水中,其自然释放铜极其缓慢,释放的铜通过海水中阴离子的络合作用产生络合铜,保持水体中一定量的络合铜对养殖生物具有极积的生态学意义。
水产动物饲料中铜添加的相关实验已有报道[8],但在养殖水体中不同形态的铜对甲壳动物生理生态的影响还知之甚少。本研究以凡纳滨对虾(Litopenaeus vannamei)为实验对象,采用目前在养殖过程中作为抑制原生动物或杀菌的LC6911型铜板为释放络合铜源的材料,并以五水硫酸铜(CuSO4·5H2O)作为对比,另设空白对照,研究养殖8周内不同实验时长、不同添加形式以及不同添加量铜对生长和不同器官免疫相关酶活性的影响,旨在探讨在水体中使用铜合金(LC6911型铜板)作为铜源,以提升凡纳滨对虾免疫功能的可行性,对今后的生产和研究提供参考数据。
1 材料与方法 1.1 实验材料实验在中国水产科学研究院东海水产研究所福鼎研究中心内进行。凡纳滨对虾购自福建福鼎康太利养殖场,体长(9.0±0.9)cm,体质量(11.5±2.3)g。实验海水经自然沉淀、砂滤、蛋白质分离器分离后使用,处理后的海水经检测离子铜含量低于1×10-6 mg/L,总铜含量(3.1×10-5±1.21×10-6) mg/L,盐度26.0±0.8。
实验用饲料为正大牌对虾饲料,其中主要成份:粗蛋白≥42%、粗脂肪≥4%、粗纤维≤5%、粗灰分≤16%、赖氨酸≥2.1%、水分≤12%,为避免饲料中铜含量溶入水中造成干扰,使用EDTA处理,参照董晓慧等[8]的方法,将饲料经EDTA溶液浸泡处理后重新烘干备用。实验用LC6911型铜板由国际铜业协会提供,根据实验池的大小,将厚度0.1 cm的铜板裁成50 cm×60 cm的小块储存备用。硫酸铜为CuSO4·5H2O,分析纯(上海国药集团化学试剂有限公司)。
1.2 实验设计 1.2.1 LC6911铜合金在海水中铜释放量用直径2 m、深1 m的玻璃钢圆桶9个,每桶加入2 m3处理过的海水,实验设0.3 m2铜板实验组和0.6 m2铜板实验组与空白组,即按水体计算分别为0.15 m2铜板/m3和0.3 m2铜板/m3,铜板铺设时不重叠,可移动。实验设3组平行,水温(27±1.0) ℃,盐度26.0±0.8,不间断充气,不换水。分别在0、1、2、4、8、12、24、36、48、60、72和96 h取各平行水样,用Cu2+离子计(雷磁PXSJ—216F型离子计)测定水体Cu2+含量以及水体总铜含量。总铜含量测定参照李登新[9]的方法:将水样降温至25 ℃,用盐酸滴定至水体pH 5.2后再用离子计测Cu2+浓度,25 ℃ Ksp[Cu (OH)2]=2.2×10-20。
1.2.2 养殖实验设计根据第1.2.1节的实验结果,在2 m3的海水中,每0.3 m2铜板48 h内的释放总铜量为(3.700±0.245)×10-4 mg/L。参照中华人民共和国农业部颁发的海水水质标准[9]和刘存岐等[10]对中国对虾(Penaeus chinensis)养殖实验中海水添加铜浓度梯度[10-11],实验设5个实验组,其中分为对照组、两个铜板实验组和两个添加CuSO4·5H2O的Cu2+组,A组为空白对照,B组为0.15 m2铜板/m3水体,C组为0.3 m2铜板/m3水体,D组为0.25 mg Cu2+/L水体,E组为0.50 mg Cu2+/L水体,均设3个重复。实验用容器与第1.2.1节所述相同,每重复分别放置40尾虾。实验开始前暂养1周。暂养和实验期间环境条件均为水温(28.0±1.1) ℃,盐度26.0±0.8,不间断充气,每隔48 h换水10%,每次换水后将重叠铜板重新铺开,向D、E组中补充因换水而降低浓度的CuSO4·5H2O。为避免饲料中的铜溶于水中干扰实验,实验开始后采用经EDTA处理后的实验饲料。投饵时均使用虾料筐,避免饲料接触容器底部的铜板,投饵1 h后清除虾料筐中的残饵并虹吸出桶底的粪便。投料量约为虾体质量的6%。
1.3 采样方法饲养期间,在0、2、4、8、16、32、56 d取样,每重复实验取三尾,测量虾体长和体质量,随后用1 mL的注射针自对虾胸下动脉抽取血淋巴,再解剖后取鳃以及肝胰脏后半部分,取得样品置离心管内,-80 ℃冷冻保存待测。
1.4 免疫活性蛋白及酶活力的测定实验所测免疫相关蛋白及酶活性包括血蓝蛋白(CP)、溶菌酶(LZM)、还原态酚氧化酶(POX)以及金属硫蛋白(MT)。其中CP采用比色法、LZM采用比浊法、MT以及POX使用酶联免疫法(Elisa)检测。实验所涉及免疫相关酶及蛋白类指标使用南京建成生物科技有限公司的试剂盒进行测定,具体方法参见说明书。
1.5 数据处理除预实验的数据外,其他实验数据处理均进行统计学分析。分析使用SPSS statistics 19软件,使用单因素ANOVA对组间进行差异显著性分析;Ducan氏法进行方差齐次性检验。P < 0.05表示差异具有显著性。
2 结果 2.1 无养殖生物条件下LC6911铜合金在海水中释放结果在无养殖生物条件下,0.15 m2铜板/m3和0.3 m2铜板/m3的水体中Cu2+含量均低于1×10-8 mg/L,可以忽略不计。24 h内铜板单位水体的总铜释放量随时间呈正比(表 1),达24 h至96 h,0.15 m2铜板/m3和0.3 m2铜板/m3释放总铜量分别稳定在1.75×10-1~2.18×10-1(mg/L)和3.27×10-1~6.47×10-1(mg/L)的水平。实验期内未放置铜板的空白组测定的总铜量值稳定在(3.18×10-5±6.88×10-7) mg/L。

|
表 1 0.15 m2/m3和0.30 m2/m3铜板实验组随时间释放的总铜含量 Tab.1 Total Cu release of 0.15 m2 copper plate/m3 and 0.30 m2 copper plate/m3 |
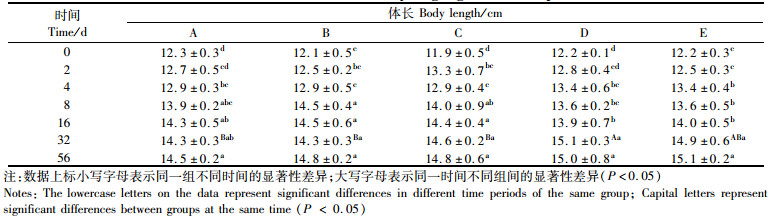
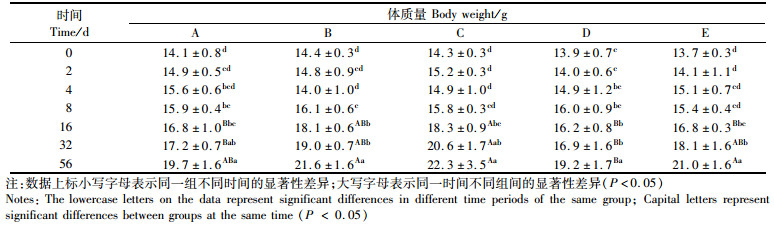
实验期间,各实验组和对照组中的凡纳滨对虾生长情况如表 2、3所示。各组在同一时间内生长无显著性差异(P > 0.05)。虾体质量随实验时长增加变化明显,0 d与56 d相比差异显著(P < 0.05)。实验期间除采样外,各实验组、对照组凡纳滨对虾存活率100%,无死亡现象。
|
表 2 不同处理条件下凡纳滨对虾体长随时间变化 Tab.2 Effects of different treatment on body length growth of Litopenaeus vannamei |
|
表 3 不同处理条件下凡纳滨对虾体质量随时间变化 Tab.3 Effects of different treatment on body mass growth of Litopenaeus vannamei |
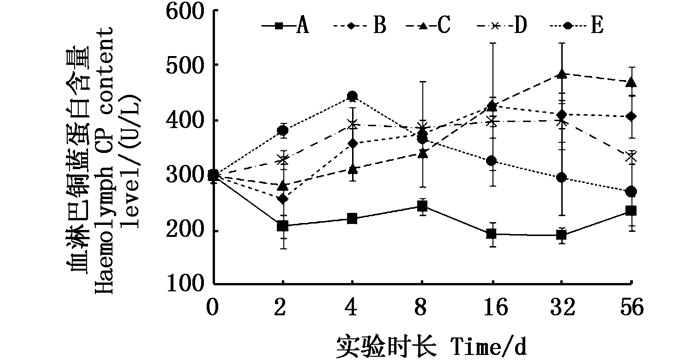
凡纳滨对虾血淋巴中铜蓝蛋白(CP)在实验周期内变化规律见图 1。未添加铜的对照组中CP在实验过程中变化不显著(P > 0.05),铜板实验组在4 d起并至实验结束始终与对照组呈显著性差异(P < 0.05),而不同添加量之间差异不显著(P > 0.05);Cu2+组同样在4 d时与对照组呈显著性差异(P < 0.05),但随实验时间的延长CP含量下降,至实验结束与对照组差异不显著(P > 0.05)。Cu2+高添加量组与铜板实验组在实验结束时也均呈显著性差异(P < 0.05)。
|
图 1 不同处理条件下凡纳滨对虾血淋巴中CP含量变化 Fig. 1 Changes of CP content level in Litopenaeus vannamei haemolymph under different treatment |
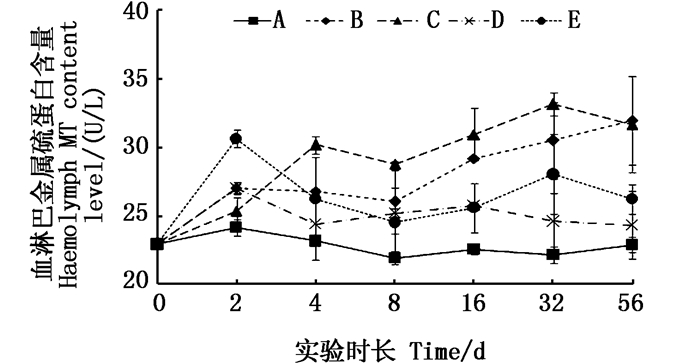
在实验周期内铜板实验组血淋巴中的金属硫蛋白(MT)含量基本稳定上升,4 d起与对照组呈显著差异(P < 0.05);而高浓度Cu2+组在第2天就出现显著差异,但随实验延长MT含量不断下降,且低添加量组在第4天起各取样时间点均与对照组之间差异不显著,见图 2。
|
图 2 不同处理条件下凡纳滨对虾血淋巴内MT含量变化 Fig. 2 Changes of MT content level in Litopenaeus vannamei haemolymph under different treatment |
在肝胰脏中, 2种添加组不同浓度的实验组均呈上升态势(图 3),实验结束时2种添加形式的MT含量均显著高于对照组(P < 0.05),且2种添加形态的实验组之间也差异显著(P < 0.05),表现为铜板实验组中的MT含量高于硫酸铜添加组,Cu2+组高于对照组。
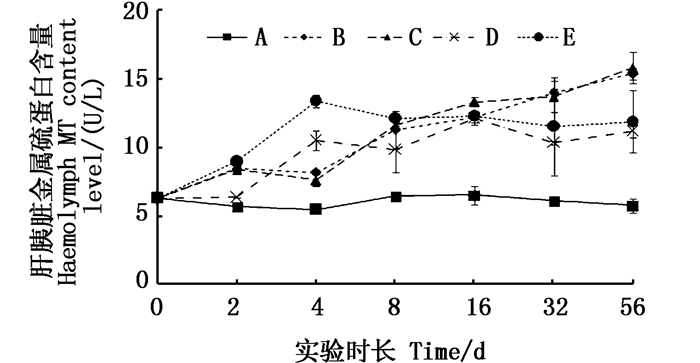
|
图 3 不同处理条件下凡纳滨对虾肝胰脏内MT含量变化 Fig. 3 Changes of MT content level in Litopenaeus vannamei liver tissue under different treatment |
还原态酚氧化酶(POX)活性在血淋巴中变化规律明显(图 4),对照组在实验过程中各取样点之间差异不显著(P > 0.05);Cu2+组显示呈上升趋势,且在16 d时开始与对照组呈显著性差异(P < 0.05):铜板实验组POX活性呈波动变化,分别在2 d和32 d与对照组呈显著性差异(P < 0.05)。56 d时铜板实验组中的POX活性降至低于Cu2+组,与对照组有显著性差异。虾肝胰脏中POX活性在实验组中呈波状上升态势,均在32 d时达到与对照组之间显著性差异(P < 0.05)。
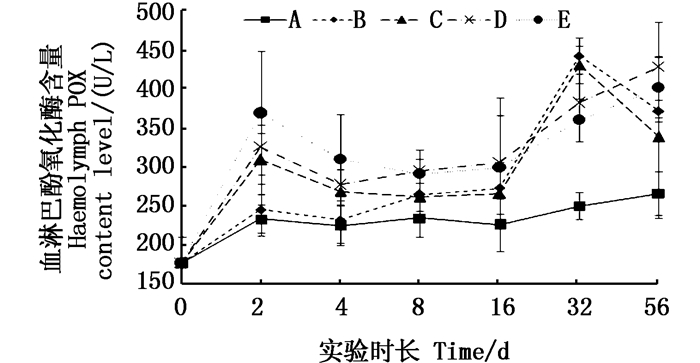
|
图 4 不同处理条件下凡纳滨对虾血淋巴POX含量变化 Fig. 4 Changes of POX content level in Litopenaeus vannamei haemolymph under different treatment |
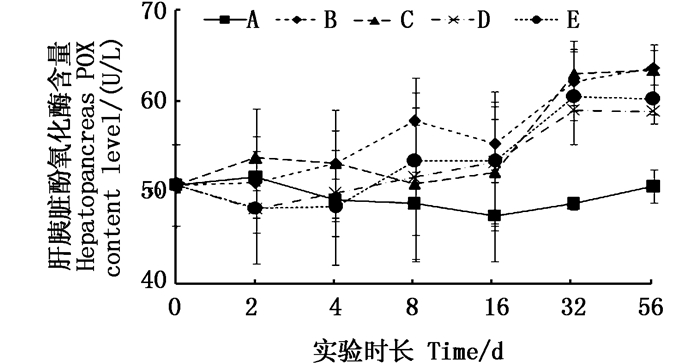
|
图 5 不同处理条件下凡纳滨对虾肝胰脏POX含量变化 Fig. 5 Changes of POX content level in Litopenaeus vannamei liver tissue under different treatment |
在肝胰脏中对照组的血清溶菌酶含量不随时间而发生变化,而2种不同溶解态铜的实验组中,虾血淋巴溶菌酶活性均随时间而发生变化,第16天开始与对照组相比均有显著性差异(P < 0.05)。2种不同溶解态铜之间以及不同水平之间都没有达到显著性差异(图 6)。
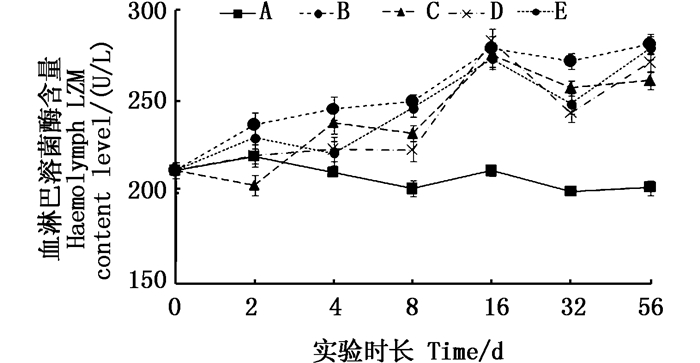
|
图 6 不同处理条件下凡纳滨对虾血淋巴LZM含量变化 Fig. 6 Changes of LZM content level in Litopenaeus vannamei haemolymph under different treatment |
在鳃组织中实验第8天实验组与对照组之间均无显著性差异(P > 0.05),随后Cu2+组的溶菌酶活性出现显著下降(P < 0.05),不同添加量之间无差异;而铜板实验组溶菌酶活性与对照组之间在不同取样时间点之间始终差异不显著。见图 7。
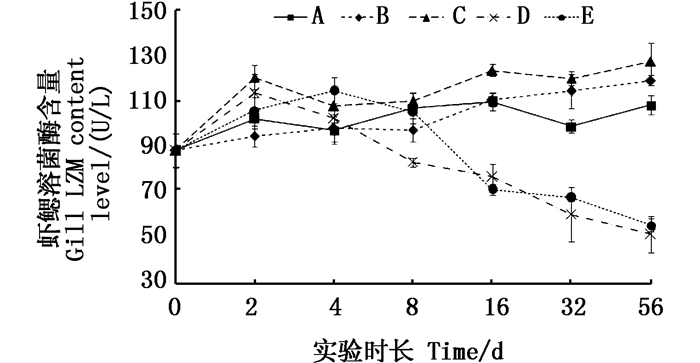
|
图 7 不同处理条件下凡纳滨对虾鳃LZM含量变化 Fig. 7 Changes of LZM content level in Litopenaeus vannamei gill under different treatment |
海水中理化环境复杂多变,铜含量不能只通过离子含量来进行判定,铜在海水中也能通过结合OH-、S2-和小分子蛋白等产生络合物或难溶解的螯合物沉积。由于不同化学组成的铜对生物的作用机理并不相同[12],因此,Cu2+组实验采用铜源控制法,即只以拟合络合态铜实验组释放的总铜计算CuSO4·5H2O添加量,不计算CuSO4·5H2O添加组水体中离子铜的含量,由于水体内Cu2+的缓慢螯合沉积,换水期间依据测定值补充CuSO4·5H2O能够减少养殖实验水体Cu2+流失。该方法能尽可能控制实验变量的准确,确保实验期间影响络合态铜实验组释放的主要为络合铜,影响Cu2+组主要因子为Cu2+。水滴在铜金属表面时接触角为82°,大于其他常见金属,这就意味着金属铜接触水时不易产生亲和作用,也就提高了其本身耐蚀性[13]。电化学原理认为,铜合金在遇海水时产生的抗腐蚀膜能够有效抑制铜的腐蚀[14],因此水体总铜含量缓慢升高且量不易超标[15]。本实验数据表明,以LC6911型铜合金在海水中自然释放为例,水体中放置铜板,其释放总铜含量低于0.5 mg/L均以络合铜形式存在。因此,该方法不仅提供甲壳类生命活动所需铜,还可以有效避免Cu2+对水生生物所产生的急性毒性影响,从而能够作为一种合理的水产用铜方法。养殖实验中以无养殖生物下铜板释放铜为参考,合理调控水中使用铜板面积以及换水时段,使实验中水体用铜量符合国内外养殖水标准[11-15],并能够对凡纳滨对虾的免疫功能产生影响。
3.2 不同溶解态铜对凡纳滨对虾生长影响研究表明,饲料中添加15 mg/kg Cu2+有利于降低凡纳滨对虾的饵料系数并提高生长率[16]。也有学者认为饲料中添加铜生物利用率为有机铜>络合铜>离子铜[17]。王维娜等[18]认为,Cu2+本底值为9.5 μg/L,外加Cu2+浓度为2 μg/L时,日本沼虾(Macrobrachium nipponense)的摄食率最高,达到85.9%。本实验与常规的生产养殖相比,生长偏慢,除了选用虾的个体较大,还与实验的容积有关。
3.3 不同溶解态铜对免疫活性物质影响大多数动物体内负责携氧的蛋白为血红蛋白,其负责结合氧的中心原子为铁(Fe),部分甲壳类以及软体动物体内负责携氧的为血蓝蛋白(CP),而血蓝蛋白负责携氧的中心原子是铜[17],软体动物和甲壳类中铜蓝蛋白即血蓝蛋白。对甲壳类而言,血蓝蛋白(CP)不仅具有输氧功能,还能控制甲壳类脱皮、角质层固化、黑色素合成[19]。关于血蓝蛋白对凡纳滨对虾的生长脱壳的影响还有待于进料一步的实验。CP能合成酚氧化酶(PO)、假性血蓝蛋白。有长期实验结果表明,水体内98 d长期含有Cu2+0.3 mg/L与无铜作为对照,凡纳滨对虾酚氧化酶活力略有下降但差异并不显著(P < 0.05)[20]。本实验结果表明,水体中总铜含量相同的情况下,离子态铜实验组4 d内可使凡纳滨对虾血淋巴中CP含量能够迅速升高。16 d以后,添加0.5 mg/L离子铜会使凡纳滨对虾CP含量逐渐降低并趋于对照组,而络合态铜实验组采用释放络合铜的方法可以使凡纳滨对虾体内CP含量保持长期缓慢提升。由此推测,同含量不同化学形态的铜均能提升凡纳滨对虾血淋巴中CP含量。离子态铜可短期见效,但当水体中Cu2+含量长期处于高于0.5 mg/L时不利于凡纳滨对虾CP合成。络合态铜产生的络合铜会更有利于凡纳滨对虾CP合成,在本实验条件下,水体总铜含量低于0.5 mg/L时不会产生副作用。
目前为止未发现甲壳类具备非特异性免疫物质,其常见免疫应答因子为溶菌酶(LZM)、酚氧化酶(PO)和金属硫蛋白(MT)等[21-22]。金属硫蛋白(MT)与许多细胞功能相关,包括基因表达、细胞凋亡、增殖和分化,是重要的生物金属中毒指示指标和解毒指标[23-24]。MT激活有两种可能:一种是摄入金属含量过高引发,当实验生物长期处于高金属含量水体中时,该免疫活性蛋白活性表现为先升高,后因机体金属含量过高会导致解毒能力下降[25];另一种表现为机体受某种有益因子刺激提升MT活性,这种情况不会因长期添加该特定浓度的影响因子造成机体损伤引发的MT活力下降。李湘萍等[26]研究表明,长期实验对比凡纳滨对虾在循环水条件下以CuSO4·5H2O为铜源添加铜0.8 mg/L和静水条件下添加等量CuSO4·5H2O,循环水条件下凡纳滨对虾MT活力下降远低于静水组。分析认为循环水条件下换水量很低,长期Cu2+会转化成络合铜成分,造成实验结果差异。本研究表明,凡纳滨对虾肝胰腺和血淋巴中MT含量与水体内不同溶解态铜密切相关。当水体含铜低于0.5 mg/L时,以络合铜存在的铜会对MT活力产生稳定高效的增益效果;以Cu2+存在的铜虽短期内对MT活力有所提升但长期使用会产生负面影响。
有学者[27]认为,对节肢类动物而言,其CP是来源于5亿5000万年前的原始的还原态酚氧化酶(POX)分化而成,这种POX不同于现今的POX,而现今节肢动物体内的POX又是由CP分化形成,这些酶辅基均含铜,参与甲壳类主要的免疫应答。也有研究[28]认为在一定条件下,POX和CP之间能够相互转换,CP可经胰蛋白酶催化形成POX,而POX是一种激活状态下的CP。本文研究针对参与免疫应答最主要的还原态酚氧化酶(POX)进行测定,结果发现血淋巴内POX变动趋势与CP基本相同,都是在短期内Cu2+组活性迅速升高,长期内效果不显著。但其变动幅度远高于CP,实验组与对照组最大差值达2.5倍左右。此外肝胰腺内随铜含量增加以及铜添加方式的不同变化该指标仅是波动幅度增大,但与各实验组之间差异均不显著。本实验结果可一定程度上证实这一观点,POX与CP浓度之间存在一定关联,可相互转化,且当水体存在Cu2+作为铜源时,POX活力能很快产生变化,络合铜为铜源时变化趋于平稳上升。长期实验影响下数据分析认为POX更易受总铜浓度影响,当水体内总铜含量长期高于0.5 mg/L时也会对POX活力产生抑制。肝胰腺作为重要的存铜器官,其POX活力的波动表明养殖水体总铜含量长期处于0.5 mg/L时肝胰腺调节能力不会受影响,即不会使肝胰腺的免疫应答能力受损。
溶菌酶(LZM)作为凡纳滨对虾用以抵御有害细菌入侵的重要屏障,由吞噬细胞合成,能水解细菌细胞壁中黏肽的乙酰氨基多糖并使之裂解,减少侵入体内有害细菌含量[29]。鳃是虾机体与水环境交流的主要器官,也是防止有害细菌入侵的第一道屏障,对比两种溶解态铜的添加方式,4 d内两种溶解态的铜均能提升虾鳃LZM活性,16 d以后,不同水平的离子态铜实验组的鳃LZM活性均出现显著性下降,实验结束时均低于对照组1倍以上,低于络合态铜实验组1.5倍左右。而血淋巴中LZM活性各实验组随时间的延长,均显著高于对照组,几乎不受不同溶解态铜影响。由于凡纳滨对虾本身吸收铜后以CP形态存储,并能够促进LZM合成,因此可以推测血淋巴内LZM活性不受水体中离子铜浓度的影响,且随血淋巴中的CP含量增加而增高其活性。水体中如果始终保持离子态的铜,则对鳃LZM活性造成抑制。
4 结论海水养殖凡纳滨对虾过程中,养殖水体存在较低浓度的络合铜能使凡纳滨对虾针对其他重金属污染的抵御能力得到增强,水体中长期添加Cu2+效果不良甚至能产生负面影响不利于养殖生产。以铜板自然析出的方法获得的络合铜相对更安全,合理用量在每立方水体为0.15~0.30 m2之间。
| [1] |
ALBERGONI V, PICCINNI E. Biological response to trace metals and their biochemical effects[M]//LEPPARD G G. Trace element speciation in surface waters and its ecological implications: NATO Conference Series (Ⅰ Ecology), vol 6.Boston, MA: Springer US, 1983: 159-175.
|
| [2] |
TOMASZEWSKA E, MUSZYHSKI S, OGNIK K, et al. Comparison of the effect of dietary copper nanoparticles with copper (Ⅱ) salt on bone geometric and structural parameters as well as material characteristics in a rat model[J]. Journal of Trace Elements in Medicine and Biology, 2017, 42(42): 103-110. |
| [3] |
许星鸿, 唐瑶, 杜丹丹, 等. 水环境污染胁迫对甲壳类免疫生理生化影响的研究进展[J]. 安徽农业科学, 2013, 41(34): 13275-13276. XU X H, TANG Y, DU D D, et al. Research progress on the effects of water environment pollution stress on the physiological and biochemical effects of crustaceans[J]. Journal of Anhui Agri.Sci, 2013, 41(34): 13275-13276. |
| [4] |
聂政伟, 王磊, 刘永利, 等. 铜合金网衣在海水养殖中的应用研究进展[J]. 海洋渔业, 2016, 38(3): 329-336. NIE Z W, WANG L, LIU Y L, et al. Development and application of fishery copper alloy netting[J]. Marine Fishery, 2016, 38(3): 329-336. |
| [5] |
HE T, ZHU W, WANG X, et al. Polydopamine assisted immobilisation of copper(Ⅱ) on titanium for antibacterial applications[J]. Materials Technology, 2015, 30(B2): B68-B72. |
| [6] |
LEAL M, VAN DEN BERG C. Evidence for strong copper(Ⅰ) complexation by organic ligands in seawater[J]. Aquatic Geochemistry, 1998, 4(1): 49-75. |
| [7] |
高春生, 王春秀, 范光丽, 等. 水体铜对黄河鲤非特异性免疫功能的影响[J]. 安全与环境学报, 2008, 8(4): 1-4. GAO C S, WANG C X, FAN G L, et al. The effect of copper on non-specific immunity of Cyprinus carpio[J]. Journal of Safety and Environment, 2008, 8(4): 1-4. |
| [8] |
董晓慧, 杨原志, 郑石轩, 等. 饲料中不同铜源和水平对凡纳滨对虾生长、免疫和组织铜含量的影响[J]. 大连水产学院学报, 2007, 22(5): 377-383. DONG X H, YANG Y Z, ZHENG S X, et al. Effects of dietary copper sources and levels on growth, immunity and Cu concentration in tissues of white legshrimp Litopenaeus vannamei[J]. Journal of Dalian Fisheries University, 2007, 22(5): 377-383. |
| [9] |
李登新. 环境工程导论[M]. 北京: 中国环境出版社, 2015: 279. LI D X. Introduction to environmental engineering[M]. Beijing: China Environmental Science Press, 2015: 279. |
| [10] |
NY5052-2001无公害食品海水养殖用水水质[S].中华人民共和国农业部, 2005. NY5052-2001 Harmless food and aquaculture water standard[S]. The ministry of agriculture of the People's Republic of China, 2005. |
| [11] |
刘存岐, 王安利, 王维娜, 等. 海水中几种金属离子对中国对虾幼体体内碱性磷酸酶和ATPase的影响[J]. 水产学报, 2001, 25(4): 298-303. LIU C Q, WANG A L, WANG W N, et al. Influences of metal ions in seawater on activities of alkaline phosphatase(AKP) and ATPase in mysis and postlarvae of Penaeus chinensis[J]. Journal of Fisheries of China, 2001, 25(4): 298-303. |
| [12] |
HANSEN D J, BERRY W J, MAHONY J D, et al. Predicting the toxicity of metal-contaminated field sediments using interstitial concentration of metals and acid-volatile sulfide normalizations[J]. Environmental Toxicology And Chemistry, 1996, 15(12): 2080-2094. |
| [13] |
徐凤珍.铜表面有机复合膜的制备及海水中腐蚀性能研究[D].中国海洋大学, 2012. XU F Z. Fabrication of organic compound membrane on copper and research on corrosion properties in seawater[D]. Ocean University of China, 2012. |
| [14] |
赵楠, 罗兵辉, 柏振海. 铜合金在海水中的腐蚀行为研究[J]. 材料保护, 2003, 36(3): 21-23. ZHAO N, LUO B H, BO Z H. Corrosion behavior of copper alloy in seawater[J]. Materials Protection, 2003, 36(3): 21-23. |
| [15] |
Standard test method for determination of copper release rate from antifouling coatings in substitute ocean water[S]. ASTM, Standards Press of US, 2005.
|
| [16] |
宋维彦, 王秀敏, 靳桂双. 铁铜锌对凡纳滨对虾生长和非特异免疫的影响[J]. 江苏农业科学, 2011, 39(6): 376-379. SONG W Y, WANG X M, JIN G S. Effects of iron and copper zinc on growth and non-specific immunity of Litopenaeus vannamei[J]. Jiangsu Agricultural Sciences, 2011, 39(6): 376-379. |
| [17] |
周萌, 王安利, 曹俊明. 饲料中不同形式的铜及添加量对凡纳滨对虾(Paneaus vannamei)生长性能、血清铜蓝蛋白和生长激素水平的影响[J]. 海洋与湖沼, 2010, 41(4): 577-582. ZHOU M, WANG A L, CAO J M. Effects of different forms of copper and supplement on growth performance, serum ceruloplasmin, and growth hormone level of Paneaus vannamei[J]. Oceanologia Et Limnologia Sinica, 2010, 41(4): 577-582. |
| [18] |
王维娜, 王安利, 孙儒泳. 水环境中的铜锌铁钴离子对日本沼虾消化酶和碱性磷酸酶的影响[J]. 动物学报, 2001, 47(s1): 72-77. WANG W N, WANG A L, SUN R Y. Effects of Cu2+, Zn2+, Fe3+ and Co2+ in freshwater on digestive enzyme and alkaline phosphatase activity of Macrobrachium nipponense[J]. Acta Zoologica Sinica, 2001, 47(s1): 72-77. |
| [19] |
DECKER H, JAENICKE E. Recent findings on phenoloxidase activity and antimicrobial activity of hemocyanins[J]. Developmental & Comparative Immunology, 2004, 28(7): 673-687. |
| [20] |
BO C, YING L, HONG Y Y, et al. Effect of copper on the growth of shrimps Litopenaeus vannamei:water parameters and copper budget in a recirculating system[J]. Chinese Journal of Oceanology and Limnology, 2014, 32(5): 1092-1104. |
| [21] |
LI N, ZHAO Y L, YANG J. Accumulation, distribution, and toxicology of copper sulfate in juvenile giant freshwater prawns, Macrobrachium rosenbergii[J]. Bulletin Of Environmental Contamination And Toxicology, 2005, 75(3): 497-504. |
| [22] |
汪多, 田相利, 董双林, 等. 不同饲料添加物对凡纳滨对虾生长和血清非特异免疫指标影响的研究[J]. 海洋湖沼通报, 2017, 39(3): 106-114. WANG D, TIAN X L, DONG S L, et al. Effects of several additives on the growth and non-specific immunity in serum of Litopenaeus vannamei[J]. Transaction of Oceanology and Limnology, 2017, 39(3): 106-114. |
| [23] |
DAVIS S R, Cousins R J. Metallothionein expression in animals:A physiological perspective on function[J]. Journal of Nutrition, 2000, 130(5): 1085-1088. |
| [24] |
SYRING R A, BROUWER T H, BROUWER M. Cloning and sequencing of cDNAs encoding for a novel copper-specific metallothionein and two cadmium-inducible metallothioneins from the blue crab Callinectes sapidus[J]. Comparative Biochemistry And Physiology C-Pharmacology Toxicology & Endocrinology, 2000, 125(3): 325-332. |
| [25] |
李诗逸, 孙继鹏, 易瑞灶, 等. 金属离子对水生动物体内金属硫蛋白应激诱导研究进展[J]. 水产科学, 2014, 33(9): 594-600. LI S Y, SUN J P, YI R Z, et al. Research progress on metal ion stress and induction to metallothionein in aquatic animals[J]. Fisheries Science, 2014, 33(9): 594-600. |
| [26] |
李湘萍, 程波, 程江峰, 等. 铜离子在养殖对虾组织中的积累及其对金属硫蛋白含量的影响[J]. 青岛科技大学学报(自然科学版), 2011, 32(5): 492-496. LI X P, CHENG B, CHENG J F, et al. Copper ion accumulation in Litopenaeus vannamei and the effect on metallothionein in different aquaculture systems[J]. Journal of Qingdao University of Science and Technology:Natural Science Edition, 2011, 32(5): 492-496. |
| [27] |
BURMESTER T. Evolutionary history and diversity of arthropod hemocyanins[J]. Micron, 2004, 35(1/2): 121-122. |
| [28] |
严芳, 章跃陵, 罗活强, 等. 凡纳滨对虾血蓝蛋白酚氧化酶活性的研究[J]. 水产科学, 2008, 27(1): 5-8. YAN F, ZANG Y L, LUO H Q, et al. The phenoloxidase activity of hemocyanin from white leg shrimp Litopenaeus vannamei[J]. Fisheries Science, 2008, 27(1): 5-8. |
| [29] |
李义, 陈星, 李红霞, 等. 乐果对日本沼虾血淋巴溶菌酶与酚氧化酶活力的影响[J]. 水利渔业, 2005, 25(6): 87-88. LI Y, CHEN X, LI H X, et al. Effects of rogor on the activities of lysozyme and oxidase in Macrobrachium nipponense[J]. Reservoir Fisheries, 2005, 25(6): 87-88. |
2. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
3. International Copper Association, Shanghai 200000, China
 2019,
Vol. 28
2019,
Vol. 28


