2. 上海水产品加工及贮藏工程技术研究中心, 上海 201306
石花菜(Gelidium amansii),又名海冻菜、石华、琼枝、草珊瑚、鸡毛菜等,主要分布在我国的台湾岛、海南岛以及广东沿海[1]。石花菜是药食两用的海藻,目前,其主要利用方式是食用及制作琼胶[2]。人体生命活动中的许多生化反应会产生自由基,受控的自由基具有调节信号传递、提高机体免疫等作用,但过量自由基则诱发人体疾病,加速机体衰老[3]。石花菜多糖能有效清除自由基,其抗氧化活性具良好保健功能[4]。
大石花菜(Gelidium pacifium Okam.)与石花菜同为石花菜属(Gelidium),产于中国浙江、福建沿海,是北太平洋西部特有的种[5],产量丰富,目前主要用于直接食用和琼胶提取,但大石花菜多糖提取及抗氧化活性等研究尚未见报道。本课题以大石花菜为实验材料,用超声波辅助提取法[6]代替传统的水提法[7]进行多糖提取[8],在单因素试验基础上经响应面法优化超声辅助提取大石花菜多糖工艺[9],并对大石花菜多糖进行体外抗氧化活性研究[10],为进一步开发利用大石花菜提供实验基础。
1 材料与方法 1.1 材料与试剂大石花菜:来源于福建,洗净、烘干至恒重、研磨、过60目筛,备用;
无水乙醇、浓盐酸、三氯乙酸、葡萄糖、苯酚、浓硫酸、Vc(抗坏血酸纯度≥ 99.8%)、DPPH、ABTS、K2S2O8、焦性没食子酸和Tris均为分析纯,购于国药化学试剂有限公司。
1.2 仪器设备RE3000-D型旋转蒸发仪(上海亚荣生化仪器厂);80-2型离心机(金坛荣华仪器厂);超声清洗器(上海塍旭超声波技术有限公司);UV/V-16/18型紫外可见分光光度计(上海美谱达仪器有限公司);水浴锅(山东鄄城华鲁电热仪器有限公司);电热鼓风干燥箱(上海讯博实业有限公司医疗设备厂)。
1.3 试验方法 1.3.1 大石花菜多糖的提取工艺超声辅助提取法:称取大石花菜适量,加水浸泡20 min后,超声辅助提取3次,即得大石花菜多糖提取液,8 000 r/min离心10 min,取上清液浓缩后加入2倍体积无水乙醇,静置,离心得粗多糖,烘干至恒重,即得大石花菜多糖[4]。水提法:采用水浴提取多糖,提取温度85 ℃,提取时间50 min,提取次数3次,液料比36 mL/g,其他步骤与超声辅助提取法相同。
采用硫酸苯酚法[11]测定大石花菜多糖得率,以葡萄糖为标准物,在490 nm处测定其多糖含量。按下式计算大石花菜多糖得率:
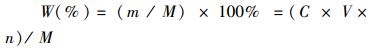 (1)
(1)
式中: W为多糖得率;m为多糖质量(mg);M为大石花菜粉质量(mg);C为多糖提取液浓度(mg/mL);V为多糖提取液体积(mL); n为稀释倍数。
1.3.2 单因素试验设计称取大石花菜适量,固定超声功率360 W、液料比30 mL/g、超声温度60 ℃,考察超声时间20、30、40、50、60 min对多糖得率的影响;固定超声功率360 W、液料比30 mL/g、超声时间50 min,考察超声温度50、60、70、80、90 ℃对多糖得率的影响;固定超声功率360 W、超声温度80 ℃、超声时间50 min,考察液料比10、20、30、40、50 mL/g对多糖得率的影响[12]。
1.3.3 响应面优化试验设计在单因素试验基础上,选取超声温度、超声时间、液料比为自变量,多糖得率为响应值,逐个考察各提取条件对多糖提取效果的影响[13]。根据响应面试验设计原理,进行三因素三水平的响应面分析试验[14],因素和水平见表 1。用Design-Expert 8软件进行回归分析,多元回归分析法拟合多元二次方程,预测大石花菜多糖提取的最佳工艺条件。

|
表 1 响应面试验设计的因素及水平 Tab.1 Factors and levels used in response surface experimental design |
(1) DPPH自由基清除能力测定
水提法与超声辅助提取法得到的大石花菜多糖抗氧化活性对比、分析[7]。配制0.2 mmol/mL的DPPH溶液,冷藏备用[15]。称取水提法得到的多糖(PGPO-AE)、超声提取法得到的多糖(PGPO-UE)和Vc各1 g,分别配制20 mg/mL的溶液,并将其分别稀释成5组不同质量浓度的溶液。取相同体积的上述稀释液与DPPH溶液混匀,室温避光反应30 min,517 nm处测其吸光度;取相同体积的多糖稀释液与蒸馏水混匀、反应、测吸光度;取相同体积的DPPH溶液与蒸馏水混匀、反应、测吸光度[16-17]。
 (2)
(2)
式中:X为DPPH自由基清除率;Aa为测定样品吸光度;Ab为样品本底吸光度;A0为空白对照吸光度。
(2) ABTS+·自由基清除能力测定
配制14 mmol/L ABTS溶液和4.9 mmol/L K2S2O8溶液,1:1混匀,室温避光12~16 h,得ABTS+·储备液。50%乙醇溶液稀释储备液至吸光度为0.70 ± 0.02,得ABTS+·测定液[17]。取两种提取法所得多糖和Vc溶液,稀释至五组不同质量浓度的溶液,取稀释液3 mL与配置好的ABTS+·测定液6 mL,混匀,30 ℃反应20 min,734 nm处测定吸光度。以蒸馏水作为对照组,测吸光度[18-19]。
Y(%)= (1 - Ai/ A0) × 100%
式中:Y为ABTS+自由基清除率;Ai为测定样品吸光度;A0为空白对照吸光度。
(3) 超氧阴离子自由基清除能力测定
配制pH=8.24的Tris-HCl缓冲溶液和1 mmol/L邻苯三酚溶液[4],备用。取上述两种多糖溶液和Vc溶液各0.2、0.4、0.6、0.8、1 mL,用Tris-HCl缓冲溶液稀释至5 mL,加邻苯三酚溶液0.3 mL,加水至10 mL,混匀。322 nm处每隔30 s记录一次吸光度,得加入样品的邻苯三酚的自氧化速率,另测一组不加入样品的邻苯三酚自氧化速率[20]。
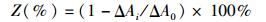 (4)
(4)
式中:Z为超氧阴离子自由基清除率;ΔAi为加入样品后邻苯三酚的自氧化速率;ΔA0为邻苯三酚自氧化速率。单位均为吸光度值每分钟的增值。
1.3.5 数据处理及验证试验所有试验均做3次平行试验,利用Excel程序对实验结果分析。使用Design-Expert 8软件进行响应面设计与分析。根据响应面分析得到的最佳工艺条件进行验证分析,并与传统的水提法比较得出其优势。
2 结果与分析 2.1 单因素实验结果 2.1.1 超声时间对多糖提取率的影响如图 1所示,超声时间20~50 min时,多糖提取率随着时间的增长而提高,并在50 min达到最大得率。这是因为超声时间较短时,不利于大石花菜组织细胞的破碎和内容多糖的溶出。超声时间为50~60 min时,多糖得率反而下降,这可能是超声时间过长引起多糖的分解而损失。因此,选取多糖提取超声时间为50 min。

|
图 1 超声时间对多糖得率的影响
Fig. 1 Effect of ultrasonic treatment time on polysaccharide yield
|
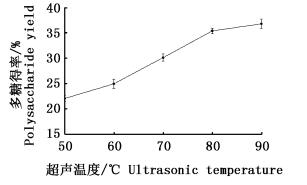
如图 2所示,随着超声温度升高,多糖提取率也逐渐提高,超声温度80 ℃时达到最大值,温度超过80 ℃后,多糖得率增幅趋于平缓。这说明温度升高有利于大石花菜多糖溶出,但温度继续提高组织细胞破碎率则会趋于平衡从而多糖得率也随之趋于平衡。
|
图 2 超声温度对多糖得率的影响
Fig. 2 Effect of ultrasonic treatment temperature on polysaccharide yield
|
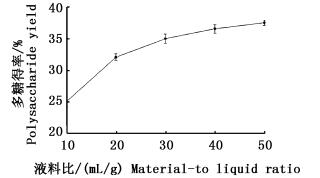
由图 3知,多糖提取率随液料比增大而逐渐增大,液料比超过30 mL/g时,增幅趋于平缓。在一定范围内,增大溶剂用量有利于提高扩散速度和多糖提取率,但达到一定限度后,溶剂用量对得率的影响逐渐减小,且溶剂过多会影响后续实验的可操作性,故选择液料比为30 mL/g。
|
图 3 液料比对多糖得率的影响
Fig. 3 Effect of liquid-to-material ratio on polysaccharide yield
|
根据Box-Benhnken的中心组合试验设计原理进行响应面试验,每组试验重复进行3次,取多糖得率的平均值为结果,如表 2。

|
表 2 超声波提取大石花菜多糖响应面试验设计及结果 Tab.2 Experimental design and corresponding results of response surface analysis for optimizing ultrasonic-assistant extraction of polysaccharides from Gelidium pacifium Okam. |
采用Design-Expert 8软件对表 2结果进行多元回归拟合,得多糖得率对超声温度(A)、超声时间(B)、液料比(C)的二次多项式回归模型:
Y = 30.25 + 2.87 A + 0.21 B + 0.87 C - 1.5 AB + (5.000E-003) AC +0.29 BC - 3.04 A2-3.14 B2-0.68 C2
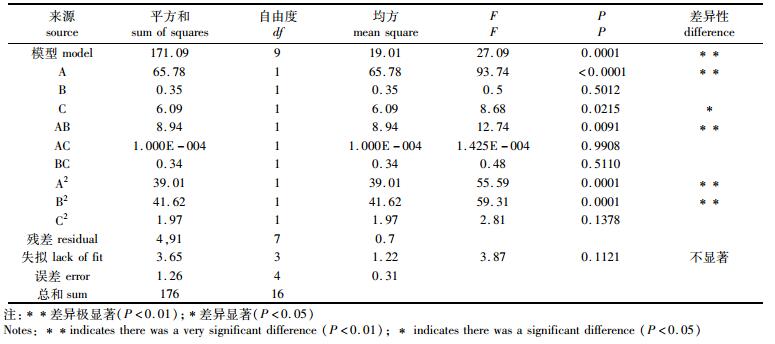
分析表 3知,因变量与各自变量的线性关系十分显著,模型P远远小于0.05(P越小则显著性越高),该模型相关系数R2=模型/总量=171.09/176=0.9721,说明模型拟合程度良好,并且失拟项检验P不显著,表明模型不失拟,这意味着所建立的回归二次模型成立,可用此模型来分析和预测超声波提取大石花菜多糖的工艺条件[21]。根据表 3中数据显著性可知,超声温度和液料比的变化对多糖得率影响最大,可根据P对3个影响多糖得率的主次因素进行排序:超声温度>液料比>超声时间。综合回归模型和试验显著性分析,得超声辅助提取大石花菜多糖最佳工艺条件:超声温度84.84 ℃、超声时间49.47 min、液料比36.28 mL/g,多糖提取率为31.21%。
|
表 3 回归模型的方差分析 Tab.3 Variance analysis for the established regression model |
从表 3的P和图 4可知,超声时间和超声温度交互作用为极显著水平(P<0.01)。当超声时间一定时,随着超声温度的延长,多糖得率不断增加且增加幅度逐渐趋于平缓。这可能是由于温度的提高增加了溶剂和溶质分子的运动,促进扩散作用但由于其他条件的限制促进作用逐渐降低。当超声温度一定时,随超声时间的增加,多糖得率呈现先升高后降低的趋势。这是因为大石花菜细胞壁及组织的破碎和细胞内容物的释放都需要一定时间,当多糖没有完全破碎时,超声时间越长,越有利于组织完全破碎,从而提高多糖得率。但超声时间增加到一定程度,持续的超声剪切作用会导致多糖部分降解,使多糖得率下降[22]。而超声温度与液料比的交互作用、超声时间与液料比的交互作用不明显,但是从图 4可看出,超声温度一定时,随着液料比增加多糖得率不断增加。料液比一定时,随着超声温度的增加多糖得率先增加后趋于平缓,而随着超声时间的不断增加多糖得率先增加后减小。

|
图 4 因素对大石花菜多糖得率交互影响的响应面图和等高线图
Fig. 4 Response surface and contour plots showing the interactive effects of ultrasonic temperature, ultrasonic duration and liquid-material ratio on polysaccharide yield from Gelidium pacifium Okam.
|
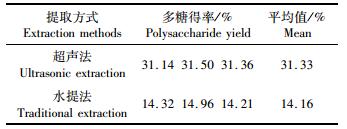
综合回归模型和试验显著性分析,得超声辅助提取大石花菜多糖最佳工艺条件:超声温度84.84℃、超声时间49.47 min、液料比36.28 mL/g,多糖提取率为31.21%。但考虑到实际操作的便利,将最佳工艺条件修正为:超声温度85 ℃、超声时间50 min、液料比36 mL/g,并在此条件下进行了验证实验,同时比较相同提取条件下传统水提法与超声辅助提取法的优劣。从表 4中可以看出,实际超声法提取率与模型中提取率相近,表明该条件的可行性。同时超声法与水提法相比优势在于提取率更高。
|
表 4 两种提取法多糖得率的比较 Tab.4 Comparison between ultrasonic extraction and traditional water extraction of polysaccharide yield from Gelidium pacifium Okam. |
由图 5可知,大石花菜多糖和Vc对DPPH自由基的清除能力随着质量浓度的升高而不断增强。在相同质量浓度下,DPPH自由基的清除能力大小依次为Vc > PGPO-UE > PGPO-AE,如在5 mg/mL时,PGPO-UE、PGPO-AE及Vc的DPPH自由基清除率分别为26.03 %、17.10 %和96.54 %。

|
图 5 大石花菜多糖对DPPH自由基的清除能力
Fig. 5 DPPH radical-scavenging activity of polysaccharides from Geligium pacifium Okam.
|
由图 6可知,随大石花菜多糖质量浓度的提高,其ABTS自由基的清除能力也不断提高,当浓度为20 mg/mL时,超声提取大石花菜多糖的自由基清除能力达到27.77 %。从整体上看,同等质量浓度下PGPO-UE的ABTS自由基清除能力都大于PGPO-AE,但仍远低于Vc。

|
图 6 大石花菜多糖对ABTS自由基的清除能力
Fig. 6 ABTS radical-scavenging activity of polysaccharides from Gelidium pacifium Okam.
|
由图 7可知,3种样品超氧阴离子自由基的清除能力均随质量浓度的增加而增强,且大石花菜多糖超氧阴离子的清除能力较好,浓度为8 mg/mL时清除率几乎达到50 %,随着浓度进一步提高,其清除率接近Vc。总体上比较3种样品超氧阴离子自由基的清除能力大小:Vc > PGPO-UE > PGPO-AE。

|
图 7 大石花菜多糖对超氧阴离子自由基的清除能力
Fig. 7 Superoxide anion free radical-scavenging activityof polysaccharides from Gelidium pacifium Okam.
|
超声辅助提取是利用超声波的机械作用、空化作用和热效应等促进细胞破碎、加快分子运动的速度和频率、加速细胞内容物在提取溶剂中的溶解,从而提高物质的提取率[23-24],与其他提取方法相比[25-26],具有节省时间、节约能源、提取效率高等特点。本试验通过响应面试验优化,确定了超声辅助提取大石花菜多糖最佳工艺条件:超声温度85℃、超声时间50 min、液料比36 mL/g,多糖得率约为31%。超声辅助提取法与传统的水提法相比,多糖提取率更高并且大大节省了提取时间。因此,超声辅助提取大石花菜多糖工艺优化的研究对其深加工利用以及实际生产具有指导意义。
本试验还考察了大石花菜多糖的抗氧化活性。结果表明,大石花菜多糖具有一定抗氧化活性,尤其是对超氧阴离子自由基的清除能力。超声辅助提取法相比水提法得到的大石花菜多糖抗氧化活性更强,这可能与超声辅助提取使其暴露了更多活性基团有关。大石花菜多糖较好的抗氧化活性,使其被开发成抗氧化药物或食品添加剂等产品成为了可能,为大石花菜进一步深入探究提供了理论依据,并为其在食品、医药等领域的广泛应用打下基础。
| [1] |
李经纬, 邓铁涛. 中医大辞典[M]. 北京: 人民卫生出版社, 1995: 243-246. LI J W, DENG T T. Chinese medicine dictionary[M]. Beijing: People's Medical Publishing House, 1995: 243-246. |
| [2] |
SASUGA K, YAMANASHI T, NAKAYAMA S, et al. Optimization of yield and quality of agar polysaccharide isolated from the marine red macroalga Pyropia yezoensis[J]. Algal Research, 2017, 26: 123-130. DOI:10.1016/j.algal.2017.07.010 |
| [3] |
ZHANG L J, CHENG Z, ZHAO Q, et al. Green and efficient PEG-based ultrasound-assisted extraction of polysaccharides from superfine ground lotus plumule to investigate their antioxidant activities[J]. Industrial Crops and Products, 2017, 109: 320-326. DOI:10.1016/j.indcrop.2017.08.018 |
| [4] |
许瑞波, 吴琳, 王吉, 等. 石花菜多糖的提取工艺及其抗氧化活性研究[J]. 淮海工学院学报(自然科学版), 2011, 20(2): 38-41. XU R B, WU L, WANG J, et al. Study on the extraction and antioxidant activity of polysaccharides from Gelidium amansii[J]. Journal of Huaihai Institute of Technology (Natural Science Edition), 2011, 20(2): 38-41. DOI:10.3969/j.issn.1672-6685.2011.02.011 |
| [5] |
严宏谟, 李龙章, 王永保, 等. 海洋大辞典[M]. 沈阳: 辽宁人民出版社, 1998: 67-69. YAN H M, LI L Z, WANG Y B, et al. A dictionary of marine science[M]. Shenyang: Liaoning People's Publishing House, 1998: 67-69. |
| [6] |
YU H, WANG C, DENG S T, et al. Optimization of ultrasonic-assisted extraction and UPLC-TOF/MS analysis of limonoids from lemon seed[J]. LWT, 2017, 84: 135-142. DOI:10.1016/j.lwt.2017.05.059 |
| [7] |
HNINI M C, BENCHANAA M, El HAMMIOUI M. Study of the interaction between water and Gelidium sesquipedale (Rhodophyta). Part Ⅰ:thermodynamic aspect of the sorption equilibrium[J]. Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(5): 795-801. DOI:10.1016/j.jtice.2013.01.023 |
| [8] |
MITTAL R, TAVANANDI H A, MANTRI V A, et al. Ultrasound assisted methods for enhanced extraction of phycobiliproteins from marine macro-algae, Gelidium pusillum (Rhodophyta)[J]. Ultrasonics Sonochemistry, 2017, 38: 92-103. DOI:10.1016/j.ultsonch.2017.02.030 |
| [9] |
YANG T H, YAO H T, CHIANG M T. Red algae (Gelidium amansii) hot-water extract ameliorates lipid metabolism in hamsters fed a high-fat diet[J]. Journal of Food and Drug Analysis, 2017, 25(4): 931-938. DOI:10.1016/j.jfda.2016.12.008 |
| [10] |
ZHU W L, XUE X P, ZHANG Z J. Ultrasonic-assisted extraction, structure and antitumor activity of polysaccharide from Polygonum multiflorum[J]. International Journal of Biological Macromolecules, 2016, 91: 132-142. DOI:10.1016/j.ijbiomac.2016.05.061 |
| [11] |
马瑞君, 郭守军, 杨永利, 等. 正交试验法优选坛紫菜多糖的提取工艺[J]. 食品科学, 2006, 27(12): 524-526. MA R J, GUO S J, YANG Y L, et al. Optimizing technique of extracting polysaccharide from Gracilaria lamaneiformis by Orthogonal test[J]. Food Science, 2006, 27(12): 524-526. DOI:10.3321/j.issn:1002-6630.2006.12.130 |
| [12] |
杨华, 庄陈丰. 响应面法优化微波辅助提取龙须菜多糖工艺及其抗氧化活性研究[J]. 食品科学, 2011, 32(20): 79-83. YANG H, ZHUANG C F. Gracilaria lamaneiformis polysaccharides:optimization of microwave-assisted extraction by response surface methodology and antioxidant properties[J]. Food Science, 2011, 32(20): 79-83. |
| [13] |
俞瑜, 余筱洁, 周存山, 等. 响应面法优化石花菜琼脂多糖提取工艺[J]. 粮油加工, 2010(12): 153-156. YU Y, YU X J, ZHOU C S, et al. Optimization of Gelidium amansii agar polysaccharides extraction by response surface methodology[J]. Cereals and Oils Processing, 2010(12): 153-156. |
| [14] |
刘晓鹏, 张俊霞, 姜宁, 等. 响应面试验优化超声辅助提取连钱草多糖工艺及其体外抗氧化活性[J]. 食品科学, 2016, 37(4): 13-19. LIU X P, ZHANG J X, JIANG N, et al. Optimization by response surface methodology of ultrasound-assisted extraction and antioxidant activities of polysaccharides from Glechoma longituba (Nakai) Kupr[J]. Food Science, 2016, 37(4): 13-19. |
| [15] |
卫强, 桂芹, 邱镇, 等. 紫荆花中多糖的微波提取工艺优化及其抗氧化活性[J]. 食品科学, 2015, 36(4): 39-44. WEI Q, GUI Q, QIU Z, et al. Microwave-assisted extraction and antioxidant activities in vitro of polysaccharides from Cercis chinensis bunge flowers[J]. Food Science, 2015, 36(4): 39-44. |
| [16] |
于慧, 李明艳, 张典, 等. 响应面试验优化裙带菜蛋白酶解工艺及酶解液抗氧化活性[J]. 食品科学, 2015, 36(6): 96-103. YU H, LI M Y, ZHANG D, et al. Optimization of enzymatic hydrolysis of Undaria pinnatifida protein and antioxidant activity of its hydrolysate[J]. Food Science, 2015, 36(4): 39-44. |
| [17] |
邱现创, 赵宁, 李晨, 等. 铁皮石斛多糖提取工艺优化及对果蝇抗氧化能力的影响[J]. 食品科学, 2018, 39(2): 273-280. QIU X C, ZHAO N, LI C, et al. Optimization of extraction of polysaccharide from Dendrobium officinale and its antioxidant effect on drosophila melanogaster[J]. Food Science, 2018, 39(2): 273-280. |
| [18] |
王智荣, 崔春, 林宗毅, 等. 海带多糖及其纯化组分的胆酸盐吸附能力及抗氧化活性[J]. 食品科学, 2016, 37(1): 22-27. WANG Z R, CUI C, LIN Z Y, et al. Bile salt adsorption capacity and antioxidant activity of polysaccharide extract from Laminaria japonica and its fractions[J]. Food Science, 2016, 37(1): 22-27. |
| [19] |
KANG C C, HAO L M, ZHANG L M, et al. Isolation, purification and antioxidant activity of polysaccharides from the leaves of maca (Lepidium Meyenii)[J]. International Journal of Biological Macromolecules, 2018, 107: 2611-2619. DOI:10.1016/j.ijbiomac.2017.10.139 |
| [20] |
王燕华, 武福华, 郭昭涵, 等. 响应面试验优化丹参中多糖的超声波提取工艺及其抗氧化活性[J]. 食品科学, 2015, 36(18): 7-12. WANG Y H, WU F H, GUO Z H, et al. Optimization of ultrasonic-assisted extraction and antioxidant activities of polysaccharides from the roots of Salvia miltiorrhiza bge[J]. Food Science, 2015, 36(18): 7-12. DOI:10.7506/spkx1002-6630-201518002 |
| [21] |
陈湘宁, 李宇华, 丁轲, 等. 响应面法优化超声波辅助提取柿子多糖工艺的研究[J]. 中国食品学报, 2012, 12(7): 105-111. CHEN X N, LI Y H, DING K, et al. Optimization of ultrasonic-assisted extraction of polysaccharide from persimmon by response surface methodology[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(7): 105-111. DOI:10.3969/j.issn.1009-7848.2012.07.016 |
| [22] |
赵鹏, 李稳宏, 朱骤海, 等. 响应面法优化金银花多糖超声提取工艺研究[J]. 食品科学, 2009, 30(20): 151-154. ZHAO P, LI W H, ZHU Z H, et al. Optimization of ultrasonic extraction for polysaccharides from Lonicera japonica[J]. Food Science, 2009, 30(20): 151-154. |
| [23] |
夏苗芬. 中药制剂检验技术[M]. 郑州: 河南科学技术出版社, 2014. XIA M F. Chinese medicine preparation inspection technology[M]. Zhengzhou: Henan Science and Technology Publishing House, 2014. |
| [24] |
秦梅颂. 超声提取技术在中药中的研究进展[J]. 安徽农学通报, 2010, 16(13): 54-55. QIN M S. Research progress of ultrasonic extraction in chinese traditional medicine[J]. Anhui Agricultural Science Bulletin, 2010, 16(13): 54-55. DOI:10.3969/j.issn.1007-7731.2010.13.023 |
| [25] |
宋思圆.黄秋葵花多糖的超声提取及其结构和抗氧化活性研究[D].杭州: 浙江大学, 2017. SONG S Y. Structure and antioxidant activity study of polysaccharides by ultrasound assited extraction from okra flowers[J]. Hangzhou: Zhejiang University, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10335-1017071371.htm |
| [26] |
唐丽娟, 钱丽, 刘玮炜, 等. 石花菜提取物对酪氨酸酶活性的影响研究[J]. 日用化学工业, 2012, 42(6): 410-412. TANG L J, QIAN L, LIU W W, et al. Effect of edible seaweed extract on tyrosinase activity[J]. China Surfactant Detergent & Cosmetics, 2012, 42(6): 410-412. |
2. Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


