2. 农业部西北地区渔业资源环境科学观测实验站, 新疆 乌鲁木齐 830000
扁吻鱼(Aspiorhynchus laticeps)俗称新疆大头鱼,体长,头大,吻扁,眼小,生长缓慢,隶属于硬骨鱼纲(Osteichyes)、鲤形目(Cyprinformes)、鲤科(Cyprinidae)、扁吻鱼属(Aspiorhynchus Kessler)。扁吻鱼1属1种,是我国塔里木河水系特有肉食鱼类,主要以塔里木裂腹鱼、高原鳅和草鲤鱼等为食[1]。由于过度捕捞和环境破坏,扁吻鱼在1998年被列为国家Ⅰ类保护动物,因此又被称为“水中大熊猫”和“古鱼类活化石”,具有很高的经济价值和科研价值[2]。
麻醉剂在挑选苗种、人工繁育、鱼体测量、标记、运输、采血样和活体组织观察等方面具有广泛的用途[3-4],通过麻醉,不仅能避免鱼体在操作过程中受到损伤[5],而且还能减轻操作引起的导致鱼体免疫低下和生长受阻的应激反应[6-7]。不同的鱼类对于相同麻醉剂的最适浓度不同[8],目前关于其他鱼类的麻醉研究[3-7]很多,但是未见有关于扁吻鱼麻醉实验的相关报道。扁吻鱼是新疆土著鱼类,地处偏远,探究扁吻鱼的经济和学术价值首先要解决的就是运输问题,麻醉剂的使用可以提升扁吻鱼在运输过程中的成活率和减少损伤。综上,进行扁吻鱼麻醉实验具有重要意义。2-苯氧乙醇(2-phenoxyethanol)是使用最广泛的麻醉剂之一[9-10],由于其价格低、准备方便和反应灵敏,且具有灭杀细菌和真菌的作用[11],被认为是一种优良的麻醉剂[12-14]。本文探讨2-苯氧乙醇对扁吻鱼麻醉效果,研究不同条件下扁吻鱼幼鱼的行为变化,分析不同麻醉阶段和复苏阶段的呼吸频率和耗时的差异,旨在为今后扁吻鱼的研究和经济价值的开发提供理论支撑。
1 材料与方法 1.1 实验材料实验选用新疆维吾尔自治区水生野生动物救护中心培育的扁吻鱼幼鱼,全长(12.96±0.32) cm,体质量(9.91±0.31) g。
1.2 培养方案对鱼苗养殖池塘全池撒网,选取活泼健康的扁吻鱼幼鱼作为实验用鱼,挑选一定数量后转入养殖车间养殖槽暂养,暂养时间30 d,使幼鱼完全适应车间环境。车间水温(11.50±0.55) ℃,pH 7.3±0.23,溶氧(9.85±0.43) mg/L,光照控制12D:12 L,每天早中晚喂食3次,实验开始前停食1 d。
化学麻醉剂选择的是德国巴斯夫(O-BASF)生产的2-苯氧乙醇。
1.3 实验方法 1.3.1 扁吻鱼幼鱼麻醉阶段和复苏阶段的行为学观察配置2-苯氧乙醇浓度为600 μL/L的麻醉液,选取6条扁吻鱼幼鱼逐条放入麻醉液中观察幼鱼在不同麻醉阶段的行为变化,以停止呼吸作为临界点,迅速将鱼转入清水中复苏,观察鱼体不同复苏阶段的行为变化,参考WEBER等[4]和ROSS等[14]的分期标准,结合扁吻鱼自身的行为特征进行分期。
1.3.2 2-苯氧乙醇麻醉浓度测定目前研究[12, 15]结果表明,2-苯氧乙醇的最适麻醉浓度为200~600 μL/L,因此选取50、100、200、400、600、800和1 000 μL/L作为实验浓度,0 μL/L作为对照组。参照以往研究[12, 15]得出的最适浓度范围,将所选浓度分为高低浓度两组,其中0、50、100、200 μL/L是低浓度组,0、400、600、800、1 000 μL/L是高浓度组。每个浓度设置3组平行,每个平行3条鱼,从放入麻醉液中开始计时,每30 s统计实验鱼10 s的鳃盖张合次数,观察鱼体的行为特征,整个麻醉时间为5 min,在5 min内扁吻鱼幼鱼呼吸停止的以呼吸停止点结束计时,统计麻醉时间,确定扁吻鱼幼鱼麻醉的最适浓度范围,即3 min麻醉,5 min苏醒[4]。
1.3.3 空气暴露时间对扁吻鱼幼鱼复苏的影响依据1.3.2节的实验结果得出最适浓度范围,选取有效范围内的最高浓度对鱼体进行麻醉,随后将幼鱼在空气中暴露,暴露时间为2、4、8、12、16和32 min,暴露0 min作为对照组,每个时间段设置3组平行,每个平行3条鱼,观察幼鱼的行为特征。到达暴露时间后将幼鱼迅速转入清水复苏,统计鱼体的复苏时间和复苏率。
1.3.4 不同溶解氧浓度对扁吻鱼幼鱼复苏的影响依据1.3.2节的实验结果得出最适浓度范围,选取有效范围内的最高浓度对鱼体进行麻醉,随后转入不同氧浓度的清水中进行复苏,不同氧浓度的制定通过在水中放置微孔气盘充入氧气获得,氧浓度通过溶氧仪测定,每组氧浓度的误差不超过±0.05 mg/L,氧浓度设定为4、8、12、16、18、22 mg/L。每个氧浓度下设置3组平行,每个平行3条鱼,统计鱼体的复苏时间和复苏率。
1.4 数据统计采用Excel 2007整理实验数据并统计作图。SPSS Statistics 23.0软件对各组数据进行单因素方差分析(One-Way ANOVA),差异显著水平设置为P < 0.05,数据采用平均值±标准差表示。
2 结果 2.1 扁吻鱼幼鱼麻醉阶段和复苏阶段的行为特征在麻醉和复苏的不同阶段,扁吻鱼幼鱼的行为发生变化,根据扁吻鱼幼鱼行为特征的变化将其麻醉阶段分为5个时期(表 1),复苏阶段分为4个时期(表 2)。

|
表 1 麻醉阶段的行为特征 Tab.1 Exhibited behaviors of anaesthesia stages |

|
表 2 复苏阶段的行为特征 Tab.2 Exhibited behaviors of recovery stages |
如表 1所示,正常状态下,扁吻鱼鳃盖张合正常,身体平衡性好,反应灵敏,此阶段标为NR。将鱼体放入麻醉液中,由于环境的变化和麻醉液的刺激,鱼体在初期会快速游动,呼吸加快,适应后,鳃盖张合频率降低,游泳缓慢,但身体平衡性仍良好,对外界反应较灵敏,鱼体进入IS1(induction stage 1)。随着时间的增加,扁吻鱼幼鱼鳃盖张合频率继续减弱,身体开始左右摇晃,但能勉强保持平衡,并伴有蹿跳行为发生(IS2)。幼鱼在进入IS3时,鱼体已经翻转,腹部朝上,呼吸减弱且无规律,出现无意识游动。随后扁吻鱼幼鱼鳃盖停止张合,腹部朝上,沉入水底,鱼体进入休克状态(IS4)。将进入休克的扁吻鱼幼鱼转入清水后(表 2),首先鳃盖恢复运动(RS1),鱼体逐渐恢复平衡,直至行为完全恢复正常(RS4)。
2.2 2-苯氧乙醇的麻醉效果 2.2.1 不同浓度2-苯氧乙醇麻醉下扁吻鱼幼鱼的麻醉效果如表 3所示,在低浓度2-苯氧乙醇麻醉下,0~30 s内,扁吻鱼幼鱼基本停留在NS,行为特征与对照组无明显变化。60 s后,100和200 μL/L组开始进入IS1,随后稳定,直至实验截止5 min时,两组的扁吻鱼幼鱼仍停留在IS1。400 μL/L组在开始30 s内已100%进入IS1,并在随后的时间段内逐步进入IS4,但是至实验截止仍有44.44%停留在IS3。600~800 μL/L高浓度组的扁吻鱼幼鱼在30 s已经完全进入麻醉阶段,1 000 μL/L组66.67%的幼鱼已经进入IS2,还有33.33%已经进入IS3,麻醉3 min后,800和1 000 μL/L组的幼鱼全部进入IS4,600 μL/L仅1条进入IS4。在实验截止5 min时,600 μL/L组仅余1条停留在IS3。

|
表 3 扁吻鱼幼鱼在不同麻醉阶段的比例 Tab.3 The proportion of juvenile A. laticeps of different anesthesia stages |
如图 1所示,不同2-苯氧乙醇浓度下扁吻鱼幼鱼的呼吸发生变化。当麻醉液浓度为50 μL/L时,扁吻鱼幼鱼的鳃盖张合频率与对照组无显著变化,但不同时间段的呼吸出现波动。当浓度达到100和200 μL/L时,幼鱼在前30 s鳃盖张合频率会出现明显下降,在30~60 s时,鳃盖张合频率又开始上升,随后整体趋于稳定(图 1a),但低于对照组(P < 0.05)。当浓度达到400和600 μL/L时,幼鱼的鳃盖张合频率在0~30 s显著下降,随后在30~210 s内保持在7次/10 s左右,然后出现下降,与对照组差异显著(P < 0.05)。在300 s时,600 μL/L组的88.89%的幼鱼已经完全麻醉,进入休克状态,400 μL/L组仅有55.56%进入休克,未休克幼鱼鳃盖张合频率维持在7次/10 s左右。800和1 000 μL/L组的幼鱼鳃盖张合频率都呈斜线下降,其中1 000 μL/L下降较快(图 1b),但两组都可以在180 s内全部进入休克,且不同时期呼吸频率显著低于对照(P < 0.05)。
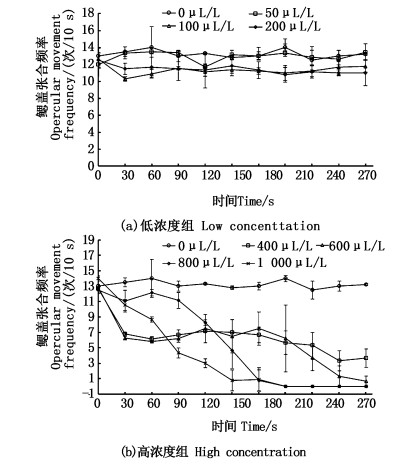
|
图 1 2-苯氧乙醇对扁吻鱼幼鱼鳃盖张合频率的影响 Fig. 1 Effect of 2-phenoxyethanol on opercular movement frequency of juvenile A. laticeps |
如图 2所示,扁吻鱼在400~800 μL/L下复苏的时间随着2-苯氧乙醇浓度的增加逐渐增加。400 μL/L组在放入清水中(155.37±13.00) s即可完全复苏,显著低于800和1 000 μL/L(P < 0.05),与600 μL/L无显著差异(P>0.05)。800和1 000 μL/L组的复苏时间高于400和600 μL/L,复苏时间分别为(284.38±61.26)和(308.67±31.35) s,分别是400 μL/L组的1.83和1.99倍(P < 0.05)。600和400、800 μL/L组无明显差异(P>0.05),但较400 μL/L组复苏时间增加23.58%,较800 μL/L组复苏时间减少48.11%。
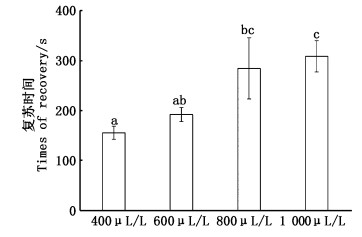
|
图 2 2-苯氧乙醇对扁吻鱼复苏的影响 Fig. 2 Effect of 2-phenoxyethanol on recovery of juvenile A. laticeps |
如图 3所示,随着暴露时间的增加,扁吻鱼幼鱼的复苏时间逐渐变短,且各组复苏率均为100%。暴露时间为2 min时,幼鱼的复苏时间为(287.22±17.91) s,比对照组降低6.81%(P < 0.05)。当暴露时间达到12 min时,将鱼体转入清水中复苏需(166.22±32.68) s,仅为对照组的53.90%,与对照组差异显著(P < 0.05)。扁吻鱼幼鱼在暴露0~12 min内呈休克状态,在12 min后,部分幼鱼鳃盖开始无规律张合,到32 min时,已有部分幼鱼鱼尾开始摆动,但对外反应能力弱,放入清水后,可在(100.56±10.60) s内快速复苏,比对照组低67.60%(P < 0.05)。

|
图 3 暴露时间对扁吻鱼幼鱼复苏的影响 Fig. 3 Effect of exposure duration on recovery of juvenile A. laticeps |
如图 4所示,扁吻鱼幼鱼在不同溶氧清水中复苏的时间存在差异,呈中间低,两边高的趋势。当溶解氧在8和22 mg/L时所需的复苏时间分别为(352±88.07)和(406.33±53.20) s,显著高于12、16和18 mg/L组(P < 0.05)。其中12 mg/L时所需复苏时间最短,仅需(129±36.50) s,22 mg/L的复苏时间最长,两组间相差高达2.15倍(P < 0.05)。当溶解氧在4和8 mg/L时分别比12 mg/L高出173.87%和182.17%(P < 0.05)。16和18 mg/L组虽有所增高,但与12 mg/L组无明显差异(P>0.05),且均显著低于其他3个实验组(P < 0.05)。
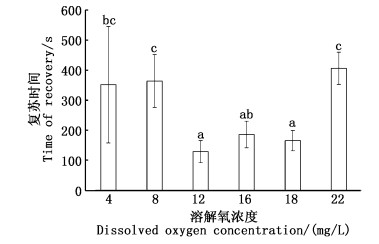
|
图 4 不同溶氧下扁吻鱼幼鱼的复苏时间 Fig. 4 Recovery time of different dissolved oxygen of juvenile A. laticeps |
本研究表明,扁吻鱼幼鱼麻醉时间随着麻醉剂浓度的增加而缩短,这与2-苯氧乙醇对海鲈(Dicentrarchus labrax) [16]、塞内加尔鳎(Solea senegalensis)[4]、黑鲫(Carassius carassius)[7]和军曹鱼(Rachycentron canadu)[17]的麻醉效果一致。扁吻鱼幼鱼的复苏时间随着浓度的增加而延长,这种现象也在几种传统的硬骨鱼[18]、大马哈鱼(Sockeye salmon)[19]和军曹鱼[17]中有相同的研究结果。因此,可以得出扁吻鱼幼鱼的麻醉时间与麻醉浓度呈负向关,复苏时间与麻醉浓度呈正相关。但是也有学者得出不同的结论,如MYLONAS等[16]在对海鲈研究发现海鲈复苏时间也会随着麻醉浓度的增加而降低。这主要是因为影响鱼体麻醉效果的因素多种多样,鱼体的长度、重量、雌雄、性成熟程度、油脂含量、健康状况、放养密度和鳃的表面积等生物因素和温度、pH、盐度、溶氧和水中矿物质等环境因素都会影响麻醉效果[13],实验鱼的不同的也会影响麻醉效果[4]。
3.2 2-苯氧乙醇扁吻鱼幼鱼的理想麻醉浓度MARKING等[20]定义在3 min内麻醉,5 min内苏醒为最适麻醉浓度,根据研究报道,2-苯氧乙醇对多数鱼类而言浓度范围为200~600 μL/L[12, 15, 21],如关健等[22]研究表明2-苯氧乙醇对许氏平鲉幼鱼的最适麻醉浓度为300 μL/L;海鲷在最低167 μL/L时就可以在3 min内麻醉[13],在对金鱼(Carassius auratus)[23]和塞内加尔鳎(Solea senegalensis)[4]的研究认为2-苯氧乙醇麻醉液浓度为600 μL/L时可在3 min内麻醉。由图 1和图 2看出,扁吻鱼幼鱼在浓度为600 μL/L时,幼鱼可以在300 s内麻醉,192 s苏醒,在浓度为800和1 000 μL/L时,幼鱼可以在180 s内麻醉,在800 μL/L幼鱼需要284 s苏醒,而在1 000 μL/L时苏醒时间为308 s,综上,2-苯氧乙醇对扁吻鱼幼鱼有效浓度范围为800~1 000 μL/L。这个浓度显著高于其他实验幼鱼浓度,但是,PAWAR等[24]对海马(Hippocampus kuda)研究认为海马的理想浓度为1 000 μL/L。这主要有以下两种原因:第一,因为鱼种的原因,种类[25-26]和生理结构不同导致差异的产生[4];第二,有环境差异的影响,本研究的水体温度为11.5 ℃,低于其他实验水温,溶氧偏高,这就导致鱼体在较低的呼吸频率下就能满足鱼体的耗氧量,而麻醉剂的摄入主要由鳃进入[24],从而使扁吻鱼幼鱼在理想时间内进入麻醉需要的麻醉剂浓度增加。
3.3 扁吻鱼麻醉和复苏的影响因子在空气中暴露,扁吻鱼幼鱼处于休克状态,鳃盖闭合,无法用鳃呼吸,暴露时间越长,复苏时间越短,这与在长鳍吻
由图 4可知,扁吻鱼幼鱼在不同溶解氧水中恢复的时间不同,在溶氧22 mg/L时幼鱼需要406.33 s才能复苏,但在12~18 mg/L时,幼鱼的最高复苏时间为(186±44.31) s,比本实验正常条件下低近40%,表明一定程度的增氧是有利于扁吻鱼幼鱼在2-苯氧乙醇麻醉下复苏的,但是过高增氧则不利于复苏,RITOLA等[30]也认为在过饱和的溶氧中会使鱼体的鳃和其他组织细胞受到氧化损伤,从而影响呼吸和生长代谢。杨凯等[31]对黄颡鱼(Pelteobag rus fulvidraco)研究发现高氧会给黄颡鱼的摄食和生长代谢带来负面作用,因此在今后进行扁吻鱼麻醉运输实验时不能一味追求高氧,而是应该根据鱼体条件和实验目的选择合适的氧浓度。
本次研究还发现,较大的扁吻鱼幼鱼比较小的扁吻鱼幼鱼麻醉时间要长,即体质量越大鱼麻醉时间越长[13]。SMALL等[32]认为这是因为大的鱼体需要更大剂量的麻醉,对金鱼的研究也表明体质量与麻醉的关系[23]。但是KRAMP等[15]和STEHLY等[33]研究却发现麻醉与体质量的关系不大,这主要是因为麻醉效果不仅与体质量有关,还与年龄、性成熟阶段、脂肪含量等都具有密切的联系[4, 13]。因此,今后再进行麻醉实验时应该多方位考虑环境因素和生理因素对麻醉的影响。
| [1] |
郭焱, 张人铭, 蔡林刚, 等. 新疆鱼类志[M]. 乌鲁木齐: 新疆科学技术出版社, 2012. GUO Y, ZHANG R M, CAI L G, et al. Fishes of Xinjiang[M]. Urumchi: Xinjiang Science & Technology Press, 2012. |
| [2] |
马燕武, 张人铭, 吐尔逊, 等. 温度和水流对扁吻鱼胚胎发育的影响[J]. 淡水渔业, 2008, 38(1): 57-61. MA Y W, ZHANG R M, TU E X, et al. Effects of water temperature and water current on the embryonic development of Aspiorhynchus laticeps[J]. Freshwater Fisheries, 2008, 38(1): 57-61. DOI:10.3969/j.issn.1000-6907.2008.01.014 |
| [3] |
IVERSEN M, FINSTAD B, MCKINLEY R S, et al. The efficacy of metomidate, clove oil, Aqui-STM and Benzoak® as anaesthetics in Atlantic salmon (Salmo salar L.) smolts, and their potential stress-reducing capacity[J]. Aquaculture, 2003, 221(1/4): 549-566. |
| [4] |
WEBER R A, PELETEIRO J B, MARTÍN L O G, et al. The efficacy of 2-phenoxyethanol, metomidate, clove oil and MS-222 as anaesthetic agents in the Senegalese sole (Solea senegalensis Kaup 1858)[J]. Aquaculture, 2009, 288(1/2): 147-150. |
| [5] |
JAVAHERY S, NEKOUBIN H, MORADLU A H. Effect of anaesthesia with clove oil in fish (review)[J]. Fish Physiology and Biochemistry, 2012, 38(6): 1545-1552. DOI:10.1007/s10695-012-9682-5 |
| [6] |
ROUBACH R, GOMES L C, FONSECA F A L, et al. Eugenol as an efficacious anaesthetic for tambaqui, Colossoma macropomum (Cuvier)[J]. Aquaculture Research, 2005, 36(11): 1056-1061. DOI:10.1111/are.2005.36.issue-11 |
| [7] |
HEO G J, SHIN G. Efficacy of benzocaine as an anaesthetic for Crucian carp (Carassius carassius)[J]. Veterinary Anaesthesia and Analgesia, 2010, 37(2): 132-135. DOI:10.1111/j.1467-2995.2009.00510.x |
| [8] |
KING V W, HOOPER B, HILLSGROVE S, et al. The use of clove oil, metomidate, tricaine methanesulphonate and 2-phenoxyethanol for inducing anaesthesia and their effect on the cortisol stress response in black sea bass (Centropristis striata L.)[J]. Aquaculture Research, 2005, 36(14): 1442-1449. DOI:10.1111/are.2005.36.issue-14 |
| [9] |
BURKA J F, HAMMELL K L, HORSBERG T E, et al. Drugs in salmonid aquaculture-A review[J]. Journal of Veterinary Pharmacology and Therapeutics, 1997, 20(5): 333-349. DOI:10.1046/j.1365-2885.1997.00094.x |
| [10] |
SVOBODA M, KOLAROVA J. Survey of anaesthetics used in the fish farming[C]//Proceedings of Health Protection of Fish-Proceeding of Papers. Czech Republic: Research Institute of Fish Culture and Hydrobiology Vodňany, 1999.
|
| [11] |
JOLLY D W, MAWDESLEY-THOMAS L E, BUCKE D. Anaesthesia of fish[J]. Veterinary Record, 1972, 91(18): 424-426. DOI:10.1136/vr.91.18.424 |
| [12] |
ORTUÑO J, ESTEBAN M A, MESEGUER J. Effects of phenoxyethanol on the innate immune system of gilthead seabream (Sparus aurata L.) exposed to crowding stress[J]. Veterinary Immunology and Immunopathology, 2002, 89(1/2): 29-36. |
| [13] |
TSANTILAS H, GALATOS A D, ATHANASSOPOULOU F, et al. Efficacy of 2-phenoxyethanol as an anaesthetic for two size classes of white sea bream, Diplodus sargus L., and sharp snout sea bream, Diplodus puntazzo C.[J]. Aquaculture, 2006, 253(1/4): 64-70. |
| [14] |
ROSS L G, ROSS B. Anaesthetic and sedative techniques for aquatic animals 3rd ed[M]. Oxford: Wiley-Blackwell, 2008.
|
| [15] |
KRAMP H H R, RAMOS L, BAKHTIAR R. A preliminary study on the feasibility of an automated blood-sampling system in conjunction with liquid chromatography/mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2001, 15(18): 1768-1772. DOI:10.1002/(ISSN)1097-0231 |
| [16] |
MYLONAS C C, CARDINALETTI G, SIGELAKI I, et al. Comparative efficacy of clove oil and 2-phenoxyethanol as anesthetics in the aquaculture of European sea bass (Dicentrarchus labrax) and gilthead sea bream (Sparus aurata) at different temperatures[J]. Aquaculture, 2005, 246(1/4): 467-481. |
| [17] |
GULLIAN M, VILLANUEVA J. Efficacy of tricaine methanesulphonate and clove oil as anaesthetics for juvenile cobia Rachycentron canadum[J]. Aquaculture Research, 2009, 40(7): 852-860. DOI:10.1111/are.2009.40.issue-7 |
| [18] |
CUNHA F E A, ROSA I L. Anaesthetic effects of clove oil on seven species of tropical reef teleosts[J]. Journal of Fish Biology, 2006, 69(5): 1504-1512. DOI:10.1111/jfb.2006.69.issue-5 |
| [19] |
WOODY C A, NELSON J, RAMSTAD K. Clove oil as an anaesthetic for adult Sockeye salmon: field trials[J]. Journal of Fish Biology, 2002, 60(2): 340-347. DOI:10.1111/jfb.2002.60.issue-2 |
| [20] |
MARKING L L, MEYER F P. Are better anesthetics needed in fisheries?[J]. Fisheries, 1985, 10(6): 2-5. DOI:10.1577/1548-8446(1985)010<0002:ABANIF>2.0.CO;2 |
| [21] |
MITJANA O, BONASTRE C, INSUA D, et al. The efficacy and effect of repeated exposure to 2-phenoxyethanol, clove oil and tricaine methanesulphonate as anesthetic agents on juvenile Angelfish (Pterophyllum scalare)[J]. Aquaculture, 2014, 433: 491-495. DOI:10.1016/j.aquaculture.2014.07.013 |
| [22] |
关健, 官曙光, 郑永允, 等. 2-苯氧乙醇和丁香酚对许氏平鲉幼鱼麻醉效果的实验研究[J]. 渔业科学进展, 2010, 31(6): 22-28. GUAN J, GUAN S G, ZHENG Y Y, et al. Effects of 2-phenoxyethanol and clove oil as anaesthetics on juvenile Sebastes schlegeli[J]. Process in Fishery sciences, 2010, 31(6): 22-28. DOI:10.3969/j.issn.1000-7075.2010.06.004 |
| [23] |
YASUI A M, YASUI G S, SHIMODA E, et al. Concentration of anaesthetic for long-term exposure and the effects of inter-suture distance in the gold fish Carassius auratus[J]. Acta Scientiarum Biological Sciences, 2009, 31(2): 203-207. |
| [24] |
PAWAR H B, SANAYE S V, SREEPADA R A, et al. Comparative efficacy of four anaesthetic agents in the yellow seahorse, Hippocampus kuda (Bleeker, 1852)[J]. Aquaculture, 2011, 311(1/4): 155-161. |
| [25] |
WEYL O, KAISER H, HECHT T. On the efficacy and mode of action of 2-phenoxyethanol as an anaesthetic for goldfish, Carassius auratus (L.), at different temperatures and concentrations[J]. Aquaculture Research, 1996, 27(10): 757-764. DOI:10.1111/j.1365-2109.1996.tb01234.x |
| [26] |
GOMES L C, CHIPPARI-GOMES A R, LOPES N P, et al. Efficacy of benzocaine as an anesthetic in juvenile tambaqui Colossoma macropomum[J]. Journal of the World Aquaculture Society, 2001, 32(4): 426-431. DOI:10.1111/jwas.2001.32.issue-4 |
| [27] |
管敏, 胡美洪, 刘勇, 等. MS-222对长鳍吻魚句幼鱼麻醉效果的研究[J]. 水产科技情报, 2015, 42(2): 72-77. GUAN M, HU M H, LIU Y, et al. The anaesthesia effects of MS-222 on juvenile Rhinogobio ven tralis[J]. Fisheries Science & Technology Information, 2015, 42(2): 72-77. |
| [28] |
何小燕, 袁显春, 潘志, 等. MS-222对布氏鲷幼鱼的麻醉效果研究[J]. 四川动物, 2013, 32(5): 729-733. HE X Y, YUAN X C, PAN Z, et al. The anaesthesia effects of MS-222 on juvenile Tilapia buttikoferi[J]. Sichuan Journal of Zoology, 2013, 32(5): 729-733. |
| [29] |
白艳龙.黄颡鱼保活技术研究[D].上海: 上海海洋大学, 2013. BAI Y L. Study on the keep-alive technology for yellow catfish[D]. Shanghai: Shanghai Ocean University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014013377.htm |
| [30] |
RITOLA O, LIVINGSTONE D R, PETERS L D, et al. Antioxidant processes are affected in juvenile rainbow trout (Oncorhynchus mykiss) exposed to ozone and oxygen-supersaturated water[J]. Aquaculture, 2002, 210(1/4): 1-19. |
| [31] |
杨凯, 樊启学, 张磊, 等. 溶氧水平对黄颡鱼稚鱼摄食、生长及呼吸代谢的影响[J]. 淡水渔业, 2010, 40(2): 24-29. YANG K, FAN Q X, ZHANG L, et al. Effects of dissolved oxygen on feed intake, growth and respiratory metabolism of juvenile Pelteobagrus fulvidraco R.[J]. Freshwater Fisheries, 2010, 40(2): 24-29. DOI:10.3969/j.issn.1000-6907.2010.02.005 |
| [32] |
SMALL B C. Anesthetic efficacy of metomidate and comparison of plasma cortisol responses to tricaine methanesulfonate, quinaldine and clove oil anesthetized channel catfish Ictalurus punctatus[J]. Aquaculture, 2003, 218(1/4): 177-185. |
| [33] |
STEHLY G R, GINGERICH W H. Evaluation of AQUI-STM (efficacy and minimum toxic concentration) as a fish anaesthetic/sedative for public aquaculture in the United States[J]. Aquaculture Research, 1999, 30(5): 365-372. DOI:10.1046/j.1365-2109.1999.00339.x |
2. Fishery Resources and Environment in Northwest China, Ministry of Agriculture, Urumqi 830000, Xinjiang, China
 2019,
Vol. 28
2019,
Vol. 28


