2. 国家远洋渔业工程技术研究中心, 上海 201306;
3. 大洋渔业资源可持续教育部重点实验室, 上海 201306;
4. 农业部大洋渔业开发重点实验室, 上海 201306;
5. 农业部大洋渔业资源环境科学观测实验站, 上海 201306
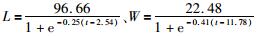 。
。近年来,克氏原螯虾(Procambarus clarkii)越来越受到人们的喜爱,成为餐桌上的一道美味,其经济效益和商业价值可观[1]。克氏原螯虾作为外来入侵物种,于20世纪30年代从日本传入我国,经过长期扩展,其资源数量和分布空间不断扩增[2],目前已经成为我国淡水虾类中的重要经济种类,广泛分布于长江中下游各省市[3]。鱼类生长是渔业种群研究的重要内容,是资源量评估的基础[4-6]。前人的研究普遍认为甲壳类的蜕壳生长贯穿其整个生命周期,相对于其他生物,甲壳类的生长是非连续性的,每次蜕壳生长过程都需要蜕去旧表皮,合成新表皮,因此其记录生物学信息的钙化结构丢失并被替换[7-8],这成为虾蟹类年龄鉴定和生长分析的棘手问题。早期学者采用饲养法、标记重捕法、体长频度法、脂褐素分析法和放射性同位素分析法等鉴定甲壳类年龄并建立生长模型;近年来有研究发现,眼柄是甲壳类少数不蜕壳的硬组织之一,可直接用于年龄和生长研究[9]。本研究利用克氏原螯虾眼柄微结构来研究其生长并建立生长模型,以期为该种类的养殖提供基础资料。
1 材料与方法 1.1 材料来源克氏原螯虾样本为2017年7月在上海市浦东新区南汇新城镇河道采集,根据《水产资源调查手册》测量样本的体质量、体长等基础生物学数据。样本个数为140尾,体长范围为69.8~109.1 mm,体质量范围为4.0~36.9 g。
1.2 眼柄摘取用剪刀剪取克氏原螯虾的1对眼柄,待剪除眼球后,用解剖针将附着在眼柄内侧的有机物(肌肉、结缔组织等)剔除,然后放置于盛有75%乙醇溶液的2 mL离心管中保存。
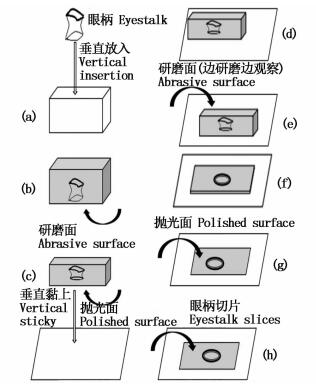
1.3 眼柄切片制备取出保存于离心管中的1个眼柄,待乙醇挥发干净后,将眼柄基部剪平,垂直放入塑料模具的底部(图 1a),并倒入配置好的冷埋树脂溶液(压克力粉和液体硬化剂的比例为1:1),使溶液完全将眼柄包裹,包埋好的模具在阴凉通风处放置24 h待其完全硬化(图 1b)。将硬化后包有眼柄的模具分别在120、600、1 200和2 500目的水磨砂纸上沿眼柄的横截面研磨,期间不断观察,直到研磨至眼柄中部且横截面清晰可见后(图 1c),再用氧化铝粉在水绒布上对研磨面进行抛光,然后抛光面朝下,利用热熔胶将其粘在载玻片上(图 1d),待其冷却后,重复以上方法研磨至眼柄中部,此过程中不断在显微镜下观察,直至眼柄横截面上的生长纹清晰可见(图 1e, f),最后重复以上抛光步骤得到眼柄切片(图 1g, h)。取出保存于离心管中的另1个眼柄,使用相同的方法处理,但在研磨时沿着眼柄的纵切面,得到另1个眼柄的切片(图 2)。制作好的眼柄切片用清水冲洗,擦拭干净后放置在载玻片盒中保存,用于之后眼柄微结构的观察。
|
图 1 克氏原螯虾眼柄切片制作示意图(横截面)
Fig. 1 Schematic of Procambarus clarkii eyestalk slices production
|

|
图 2 克氏原螯虾眼柄切片制作示意图(纵切面)
Fig. 2 Schematic of Procambarus clarkii eyestalk slices production
|
制作好的切片置于连接有电荷耦合元件(Charge-coupled Device,CCD)图像传感器的显微镜下,放大400×倍对眼柄上的生长纹进行拍照,然后用Photoshop7.0图像处理软件对所拍图片进行拼图处理[10]。采用Digimizer图像处理软件对生长纹进行标记和计数,并测量眼柄各层的宽度和生长纹间距。
1.5 数据分析方法生长纹计数时,由眼柄内侧向外侧进行,并且每个样本独立计数3次,采用变异系数(Coefficient of Variation,CV)检验计数的准确性,其计算公式为
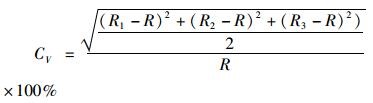 (1)
(1)
式中:R代表每个样本3次独立计数的平均值,R1、R2、R3分别代表每个样本3次独立计数的数值。
在进行生长纹计数时,其可信临界标准通常是每个样本独立计数2~3次的计数值差异不高于10%[10-11]。
1.6 建立生长模型在建立克氏原螯虾体长和体质量与生长纹之间的关系时,采用线性、幂函数、指数、对数、逻辑斯蒂、V-B和冈珀茨等7个生长模型来拟合:
线性(Linear)方程:
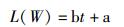 (1)
(1)
幂函数(Power)方程:
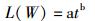 (2)
(2)
指数(Exponent)方程:
 (3)
(3)
对数(Logarithm)函数方程:
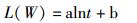 (4)
(4)
逻辑斯蒂(Logistic)函数方程:
 (5)
(5)
V-B(von Bertalanffy)生长方程:
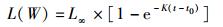 (6)
(6)
冈珀茨(Gompertz)生长方程:
 (7)
(7)
式中:L和W分别代表克氏原螯虾的体长和体质量,t表示克氏原螯虾眼柄生长纹独立计数3次的平均值。
依据赤池信息准则(Akaike information criterion, AIC)来选择最适模型[11]。AIC值的计算公式为:
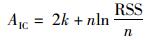 (8)
(8)
式中:k为模型的参数数量,n为样本数量,RSS为残差平方和。
2 结果 2.1 眼柄两种研磨方向比较实验发现,沿眼柄的纵切面(图版-1)和横截面(图版-2)研磨制备的切片在显微镜下均可观察到明显的生长纹。眼柄两种切片分别独立计数3次,取平均值后进行比较,两种切片生长纹数目无显著差异(P < 0.05), 见图 3。

|
图版 克氏原螯虾眼柄微结构 Plate The microstructures of eyestalks of Procambarus clarkia 1.克氏原螯虾眼柄纵切面;2.克氏原螯虾眼柄横截面;3.克氏原螯虾眼柄4层结构;4.克氏原螯虾内部生长纹;5.靠近色素层的克氏原螯虾生长纹间距变化;6.靠近膜层的克氏原螯虾生长纹间距变化 1. Slice of the Procambarus clarkii eyestalk of vertical grinding; 2. Slice of the Procambarus clarkii eyestalk of horizontal grinding; 3.4-layer structure of Procambarus clarkii; 4. growth increments (white points) of Procambarus clarkii; 5. Variation of growth increments space near exocuticlelayer of Procambarus clarkii; 6. Variation of growth increments space near membranous layer of Procambarus clarkia |

|
图 3 眼柄两种切片生长纹数目比较
Fig. 3 The number of growth increments of the two sections of the eyestalk
|
在显微镜下观察发现,克氏原螯虾眼柄微结构由4个部分组成(图版-3),由外到内分别是表层(epicuticle)、色素层(exocuticle)、钙化层(endocuticle)和膜层(membranous)。其中钙化层最厚,色素层其次,表层和膜层的厚度比较接近,4个部分分别占眼柄总厚度的4%、24%、66%和6%。位于眼柄最外层的是表层,轮廓清晰。位于表层下方的是色素层,内有许多类似色素的沉淀物,以及平行于眼柄表层排列紧密的生长纹,有的切片在显微镜下可以看到色素层的颜色。位于色素层下方的是钙化层,钙化层是整个眼柄中最厚的部分,也是钙化程度最高的一层,色素颗粒较少,有平行于眼柄表层且排列明显的生长纹(图版-4)。靠近色素层的生长纹颜色深,间距大,排列稀疏,较为清晰(图版-5);靠近膜层的生长纹颜色浅,间距小,排列紧密,清晰度略差(图版-6)。位于钙化层下方的是膜层,膜层的厚度也较薄,透明度最高,是眼柄的生长边缘,若样本内的有机物处理不干净,膜层在显微镜下的成像也将会受到影响。
2.3 生长纹间距实验表明,克氏原螯虾眼柄钙化层生长纹平均间距为6.930 μm,从色素层与钙化层的交界处到钙化层与膜层的交界处呈现出由宽到窄的变化趋势(图 4),钙化层靠近色素层部分生长纹间距大,钙化层靠近膜层部分生长纹间距小,且间距波动变化明显,最大22.233 μm,最小1.209 μm。
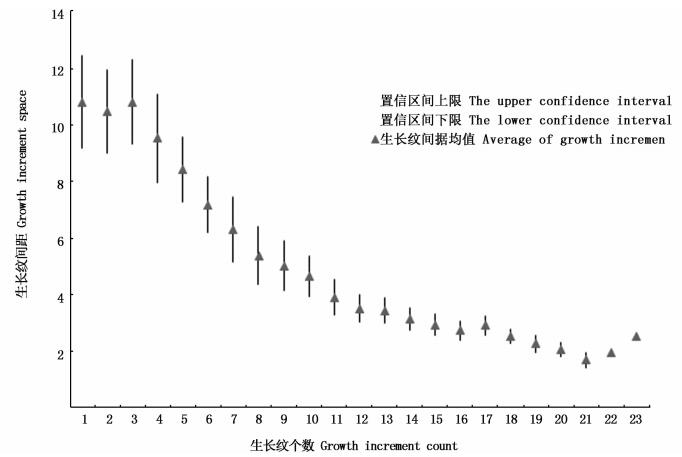
|
图 4 克氏原螯虾生长纹间距变化趋势
Fig. 4 The space of growth increments of Procambarus clarkii
|
分析结果显示,克氏原螯虾眼柄生长纹的3次独立计数CV值在0.00%~9.78%之间,均小于10%,因此眼柄生长纹计数准确。
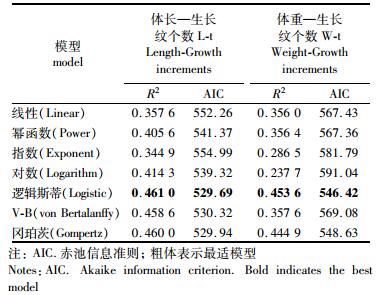
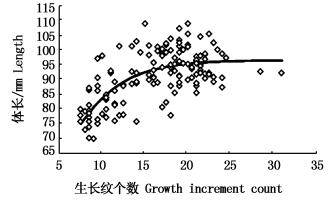
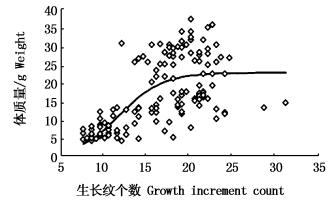
2.5 眼柄生长纹个数与体长和体重的关系根据最小AIC法(表 1),克氏原螯虾眼柄生长纹个数与体长(图 5)和体质量(图 6)的关系均最适合用Logistic生长方程曲线来描述,关系式分别为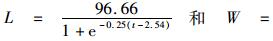
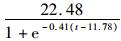
|
表 1 线性、幂函数、指数、对数、逻辑斯蒂、V-B和冈珀茨等7个生长方程拟合克氏原螯虾体长—生长纹和体重—生长纹参数值 Tab.1 Parameters of linear, power, exponential, logarithmic, logistic, von Bertalanffy and Gompertz models fitted to L-t and W-t data for Procambarus clarkii |
|
图 5 克氏原螯虾眼柄生长纹个数与体长的关系
Fig. 5 Relationship between the number of growth increments and length of Procambarus clarkii
|
|
图 6 克氏原螯虾眼柄生长纹个数与体质量的关系
Fig. 6 Relationship between the number of growth increments and weight of Procambarus clarkii
|
虾蟹的甲壳是非细胞结构,含有丰富的几丁质,几丁质内的钙质含量会影响壳的厚薄和坚硬程度[12],克氏原螯虾的壳钙质含量高,眼柄质地比较坚硬。过去的研究认为[12],甲壳类壳是由非几丁质层、几丁质外层、几丁质中层和几丁质内层构成。质地比较均匀,通常非几丁质的是表层;含有色素颗粒,充满钙盐的圆柱状几丁质是色素层;厚度最大,含有钙盐的是钙化层;未钙化的几丁质层是膜层[13]。本研究观察到克氏原螯虾的眼柄分为4个部分,这与早期学者观察到的相一致。
3.2 眼柄生长纹本研究发现,克氏原螯虾的眼柄生长纹从色素层与钙化层的交界处到钙化层与膜层的交界处呈现出由宽到窄的变化趋势,这与水生生物其他硬组织相似,个体不同生长时期的生长速率不同造成生长纹宽度不同[14-15]。克氏原螯虾的生长依靠蜕壳来实现,在其生命周期的早期蜕壳周期短,生长迅速,体长和体质量变化大,随着接近性成熟,周期也逐渐略微增长,性成熟以后,蜕壳的周期变长,生长速度放缓,体长和体质量增加速度慢[16]。反映在生长纹间距中,即靠近色素层的生长纹处在生长的早期,靠近膜层的生长纹处在成体期,在不同的生长时期生长纹越宽表示生长速率越快,这也是克氏原螯虾眼柄生长纹间距变化的原因。而早期学者测得美国龙虾(Homarus americanus)眼柄生长纹整体分布较为狭窄,生长纹周期性存在性别的差异[17];先前有研究认为采集于挪威和冰岛的欧洲螯龙虾(Homarus gammarus)、挪威海螯虾(Nephrops norvegicus)、斑纹黄道蟹(Cancer irroratus)及北极甜虾(Pandalus borealis)的生长纹一条宽带为1龄[18]。克氏原螯虾眼柄生长纹的形成周期是否与克氏原螯虾性别、生长环境差异相关以及与年龄的关系需要以后进一步的研究和探讨。
3.3 克氏原螯虾的生长有学者研究表明克氏原螯虾生长规律符合Logistic生长曲线,这与本文通过眼柄生长纹建立的生长关系相一致[19]。克氏原螯虾的生长依靠蜕壳,在其过程中存在着快速生长时期,即其幼体时期,其体长和体重增长幅度大,蜕壳的周期短,随着性腺的发育,其生长速率会减缓,蜕壳的周期变长。而且,生长纹间距的变化规律与克氏原螯虾生长速率变化趋势[19]是一致的,生长纹越宽生长速率越快,这与早期学者利用脂褐素分析法研究欧洲龙虾(Homarus gammarus)[20]以及利用眼柄生长纹研究红蹲龙虾(Pleuroncodes monodon)、黄扁虾(Curvimunida johni)及尼龙虾(Heterocarpus reedi)[21]的结果一致。
4 结论与展望本研究通过对克氏原螯虾眼柄微结构的观察,掌握了其眼柄微结构的组成和形态结构,并通过测量生长纹之间的间距来了解其生长规律,建立了生长纹与体长和体质量的关系模型,为今后研究克氏原螯虾增长、生产率及死亡率奠定了基础,同时对该种类的渔业管理、养护以及资源评估也有重要作用。本研究采用的样本是野生克氏原螯虾,其生长纹和年龄是否存在关系还需要今后采用实验室养殖的已知年龄的克氏原螯虾样本做进一步的研究。由于采样地点和时间单一,克氏原螯虾眼柄生长纹的形成周期是否与其个体差异、生长环境差异、季节差异等因素相关还需要今后多时间段、多地点采样后进一步探讨。
| [1] |
黄羽, 戴银根, 胡成钰, 等. 克氏原螯虾产业发展现状及可持续发展对策[J]. 江苏农业科学, 2011(1): 274-277. HUANG Y, DAI Y G, HU C Y, et al. Status and sustainable development strategy of Procambarus clarkii industry[J]. Jiangsu Agricultural Sciences, 2011(1): 274-277. DOI:10.3969/j.issn.1002-1302.2011.01.101 |
| [2] |
徐加涛, 阎斌伦, 徐国成. 克氏原螯虾产业发展背景、现状与展望[J]. 水产科技情报, 2011, 38(4): 172-176, 180. XU J T, YAN B L, XU G C. Industry development background, current situation and prospect of Procambarus clarkii[J]. Fisheries Science & Technology Information, 2011, 38(4): 172-176, 180. DOI:10.3969/j.issn.1001-1994.2011.04.003 |
| [3] |
汤靓颖. 小龙虾产业发展研究[J]. 现代农业科技, 2009(22): 308-309. TANG L Y. Industrial development research of crawfish[J]. Modern Agricultural Science and Technology, 2009(22): 308-309. DOI:10.3969/j.issn.1007-5739.2009.22.203 |
| [4] |
KRAFFT B A, KVALSUND M, SØVIK G, et al. Detection of growth zones in the eyestalk of the Antarctic krill Euphausia superba (Dana, 1852) (Euphausiacea)[J]. Journal of Crustacean Biology, 2016, 36(3): 267-273. DOI:10.1163/1937240X-00002428 |
| [5] |
孙松, 王荣. 南极磷虾年龄鉴定研究简述[J]. 南极研究(中文版), 1995, 7(2): 59-62. SUN S, WANG R. Aging the Antarctic krill[J]. Antarctic Research (Chinese Edition), 1995, 7(2): 59-62. |
| [6] |
周灿, 祝茜, 刘焕章. 长江上游圆口铜鱼生长方程的分析[J]. 四川动物, 2010, 29(4): 510-516. ZHOU C, ZHU Q, LIU H Z. Analysis of the growth function of the largemouth bronze gudgeon Coreius guichenoti in the upper reaches of the Yangtze River[J]. Sichuan Journal of Zoology, 2010, 29(4): 510-516. |
| [7] |
HARTNOLL R G. Growth in crustacea-twenty years[M]. Springer Netherlands, 2001.
|
| [8] |
李旭光, 周刚, 谷孝鸿. 水生甲壳类蜕皮发生过程及其影响因素的研究与进展[J]. 动物学杂志, 2014, 49(2): 294-302. LI X G, ZHOU G, GU X H. Review of aquatic crustaceans molting and its influencing factors[J]. Chinese Journal of Zoology, 2014, 49(2): 294-302. |
| [9] |
蒋瑞, 刘必林, 张健, 等. 甲壳类年龄鉴定方法研究进展[J]. 海洋渔业, 2017, 39(4): 471-480. JIANG R, LIU B L, ZHANG J, et al. Advance on methods for the age identification of crustaceans[J]. Marine Fisheries, 2017, 39(4): 471-480. DOI:10.3969/j.issn.1004-2490.2017.04.013 |
| [10] |
刘必林, 陈新军, 李建华. 东太平洋茎柔鱼的耳石微结构[J]. 水产学报, 2016, 40(8): 1211-1217. LIU B L, CHEN X J, LI J H. Statolith microstructure analysis of the Humboldt squid (Dosidicus gigas) in the eastern Pacific Ocean[J]. Journal of Fisheries of China, 2016, 40(8): 1211-1217. |
| [11] |
JACKSON G D, FORSYTHE J W, HIXON R F, et al. Age, growth, and maturation of Lolliguncula brevis (Cephalopoda:Loliginidae) in the northwestern Gulf of Mexico with a comparison of length-frequency versus statolith age analysis[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1997, 54(12): 2907-2919. DOI:10.1139/f97-192 |
| [12] |
冯玉爱. 虾蟹的壳及蜕壳[J]. 福建水产, 1984(2): 46-50. FENG Y A. Shell and exuvial shell of shrimp and crab[J]. Journal of Fujian Fisheries, 1984(2): 46-50. |
| [13] |
赵红霞. 甲壳动物蜕皮调控研究及蜕壳素的使用[J]. 广东饲料, 2006, 15(1): 32-35. ZHAO H X. Study on regulation of the molt of crustacean and the application of molt-accelerating hormone[J]. Guangdong Feed, 2006, 15(1): 32-35. DOI:10.3969/j.issn.1005-8613.2006.01.012 |
| [14] |
朱清澄, 杨明树, 高玉珍, 等. 西北太平洋秋刀鱼耳石生长与性成熟度、个体大小的关系[J]. 上海海洋大学学报, 2017, 26(2): 263-270. ZHU Q C, YANG M S, GAO Y Z, et al. The relationship between statolith growth, sexual maturity and body size of Cololabis saira in the Northwest Pacific Ocean[J]. Journal of Shanghai Ocean University, 2017, 26(2): 263-270. |
| [15] |
胡贯宇, 陈新军, 刘必林, 等. 茎柔鱼耳石和角质颚微结构及轮纹判读[J]. 水产学报, 2015, 39(3): 361-370. HU G Y, CHEN X J, LIU B L, et al. Microstructure of statolith and beak for Dosidicus gigas and its determination of growth increments[J]. Journal of Fisheries of China, 2015, 39(3): 361-370. |
| [16] |
刘其根, 李应森, 陈兰荪, 等. 克氏原螯虾的生物学[J]. 水产科技情报, 2008, 35(1): 21-23. LIU Q G, LI Y S, CHEN L S, et al. Ecological culture of red swamp crawfish Procambarus clarki[J]. Fisheries Science & Technology Information, 2008, 35(1): 21-23. DOI:10.3969/j.issn.1001-1994.2008.01.011 |
| [17] |
KILADA R, SAINTE-MARIE B, ROCHETTE R, et al. Direct determination of age in shrimps, crabs, and lobsters[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2012, 69(11): 1728-1733. DOI:10.1139/cjfas-2012-0254 |
| [18] |
KILADA R, AGNALT A L, ARBOE N H, et al. Feasibility of using growth band counts in age determination of four crustacean species in the Northern Atlantic[J]. Journal of Crustacean Biology, 2015, 35(4): 499-503. DOI:10.1163/1937240X-00002353 |
| [19] |
韩光明, 张家宏, 王守红, 等. 克氏原螯虾生长规律及大规格生态养殖的关键技术和效益分析[J]. 江西农业学报, 2015, 27(2): 91-94. HAN G M, ZHANG J H, WANG S H, et al. Growth regularity of Procambarus clarkii, key technology and benefit analysis of its large-size ecological rearing[J]. Acta Agriculturae Jiangxi, 2015, 27(2): 91-94. DOI:10.3969/j.issn.1001-8581.2015.02.022 |
| [20] |
SHEEHY M R J, BANNISTER R C A, WICKINS J F, et al. New perspectives on the growth and longevity of the European lobster (Homarus gammarus)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1999, 56(10): 1904-1915. DOI:10.1139/f99-116 |
| [21] |
KILADA R, ACUÑA E. Direct age determination by growth band counts of three commercially important crustacean species in Chile[J]. Fisheries Research, 2015, 170: 134-143. DOI:10.1016/j.fishres.2015.05.026 |
2. National Engineering Research Center for Oceanic Fisheries, Shanghai 201306, China;
3. The Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture, Shanghai 201306, China;
5. Scientific Observing and Experimental Station of Oceanic Fishery Resources, Ministry of Agriculture, Shanghai 201306, China
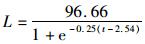 and
and  respectively.
respectively.
 2018,
Vol. 27
2018,
Vol. 27


