2. 上海海洋大学 省部共建水产种质资源发掘与利用教育部重点实验室, 上海 201306
三角帆蚌(Hyriopsis cumingii)是我国特有的优质淡水育珠蚌,它形成的珍珠具有珠质光滑细腻、色泽鲜艳等优点,是淡水蚌中育珠质量最佳者[1-2]。颜色是评价珍珠质量的一个重要因素,珍珠颜色不仅受到育珠蚌贝壳珍珠质颜色的影响,同样作为供体的供片蚌贝壳珍珠质的颜色对珍珠的颜色也有重要影响,所以在生产中把贝壳珍珠质颜色作为珍珠蚌遗传育种的选育指标具有重要意义[3-6]。研究表明,类胡萝卜素的存在与珍珠及贝壳珍珠质的颜色形成密切相关,是珍珠和贝壳珍珠质呈色的重要原因之一[7-9]。URMOS等[10]首次报道在天然珍珠中探测到的有机物峰是由类胡萝卜素引起的,并且推测类胡萝卜素的存在是珍珠呈色的主要原因。前期研究发现三角帆蚌体内总类胡萝卜素含量(TCC)不仅在不同组织中差异显著,而且在紫色选育系三角帆蚌个体中TCC总是显著高于白色选育系三角帆蚌个体,表明三角帆蚌总类胡萝卜素含量与贝壳珍珠质颜色密切相关[11]。
类胡萝卜素(Carotenoids)是一类广泛存在于自然界中的脂溶性物质,具有重要的生物学功能,是一种天然的着色剂,并与动物的健康关系密切[12-13]。然而,大多数动物自身不能够合成类胡萝卜素,必须从食物中摄取外源类胡萝卜素直接储存或转化后沉积于体内[14-15]。作为一种被广泛使用的增色剂,类胡萝卜素在养殖中经常通过在饵料中添加富含类胡萝卜素的物质来改变水产动物的体色[16-18]。LI等[11]研究发现类胡萝卜素在三角帆蚌各组织中的分布与含量不同,肝胰腺作为三角帆蚌主要的吸收和储存类胡萝卜素的组织,其TCC最高,外套膜作为直接参与贝壳和珍珠形成的组织,其TCC也较高。基于此,本研究拟通过在不同颜色选育系(紫色选育系和白色选育系)三角帆蚌养殖中添加β-胡萝卜素,测定三角帆蚌不同颜色选育系体内总类胡萝卜素含量的累积变化情况,并通过对三角帆蚌贝壳珍珠质颜色参数的测定,评价添加类胡萝卜素对贝壳珍珠质颜色的影响,以期为实际生产中提高贝壳珍珠质和珍珠的色泽度提供理论依据。
1 材料与方法 1.1 实验材料及试剂本实验所用紫色和白色选育系三角帆蚌均为2龄蚌,采自于浙江省金华市三角帆蚌良种场,随机挑选同一规格[壳长(10.0±2.0) cm]的两种颜色三角帆蚌各300只。β-胡萝卜素(含量10%)购自浙江嘉兴天和诚生物科技有限公司),丙酮、无水硫酸钠等有机试剂均为分析纯,购自上海生工。
1.2 实验方法 1.2.1 饲养管理实验开始前,将三角帆蚌根据需要暂养于实验室一周时间,使其逐渐适应养殖环境和实验条件。养殖用水以自来水为水源,饲养前将水增氧曝气24 h以上使用。以小球藻投喂三角帆蚌,投喂密度为5.5×105~2.0×106 cell/mL,实验组除投喂小球藻外还同时投喂类胡萝卜素,每天上午9:00和下午5:00定时进行两次投喂。用气泵适量充气增氧,每日换水量为1/3,试验期间,每日第一次投喂前换水量为1/5,同时补入等量的经曝气的水。用加热棒控制水温在18~23 ℃范围内,pH在6.5~7.5之间。
1.2.2 实验设计紫色、白色选育系三角帆蚌共分成5组,编号依次为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ。每组设3个平行组,每个平行组分别取紫色、白色三角帆蚌各20只,饲养在水族箱中(1.0 m×0.5 m×0.5 m),实验期间水深30 cm。共设4个实验组和1个对照组,分别将β-胡萝卜素按5、10、20和40 mg/L 4种梯度分别添加到Ⅰ、Ⅱ、Ⅲ、Ⅳ实验组中,未添加β-胡萝卜素的Ⅴ组为对照组。实验总时间为40 d,分别于第0 h,6 h,12 h,1 d,3 d,7 d,14 d,21 d,28 d测定各组三角帆蚌体内的总类胡萝卜素含量。添加类胡萝卜素28 d后,停止添加;然后分别在第30,35,40天测定各组三角帆蚌的总类胡萝卜素含量。取样时,从每组中随机取出3个三角帆蚌,分别取肝胰腺和外套膜(边缘膜和中央膜)组织,放入-80 ℃超低温冰箱中保存。取样后的贝壳清洗干净后常温避光保存,以备壳色数据测量。
1.2.3 总类胡萝卜素的提取及含量测定将所取的组织样品放入棕色玻璃瓶中,用封口薄膜封口(在薄膜上用针扎些小洞,以便真空干燥时气体的排出),置于真空冷冻干燥机中进行干燥处理48~96 h,然后取出样品研磨成粉末状。称取上述研磨后的粉末0.2 g,放入10 mL棕色试管中,加入等量无水硫酸钠和4 mL的分析纯丙酮,37 ℃条件下避光200 r/min震荡提取2 h,然后5 000 r/min离心5 min取上清,沉淀重复上述步骤提取一次,合并两次的丙酮提取液,使用NanoDrop 2000c型分光光度计(Thermo Scientific, Wilmington, USA)测定丙酮提取液的吸光值。总类胡萝卜素含量(Total carotenoids content, TCC)的测定参照YANAR等的方法[19],计算公式如下:
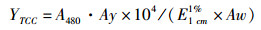 (1)
(1)
式中:YTCC为测得的总类胡萝卜素含量;A480为提取液在480 nm处的吸光值;Ay为提取液的体积(mL);Aw为提取样品重量(g);E1 cm1%表示在1 cm光程长的比色杯中1 g/L浓度溶质的理论吸收值,平均E1 cm1%值为1 900。每个样品重复测量3次,以3次测量的平均值作为该样品的总类胡萝卜素含量,以干重μg/g表示。
1.2.4 贝壳珍珠质颜色参数测量对上述取样后保存的贝壳进行相应贝壳珍珠质颜色参数的测定。采用Lovibond RT200表面色度计(Tintometer Limited, Salisbury, UK)进行测量并使用Lovibond RT Colour V3.0软件进行数据分析。测量选用国际照明委员会(CIE)均匀色度空间系统CIE L*a*b*(CIE1976)进行参数设定,分别测定颜色参数值L*、a*、b*以及饱和度C*和色差ΔE[20]。测量位置分别为贝壳的内脏团痕与纵肋的交叉处和中央膜插核处,测量时应避开凹凸和瑕疵,共测量3次,以3次测量的颜色数据的平均值作为该处贝壳珍珠质的颜色数据。
1.2.5 数据统计与分析所有数据均用平均值±标准差表示,采用SPSS 19.0(SPSS Inc., Chicago, IL, USA)统计分析软件进行统计分析。采用方差分析(ANOVA)法对TCC差异进行分析,用Tukey HSD法进行多重比较,P < 0.05为差异显著,P <0.01为差异极显著。
2 结果与分析 2.1 三角帆蚌肝胰腺中TCC的变化各实验组肝胰腺组织中总类胡萝卜素含量(TCC)见表 1。结果显示,添加28 d后,随着类胡萝卜素添加剂量的增加,三角帆蚌肝胰腺组织中TCC也相应增加,但不同颜色选育系三角帆蚌的肝胰腺组织对类胡萝卜素的累积效果差异显著(P < 0.05)。添加实验结束时,紫色选育系三角帆蚌实验组中的TCC均显著高于对照组的(52.32±2.27) μg/g,同时添加量为5 mg/L和添加量为10 mg/L的实验组之间差异不显著,但均显著低于添加量为20 mg/L和添加量为40 mg/L的实验组(P < 0.05),而添加量为20mg/L和添加量为40 mg/L的实验组之间差异也不显著(P>0.05)。白色选育系中,添加实验结束时所有实验组中TCC均显著高于对照组(P < 0.05),但各不同添加量的实验组之间TCC差异不显著(P>0.05)。

|
表 1 三角帆蚌肝胰腺总类胡萝卜素含量变化 Tab.1 Variations of TCC in hepatopancreas of H. cumingi |
实验进行40 d后,白色、紫色选育系三角帆蚌对照组中的TCC与实验前相比有所降低,但差异不显著。紫色选育系三角帆蚌实验组中TCC均显著高于对照组,添加量为20 mg/L和添加量为40 mg/L的实验组中TCC显著高于添加量为5 mg/L和添加量为10 mg/L的实验组(P < 0.05)。白色选育系三角帆蚌中,添加量为5 mg/L的实验组与对照组中TCC差异不显著,其余各实验组TCC均显著高于对照组(P < 0.05),但各组之间差异不显著(P>0.05)。
2.2 三角帆蚌边缘膜中TCC的变化各实验组边缘膜总类胡萝卜素含量见表 2。结果显示,添加28 d后,随着类胡萝卜素添加剂量的增加,三角帆蚌边缘膜中TCC也相应增加,但不同颜色选育系三角帆蚌的边缘膜对类胡萝卜素的累积效果差异显著(P < 0.05)。添加实验28 d时,紫色选育系三角帆蚌中,添加量为20 mg/L和添加量为40 mg/L的实验组与对照组之间TCC差异显著(P < 0.05),并且也显著高于添加量为5 mg/L和添加量为10 mg/L的实验组。白色选育系中,添加结束时只有添加量为40 mg/L的实验组中TCC显著高于对照组(P < 0.05),其他添加量的实验组与对照组之间差异不显著(P>0.05)。实验进行40 d后,白色、紫色选育系三角帆蚌对照组中的TCC与实验前相比有所降低,但差异不显著。紫色选育系三角帆蚌实验组中只有添加量为20 mg/L和添加量为40 mg/L的实验组中TCC显著高于对照组中的TCC(P < 0.05)。白色选育系三角帆蚌中,各实验组TCC与对照组均无显著性差异(P>0.05)。
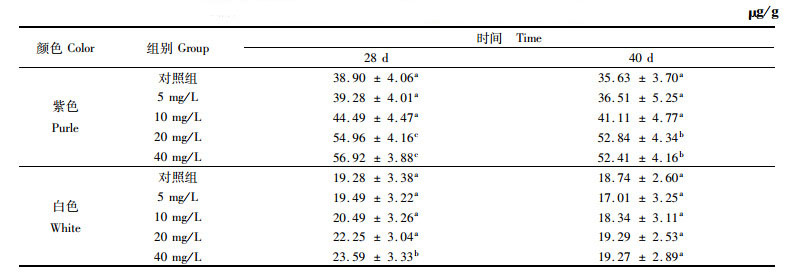
|
表 2 三角帆蚌边缘膜总类胡萝卜素含量变化 Tab.2 Variations of TCC in fringe mantle of H. cumingi |
各实验组中央膜总类胡萝卜素含量见表 3。从表中可以看出,添加实验28 d时,紫色选育系三角帆蚌中,添加量为5 mg/L的实验组与对照组之间TCC差异不显著(P>0.05),而添加量为10 mg/L、20 mg/L以及40 mg/L的实验组与对照组之间TCC差异显著(P < 0.05)。白色选育系中,添加结束时只有添加量为40 mg/L的实验组中TCC显著高于对照组(P < 0.05),其他添加量的实验组与对照组之间差异不显著(P>0.05)。实验进行40 d后,白色、紫色选育系三角帆蚌对照组中的TCC与实验前相比有所降低,但差异不显著。紫色选育系三角帆蚌实验组中只有添加量为20 mg/L和添加量为40 mg/L的实验组中TCC显著高于对照组中的TCC(P < 0.05)。白色选育系三角帆蚌中,同样各实验组TCC与对照组均无显著性差异(P>0.05),这一结果和三角帆蚌边缘膜中TCC变化规律比较一致。
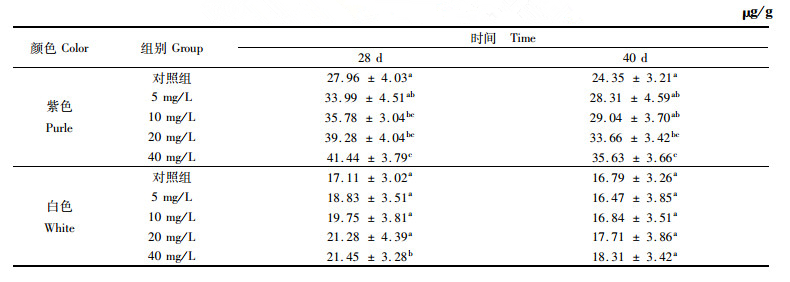
|
表 3 三角帆蚌中央膜总类胡萝卜素含量变化 Tab.3 Variations of TCC in middle mantle of H. cumingi |
由于紫色选育系三角帆蚌中,添加量为20 mg/L的实验组TCC显著高于对照组(P < 0.05),且与添加量为40 mg/L的实验组之间差异不显著(P>0.05),所以重点研究了添加量为20 mg/L条件下,添加时间对三角帆蚌TCC的影响。随着添加时间的延长,紫色选育系三角帆蚌和白色选育系三角帆蚌中TCC均逐渐升高,但累积效果和达到最大值的时间均显著不同。紫色选育系三角帆蚌肝胰腺中TCC在28 d达到最大值[(93.82±4.96) μg/g],显著高于添加之前的TCC[(50.46±3.14) μg/g];而白色选育系三角帆蚌肝胰腺中TCC在14 d达到最大值[(45.69±2.82) μg/g],也显著高于添加之前的TCC[(26.00±4.10) μg/g],见图 1。
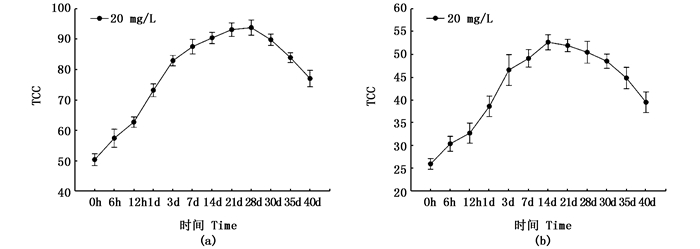
|
图 1 三角帆蚌肝胰腺TCC随添加时间的变化图
Fig. 1 Dynamic changes of TCC in hepatopancreas of H. cumingi
(a)紫色选育系三角帆蚌;(b)白色选育系三角帆蚌 (a) purple mussel group; (b) white mussel group |
紫色选育系三角帆蚌边缘膜中TCC在30 d达到最大值[(57.07±4.11) μg/g],显著高于添加之前的TCC[(35.63 ± 4.52) μg/g];而白色选育系三角帆蚌边缘膜中TCC在21 d达到最大值[(23.27±3.43) μg/g],也显著高于添加之前的TCC[(18.74±2.14) μg/g], 见图 2。
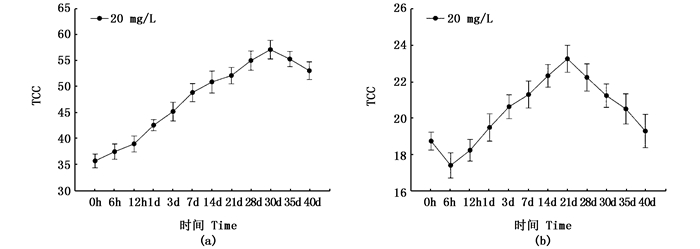
|
图 2 三角帆蚌边缘膜TCC随添加时间的变化图
Fig. 2 Dynamic changes of TCC in fringe mantle of H. cumingi
(a)紫色选育系三角帆蚌;(b)白色选育系三角帆蚌 (a) purple mussel group; (b) white mussel groups |
紫色选育系三角帆蚌中央膜TCC在28 d达到最大值[(39.28±4.04) μg/g],显著高于添加之前的TCC[(24.34±3.21) μg/g];白色选育系三角帆蚌中央膜中TCC也在28 d达到最大值[(21.28±4.39) μg/g],并且也显著高于添加之前的TCC[(16.58±3.11) μg/g],见图 3。从图 3中可以看出,随着28 d以后停止添加类胡萝卜素,各实验组三角帆蚌的TCC均呈现逐渐下降的趋势,均在40 d时含量达到最低。
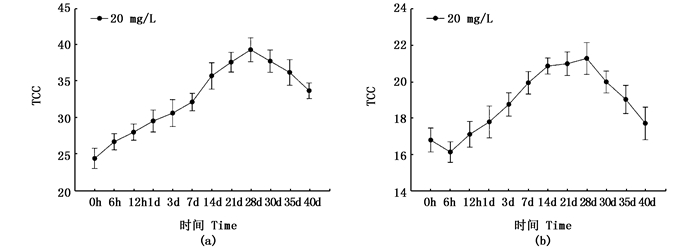
|
图 3 三角帆蚌中央膜TCC随添加时间的变化图
Fig. 3 Dynamic changes of TCC in middle mantle of H. cumingi
(a)紫色选育系三角帆蚌;(b)白色选育系三角帆蚌 (a) purple mussel group; (b) white mussel groups |
实验40 d后,对不同实验组的三角帆蚌贝壳珍珠质颜色参数进行测量,比较分析不同实验组和对照组之间颜色参数差异是否显著。如图 4所示,40 d后,紫色选育系三角帆蚌贝壳珍珠质的各颜色参数(L*、a*、b*、C*和ΔE)之间均无显著差异,其中不同实验组之间随着类胡萝卜素添加量的增加,紫色选育系三角帆蚌边缘壳珍珠质颜色参数值a*、b*和C*也呈现上升的趋势,在添加量为40 mg/L条件下的实验组三角帆蚌边缘壳珍珠质颜色参数a*、b*和C*值均最大,但与其他实验组差异不显著(P>0.05)。同样白色选育系各实验组三角帆蚌贝壳珍珠质的颜色参数值(L*、a*、b*、C*和ΔE)之间差异也均不显著(P>0.05),见图 5。
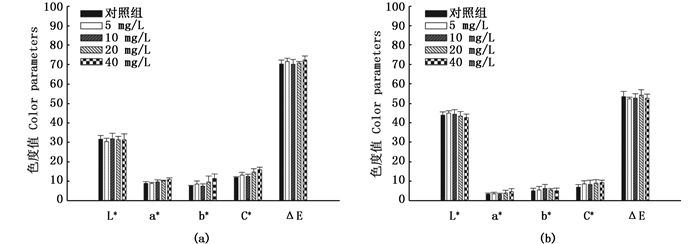
|
图 4 紫色选育系三角帆蚌贝壳珍珠质色度值变化
Fig. 4 Dynamic changes of color parameters in purple line mussels of H. cumingi
(a)边缘壳;(b)中央壳 (a) fringe shell; (b) middle shell |
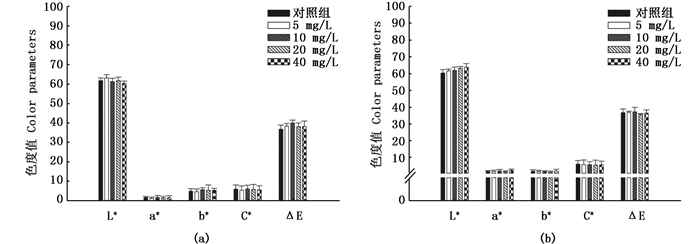
|
图 5 白色选育系三角帆蚌贝壳珍珠质色度值变化
Fig. 5 Dynamic changes of color parameters in white line mussels of H. cumingi
(a)边缘壳;(b)中央壳 (a) fringe shell; (b) middle shell |
由于贝类只能从外界环境中摄取类胡萝卜素,因此贝类的养殖环境、食物的种类组成及其所含的类葫萝卜素均与贝类对类胡萝卜素的吸收和富集有密切关系。刘合露[21]用金藻、扁藻、硅藻3种不同藻类单独和混合投喂华贵栉孔扇贝,研究了其在性腺发育过程中体内总类胡萝卜素含量是否与所投喂的食物有关,结果发现用不同的饵料投喂华贵栉孔扇贝对其体内总类胡萝卜素含量有显著影响。李宁[22]研究发现虾夷扇贝在春季性腺发育时体内总类胡萝卜素含量显著高于其他季节时内体总类胡萝卜素含量。本实验所构建的三角帆蚌选育系均在同一良种场进行繁育和养殖,各选育系的养殖环境和食物组成基本一致,但是紫色选育系个体和白色选育系个体的总类胡萝卜素含量存在显著差异[11],说明紫色选育系三角帆蚌和白色选育系三角帆蚌对外界环境中类胡萝卜素的吸收和富集能力存在差异。为了进一步证明和研究不同颜色选育系三角帆蚌对类胡萝卜素的吸收和累积效率,本实验通过在三角帆蚌养殖环境中添加不同浓度的类胡萝卜素,研究紫色和白色选育系三角帆蚌体内类胡萝卜素的累积变化情况和差异。随着β-胡萝卜素添加浓度的增加,无论是紫色选育系三角帆蚌还是白色选育系三角帆蚌,体内TCC均逐渐升高,但两种颜色选育系三角帆蚌对类胡萝卜素的吸收和累积效率存在显著差异。添加实验结束时,紫色选育系三角帆蚌实验组中肝胰腺的TCC均显著高于对照组,同时不同添加量的实验组之间也存在显著性差异,添加量为20 mg/L和添加量为40 mg/L的实验组TCC显著高于添加量为5 mg/L和添加量为10 mg/L的实验组(P < 0.05)。此外,白色选育系中,添加实验结束时所有实验组中TCC均显著高于对照组,但各不同添加量的实验组之间TCC差异不显著。而三角帆蚌外套膜对类胡萝卜素吸收和累积又不同于肝胰腺组织。添加实验结束时,紫色选育系三角帆蚌添加浓度为5 mg/L的实验组中TCC与对照组之间没有显著性差异,添加量为20 mg/L的实验组和添加量为40 mg/L的实验组之间差异也不显著(P> 0.05),而白色选育系三角帆蚌外套膜组织对类胡萝卜素的吸收累积效率更低,只有添加量为40 mg/L的实验组与对照组之间TCC存在显著性差异。前期研究结果表明,类胡萝卜素在三角帆蚌各组织中的分布与含量不同,肝胰腺作为三角帆蚌主要的吸收和储存类胡萝卜素的组织,其TCC最高[11]。本实验中肝胰腺TCC升高的程度显著高于外套膜,说明类胡萝卜素在三角帆蚌体内沉积的组织具有一定的选择性,不同部位累积类胡萝卜素的效率不同。同时,紫色选育系三角帆蚌和白色选育系三角帆蚌在添加类胡萝卜素后,肝胰腺组织中TCC存在显著性差异,进一步说明紫色、白色选育系三角帆蚌对类胡萝卜素吸收和累积效率的不同。
3.2 添加时间对三角帆蚌组织中TCC的影响本实验中,随着添加和养殖时间的延长,三角帆蚌肝胰腺和外套膜组织中的TCC也逐渐升高,并且是在类胡萝卜素添加一定时间后,组织中的TCC才会显著增加,而紫色选育系和白色选育系三角帆蚌对类胡萝卜素累积效果和TCC达到最大值的时间又显著不同。同样在添加浓度为20 mg/L的条件下,紫色选育系三角帆蚌肝胰腺TCC在28 d达到最大值,而白色选育系三角帆蚌肝胰腺TCC在14 d达到最大值。紫色选育系三角帆蚌边缘膜TCC在停止添加类胡萝卜素后的30 d达到最大值,而白色选育系三角帆蚌边缘膜TCC则在21 d时就已达最大值,这些结果进一步说明紫色选育系三角帆蚌对类胡萝卜素的吸收和累积效率要高于白色选育系三角帆蚌。一般来说,动物体内类胡萝卜素含量与添加类胡萝卜素的浓度和时间均呈正相关,但TCC不会无限升高,当体内类胡萝卜素含量达到一定的浓度后,动物体内对类胡萝卜素的吸收累积和分解代谢会处于一个动态平衡状态,此时体内的类胡萝卜素含量将不会再显著增加,而在停止添加后又会因类胡萝卜素的代谢而使TCC下降[23-24]。本实验中随着28 d以后停止添加类胡萝卜素,各实验组三角帆蚌的TCC均呈现逐渐下降的趋势,均在40 d时含量达到最低。TORRISSEN等[25]研究发现,在停止添加着色剂而只对虹鳟鱼投喂基础饲料养殖一段时间后,其色素含量会明显下降。在本实验中也出现了类似的情况,即随着类胡萝卜素停止添加时间的延长,三角帆蚌各组织中的TCC逐渐降低,这是由于体内对类胡萝卜素的分解代谢而使TCC降低。
目前,关于类胡萝卜素在动物体内的吸收机制说法不一。通过利用离体大鼠小肠细胞和人肺成纤维细胞进行的体外试验及用牛离体小肠细胞对β-胡萝卜素和叶黄素的吸收研究均显示了类胡萝卜素的被动吸收机制[26-27]。TYCZKOWSKI等[28]通过研究认为蛋鸡对类胡萝卜素的吸收方式为被动扩散。然而,最近越来越多的研究发现动物对类胡萝卜素的吸收方式更趋向于有转运载体参与的吸收方式。通过对CaCo-2单层细胞的类胡萝卜素吸收研究表明,类胡萝卜素的吸收和转运表现出浓度依赖性、时间依赖性和饱和性,故认为类胡萝卜素的吸收可能有专一的上皮转运因子的参与[29]。杨文平[30]通过外模拟吸收实验研究证实牛和鸡肠上皮细胞对类胡萝卜素吸收同样具有时间依赖性和饱和性。SHYAM等[31]利用TC7细胞作为模型研究了叶黄素LUT的吸收,发现SRBI介导LUT的吸收,认为类胡萝卜素的吸收至少部分是通过包括SRBI在内的转运载体参与的运输过程。本实验研究结果也证实三角帆蚌对外界类胡萝卜素的吸收也表现出浓度依赖性、时间依赖性及饱和性,说明三角帆蚌对外界类胡萝卜素的吸收和转运是一个通过载体蛋白参与介导的易化运输过程。
3.3 添加类胡萝卜素对三角帆蚌贝壳珍珠质颜色的影响本实验中所测量的贝壳珍珠质颜色主要集中在两个区域:一处为贝壳的内脏团痕与纵肋的交叉处,称为边缘壳;另一处为中央膜插核处,称为中央壳。在珍珠的生产培育过程中,前者所对应的外套膜组织通常用于制备成细胞小片插入育珠蚌内培育珍珠;而后者所对应的区域通常为细胞小片插核育珠处。由于珍珠颜色主要受提供外套膜细胞小片的供片蚌贝壳珍珠质的颜色所影响,因此对此部位贝壳珍珠质颜色的测量将能够大致预测出此蚌作为供片蚌所培育的珍珠颜色。在实验40 d后,对不同实验组的三角帆蚌贝壳珍珠质颜色参数进行了测量,比较分析不同实验组和对照组之间颜色参数差异是否显著,以期研究体外添加类胡萝卜素是否对三角帆蚌贝壳珍珠质颜色具有显著影响。结果显示, 只在紫色选育系三角帆蚌中边缘壳的珍珠质颜色参数a*、b*和C*随着类胡萝卜素添加浓度的增加呈现上升趋势,然而与对照组之间差异并不显著。白色选育系三角帆蚌各实验组贝壳珍珠质的颜色参数值之间差异均不显著。马孝甜[32]通过虾青素对马氏珠母贝的影响研究中发现,通过投喂虾青素,贝体可以摄取虾青素,累积后可通过代谢将虾青素转运至贝壳中,从而使贝壳致色。本实验中三角帆蚌添加类胡萝卜素后,贝壳珍珠质颜色参数值所表现出的规律性较弱,数据出现反复性,这可能是由于贝壳中CaCO3等无机物占95%左右,而有机物含量较少,且贝壳珍珠质致色是一个复杂的生物矿化过程,有机色素需要长时间的富集而最终致色[33-34]。
| [1] |
汪桂玲, 白志毅, 刘晓军, 等. 三角帆蚌种质资源研究进展[J]. 水产学报, 2014, 38(9): 1618-1627. WANG G L, BAI Z Y, LIU X J, et al. Research progress on germplasm resources of Hyriopsis cumingii[J]. Journal of Fisheries of China, 2014, 38(9): 1618-1627. |
| [2] |
李家乐, 刘越. 影响养殖珍珠质量的主要因子[J]. 水产学报, 2011, 35(11): 1753-1760. LI J L, LIU Y. The main influencing factors on the quality of cultured pearls[J]. Journal of Fisheries of China, 2011, 35(11): 1753-1760. |
| [3] |
LI Q Q, BAI Z Y, HAN X K, et al. Freshwater nucleated pearl quality is influenced by host mussel growth traits in Hyriopsis cumingii[J]. Aquaculture Research, 2017, 48(9): 4656-4665. DOI:10.1111/are.2017.48.issue-9 |
| [4] |
BAI Z Y, LI Q Q, HAN X K, et al. Estimates of genetic parameters and genotype by environment interactions for shell nacre color and growth traits in the purple freshwater pearl mussel Hyriopsis cumingii[J]. Aquaculture International, 2017, 25(6): 2079-2090. DOI:10.1007/s10499-017-0170-x |
| [5] |
毛媛媛, 郑荣泉, 张启鹏, 等. 转录组测序研究三角帆蚌珍珠颜色相关基因[J]. 水产学报, 2018, 42(3): 322-333. MAO Y Y, ZHENG R Q, ZHANG Q P, et al. Transcriptome sequencing analysis on pearl color related genes in Hyriopsis cumingii[J]. Journal of Fisheries of China, 2018, 42(3): 322-333. |
| [6] |
MCGINTY E L, EVANS B S, TAYLOR J U U, et al. Xenografts and pearl production in two pearl oyster species, P. margaritifera:Effect on pearl quality and a key to understanding genetic contribution[J]. Aquaculture, 2010, 302(3/4): 175-181. |
| [7] |
ZHENG H P, LIU H L, ZHANG T, et al. Total carotenoid differences in scallop tissues of Chlamys nobilis (Bivalve:Pectinidae) with regard to gender and shell colour[J]. Food Chemistry, 2010, 122(4): 1164-1167. DOI:10.1016/j.foodchem.2010.03.109 |
| [8] |
BAI Z Y, ZHENG H F, LIN J Y, et al. Comparative analysis of the transcriptome in tissues secreting purple and white nacre in the pearl mussel Hyriopsis cumingii[J]. PLoS One, 2013, 8(1): e53617. DOI:10.1371/journal.pone.0053617 |
| [9] |
ZHANG W G, ZHANG G S. Dynamic structural color in the nacre of Hyriopsis cumingii and its cause[J]. Optik-International Journal for Light and Electron Optics, 2017, 135: 252-255. DOI:10.1016/j.ijleo.2017.01.098 |
| [10] |
URMOS J, SHARMA S K, MACKENZIE F T. Characterizations of some biogenic carbonates with Raman spectroscopy[J]. American Mineralogist, 1991, 76(3): 641-646. |
| [11] |
LI X L, BAI Z Y, LUO H R, et al. Comparative analysis of total carotenoid content in tissues of purple and white inner-shell color pearl mussel, Hyriopsis cumingii[J]. Aquaculture International, 2014, 22(5): 1577-1585. DOI:10.1007/s10499-014-9766-6 |
| [12] |
DESMARCHELIER C, BOREL P. Overview of carotenoid bioavailability determinants:From dietary factors to host genetic variations[J]. Trends in Food Science and Technology, 2017, 69: 270-280. DOI:10.1016/j.tifs.2017.03.002 |
| [13] |
LINAN-CABELLO M A, PANIAGUA-MICHEL J, HOPKINS P M. Bioactive roles of carotenoids and retinoids in crustaceans[J]. Aquaculture Nutrition, 2002, 8(4): 299-309. DOI:10.1046/j.1365-2095.2002.00221.x |
| [14] |
LI N, HU J J, WANG S, et al. Isolation and identification of the main carotenoid pigment from the rare orange muscle of the Yesso scallop[J]. Food Chemistry, 2010, 118(3): 616-619. DOI:10.1016/j.foodchem.2009.05.043 |
| [15] |
TOEWS D P, HOFMEISTER N R, TAYLOR S A. The evolution and genetics of carotenoid processing in animals[J]. Trends in Genetics, 2017, 33(3): 171-182. DOI:10.1016/j.tig.2017.01.002 |
| [16] |
公翠萍, 朱文彬, 刘浩亮, 等. 饲料中添加虾青素对红罗非鱼各组织类胡萝卜素含量和沉积率的影[J]. 上海海洋大学学报, 2014, 23(3): 417-422. GONG C P, ZHU W B, LIU H L, et al. Effect of dietary astaxanthin on carotenoid content and deposition rate in tissues of red tilapia[J]. Journal of Shanghai Ocean University, 2014, 23(3): 417-422. |
| [17] |
麻楠, 龙晓文, 赵磊, 等. 饲料中添加合成虾青素对中华绒螯蟹成体雌蟹性腺发育、色泽和抗氧化能力的影响[J]. 水生生物学报, 2017, 41(4): 755-765. MA N, LONG X W, ZHAO L, et al. Effects of dietary supplementation of synthetic astaxanthin on ovarian development, coloration and antioxidant capacity of adult female Chinese mitten crab, Eriocheir sinensis[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 755-765. DOI:10.7541/2017.94 |
| [18] |
程云生, 陈世金, 李静, 等. 饲料中组合色素对红草金鱼体色的影响[J]. 淡水渔业, 2015, 45(5): 94-99. CHENG Y S, CHEN S J, LI J, et al. Effects of combinated dietary pigments on body color of red Carassius auratus[J]. Freshwater Fisheries, 2015, 45(5): 94-99. |
| [19] |
YANAR Y, CELIK M, YANAR M. Seasonal changes in total carotenoid contents of wild marine shrimps (Penaeus semisulcatus and Metapenaeus monoceros) inhabiting the eastern Mediterranean[J]. Food Chemistry, 2004, 88(2): 267-269. DOI:10.1016/j.foodchem.2004.01.037 |
| [20] |
WANG X C, GONG Y J, SONG D C. Design and study of a color sensitivity function[J]. Color Research and Application, 2005, 30(2): 118-124. DOI:10.1002/(ISSN)1520-6378 |
| [21] |
刘合露. 华贵栉孔扇贝橙色闭壳肌个体富集类胡萝卜素原因的初步研究[D]. 汕头: 汕头大学, 2011. LIU H L. Preliminary study on cause of carotenoids enriched in orange adductor individuals in the noble scallops Chlamys nobilis Neeve[D]. Shantou: Shantou University, 2011. |
| [22] |
李宁. 虾夷扇贝橘红色闭壳肌产生的原因及其在育种中的应用[D]. 青岛: 中国海洋大学, 2009. LI N. What accounting for orange color of Yesso scallop muscle (Patinopecten yessoensis) and its application in breeding[D]. Qingdao: Ocean University of China, 2009. |
| [23] |
DE LA MORA G I, ARREDONDO-FIGUEROA J L, PONCE-PALAFOX J T, et al. Comparison of red chilli (Capsicum annuum) oleoresin and astaxanthin on rainbow trout (Oncorhyncus mykiss) fillet pigmentation[J]. Aquaculture, 2006, 258(1/4): 487-495. |
| [24] |
KALINOWSKI C T, ROBAINA L E, FERNáNDEZ-PALACIOS H, et al. Effect of different carotenoid sources and their dietary levels on red porgy (Pagrus pagrus) growth and skin colour[J]. Aquaculture, 2005, 244(1/4): 223-231. |
| [25] |
TORRISSEN O J. Pigmentation of salmonids:Factors affecting carotenoid deposition in rainbow trout (Salmo gairdneri)[J]. Aquaculture, 1985, 46(2): 133-142. DOI:10.1016/0044-8486(85)90197-8 |
| [26] |
周光宏, TUMER, LARSENT. 离体牛小肠细胞对β-胡萝卜素和叶黄素吸收的研究[J]. 动物营养学报, 1996, 8(4): 15-18. ZHOU G H, TUME R, LARSEN T. In vitro uptake of β-carotene and lutein by small intestinal cells of calves[J]. Acta Zoonutrimenta Sinica, 1996, 8(4): 15-18. |
| [27] |
刘清, 周光宏. 离体小肠粘膜细胞对类胡萝卜素的吸收[J]. 南京农业大学学报, 1997, 20(4): 54-59. LIU Q, ZHOU G H. Uptake of carotenoids by intestinal mucous cells of layers and goats in vitro[J]. Journal of Nanjing Agricultural University, 1997, 20(4): 54-59. |
| [28] |
TYCZKOWSKI J K, HAMILTON P B. Canthaxanthin as a model for the study of utilization of oxycarotenoids by chickens[J]. Poultry Science, 1986, 65(7): 1350-1356. DOI:10.3382/ps.0651350 |
| [29] |
DURING A, HUSSAIN M M, MOREL D W, et al. Carotenoid uptake and secretion by CaCo-2 cells:β-carotene isomer selectivity and carotenoid interactions[J]. Journal of Lipid Research, 2002, 43(7): 1086-1095. DOI:10.1194/jlr.M200068-JLR200 |
| [30] |
杨文平. 类胡萝卜素体外模拟吸收研究[D]. 南京: 南京农业大学, 2007. YANG W P. Study on the intestinal carotenoids uptake in vitro[D]. Nanjing: Nanjing Agricultural University, 2007. |
| [31] |
SHYAM R, VACHALI P, GORUSUPUDI A, et al. All three human scavenger receptor class B proteins can bind and transport all three macular xanthophyll carotenoids[J]. Archives of Biochemistry and Biophysics, 2017, 634: 21-28. DOI:10.1016/j.abb.2017.09.013 |
| [32] |
马孝甜. 虾青素对马氏珠母贝的影响研究[D]. 湛江: 广东海洋大学, 2012. MA X T. Study on the influence of astaxanthin on Pinctada martensii[D]. Zhanjiang: Guangdong Ocean University, 2012. |
| [33] |
SUN X J, YANG A G, WU B, et al. Characterization of the mantle transcriptome of yesso scallop (Patinopecten yessoensis):identification of genes potentially involved in biomineralization and pigmentation[J]. PLoS One, 2015, 10(4): e0122967. DOI:10.1371/journal.pone.0122967 |
| [34] |
KY C L, DEMMER J, BLAY C, et al. Age-dependence of cultured pearl grade and colour in the black-lipped pearl oyster Pinctada margaritifera[J]. Aquaculture Research, 2017, 48(3): 955-968. DOI:10.1111/are.2017.48.issue-3 |
2. Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


