2. 河南省水产动物养殖工程技术研究中心, 河南 新乡 453007
麦穗鱼(Pseudorasbora Parva)隶属于鲤形目(Cypriniformes)鲤科(Cyprinidae)麦穗鱼属(Pseudorasbora),其原产地为中国东部、日本、韩国和蒙古[1]。目前麦穗鱼随经济鱼类引种已扩散至我国西部地区及世界各地,分布区域达到35个国家和地区,遍布亚洲、欧洲及大洋洲[2]。麦穗鱼在云南天然分布于金沙江和南盘江水系[3],在1963至1970年间引进“四大家鱼”等经济鱼类时,被带入洱海等滇中湖泊[4],现已广泛分布于云南伊洛瓦底江、怒江、澜沧江、红河水系等非天然分布水体[5]。
李仙江属红河水系一级支流,发源于大理南涧,流域涉及景东、镇沅、普洱、墨江等县。把边江和阿墨江为李仙江的两条一级支流,二者在江城三锅桩附近汇合,始称李仙江[6]。中国科学院昆明动物研究所和西南林业大学先后对李仙江鱼类组成进行了调查,使得李仙江鱼类记录达到64种(亚种),其中,包括6种外来种,分别为麦穗鱼、高体鳑鲏(Rhodeus ocellatu)、波氏吻鰕虎鱼(Rhinogobius cliffordpopei)、子陵吻鰕虎鱼(Rhinogobius giurinus)、莫桑比克罗非鱼(Oreochromis mossambicus)和食蚊鱼(Gambusia affinis)[7-8]。入侵风险评估结果显示,麦穗鱼为高入侵风险鱼类,可与同一生态位土著鱼类竞争饵料,威胁其生存,造成不可估计的经济及生物多样性损失[9]。
入侵成功的生物往往具有较为灵活的生活史、较强的形态可塑力和繁殖力[10]。其中形态可塑性情况是生物体遗传或表观遗传与环境相互作用的直接体现[11]。1966年麦穗鱼进入波兰,入侵波兰的居群在约30年后形态上产生了显著变异[12]。随后,对欧洲地区麦穗鱼进行较为全面的形态学分析发现,麦穗鱼的确存在显著的形态变异,即便是同一国家的不同居群,虽然形态上非常相似,但也存在差异[13]。然而曾燏[14]对四川南充、石棉、茂县和西昌入侵麦穗鱼居群间的形态学研究发现,这些居群在形态上没有显著差异。
麦穗鱼作为外来种进入云南的时间与欧洲引入时间类似,红河水系李仙江由两条一级支流及干流组成。充足的引入时间及复杂的水域环境是否造成李仙江麦穗鱼形态出现变异?本文通过多变量形态度量学方法结合主成分分析、判别分析和差异性分析来检验李仙江麦穗鱼地理居群间的形态学变化,旨在为深入开展该种鱼类形态分化、生态变异研究提供基础资料。
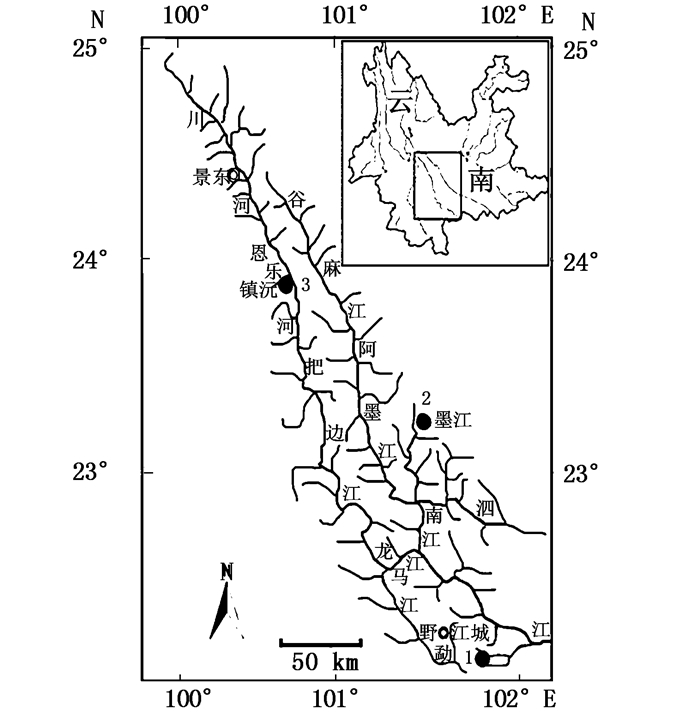
1 材料与方法 1.1 标本来源本研究检视标本分别于2015年1月采自镇沅五一水库、墨江碧溪、江城中寨,采集信息见表 1和图 1。均系福尔马林浸制标本,共89尾。标本鉴定参照禇新洛和陈银瑞[3],陈宜喻[5]。为方便所用标本在主成分分值散点图中识别,对同一采样点的标本给予统一的分组编号(表 1)。
|
图 1 李仙江麦穗鱼取样点分布图(序号与表 1的分组号对应)
Fig. 1 Distribution map of grouping species of P. parva from Lixianjiang (the number corresponds with the grouping number in Tab. 1)
|
|
表 1 麦穗鱼标本采集信息 Tab.1 The sample size and localities information of Pseudorasbora pava |
形态测量参照ZÁHORSKÁ[13]等的框架结构(truss-procotol),选择23个解剖学坐标点(landmarks of anatomy)(图 2),采用电子数显卡尺测量两坐标点之间的直线距离,常规性测量了包括头长(11-8)、头高(15-2)、眼径(13-12)等在内的共计11个常规性状和16个框架结构性状。选择标本左侧进行测量,测量数据精确到0. 1 mm。

|
图 2 麦穗鱼测量框架图
Fig. 2 Frame chareacters for P. pava
1.尾鳍下叶末端;2.鳃峡;3.腹鳍起点;4.臀鳍起点;5.尾鳍腹侧起点;6.胸鳍起点;7.臀鳍基部末端;8.鳃盖后缘;9.尾鳍上下叶最凹处;10.尾鳍基部;11.吻端;12.眼眶后缘;13.眼眶前缘;14.尾鳍背侧起点;15.枕骨后缘;16.尾鳍上叶末端;17.背鳍基部末端;18.背鳍起点;19.背鳍鳍条末端;20.胸鳍鳍条末端;21.腹鳍鳍条末端;22.臀鳍鳍条末端;23.口裂终点 1. Terminal of caudal fin upper lobe; 2.Gill Gorge; 3.Origin of pelvic fin; 4. Origin of anal fin; 5. Ventral origin of caudal fin; 6.Origin of pectoral fin; 7.Terminal of anal fin base; 8.Terminal of operculum; 9. The most concave of caudal fin; 10.Caudal fin base; 11.Tip of snout; 12.Behind of orbit; 13.Frontier of orbit; 14.Dorsal origin of caudal fin; 15.Behind of occipital bone; 16.Terminal of caudal fin inferior lobe; 17Terminal of dorsal fin base; 18.Origin of dorsal fin; 19.Terminal of dorsal fin rays; 20.Terminal of pectoral fin rays; 21.Terminal of pelvic fin rays; 22.Terminal of anal fin rays; 23.Terminal of mouth |
测量数据通过Microsoft Excel 2010进行初步统计和数据标准化。可量性状的测量值经对数转换(log10)消除体型差异及异速生长对分析结果的影响,除体长外的其他形态测量值按ELLIOTT[15]等提出的公式进行了标准化:
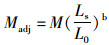
式中: M是原先测量值; Madj是按体长调整后的测量值; L0是标准体长; Ls是所有样本鱼标准体长的平均值; 参数b是logM与logL0回归的斜率。计算转换变量与标准体长之间的相关系数,检验在消除数据中的体长效应时数据转换是否有效。标准化后的测量值与标准体长无显著相关性,因异速生长造成的体长效应被成功消除[15]。
主成分分析(principle analysis,PCA)在SPSS 22.0软件中进行。确定进行分析的变量是否适合因子分析时,选择KMO和Bartleet球形度检验[16]。使用因子分析(Factoranalysis)中的默认设置,选择协方差矩阵(Covariance matrix)和Varimax正交旋转法;将各个主成分的得分值(Scores)进一步制成散点图进行分析。
通过因子分析,从11个常规变量和16框架结构性状数据中筛选出对区分3个种群贡献较大的7个性状,使用SPSS 22. 0软件中的Fisher判别函数进行分析[17],分别建立该3个种群的判别函数式,并检验其判别准确率。
为辅助主成分分析方法对物种形态变异的有效性分析,进一步通过地理种群形态差异系数(coefficient of difference,CD)进行分析,以确定不同居群的散点是否为种内不同地理种群的差异。差异系数计算公式:CD=|M1-M2| / (SD1+SD2),M1和M2分别为1、2种群某参数标准化后的均值,SD1和SD2分别为1、2种群某参数的标准差[18]。
2 结果与分析 2.1 主成分分析经KMO和Bartlett检验表明:KMO值为0.905,其值接近1;Bartlett值为2 882.986,形态特征值在居群间差异极显著(P<0.001),说明原有变量适合进行因子分析。
主成分分析结果显示,主成分1(PC1)、主成分2(PC2)和主成分3(PC3)的贡献率分别为55.094%,8.397%和6.988%,累积贡献率为70.469%。第一主成分主要反应的是麦穗鱼鱼鳍鳍位特征以及尾部形态特征,第二主成分主要反应的是鱼类臀鳍特征,第三主成分主要反应的是鱼类体高特征。说明可以用几个相互独立的因子来概括不同采样点居群间的形体差异。所有采集点标本凭借PC1和PC2的分值散点大致分为2群:镇沅居群,江城和墨江居群(图 3A),而PC2和PC3的分值散点图(图 3B)则不能将三者有效区分。

|
图 3 李仙江麦穗鱼3个居群主成分分析散点图
Fig. 3 Scatter plots for the Lixianjiang three groups of principal component analysis
(a)第1、2主成分散点图; (b)第2、3主成分散点图 (a) Scatter plot of scores on PC1 and PC2; (b) Scatter plot of scores on PC2 and PC3 |
镇沅居群凭借PC1的分值散点与江城居群和墨江居群区分,以PC1负荷绝对值大小排序,处于前7位的是吻端至腹鳍起点距离(11-3)、腹鳍起点至臀鳍起点距离(3-4)背鳍基部末端至尾鳍基部距离(17-10)、背鳍基部末端至尾鳍背侧起点距离(17-14)、腹鳍长(3-21)、背鳍基部末端至臀鳍起点距离(17-4)、尾柄高(14-5),表明与江城和墨江标本相区别时,镇沅居群的腹鳍、背鳍、臀鳍、尾鳍间相对位置及腹鳍长和尾柄高起到主要贡献作用。
2.2 判别分析逐步对11个常规变量和16框架结构性状变量进行筛选,选择对区分3个地理居群麦穗鱼有显著贡献的7个变量(P < 0.01),按照差异大小依次为吻端至腹鳍起点距离(11-3)、腹鳍起点至臀鳍起点距离(3-4)、背鳍基部末端至尾鳍基部距离(17-10)、背鳍基部末端至尾鳍背侧起点距离(17-14)、腹鳍长(3-21)、背鳍基部末端至臀鳍起点距离(17-4)、尾柄高(14-5)。以此7个性状为自变量,建立麦穗鱼3个地理种群的判别函数式:
江城种群:Y1=9.543X1+8.320X2+3.132X3+67.891X4+7.739X5+8.025X6+6.440X7-201.964
墨江种群:Y2=12.792X1+14.450X2+2.668X3+7.5317X4+6.569X5+6.007X6+4.064X7-208.892
镇沅种群:Y1=9.864X1-0.349X2+4.567X3+10.557X4+8.259X5+10.7562X6+8.2903X7-286.2322
用上述3式分别对麦穗鱼江城居群、墨江居群和镇沅居群的个体进行判别分类,其中镇沅居群的判别率高达100%,江城居群、墨江居群的判别率均为96.7%。综合判别率为97.8% (表 2)。

|
表 2 李仙江麦穗鱼3个地理种群的判别结果 Tab.2 Discriminant results of P. pava populations from Jiangcheng, Mojiang and Zhenyuan in Lixianjiang |
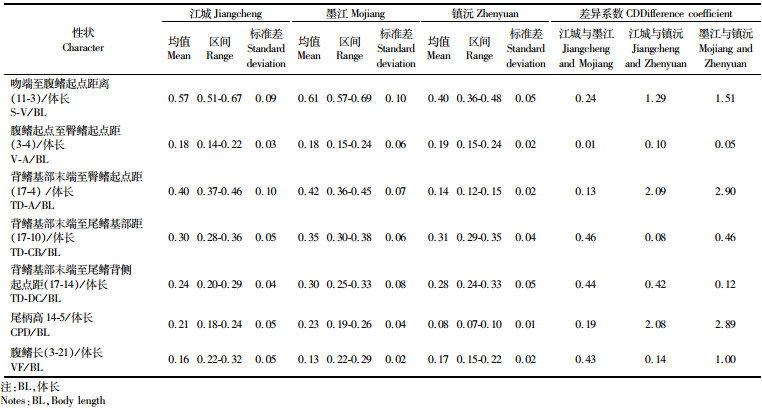
取主成分分析中起主要贡献作用的5个框架性状和2个常规性状与体长的比值进行形态差异系数分析。发现,江城地理居群与镇沅地理居群之间差异系数大于1.28的比例性状有3个,墨江地理居群与镇沅地理居群之间亦有3个。但是,江城地理居群和墨江地理居群之间最大仅为0.46(表 3)。
|
表 3 与主成分相关性状的差异性分析 Tab.3 Analysis of characters relative to principal components |
多变量形态度量分析,主要通过汇集物种外部形态框架结构中的多维空间变量信息,然后利用SPSS等统计学软件进行统计分析,从中筛选出有效的差异形态变量,用于对传统度量学方法难以辨认的物种进行鉴定。从而确定物种的有效性及潜在的种下阶元的存在[19]。本研究选用的27个测量指标参照了ZÁHORSKÁ[13]对欧洲麦穗鱼形态特征进行分析的相应指标,指标的选择上具有代表性,也较为充分,能够反映麦穗鱼的形态结构特点。
对形态测量数据的分析,分类学常用的方法为因子分析即主成分分析和差异系数分析进行鉴别[20-22]。而判别分析法,可利用数学方法建立判别方程,对种群来源进行归类分析,也是一种可对数据进行有效提取的一种重要手段,目前逐渐在形态学分析中有所应用[23-24]。此三种方法在鱼类形态多变量分析过程中可相互补充、相互印证,实现对数据的充分挖掘,已被广泛应用于鱼类分类学及生态学研究[25-27]。
本研究通过主成分分析方法可将标本大致分为两群,其中,镇沅居群相对独立,而江城、墨江居群不能完全区分开来。区分镇沅居群的7个性状是吻端至腹鳍起点距离、腹鳍起点至臀鳍起点距离、背鳍基部末端至尾鳍基部距离、背鳍基部末端至尾鳍背侧起点距离、腹鳍长、背鳍基部末端至臀鳍起点距离、尾柄高,表明镇沅居群的麦穗鱼鱼鳍鳍位特征以及尾部形态特征与江城和墨江居群有显著差异。在差异系数分析结果中,5个框架性状、2个常规性状中镇沅地理居群与江城居群存在差异的有3个,而与墨江地理居群存在差异的达3个,同样显示镇沅居群麦穗鱼具有一定程度的分化。通过判别分析建立麦穗鱼3个地理种群的判别函数,对镇沅居群的判别率高达100%,与主成分分析结果一致。而另外两个江城和墨江居群的内分别仅有1个判错,判别率高达96.7%。通过判别函数,可有效区分三个种群。三种方法均支持镇沅居群形态特征与其他两个居群存在显著差异。
镇沅麦穗鱼居群相对独立,可能由多方面原因造成。包括麦穗鱼来源,生境差异及地理隔离。首先,李仙先江麦穗鱼是引进“四大家鱼”等经济鱼类时被引种带入,但是何时,从何地引入,目前无法确认。麦穗鱼自然分布非常广泛,长江、珠江、黄河等均有分布,这三大水系均有可能是其引种来源。造成镇沅地区样品形态特征差异较大的原因极有可能是镇沅地区麦穗鱼样品的来源与其他地区不同。其次,生境方面,由于流域的东侧降雨大于西侧, 因此李仙江流域的东侧支流阿墨江的径流深要大于西侧把边江的径流深[6], 水文环境的差异可能导致镇沅与墨江的麦穗鱼鱼鳍鳍位特征以及尾部形态特征产生差异。此外,地理隔离也可能是一方面原因。本研究取样点镇沅和墨江分属于李仙江一级支流把边江和阿墨江,江城属李仙江干流流域。镇沅与墨江直线距离虽然较近,为100.33 km,但中间有云岭山脉分隔,在自然状况下,河流不能跨越山脉流动,除人为因素外,二者间无法进行自然交流。相对孤立的环境下,也容易形成特殊的地理种群。尽管仅仅100.33km的隔离太短。但由于地理位置特殊性,也可能造成其产生形态变异的原因。
在李仙江流域的镇沅、墨江、江城三地中,麦穗鱼形态差异的出现可能还与时间变异有关。外来物种形态变异受到时间进程显现出来的变异称之为时间变异。麦穗鱼引入欧洲约半个世纪,8个不同国家的麦穗鱼居群(4个罗马尼亚居群,2个斯洛伐克居群,1个英国居群和1个法国居群)分别在头长、臀鳍基部末端至尾鳍基部距离、尾叉长、尾下叶长度等形态学参数上存在显著差异[13]。此外,小范围的波兰地区的麦穗鱼间也同样出现了形态显变异[12]。其他入侵种同样存在此现象。鰕虎鱼(Neogobius kessleri)在1990s早期在多瑙河中游出现,随后种群数量大幅增加,在短短10几年里其形态发生了强烈变化,表现出极强的表型适应性[28]。麦穗鱼进入云南的时间与进入欧洲的时间接近[4],在半个世纪的时间内,麦穗鱼在镇沅、墨江、江城三地相对独立的地理环境中,形态差异的出现可能体现出空间和时间变异的累积。
物种表型的表现形式除受环境因素影响外,遗传因素也发挥着不容忽视的作用。物种内部形态变异的呈现也同样体现着环境和遗传两种因素的协同效应[29]。然而本文仅从形态度量学角度探讨了李仙江流域的3个麦穗鱼种群形态分化、差异的特点。李仙江麦穗鱼形态变异的产生是环境异质性的结果还是遗传因素的影响,二者的影响程度如何?两因素协同作用的贡献率分别是多少?此外,环境异质性因素中时间变异及空间变异对总的形态变异的贡献程度也有待进一步分析。今后有望借助于微卫星[30]、线粒体Cytb、核基因序列rpS7、简化基因组SNP位点等分子生物学手段对李仙江和原产地麦穗鱼进行分析,判断李仙江麦穗鱼的来源,阐明其形态变异的产生的具体原因。
| [1] |
GOZLAN R E, ANDREOU D, ASAEDA T, et al. Pan-continental invasion of Pseudorasbora parva:towards a better understanding of freshwater fish invasions[J]. Fish and Fisheries, 2010, 11(4): 315-340. DOI:10.1111/faf.2010.11.issue-4 |
| [2] |
KARABANOV D P, KODUKHOVA Y V. Stone moroco Pseudorasbora parva (Cyprinidae):New species in the ichthyofauna of Vietnam[J]. Journal of Ichthyology, 2013, 53(3): 235-239. DOI:10.1134/S0032945213020057 |
| [3] |
禇新洛, 陈银瑞. 云南鱼类志(上册)[M]. 北京: 科学出版社, 1989. CHU X L, CHEN Y R. The fishes of Yunnan, China (Ⅰ)[M]. Beijing: Science Press, 1989. |
| [4] |
张玉娟, 张乃明, 高阳俊. 云南省生物入侵现状分析[J]. 云南环境科学, 2004, 23(1): 10-14. ZHANG Y J, ZHANG N M, GAO Y J. Analysis of the present situation of biological invasion in Yunnan province[J]. Yunnan Environmental Science, 2004, 23(1): 10-14. |
| [5] |
陈宜瑜. 中国动物志:硬骨鱼纲.鲤形目(中卷)[J]. 北京:科学出版社, 1998. CHEN Y Y. China fauna. Osteichthyes. Carp shape mesh (volume)[J]. Beijing:Science Press, 1998. |
| [6] |
王国华. 李仙江流域水文特性[J]. 山西建筑, 2009, 35(30): 361-362. WANG G H. The hydrographic characteristics of Lixian river drainage area[J]. Shanxi Architecture, 2009, 35(30): 361-362. DOI:10.3969/j.issn.1009-6825.2009.30.227 |
| [7] |
杨剑, 潘晓赋, 陈小勇, 等. 李仙江鱼类资源的现状与保护对策[J]. 水生态学杂志, 2010, 3(2): 54-60. YANG J, PAN X F, CHEN X Y, et al. Status and conservation strategy of fish resources in Lixianjiang River[J]. Journal of Hydroecology, 2010, 3(2): 54-60. |
| [8] |
杨丽萍, 杨琴, 李奇生, 等. 李仙江鱼类的区系存在度分析[J]. 安徽农业大学学报, 2012, 39(2): 184-188. YANG L P, YANG Q, LI Q S, et al. Analysis of the value of faunal presence of fish in the Lixian River[J]. Journal of Anhui Agricultural University, 2012, 39(2): 184-188. |
| [9] |
杨丽萍, 杨琴, 宁航, 等. 李仙江流域外来鱼种调查及风险分析[J]. 广东农业科学, 2012, 39(13): 177-179. YANG L P, YANG Q, NING H, et al. Investigation and risk analysis of introduced fishes in Lixianjiang basin[J]. Guangdong Agricultural Sciences, 2012, 39(13): 177-179. DOI:10.3969/j.issn.1004-874X.2012.13.060 |
| [10] |
PHILLIPS B L, SHINE R. Adapting to an invasive species:toxic cane toads induce morphological change in Australian snakes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(49): 17150-17155. DOI:10.1073/pnas.0406440101 |
| [11] |
李光雷, 喻树迅, 范术丽, 等. 表观遗传学研究进展[J]. 生物技术通报, 2011, 31(1): 40-49. LI G L, YU S X, FAN S L, et al. Advances of research on epigenetics[J]. Biotechnology Bulletin, 2011, 31(1): 40-49. |
| [12] |
KOTUSZ J, WITKOWSKI A. Morphometrics of Pseudorasbora parva (Schlegel, 1842) (Cyprinidae:Gobioninae), a species introduced into the Polish waters[J]. Acta Ichthyologica et Piscatoria, 1998, 28(2): 3-14. |
| [13] |
ZÁHORSKÁ E, KOVÁČ V, Falka I, et al. Morphological variability of the Asiatic cyprinid, topmouth gudgeon Pseudorasbora parva, in its introduced European range[J]. Journal of Fish Biology, 2009, 74(1): 167-185. DOI:10.1111/jfb.2009.74.issue-1 |
| [14] |
曾燏. 入侵种麦穗鱼的形态特征分析[J]. 水生态学杂志, 2012, 33(2): 115-120. ZENG Y. Morphometrics analysis of the invasive Pseudorasbora parva from different habitats[J]. Journal of Hydroecology, 2012, 33(2): 115-120. |
| [15] |
ELLIOTT N G, HASKARD K, KOSLOW J A. Morphometric analysis of orange roughy (Hoplostethus atlanticus) off the continental slope of southern Australia[J]. Journal of Fish Biology, 1995, 46(2): 202-220. DOI:10.1111/jfb.1995.46.issue-2 |
| [16] |
闵锐, 叶莲, 陈小勇, 等. 滇池金线鲃形态度量学分析(Cypriniformes:Cyprinidae)[J]. 动物学研究, 2009, 30(6): 707-712. MIN R, YE L, CHEN X Y, et al. Morphometrics analysis of Sinocyclocheilus grahami (Cypriniformes:Cyprinidae)[J]. Zoological Research, 2009, 30(6): 707-712. |
| [17] |
任志娟. SPSS中判别分析方法的正确使用[J]. 统计与决策, 2006(3): 157. REN Z J. Proper use of discriminant analysis in SPSS[J]. Statistics and Decision, 2006(3): 157. |
| [18] |
MAYRE, LINSLEY E G, USINGER R L. Methods and principles of systematic zoology[M]. New York: McGraw-Hill, 1953.
|
| [19] |
刘彩霞, 彭作刚, 何舜平. 长臀鮠属鱼类多变量形态分析及物种有效性研究[J]. 水生生物学报, 2005, 29(5): 507-512. LIU C X, PENG Z G, HE S P. Studies on species classification for genus Cranoglanis peters with the method of morphometrics[J]. Acta Hydrobiologica Sinica, 2005, 29(5): 507-512. |
| [20] |
杨琴, 周伟, 舒树森. 云南盘鮈不同地理居群的形态变异及分化[J]. 动物分类学报, 2011, 36(1): 117-124. YANG Q, ZHOU W, SHU S S. Morphological variations and differentlation of Discogobio yunnanensis from different population[J]. Acta Zootaxonomica Sinica, 2011, 36(1): 117-124. |
| [21] |
姚景龙, 严云志, 高勇, 等. 扁头鮡地理种群形态变异的研究兼论大鳍鮡的物种有效性[J]. 动物分类学报, 2007, 32(4): 814-821. YAO J L, YAN Y Z, GAO Y, et al. Study on morphological variations of Pareuchiloglanis kamengensis and species validity of P. Macropterus in Southwestern of China[J]. Acta Zootaxonomica Sinica, 2007, 32(4): 814-821. |
| [22] |
徐衡, 胡永来, 徐义平, 等. 浙江彩虹明樱蛤群体的形态和遗传多样性分析[J]. 上海海洋大学学报, 2016, 25(4): 508-514. XU H, HU R L, XU Y P, et al. The analysis of genetic diversity and morphology of Moerella iridescens in Zhejiang Province[J]. Journal of Shanghai Ocean University, 2016, 25(4): 508-514. DOI:10.12024/jsou.20151001576 |
| [23] |
梁超, 杨爱国, 刘志鸿, 等. 4个地理群体魁蚶(Scapharca broughtonii)的形态差异与判别分析[J]. 海洋科学, 2011, 35(11): 108-113. LIANG C, YANG A G, LIU Z H, et al. Morphological variations and discriminant analysis of different geographical populations of Scapharca broughtonii Schrenck[J]. Marine Sciences, 2011, 35(11): 108-113. |
| [24] |
李秀启, 安丽, 王亚楠, 等. 南水北调东线南四湖湖鲚种群的形态判别与地理亲缘关系[J]. 水生态学杂志, 2015, 36(2): 81-87. LI X Q, AN L, WANG Y N, et al. Morphological discriminant analysis and phylogeography of Coilia ectenes in Nansi lake on the Eastern Route of the South-to-North Water Transfer Project[J]. Journal of Hydroecology, 2015, 36(2): 81-87. |
| [25] |
马爱军, 王新安, 孙志宾, 等. 红鳍东方鲀(Takifugu rubripes)三个不同群体的形态差异分析[J]. 海洋与湖沼, 2016, 47(1): 166-172. MA A J, WANG X A, SUN Z B, et al. Morphological variations among three different populations of Takifugu rubripes[J]. Oceanologia et Limnologia Sinica, 2016, 47(1): 166-172. |
| [26] |
代应贵, 岳晓炯, 尹邦一. 濒危鱼类稀有白甲鱼沅江种群与西江种群形态度量学性状的差异性[J]. 生态学杂志, 2013, 32(3): 641-647. DAI Y G, YUE X J, YIN B Y. Morphometrics differences between the populations of endangered species Onychostoma rara from Yuanjiang River and Xijiang River systems, Southwest China[J]. Chinese Journal of Ecology, 2013, 32(3): 641-647. |
| [27] |
廖锐, 区又君, 勾效伟, 等. 黄唇鱼、大黄鱼、丁氏(鱼或)和棘头梅童鱼的形态差异和判别分析[J]. 大连水产学院学报, 2009, 24(4): 305-310. LIAO R, OU Y J, GOU X W, et al. Morphological variations and discrimination of four fish species Chinese bahaba Bahaba flavolabiata, large yellow croaker Pseudosciaena crocea, Ting'wak Wak tingi and spinyhead croaker Collichthys lucidus[J]. Journal of Dalian Fisheries University, 2009, 24(4): 305-310. |
| [28] |
KOVÁČ V, SIRYOVÁ S. Ontogenetic variability in external morphology of bighead goby Neogobius kessleri from the Middle Danube, Slovakia[J]. Journal of Applied Ichthyology, 2005, 21(4): 312-315. DOI:10.1111/jai.2005.21.issue-4 |
| [29] |
杨继. 植物种内形态变异的机制及其研究方法[J]. 武汉植物学研究, 1991, 9(2): 185-195. YANG J. Infraspecific variation in plant and the exploring methods[J]. Journal of Wuhan Botanical Research, 1991, 9(2): 185-195. |
| [30] |
马洪雨, 郭金峰, 岳永生, 等. 东平湖麦穗鱼群体遗传结构的微卫星标记分析[J]. 生命科学研究, 2006, 10(1): 67-70. MA H Y, GUO J F, YUE Y S, et al. Genetic variation of Pseudorasbora parva in Dongping Lake Using microsatellites[J]. Life Science Research, 2006, 10(1): 67-70. |
2. Engineering Technology Research Center of Henan Province for Aquatic Animal Cultivation, Henan Normal University, Xinxiang 453007, Henan, China
 2018,
Vol. 27
2018,
Vol. 27


