2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产国家教学示范中心, 上海 201306
随着人口增长与经济发展,水体营养化问题日益加剧。水体氮磷含量升高、沉水植被破坏和退化,必定造成藻类水华频发[1]。水生植物是湖泊系统演化和生态平衡的重要调节者[2],沉水植物[3]在富营养化水体治理和湖泊生态恢复上起到主要作用。然而,需改善发生水华水体的水质以满足适当的光照、底质等水生植物生长的基本条件[4]。自1975年SHAPIRO等提出生物操纵理论以来,重视富营养化水体生态调控[5-6]的学者越来越多,其核心[7]就是利用大型浮游动物的摄食作用抑制水体浮游植物增长,从而达到净化水质与降低富营养化程度的目的,为沉水植物提供一个合适的生存环境。
大型溞(Daphnia magna)作为湖泊和水库中常见的枝角类动物,能摄食引起水华的蓝、绿藻等浮游植物。在较高磷浓度下,生物操纵条件之一为恢复、重建水生植被[8]。大型溞通过摄食浮游植物,降低其生物密度,提高透明度,为苦草提供适宜的生存条件,同时减少水体富营养物质浓度。在藻-溞系统中加入大型水生植物可减小水体N/P,有利于增强其竞争力,从而抑制藻类繁殖[9],提高溞对藻的控制效果,同时增加生态系统的复杂性和生物多样性。苦草(Valisneria natans)[10]属水鳖科(Hydrocharitaceae)苦草属(Valisneria),常被称为扁担草、水韭菜、面条草,是我国常见的沉水植物之一,具有个体繁殖快、再生能力强、环境适应性强、破坏后恢复时间短的特点[11],是湖泊水生植被重建的先锋种之一[12]。苦草叶、根可分别吸收转化水体、底泥中各种形式的氮磷,使其控制在合理浓度范围内。
本实验利用大型溞与苦草的协同作用配合处理富营养水体,以强化生态修复效果。研究模拟处理系统的水质变化特征,为深入研究生物操纵机理,指导湖泊水华控制和生态恢复实践提供参考。
1 材料与方法 1.1 实验设计溞-草系统所用苦草采自上海市金山区朱行实验基地,植株健壮,长(10.0±0.5) cm。每株5个分枝,无分芽。大型溞是实验室驯化改良品种,繁殖迅速,摄食绿藻效率高,能抵御恶劣环境影响,对生态系统危害小,被称为“食藻虫”。
实验系统为2 m×5 m×0.4 m的露天水泥池,实验组为溞-草系统,对照组仅种植苦草,不投放大型溞,空白组未加苦草和大型溞,各设3个平行。底泥采自朱行实验基地池塘,混合均匀铺于池底,厚6: 8 cm。试验用水取自基地井水,TAN为1.44 mg/L、TN为1.48 mg/L、TP为0.149 mg/L。实验水深(36±2) cm,水温28: 40 ℃,pH为7: 8。试验期间在10、18、24 d补水3次以维持深度不变。用漂白水杀菌,一周后种植苦草,均质量1.28 g,种植密度100株/池,成活率100%。向实验组投放3次大型溞,11、15 d投放密度20 ind/L,23 d为10 ind/L。
1.2 采样与检测方法实验27 d前每隔三天采集实验组和对照组水样一次,共5次,27 d后每隔七天采一次,共3次。每实验池选取四角和中心共5个采样点测定水体透明度,各采1 L后混合均匀后储存待测,同时取1 L食藻虫计数。每点随机取两株苦草测定生物量。水质指标检测方法为氨氮(纳氏试剂光度法)、总氮(过硫酸钾紫外分光光度法)、总磷(钼锑抗分光光度法)、透明度(透明度盘)。
1.3 数据处理与统计分析数据经Excel处理后用SPSS进行差异显著性检验。
以11 d开始实验计,最大去除率为相邻两次采样浓度计算得到去除率的最大值,最终去除率为实验初、末期浓度计算得到的总去除率。去除率和最终去除率计算公式如下:
 (1)
(1)
 (2)
(2)
式中:W1与W2分别为最大去除率与最终去除率;c初、c末为实验初期和末期浓度(mg/L);cn、cn+1为相邻两次采样时水样浓度(mg/L)。
2 结果与分析 2.1 大型溞与苦草对水质的影响 2.1.1 总氮由图 1表示,11 d各组总氮浓度最大,为5: 6 mg/L。15 d后实验组浓度大幅下降,且降幅显著大于对照组和空白组(P < 0.01)。3次投放大型溞后总氮去除率实验组>对照组>空白组,实验组分别为70%、35%、39%,对照组为35%、15%、20%,而空白组仅为12%、7%、2%。第一次投放实验组与对照组总氮去除率为最大,去除率随时间逐渐降低。实验组、对照组、空白组最终去除率具有显著差异(P < 0.05),分别为87%、67%、43%。

|
图 1 实验期间水体总氮浓度的变化
Fig. 1 Variations of total nitrogen in eutrophic water during the experiment
|
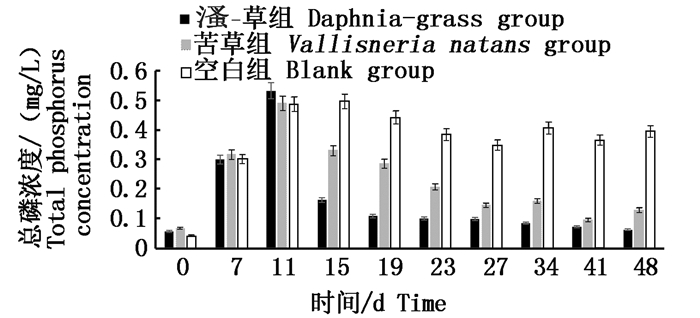
图 2为实验期间总磷浓度变化,可见与总氮变化规律基本一致。11 d总磷浓度达到最大,之后开始下降,实验组总磷浓度降幅显著大于对照组和空白组(P < 0.01)。3次投入大型溞后实验组总磷去除率分别为70%、33%、2%,此时对照组为30%、13%、29%,而空白组为-2%、11%、10%。15 d实验组与对照组总磷去除率最大,随时间逐渐降低。实验组、对照组、空白组最终去除率具有显著差异(P < 0.05),分别为88%、73%、18%。
|
图 2 实验期间水体总磷浓度的变化
Fig. 2 Variations of total phosphorus in eutrophic water during the experiment
|
图 3为实验期间氨氮的浓度变化,与总氮、总磷浓度变化趋势相同。11 d氨氮浓度达到最大,占总氮的90%,之后迅速下降,实验组氨氮浓度降幅显著大于对照组(P < 0.01)。3次投入大型溞后实验组氨氮去除率分别为86%、7%、-105%,此时对照组为57%、7%、-41%,而空白组仅为20%、10%、-8%。15 d实验组与对照组氨氮去除率最大,并随时间逐渐降低。实验组与对照组最终去除率无显著差异,但显著大于空白组(P>0.05),分别为96%、94%、68%。

|
图 3 实验期间水体氨氮浓度的变化
Fig. 3 Variations of ammonia nitrogen in eutrophic water during the experiment
|
图 4为实验期间透明度变化,实验组透明度改善明显快于对照组。3个组的透明度变化具有显著性(P < 0.05)。3次投入大型溞后实验组的透明度为16、24、38 cm,对照组为10、14、19 cm,空白组为12、16、17 cm。3个组最终的水体透明度为38、35、32 cm。

|
图 4 实验期间水体透明度的变化
Fig. 4 Variations of transparency in eutrophic water during the experiment
|
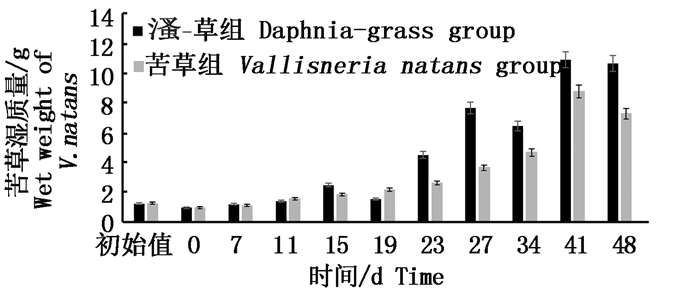
图 5为实验期间苦草生物量变化。15 d开始生长,实验组与对照组的苦草生长量幅度有显著性差异(P < 0.05)。23 d实验组苦草生物量涨幅最大,达到186%,对照组仅为46%;41 d实验组涨幅在68%,对照组为87%。苦草最终生物量涨幅实验组为740%,对照组为470%。
|
图 5 实验期间苦草生物量的变化
Fig. 5 Variations of biomass(wet weight) of V.natans during the experiment
|
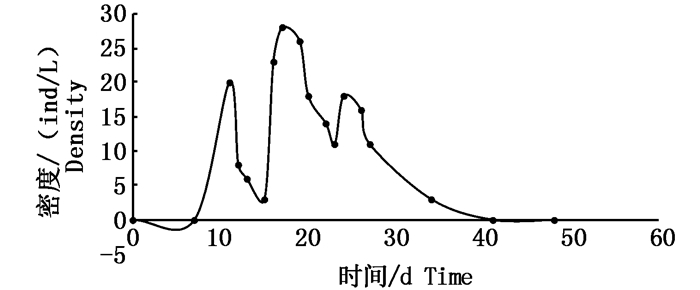
图 6为实验期间大型溞密度变化。11 d氮磷浓度最高时投放大型溞,15 d仅有3 ind/L,此型溞,17 d大型溞有所增长,密度为28 ind/L,之后密度下降,23 d密度为11 ind/L,此时投放大时投放大型溞,没有再生长,40 d密度为0 ind/L。
|
图 6 实验期间大型溞密度的变化
Fig. 6 Variations of density of Daphnia magna during the experiment
|
图 7、图 8为实验期间底泥氮磷变化,波动较大。48 d内,实验组氮浓度由初始2 392 mg/kg降到1 571 mg/kg,去除率为39%,对照组由2 437 mg/kg下降到1 461 mg/kg,去除率为40%;实验组磷浓度由1 219 mg/kg下降到747 mg/kg,去除率为38%,对照组由1 219 mg/kg下降到827 mg/kg,去除率为32%。

|
图 7 实验期间底泥总氮浓度的变化
Fig. 7 Variations of total nitrogen in sediment during the experiment
|

|
图 8 实验期间底泥总磷浓度的变化
Fig. 8 Variations of total phosphorus in sediment during the experiment
|
富营养水体氮磷主要来源为沉积物内源性释放[13-14]。在本实验中,11 d后底泥总氮、总磷浓度都呈先增后减的趋势,浓度增加可能为浮游生物和悬浮物颗粒沉降造成。沉降是提高水体透明度的途径之一,且物理沉降效率比生物沉降大[15],不过副作用也较大。孙小静等[16]和CARIGNAN[17]认为物理沉降过程中藻细胞破裂释放胞内物质,其有机氮在微生物作用下降解成无机氮营养盐。在本实验中,实验组透明度明显大于对照组,可见大型溞有利于摄食浮游植物并沉降颗粒物质。
沉降也是降低水体氮磷浓度较高效的方法。么男[18]等用复合硅酸铝水处理剂吸附、沉降水体中有毒有害的微小污染物和大颗粒污染物,能提高透明度,降低水体氮磷浓度。本实验中,大型溞摄食微藻,死亡后沉降,充当了“生物沉降剂”的角色。第一次投放大型溞3 d后实验组总氮、总磷、氨氮去除率最大,分别为70%、70%、86%,远大于对照组(35%、30%、57%)。最终去除率实验组也高于对照组,表明投入大型溞有利于降低水体氮磷浓度。
3.2 大型溞有利于苦草生长苦草处理富营养化水体非常高效。周裔文等[19]研究发现,高氮磷浓度(TN=12 mg/L,TP=1.0 mg/L)下苦草对氮磷的净化能力更强,并随着浓度降低,净化能力减弱。苦草虽能在暗光下生长,但在高密度浮游植物水体中生长受限[20],说明浮游植物对苦草生长的影响并不限于遮光作用。在实验组中大型溞配合苦草处理富营养化水体,短时间内抑制并减少浮游植物密度,提高透明度,给苦草生长营造良好环境。本实验中,实验组苦草生长明显优于对照组,投放大型溞后苦草生长变快,最终均质量为10.68 g,优于对照组(7.3 g)。并且,大型溞生长周期短,含水率高,消亡后对环境造成影响很小[21]。
氨氮是苦草可利用氮源的主要形态,当氨氮含量较高时苦草优先吸收氨氮[22]。本实验中,实验组和对照组氨氮最终去除率分别为96%和94%,差异不大。但11 d投放大型溞后实验组氨氮浓度迅速降低,15 d去除率达86%,占总去除率的90%;而对照组去除率仅为57%,占总去除率的60%。这可能是大型溞促进苦草生长,加快对水体氨氮的吸收所致。
3.3 大型溞有利于系统稳定溞-草配合处理富营养化水体较好地解决了物种的单一性问题,提高了生态系统的稳定性。王程丽[23]混合培养小球藻-混合大型溞-金鱼藻,在高浓度氮磷水体中溞与草是正增长,具有促进作用,而藻类呈负增长,体现抑制效果;同时,溞、草单独或联合作用都能有效控制藻类,但小球藻-混合大型溞-金鱼藻效果更好,系统更加稳定。
在本实验系统中,沉水植物群落可为浮游动物提供主要栖居地和避难场所[24],大型溞与苦草相辅相成,形成一个良性水生态系统。CANFIELD等[25]研究发现,浮游甲壳类动物生物量与沉水植物在水体中的占有体积(Plant Volume Inhabited,PVI)呈显著正相关(R=0.47,P=0.000 1)。大型溞摄食微藻,沉降大颗粒物,有益于沉水植被光合作用释放氧气,水体含氧量增加后又有利于大型溞生长[26-28],从而形成共生关系。而沉水植物可以通过吸收氮、磷营养盐、无机碳等竞争限制藻类生长[29]。
4 总结(1) 本实验通过大型溞-苦草配合处理富营养水体,处理效果比单一沉水植物处理效果好。大型溞-苦草配合处理污水的效率更高,最大去除率TN:70%,TP:70%,NH3-N:86%,最终去除率TN:87%,TP:88%,NH3-N:96%,底泥去除率TN:39%,TP:38%,大于单一苦草处理的对照组。
(2) 加入大型溞能更好地控制水体浮游植物,增加透明度,促进苦草的生长。实验组在27 d透明度即可见底,且水草最终生长率740%。
| [1] |
姚雁鸿, 余来宁. 生物操纵在退化湖泊生态恢复上的应用[J]. 江汉大学学报(自然科学版), 2007, 35(2): 81-84. YAO Y H, YU L N. Biomanipulation and its application in restoration of degradation lake[J]. Journal of Jianghan University (Natural Sciences), 2007, 35(2): 81-84. |
| [2] |
MOSS B. Engineering and biological approaches to the restoration from eutrophication of shallow lakes in which aquatic plant communities are important components[J]. Hydrobiologia, 1990, 200(1): 367-377. |
| [3] |
谷孝鸿, 张圣照, 白秀玲, 等. 东太湖水生植物群落结构的演变及其沼泽化[J]. 生态学报, 2005, 25(7): 1541-1648. GU X H, ZHANG S Z, BAI X L, et al. Evolution of community structure of aquatic macrophytes in East Taihu Lake and its wetlands[J]. Acta Ecological Sinica, 2005, 25(7): 1541-1648. |
| [4] |
SHAPIRO J, LAMARRA V, LYNCH M. Biomanipulation: an ecosystem approach to lake restoration[C]//BREZONIK P L, Fox J L eds. Proceedings of a Symposium on Water Quality Management through Biological Control. Gainesville: University of Florida, 1975: 85-96.
|
| [5] |
孙刚, 盛连喜. 湖泊富营养化治理的生态工程[J]. 应用生态学报, 2001, 12(4): 590-592. SUN G, SHENG L X. Ecological engineering for eutrophication control in lake[J]. Chinese Journal of Applied Ecology, 2001, 12(4): 590-592. |
| [6] |
石岩, 张喜勤, 付春艳, 等. 浮游动物对净化湖泊富营养化的初步探讨[J]. 东北水利水电, 1998(3): 31-33. SHI Y, ZHANG X Q. Preliminary discussion on eutrophication of purified lakes by zooplankton[J]. Water Resources & Hydropower of Northeast China, 1998(3): 31-33. |
| [7] |
刘晶, 秦玉洁, 丘焱伦, 等. 生物操纵理论与技术在富营养化湖泊治理中的应用[J]. 生态科学, 2005, 24(2): 188-192. LIU J, QIN Y J, QIU Y L, et al. Advances on biomanipulation in control of eutrophic lakes[J]. Ecological Science, 2005, 24(2): 188-192. |
| [8] |
马剑敏, 成水平, 贺锋, 等. 武汉月湖水生植被重建的实践与启示[J]. 水生生物学报, 2009, 33(2): 222-229. MA J M, CHENG S P, HE F, et al. Practice and implication of establishing aquatic vegetation in Lake Yuehu in Wuhan, China[J]. Acta Hydrobiologica Sinica, 2009, 33(2): 222-229. |
| [9] |
马帅, 王程丽, 张亚捷, 等. 氮磷浓度对藻-溞-草间相互作用的影响[J]. 水生生物学报, 2012, 36(1): 66-72. MA S, WANG C L, ZHANG Y J, et al. Influences of nitrogen and phosphorus concentration on interactions among Chlorella vugaris, Daphnia magna and Ceratophyllum demersum[J]. Acta Hydrobiologica Sinica, 2012, 36(1): 66-72. |
| [10] |
熊秉红, 李伟. 我国苦草属(Vallisneria L.)植物的生态学研究[J]. 武汉植物学研究, 2000, 18(6): 500-508. |
| [11] |
祖艳群, 李元, 陈海燕, 等. 蔬菜中铅镉铜锌含量的影响因素研究[J]. 农业环境科学学报, 2003, 22(3): 289-292. ZU Y Q, LI Y, CHEN H Y, et al. Research on factors influencing concentrations of Pb, Cd, Cu and Zn in vegetable[J]. Journal of Agro-Environment Science, 2003, 22(3): 289-292. |
| [12] |
胡旭. 富营养化湖泊水生植被恢复及其生态效应研究[D]. 武汉: 华中农业大学, 2013. HU X. Restoration of aquatic vegetation and its ecological effects in eutrophic lake[D]. Wuhan: Huazhong Agricultural University, 2013. |
| [13] |
张治中. 滇池氮与富营养化研究[J]. 环境科学导刊, 2007, 26(6): 34-36. ZHANG Z Z. Study on nitrogen and eutriophication of Dianchi Lake[J]. Environmental Science Survey, 2007, 26(6): 34-36. |
| [14] |
周小宁, 王圣瑞, 金相灿. 沉水植物黑藻对沉积物有机、无机磷形态及潜在可交换性磷的影响[J]. 环境科学, 2006, 27(12): 2421-2425. ZhOu X N, WANG S R, JIN X C. Influences of submerged vegetation Hydrilla verticillata on the forms of inorganic and organic phosphorus and potentially exchangeable phosphate in sediments[J]. Environmental Science, 2006, 27(12): 2421-2425. DOI:10.3321/j.issn:0250-3301.2006.12.010 |
| [15] |
张木兰, 潘纲, 陈灏, 等. 改性沉积物除藻对水质改善的效果研究[J]. 环境科学学报, 2007, 27(1): 13-17. ZHANG M L, PAN G, CHEN H, et al. Study of the effect on water quality improvement by removal of algal blooms using modified sediment[J]. Acta Scientiae Circumstantiae, 2007, 27(1): 13-17. |
| [16] |
孙小静, 秦伯强, 朱广伟. 蓝藻死亡分解过程中胶体态磷、氮、有机碳的释放[J]. 中国环境科学, 2007, 27(3): 341-345. SUN X J, QIN B Q, ZHU G W. Release of colloidal phosphorus, nitrogen and organic carbon in the course of dying and decomposing of cyanobacteria[J]. China Environmental Science, 2007, 27(3): 341-345. |
| [17] |
CARIGNAN R, KALFF J. Phosphorus sources for aquatic weeds:water or sediments?[J]. Science, 1980, 207(4434): 987-989. DOI:10.1126/science.207.4434.987 |
| [18] |
么男. 天津市河湖水生态治理与修复技术研究[D]. 天津: 天津大学, 2015. YAO N. Research on treatment and rehabilitation technology of Tianjin rivers and Lakes ecological[D]. Tianjin: Tianjin University, 2015. |
| [19] |
周裔文, 许晓光, 韩睿明, 等. 水体氮磷营养负荷对苦草净化能力和光合荧光特性的影响[J]. 环境科学, 2018, 39(3): 1180-1187. ZHOU Y W, XU X G, HAN R M, et al. Effect of nutrient loadings on the regulation of water nitrogen and phosphorus by Vallisneria natans and its photosynthetic fluorescence characteristics[J]. Environmental Science, 2018, 39(3): 1180-1187. |
| [20] |
黎慧娟. 富营养水体中光照、营养及浮游植物对沉水植物生长和生理影响的研究[D]. 武汉: 中国科学院研究生院(水生生物研究所), 2006. LI H J. The influences of light, nutrition and phytoplankton on growth and physiology of submerged macrophytes in eutrophic waters[D]. Wuhan: Institute of Hydrobiology, Chinese Academy of Sciences, 2006. |
| [21] |
蔡清洁. pH和盐度对大型溞摄食行为及抗逆响应的影响[D]. 上海: 上海海洋大学, 2015. CAI Q J. The effects of feeding behavior and resistance response on daphnia magna about pH and salinity[D]. Shanghai: Shanghai Ocean University, 2015. |
| [22] |
徐昇, 李欣, 钟萍, 等. 苦草根系对硝氮和氨氮的吸收[J]. 生态科学, 2012, 31(3): 312-317. XU S, LI X, ZHONG P, et al. The uptake of nitrate and ammonium by the root of Vallisneria natans[J]. Ecological Science, 2012, 31(3): 312-317. |
| [23] |
王程丽. 氮磷浓度对溞-藻-草三者间相互作用关系的影响研究[D]. 新乡: 河南师范大学, 2011. WANG C L. Study on the interaction among flea-algae-grass cultured in different nitrogen and phosphorus concentration[D]. Xinxiang: Henan Normal University, 2011. |
| [24] |
BURKS R L, LODGE D M, JEPPESEN E, et al. Diel horizontal migration of zooplankton:costs and benefits of inhabiting the littoral[J]. Freshwater Biology, 2002, 47(3): 343-365. DOI:10.1046/j.1365-2427.2002.00824.x |
| [25] |
CANFIELD D E JR. Prediction of chlorophyll a concentrations in Florida Lakes:the importance of phosphorus and nitrogen[J]. JAWRA Journal of the American Water Resources Association, 1983, 19(2): 255-262. DOI:10.1111/jawr.1983.19.issue-2 |
| [26] |
李佩. 附着藻类及浮游植物与苦草的相互关系研究[D]. 武汉: 华中农业大学, 2012. LI P. Researchs on the relationships between periphytic algae, phytoplankton and Vallisneria natans[D]. Wuhan: Huazhong Agricultural University, 2012. |
| [27] |
宋大祥. 大型溞(Daphnia magna Straus)的初步培养研究[J]. 动物学报, 1962, 14(1): 49-62. SONG D X. Studies on the culturing of Daphnia magna Straus (Crustacea, Cladocera)[J]. Acta Zoologica Sinica, 1962, 14(1): 49-62. |
| [28] |
SCHEFFER M, CARPENTER S, FOLEY J A, et al. Catastrophic shifts in ecosystems[J]. Nature, 2001, 413(6856): 591-596. DOI:10.1038/35098000 |
| [29] |
杨凤娟, 蒋任飞, 饶伟民, 等. 沉水植物在富营养化浅水湖泊修复中的生态机理[J]. 安徽农业科学, 2016, 44(26): 58-61. YANG F J, JIANG R F, RAO W M, et al. Ecological mechanisms of submerged macrophytes inthe restoration of eutrophic shallow lakes[J]. Journal of Anhui Agricultural Sciences, 2016, 44(26): 58-61. DOI:10.3969/j.issn.0517-6611.2016.26.022 |
2. Key Laboratory of Freshwater Fishery Germplasm Rescources, Ministry of Agriculture, Shanghai Ocean University, Shanghai 201306, China;
3. National Demonstration Center for Fisheries Education, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


