2. 国家海洋局 东海环境监测中心, 上海 201206;
3. 国家海洋局 东海分局, 上海 200137;
4. 国家海洋局 宁德海洋环境监测中心站, 福建 宁德 352000
三沙湾位于福建省东北部,是由东冲半岛和鉴江半岛环抱而成的海湾。其地形口小腹大,面积约714 km2,宽仅2.6 km,西北侧有塞江、霍童溪等注入,东南方仅有东冲口与东海相连。三沙湾海岸线曲折,海湾众多,湾内相对风平浪静,有著名良港三都澳以及城澳、漳湾、白马、盐田等作业区。三沙湾还是全国唯一的内湾性大黄鱼产卵场及最大的海水网箱养殖基地[1-3]。此外,8县(市)约8 700 km2流域面积的溪、河汇集于此,还承纳了200多万人口的生产、生活污水。据2004—2006年赤潮灾害统计表明,三沙湾赤潮监控区发生了14起赤潮[4],均发生在福宁湾内,但从2011年5月起,三沙湾也出现了赤潮现象,对其渔业和养殖业产生了一定的影响。
近年来对于三沙湾浮游植物的研究大多为浮游植物种类组成和数量分布[5-6],关于三沙湾浮游植物与环境因子之间关系的探讨尚未见报道。浮游植物的生长繁殖受多种环境因子的共同作用,运用多元分析可以很好地反映环境因子对浮游植物的影响。冗余分析(redundancy analysis, RDA)是一种线性多元直接梯度分析,它是基于统计学的角度来评价一个或一组变量与另一组多变量数据之间的关系[7]。RDA分析能有效地对多个环境指标进行统计检验,并确定对群落变化具最大解释能力的最小变量组,从而更好地反映群落与环境之间的关系[8]。本研究的主要目的是,在对三沙湾浮游植物和环境因子进行调查的基础上,运用多元分析技术分析浮游植物与环境因子之间的关系,识别出影响浮游植物生长的关键环境因子,以期为该区域的赤潮预测提供科学依据。
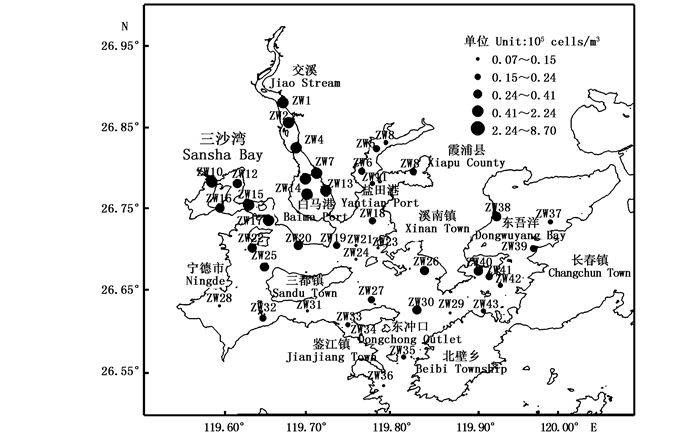
1 材料与方法 1.1 采样时间与站位布设2016年3月30日—4月3日(春季)小潮期完成三沙湾水质、浮游植物调查。由于三沙湾是一个湾中有湾,港中有港的复杂海湾,为使监测数据全面且具有代表性,因此在三沙湾主要河流入海处、湾中央部位、大黄鱼海洋保护区以及与海的交汇处共设置43个站位(图 1),分布于整个三沙湾海域。

|
图 1 三沙湾浮游植物调查站位
Fig. 1 Sampling stations in Sansha bay
|
浮游植物以水采样品进行定量分析。分层采水,每层采水量0.5 L,用Lugol′s溶液(复方碘溶液)固定。水深在15 m以内的站位,分别采表、底两层水样;水深大于15 m的站位,分别采表、中、底三层水样。采用各层水样混合样计数,带回实验室进行显微镜鉴定,分析每站的浮游植物种类、数量。相关水文化学样品的采集均为表层水体,分析均按照《海洋监测规范》(GB17378—2007)的规定执行。
1.3 数据处理和统计分析 1.3.1 生物指数的计算采用Shannon-Weaver多样性指数(H′)、均匀度指数(J)、丰度指数(d) (公式1-3)对浮游植物群落多样性进行分析评价,通过优势种优势度(Y,公式4)确定样本优势种群。
(1) 多样性指数(H′)计算公式:
 (1)
(1)
式中:H′为种类多样性指数、S为样品中的总种数、Pi为第i种的个体数(ni)与总个体数(N)的比值(ni/N)。评价标准为:H′在3~4为清洁区域;2~3为轻度污染,1~2为中度污染;小于1为重度污染。
(2) 均匀度指数(J)计算公式:
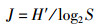 (2)
(2)
式中:J表示均匀度、H′表示种类多样性指数值、S表示样品中总种数。J值范围为0~1之间,J值大时,体现种间个体数分布较均匀;J值小时,反映种间个体数分布欠均。由于环境污染种间个体数分布差别大,则J值也小。
(3) 丰富度指数(d)计算公式:
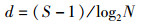 (3)
(3)
式中:d表示丰富度指数、S表示样品中的总种数、N表示样品中的生物总个数。一般而言,健康的环境,种类丰度高;污染的环境,种类丰度较低。
(4) 优势种优势度(Y)的计算公式:
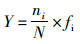 (4)
(4)
式中:fi为第i个种在各样方中出现频率、ni为群落中第i个种在空间中的个体数量;N为群落中所有种的个体数总和。本次调查生物优势度Y≥0.02即为优势种。
1.3.2 统计分析基础数据统计用Excel完成。运用Canoco 4.5软件对浮游植物和环境因子进行分析。浮游植物筛选要求为该物种在各样点出现的频率大于等于12.5%[9-10]。分析前对数据进行相应的处理:浮游植物数据和环境因子(除pH外)均转换为lg(x+1)的形式。最终分析数据包含15种浮游植物和8种环境因子(水温、pH、盐度、悬浮物、溶解氧、化学需氧量、活性磷酸盐、无机氮)。首先对浮游植物进行除趋势对应分析(detrended correspondence analysis, DCA),以确定群落属于单峰型分布还是线型分布[11],如果4个排序轴的梯度最大值超过4,选择单峰模型比较合适,如果小于3,则线性模型比较合适;介于3~4之间,两种模型均合适。由于环境因子之间可能存在较高的相关性,因此膨胀因子(Inflation factor)大于20的环境因子都将被剔除[12]。同时采用向前选择(Forward selection),相关显著性用蒙特卡洛置换检验(Monte Carlo Permutation tests)逐步筛选出显著的环境变量。
2 结果与分析 2.1 调查海域环境状况三沙湾43个站点的水环境概况见表 1。本文图表中的环境因子名称与代码均与表 1相同。调查海域水环境因子理化性状变化较大,如表层温度的变化范围为14.1~27.8;表层盐度的变化范围为5.8~27.8,表层温度、盐度呈现出从湾顶到湾口逐渐增大的趋势,说明各个站位间的环境条件存在较大差异。

|
表 1 三沙湾水环境因子状况 Tab.1 variations of environmental factors of the Sansha Bay |
本次调查海域共鉴定浮游植物3门22属38种。种类组成以硅藻门为主,有19属34种,占总种数的89.47%,是调查海域的主要类群;甲藻门共鉴定出2属3种,占总种数的7.89%;金藻门共鉴定出1属1种,占总种数的2.63%。三沙湾浮游植物优势种(Y≥0.02)为粒径较小的微型浮游植物中肋骨条藻(Skeletonema costatum),优势度为0.89,隶属于硅藻门。细胞数量为5.75×106 cells/L,占三沙湾海域细胞总密度的89.4%,出现频度达100%。
三沙湾春季各站位浮游植物总数量变化范围在7.40×103~8.70×105 cells/L之间,平均为1.63×105 cells/L。其中总数量在zw1站最高,zw24站最低,三沙湾西北方的交溪、白马港区和卢门港区附近海域为高数量区(图 2)。
|
图 2 浮游植物数量空间分布示意图
Fig. 2 Distribution of phytoplankton amount
|
三沙湾春季水采浮游植物群落Shannon-Weaver多样性指数(H′)、均匀度指数(J)和丰度指数(d)的平面分布如图 3所示。多样性指数H′范围在0.04~1.67之间,呈现出自湾外向湾内降低的趋势;均匀度指数J范围在0.03~0.72之间,分布趋势与H′大体相同;丰度指数d范围在0.13~0.62,某些区域d和H′大致呈嵌套分布,说明在某些丰度的高值区,浮游植物的群落结构较为单一,基本上是由高丰度的单一种群组成的。
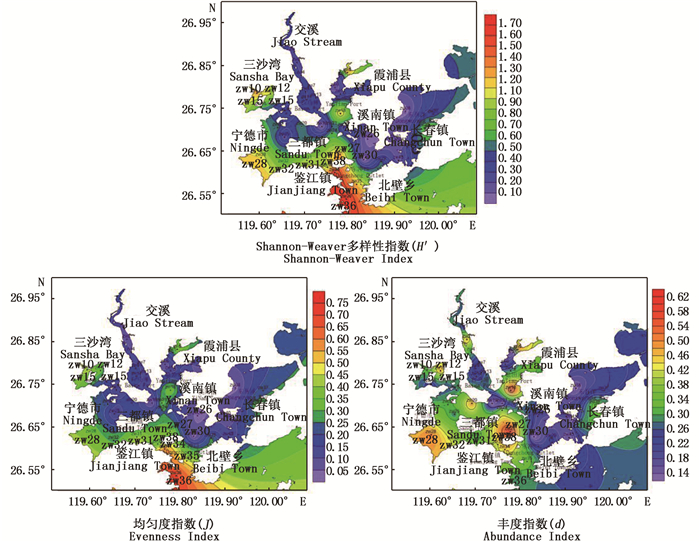
|
图 3 三沙湾浮游植物各项生物指数分布
Fig. 3 Distribution of biological indexes of phytoplankton in Sansha Bay
|
DCA分析结果表明,每个排序轴中梯度长度最大值为2.329,小于3,因此选择冗余分析(RDA)对浮游植物与环境因子之间的关系进行分析。三沙湾春季浮游植物与环境因子的RDA分析结果见表 2。RDA分析结果显示前两个排序轴的特征值分别为0.273和0.114,前两轴累计解释了春季37.7%的物种变化信息。环境因子轴与物种排序轴之间的相关系数分别为0.902和0.893,前两轴累计解释了春季72.9%的物种-环境关系信息;两个物种排序轴和两个环境排序轴均近似垂直,相关系数分别为-0.03和0,说明排序轴与环境因子间线性结合程度较好地反映了物种与环境之间的关系,排序结果可靠[13]。
|
表 2 浮游植物群落RDA统计结果 Tab.2 Summary of redundancy analysis(RDA) of phytoplankton community for the first two axes |
利用向前引入法对环境因子进行逐步筛选,MonteCarlo置换检验结果显示,8个环境因子中有4个环境因子达到显著水平,分别为溶解氧(F=11.0,P =0.002)、盐度(F=3.8,P =0.002)、水温(F=3.9,P =0.002)和活性磷酸盐(F=3.6,P =0.002),说明这4个环境因子是影响三沙湾春季浮游植物的主要环境因子。
三沙湾春季浮游植物与环境因子的关系可以很好地在RDA图(图 4)中表现出来, 浮游植物种类代码见表 3。从RDA分析图中可以看出,影响物种分布的主要环境因子中与轴1相关性较强的环境因子为DO和Sal,相关系数分别为0.79和-0.50;与轴2相关性较强的环境因子为SPR和WT,相关系数分别为0.57和-0.54。
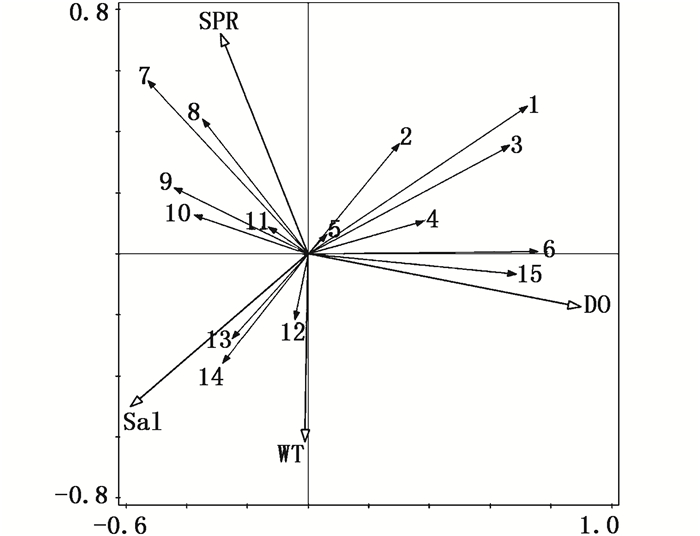
|
图 4 浮游植物与环境因子RDA排序图
Fig. 4 Correlation plots of the redundancy analysis(RDA) on the relationshio between the environment variables and phytoplankton taxa
|

|
表 3 RDA分析中浮游植物种类代码 Tab.3 Code of phytoplankton species for RDA |
由RDA分析可根据浮游植物对环境因子的需求将其分为5组:组Ⅰ为海洋曲舟藻(Pleurosigma pelagicum)和菱形藻(Nitzschia sp.),分布在SRP轴附近,与其呈正相关,与WT呈负相关。组Ⅱ包括:海链藻(Thalassiosira sp.)、舟形藻(Navicula sp.)和有翼圆筛藻(Coscinodiscus bipartitus),与Sal、SRP呈正相关,与WT、DO呈负相关,表明其分布环境具有高磷酸盐低溶解氧的特点;组Ⅲ为曲舟藻(Pleurosigma sp.)、羽纹藻(Pinnularia sp.)和具槽直链藻(Melosira sulcata),与WT、Sal呈正相关,与DO、SRP呈负相关,该组主要分布于温度、盐度相对较高的区域;Ⅳ组为琼氏圆筛藻(Coscinodiscus jonesianus)和太平洋海链藻(Thalassiosira pacifica),分布于DO轴附近,且与溶解氧轴呈强烈正相关,表明其生长与溶解氧密切相关。Ⅴ组包括:布氏双尾藻(Ditylum brightwellii)、变异直链藻(Melosira varians)、异常角毛藻(Chaetoceros abnormis)、中肋骨条藻和新月菱形藻(Nitzschia closterium),与DO、SRP呈正相关,与WT、Sal呈负相关,表明其对于低温低盐高溶解氧和高磷酸盐生境的适应性。
3 讨论 3.1 浮游植物优势种的变化随着海岸工程开发,海水养殖业的迅速发展以及工业、生活废水的污染,三沙湾海域的生态环境发生了巨大变化。以往对三沙湾浮游植物的研究多以浅水Ⅲ型浮游生物网采集的样品为主,而本文研究的是水采样品,因此在种类和细胞数量上会与以往的研究存在差异,所以本文仅以优势种的变化进行讨论。据林金美[5]1990年到1991年的调查,三沙湾春季浮游植物优势种为旋链角毛藻(Chaetoceros curvisetus)、中肋骨条藻、中心圆筛藻(Coscinodiscus centralis)和密联角毛藻(Chaetoceros densus)等。根据2013年三沙湾生态监控区的春季调查结果显示,优势种有中肋骨条藻、美丽盒形藻(Biddulphia pulchella)、琼氏圆筛藻、奇异菱形藻(Nitzschia paradoxa)、海生斑条藻(Grammatophora marina)、亚得里亚海杆线藻(Rhabdonema adriaticum), 整体分布较均匀,没有明显的高值或低值区。而此次浮游植物调查鉴定三沙湾春季浮游植物的优势种为中肋骨条藻,优势种高度集中且占绝对优势。王兴春等研究三沙湾浮游植物的生态类群时,发现主要是广温广盐性群落,以中肋骨条藻为主,且所占比例较大,与本研究结果一致[6]。优势种决定了群落内物质循环和能量流动的方式,支配着群落演替的方向[14]。20世纪70年代MAR ARTHUR和ELTON提出多样性-稳定性理论,该理论直到现在仍是指导着生物多样性和生态系统保护的基础理论[15],该理论表明浮游植物多样性与海洋生态系统的稳定性有着密切的联系。优势种种类及其数量对群落结构的稳定性有重要影响。优势种种类数越多、优势度越小,代表群落结构越复杂、越稳定[16]。本次调查优势种种类数少,为1种,优势度高,为0.89,多样性指数低,介于0.04~1.67之间,表明三沙湾春季浮游植物群落较单一,环境污染较严重。根据《2016年东海区海洋环境公报》显示,近岸局部海域污染较为严重,春季东海区近岸海域超第一类海水水质标准的海域面积为86 728 km2,劣于第四类海水水质标准的海域面积分为33 658 km2,主要分布于江苏近岸、长江口、杭州湾、浙江近岸及三沙湾、闽江口、厦门港等近岸海域。由此可见三沙湾海域污染严重,浮游植物群落结构的单一化可能使其存在着赤潮暴发的潜在风险。
3.2 浮游植物群落结构与环境因子的关系本次调查中硅藻种类数较多且占绝对优势,甲藻种类数较少,因为春季三沙湾受到浙闽沿岸流和湾内大陆径流的影响,水文性质较为复杂,而甲藻适应于温度较高、水体较稳定的环境,因此三沙湾春季的水采样品中甲藻仅在zw18、zw20和zw27出现。硅藻则适应于水动力条件混合强烈,营养盐浓度较高的春季[17],所以硅藻在各个站位均有分布。三沙湾属于内海,主要受太阳辐射和陆地径流(交溪、霍童溪、七都溪等)的影响。春季正值华南雨季,三沙湾西北面的白马河与霍童溪径流量增大,陆地径流作用较强,使得该海区平均盐度较低,与此同时带来了丰富的营养盐,因此高数量密集区分布于西北面的河口区。在春季占绝对优势的中肋骨条藻亦大量分布于此,根据三沙湾以往的调查结果显示,中肋骨条藻高值期通常出现在春季(7.53×104 cells/L),高数量区位于三都岛北面水域[18],与此次调查结果基本一致。在本研究中,中肋骨条藻是优势种,由于优势种对整个群落具有控制性影响,因此分析优势种与环境的关系可以代表整个群落与环境的关系[19]。从排序图中可以看出,中肋骨条藻距盐度向量反向延长线的垂直距离最近,说明盐度是影响它分布最重要的原因,且与盐度呈显著负相关。春季中肋骨条藻主要分布于三沙湾北部的交溪河口区,该处交溪的汇入使其盐度相对较低,适宜其生长;但中肋骨条藻是一种广温广盐性硅藻,在水温为0~37℃、盐度为13~36范围内均可生长[20],因此中肋骨条藻在三沙湾各个站位均有分布。栾青杉等[21]在研究长江口浮游植物群落与环境因子的关系时发现该海域的优势种中肋骨条藻的分布与海水的盐度呈负相关,盐度降低对中肋骨条藻的生长起促进作用,且主要分布在长江河口与冲淡水区域,与本研究结果一致。浮游植物的生长受温度、盐度、光照和营养盐等环境因素的影响。三沙湾浮游植物与环境因子的RDA分析表明,影响三沙湾春季浮游植物分布的关键环境因子是水温、盐度、溶解氧和活性磷酸盐。各种浮游植物的生态习性不同,因此对不同环境因子的响应机制也不同。其中温度是影响浮游植物生长最重要的环境因子之一[22]。硅藻是三沙湾最主要的浮游植物,硅藻喜低温,最适温度通常低于18 ℃[23-24]。三沙湾春季平均水温为17.2 ℃,是硅藻生长的理想温度,因此能促进其大量繁殖,形成明显的优势种。盐度是另一个控制浮游植物生长的重要环境因子[25],三沙湾春季,由于河水入海稀释了河口区海水的盐度,所以整个海域盐度差异较为明显,但该海域的硅藻多为广盐种类,因此能适应各种盐度而广泛分布[26]。海水中的溶解氧是浮游植物呼吸作用的必备条件,不同浮游植物对其含量有不同要求。李广玉等[27]在研究胶州湾浮游植物多样性及其与环境因子的关系时发现当浮游植物大量繁殖时,光合作用会产生大量的氧,浮游植物细胞总量与溶解氧数量呈正相关关系。冉祥浜等[28]在研究乳山湾浮游植物与环境因子的关系时亦发现乳山湾浮游植物数量大小与溶解氧之间具有非常明显的正相关关系。本研究中中肋骨条藻、琼式圆筛藻和异常角毛藻作为最主要的种类,它们的光合作用是水体中溶解氧的重要来源[29],故应与溶解氧呈正相关,与本研究RDA分析结果一致。营养盐也是一个影响浮游植物生长的重要环境因子,相关研究表明,营养盐浓度的升高有利于硅藻门丰度的升高[30],本次筛选出进入RDA分析的浮游植物种类均为硅藻门种类,故绝大部分与营养盐呈正相关,RDA分析表明除曲舟藻、羽纹藻和具槽直链藻以外的其余藻类均与活性磷酸盐呈正相关。王迪等[31]在对钦州湾浮游植物周年生态特征进行研究时发现春季浮游植物丰度与活性磷酸盐呈正相关,与本研究结果基本一致。
| [1] |
刘家富, 郑钦华, 陈洪清, 等. 三沙湾的水质状况[J]. 台湾海峡, 2003, 22(2): 201-204. LIU J F, ZHENG Q H, CHEN H Q, et al. Water quality condition in Sansha Bay[J]. Journal of Oceanography in Taiwan Strait, 2003, 22(2): 201-204. |
| [2] |
邵留, 于克锋, 吴海龙, 等. 三沙湾海域水质周年变化分析与评价[J]. 上海海洋大学学报, 2014, 23(2): 228-237. SHAO L, YU K F, WU H L, et al. Annual analysis and evaluation of water quality in Sansha Bay, Fujian[J]. Journal of Shanghai Ocean University, 2014, 23(2): 228-237. |
| [3] |
胡明, 韦章良, 韩红宾, 等. 三沙湾盐田港海水养殖海域水质调查与评价[J]. 上海海洋大学学报, 2014, 23(4): 582-587. HU M, WEI Z L, HAN H B, et al. The survey and assessment of water environmental quality in the mariculture area in the enclosed Sansha Bay[J]. Journal of Shanghai Ocean University, 2014, 23(4): 582-587. |
| [4] |
房月英. 三都湾赤潮监控区海水富营养化与赤潮发生的关系研究[D]. 福州: 福建师范大学, 2008. FANG Y Y. Relationships between eutrophication and the occurrences of red tide in red tide-monitoring area of Sandu Bay[D]. Fuzhou: Fijian Normal University, 2008. |
| [5] |
林金美. 三沙湾浮游植物的分布[J]. 台湾海峡, 1993, 12(4): 319-323. LIN J M. Distribution of phytoplankton in Sansha Bay, Fujian[J]. Journal of Oceanography in Taiwan Strait, 1993, 12(4): 319-323. |
| [6] |
王兴春. 三沙湾夏季浮游植物(Phytoplankton)分布状况初步研究[J]. 现代渔业信息, 2006, 21(7): 20-22. WANG X C. Primary study on distribution situation of Phytoplankton during summer at the Sansha Bay[J]. Modern Fisheries Information, 2006, 21(7): 20-22. |
| [7] |
BORCARD D, LEGENDRE P, DRAPEAU P. Partialling out the spatial component of ecological variation[J]. Ecology, 1992, 73(3): 1045-1055. DOI:10.2307/1940179 |
| [8] |
NOBES K, UTHICKE S, HENDERSON R. Is light the limiting factor for the distribution of benthic symbiont bearing foraminifera on the Great Barrier Reef?[J]. Journal of Experimental Marine Biology and Ecology, 2008, 363(1/2): 48-57. |
| [9] |
LOPES M R M, DE M BICUDO C E, FERRAGUT M C. Short term spatial and temporal variation of phytoplankton in a shallow tropical oligotrophic reservoir, southeast Brazil[J]. Hydrobiologia, 2005, 542(1): 235-247. DOI:10.1007/s10750-004-8332-z |
| [10] |
MUYLAERT K, SABBE K, VYVERMAN W. Spatial and temporal dynamics of phytoplankton communities in a freshwater tidal estuary(Schelde, Belgium)[J]. Estuarine, Coastal and Shelf Science, 2000, 50(5): 673-687. DOI:10.1006/ecss.2000.0590 |
| [11] |
LEPS J, SMILAUER P. Multivariate analysis of ecological data using CANOCO[M]. Cambridge: Cambridge University Press, 2003.
|
| [12] |
TER BRAAK C J F, PRENTICE I C. A theory of gradient analysis[J]. Advances in Ecological Research, 1988, 18: 271-317. DOI:10.1016/S0065-2504(08)60183-X |
| [13] |
TER BRAAK C J F. Canonical correspondence analysis:a new eigenvector technique for multivariate direct gradient analysis[J]. Ecology, 1986, 67(5): 1167-1179. DOI:10.2307/1938672 |
| [14] |
张峰, 上官铁梁. 山西南方红豆杉(Taxus mairei)森林群落的生态优势度分析[J]. 山西大学学报(自然科学版), 1988(3): 84-89. ZHANG F, SHANGGUAN T L. Analysis on the ecological dominance of the Taxus mairei forest community in Shanxi[J]. Journal of Shanxi University (Natural Science Edition), 1988(3): 82-87. |
| [15] |
孙军, 刘东艳. 多样性指数在海洋浮游植物研究中的应用[J]. 海洋学报, 2004, 26(1): 62-75. SUN J, LIU D Y. The application of diversity indices in marine phytoplankton studies[J]. Acta Oceanologica Sinica, 2004, 26(1): 62-75. |
| [16] |
柳丽华, 左涛, 陈瑞盛, 等. 2004年秋季长江口海域浮游植物的群落结构和多样性[J]. 海洋水产研究, 2007, 28(3): 112-119. LIU L H, ZUO T, CHEN R S, et al. Community structure and diversity of phytoplankton in the estuary of Yangtse River in Autumn[J]. Marine Fisheries Research, 2007, 28(3): 112-119. |
| [17] |
傅明珠, 孙萍, 孙霞, 等. 锦州湾浮游植物群落结构特征及其对环境变化的响应[J]. 生态学报, 2014, 34(13): 3650-3660. FU M Z, SUN P, SUN X, et al. Phytoplankton community structure and its ecological responses to environmental changes in Jinzhou Bay, China[J]. Acta Ecologica Sinica, 2014, 34(13): 3650-3660. |
| [18] |
林更铭, 杨清良. 三沙湾宁德火电厂周边海域初秋浮游植物的种类组成和数量分布[J]. 台湾海峡, 2006, 25(2): 243-249. LIN G M, YANG Q L. Species composition and density distribution of phytoplankton in nearshors waters of Ningde power station in Sansha Bay[J]. Journal of Oceanography in Taiwan Strait, 2006, 25(2): 243-249. |
| [19] |
周然, 彭士涛, 覃雪波, 等. 渤海湾浮游植物与环境因子关系的多元分析[J]. 环境科学, 2013, 34(3): 864-873. ZHOU R, PENG S T, Qin X B, et al. Phytoplankton assemblages and their relation to environmental factors by multivariate statistic analysis in Bohai Bay[J]. Environmental Science, 2013, 34(3): 864-873. |
| [20] |
霍文毅, 俞志明, 邹景忠, 等. 胶州湾中肋骨条藻赤潮与环境因子的关系[J]. 海洋与湖沼, 2001, 32(3): 311-318. HUO W Y, YU Z M, ZOU J Z, et al. Outbreak of Skeletonema costatum red tide and its Relations To environmental factors in Jiaozhou Bay[J]. Oceanologia et Limnologia Sinica, 2001, 32(3): 311-318. |
| [21] |
栾青杉, 孙军, 宋书群, 等. 长江口夏季浮游植物群落与环境因子的典范对应分析[J]. 植物生态学报, 2007, 31(3): 445-450. LUAN Q S, SUN J, SONG S Q, et al. Canonical correspondence analysis of summer phytoplankton community and its environment in the Yangtze River Estuary, China[J]. Journal of Plant Ecology (Chinese Version), 2007, 31(3): 445-450. |
| [22] |
DUPUIS A P, HANN B J. Warm spring and summer water temperatures in small eutrophic lakes of the Canadian prairies:potential implications for phytoplankton and zooplankton[J]. Journal of Plankton Research, 2009, 31(5): 489-502. DOI:10.1093/plankt/fbp001 |
| [23] |
DA SILÜA C A, TRAIN S, RODRIGUES L C. Phytoplankton assemblages in a Brazilian subtropical cascading reservoir system[J]. Hydrobiologia, 2005, 537(1/3): 99-109. |
| [24] |
WASMUND N, TUIMALA J, SUIKKANEN S, et al. Long-term trends in phytoplankton composition in the western and central Baltic Sea[J]. Journal of Marine Systems, 2011, 87(2): 145-159. DOI:10.1016/j.jmarsys.2011.03.010 |
| [25] |
MCQUOID M R. Influence of salinity on seasonal germination of resting stages and composition of microplankton on the Swedish west coast[J]. Marine Ecology Progress Series, 2005, 289: 151-163. DOI:10.3354/meps289151 |
| [26] |
BALZANO S, SARNO D, KOOISTRA W H C F. Effects of salinity on the growth rate and morphology of ten Skeletonema strains[J]. Journal of Plankton Research, 2011, 33(6): 937-945. DOI:10.1093/plankt/fbq150 |
| [27] |
李广玉, 鲁静, 何拥军. 胶州湾浮游植物多样性及其与环境因子的关系[J]. 海洋地质动态, 2005, 21(4): 10-13. LI G Y, LU J, HE Y J. Relation between diversity of phytoplankton and environmental factors in the Jiaozhou Bay[J]. Marine Geology Letters, 2005, 21(4): 10-13. |
| [28] |
冉祥浜, 臧家业, 韦钦胜, 等. 乳山湾邻近海域低氧现象及成因浅析[J]. 海洋科学展, 2012, 30(3): 347-356. RAN X B, ZANG J Y, WEI Q S, et al. Hyposia and its cause of formation in the adjacent waters of Rushan Bay[J]. Advances in Marine Science, 2012, 30(3): 347-356. |
| [29] |
孟繁丽, 何连生, 李一葳, 等. 白洋淀草型与藻型水域溶解氧含量的差异性[J]. 湿地学, 2013, 11(2): 292-296. MENG F L, HE L S, LI Y W, et al. Differences of contents of dissolved oxygen between oligotrophic water area and algal water area in Baiyangdian Lake[J]. Wetland Science, 2013, 11(2): 292-296. |
| [30] |
LÜ H, YANG J, LIU L M, et al. Temperature and nutrients are significant drivers of seasonal shift in phytoplankton community from a drinking water reservoir, subtropical China[J]. Environmental Science and Pollution Research, 2014, 21(9): 5917-5928. DOI:10.1007/s11356-014-2534-3 |
| [31] |
王迪, 陈丕茂, 逯晶晶, 等. 钦州湾浮游植物周年生态特征[J]. 应用生态学报, 2013, 24(6): 1686-1692. WANG D, CHEN P M, LU J J, et al. Annual changes of phytoplankton's ecological features in Qinzhou Bay of South China[J]. Chinese Journal of Applied Ecology, 2013, 24(6): 1686-1692. |
2. East China Sea Environmental Monitoring Center of State Oceanic Administration, Shanghai 201206, China;
3. East China Sea Branch of the State Oceanic Administration, Shanghai 200137, China;
4. Ningde Marine Environmental Monitoring Center of State Oceanic Administration, Ningde 352000, Fujian, China
 2018,
Vol. 27
2018,
Vol. 27


