2. 河南师范大学 水产学院, 河南省水产动物养殖工程技术研究中心, 河南 新乡 453007;
3. 水产高效健康生产湖南省协同创新中心, 湖南 常德 415000
胚胎干细胞(Embryonic stem cells, ESCs)从囊胚的内细胞团分离而来[1],具有自我更新和多向分化潜能,可用于胚胎早期发育机制、药物筛选、再生医学、细胞毒理以及转基因动物生产等多方面的研究,应用前景广阔[2]。在此过程中,一些转录因子如Oct4,Sox2和Nanog等对于维持ESCs的自我更新和多能性起着非常重要的作用。其中Oct4在维持ESCs自我更新和分化为特定细胞系过程中处于中心地位[3],是一种细胞全能性标志基因[4],可以促进斑马鱼(Danio rerio)神经系统[5]、脑部[6]、外胚层[7]等的发育和背腹轴[8]的建立,还是形成诱导多潜能干细胞唯一不可缺少的转录因子[9]。因此,Oct4在干细胞多能性维持、胚胎早期发育及体细胞重编程过程中均具有非常重要的作用。
关于Oct4的研究多集中在哺乳动物[10-14],在鱼类中的研究相对较少[15-18],鱼类Oct4的相关功能尚有待深入探讨,而制备特异性强的Oct4抗体对于进一步研究其生物学功能十分必要。目前关于Oct4抗体的报道主要在人(Homo sapiens)[19]、小鼠(Mus musculus)[20]和模式鱼类青鳉(Oryzias latipes)[17]与斑马鱼[21],其中多使用短肽作为抗原制备抗体。由于鱼类与哺乳动物的Oct4蛋白相似性较低,仅为31%~34%,而青鳉与斑马鱼的Oct4蛋白相似性也只有63%[22],现有Oct4抗体往往具有针对其物种抗原的特异性而无法满足不同鱼类的研究需要。HUANG等[18]在罗非鱼(Oreochromis niloticus)和高金宁[23]在牙鲆(Paralichthys olivaceus)中通过自制特异性抗体进一步研究了鱼类Oct4基因的功能,但在淡水鱼类中以原核表达诱导蛋白进行Oct4抗体的研究尚未见报道。
团头鲂(Megalobrama amblycephala)是我国大宗淡水鱼类之一,具有重要的经济价值和科学研究意义,获得团头鲂Oct4蛋白的特异性抗体可为研究鱼类Oct4基因功能提供有力工具。目前已经克隆了团头鲂Oct4基因(Ma-Oct4, NCBI序列号KY994571),本文进一步表达了Ma-Oct4蛋白并制备了特异性的抗体,为进一步研究鱼类Oct4的功能奠定了基础。
1 材料与方法 1.1 实验材料菌种、载体与细胞系:感受态大肠杆菌(Escherichia coli)TOP10和BL21(DE3)pLysS购自北京全式金生物技术有限公司;载体pET32a、pCVpr及人肝癌细胞系HepG2均由本实验室保存。
主要试剂包括胶回收试剂盒和质粒提取试剂盒(Omega,美国);限制性内切酶(NEB,美国);T4 DNA连接酶(TaKaRa,日本);蛋白制备及Western blot试剂包括SDS-PAGE Gel Kit、蛋白提取试剂盒、BCA蛋白定量试剂盒、蛋白印迹膜再生液(康为世纪,北京);抗体包括His一抗、羊抗兔及羊抗鼠二抗(Vazyme,南京),Actin一抗(博奥森,北京),RFP一抗(Abbkine,美国),羊抗鼠荧光二抗(LI-COR Biosciences,美国);细胞培养及转染试剂包括DMEM培养基及胎牛血清(Gibco,美国),LipofectamineTM 2000(Invitrogen,美国);引物由武汉擎科生物技术有限公司合成,其他试剂均为国产分析纯。
1.2 方法 1.2.1 原核表达载体的构建与鉴定使用PCR方法从本实验室克隆的Ma-Oct4 CDS序列获得编码C端235个氨基酸的目的片段C-Ma-Oct4。所用引物为C-Ma-Oct4-F:5′-AAAGATATCTCCTCAAGTGGAGGCTGC-3′,C-Ma-Oct4-R:5′-TTTAAGCTTGCTGGTGAGGTGACCCAC-3′,包含酶切位点EcoRⅤ和HindⅢ。反应条件为94 ℃预变性3 min,94 ℃ 20 s,57 ℃ 30 s,72 ℃ 70 s,25个循环,72 ℃延伸5 min。将PCR产物与pET32a分别用EcoRⅤ和HindⅢ酶切后构建重组表达载体pET32a-MaOct4。质粒经测序正确后转化表达菌株BL21(DE3)pLysS。
1.2.2 重组蛋白的诱导表达与表达条件优化挑取含有pET32a-MaOct4质粒的单克隆接种于LB(Ampr, 100 μg/mL)液体培养基中,按常规方法诱导3 h,取1 mL菌液离心处理后进行SDS-PAGE电泳分析和染色后拍照;蛋白样通过Western blot检测His-Oct4标签的融合蛋白。表达条件优化如下。(1)诱导前接菌浓度和菌液培养时间:将过夜培养菌液分别按以下不同浓度和培养时间组合0.5‰+1 h、1%+1 h、0.5‰+2 h、1%+2 h,在37 ℃、0.5 mmol/L IPTG诱导3 h后取样;(2)诱导时间:根据优化后的(1)中条件,分别诱导2、4、6、8 h后取样。
1.2.3 Oct4抗体的制备取诱导后菌液100 mL,经离心和PBS重悬沉淀后置冰浴中超声波破碎菌体,分别取全菌、上清和沉淀进行SDS-PAGE电泳以鉴定蛋白表达形式。鉴定结果显示Ma-Oct4蛋白主要以包涵体形式表达。往包涵体中加入8 mol/L尿素悬浮沉淀,冰浴2 h后在4 ℃以10 000 r/min离心15 min,收集上清;利用高亲和性Ni树脂纯化,收集流穿液、洗脱液,经SDS-PAGE鉴定蛋白纯化效果;纯化后蛋白再通过梯度透析除去咪唑,SDS-PAGE鉴定蛋白复性效果。用复性后的纯化蛋白免疫新西兰兔产生抗体,抗体的制备与效价检测方法参照文献[24],其中效价判定标准为OD阳/OD阴>2.5。实验中的蛋白纯化和免疫等工作由上海佑隆生物科技有限公司完成。
1.2.4 Oct4抗体的特异性检测与应用制备不同来源的Ma-Oct4蛋白,采用Western blot方法检测多克隆抗体的反应性。将Ma-Oct4纯化重组蛋白逐级稀释后按上样量450、45、4.5、0.45、0 ng作为抗原进行进行检测;诱导表达pET32a-MaOct4菌液中的蛋白提取液来检测抗体;提取团头鲂1细胞期和32细胞期的胚胎蛋白溶液来测试抗体;用pCMV-MaOct4-Red和对照pCMV-Puro-DsRed质粒转染HepG2细胞并制备细胞蛋白提取液来检测抗体与Ma-Oct4:DsRed融合蛋白的反应,具体实验步骤参考文献[24]。
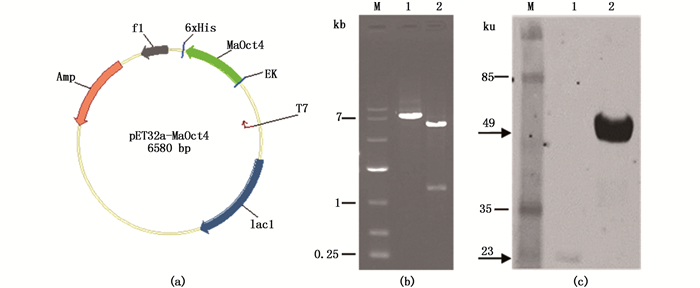
2 结果 2.1 原核表达载体的构建将PCR扩增得到的Ma-Oct4 C端723 bp目的序列插入到pET32a构建原核表达载体pET32a-MaOct4(图 1a),经酶切后分别得到大小为6 580 bp和5 344+1 236 bp的预期片段(图 1b),载体经测序确认读码框无突变及移码。
|
图 1 pET32a-MaOct4原核表达载体构建及融合蛋白的表达与鉴定
Fig. 1 Construction of pET32a-MaOct4 prokaryotic expression vector and the expression and detection of the fusion protein
(a) pET32a-MaOct4质粒图谱;(b) pET32a-MaOct4质粒酶切鉴定,1.XbaⅠ;2.XbaⅠ+ HindⅢ;(c) Western blot检测融合蛋白His标签的表达,1.pET32a空载体对照;2.pET32a-MaOct4;M.DL10000 DNA marker或预染蛋白marker,箭头示目的条带 (a) map of pET32a-MaOct4 vector; (b) validation of pET32a-MaOct4 vector, 1. XbaⅠ; 2. XbaⅠ+ HindⅢ; (c) detection of His tag expression by Western blot, 1. pET32a; 2. pET32a-MaOct4; M. DL10000 DNA marker or prestained protein marker, the arrow indicates the interested bands |
pET32a载体上的标签蛋白分子量约为23 ku[25],Oct4目的蛋白为235个氨基酸,因此预期重组蛋白的分子量约49 ku。转入pET32a-MaOct4载体的表达菌在IPTG诱导后经SDS-PAGE电泳分析,结果显示有约49 ku的预期条带;用His抗体进行Western blot,能检测到约23 ku的空载体及49 ku的特异性目的条带(图 1c),说明Oct4融合蛋白在BL21(DE3)pLysS中正确表达。
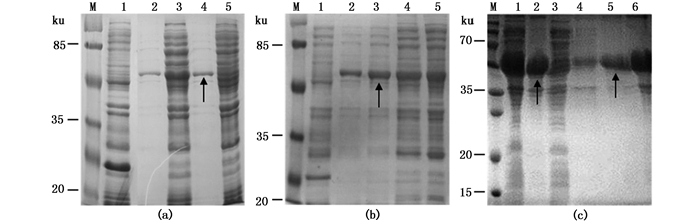
2.3 Oct4重组蛋白诱导条件优化和重组蛋白的纯化根据前期预实验结果,IPTG浓度选用0.5 mmol/L诱导外源蛋白表达合适。不同接菌浓度和培养时间优化结果表明,pET32a-MaOct4在接菌浓度0.5‰条件下培养2 h后进行诱导得到的蛋白量最大并且目的蛋白相对含量最高(图 2a)。IPTG诱导时间优化结果显示,在诱导2、4、6、8 h后各融合蛋白均有表达,其中诱导4 h目的蛋白表达量最大且占总蛋白比例最大(图 2b),而且重组蛋白主要存在于包涵体中(图 2c)。经Ni2+亲和层析纯化和80 mmol/L咪唑洗脱能得到较高纯度的重组蛋白(图 2c)。实验获得纯度达85%的目的蛋白5 mg用于后续抗体的制备。
|
图 2 pET32a-MaOct4融合蛋白诱导条件优化及其表达形式鉴定与纯化
Fig. 2 Optimization of expression conditions and the type and purification of pET32a-MaOct4 fusion protein
(a)诱导前接菌浓度和摇菌时间对pET32a-MaOct4蛋白表达的影响,1.空载体对照;2.0.5 ‰,1 h;3.1%,1 h;4.0.5 ‰,2 h;5.1%,2 h;(b) IPTG诱导时间对pET32a-MaOct4蛋白表达的影响,1.空载体对照;2~5.诱导时间2、4、6、8 h;(c) pET32a-MaOct4融合蛋白的表达形式与纯化,1.全菌;2.沉淀;3.上清;4~6. 40、80、150 mmol/L咪唑洗脱液;M.预染蛋白marker,箭头表示目的条带 (a) fusion protein expression under different E.coli BL21 inoculation concentration and waving time before IPTG induction, 1. pET32a as control, 1%, 1 h; 2. 0.5 ‰, 1 h; 3. 1%, 1 h; 4. 0.5 ‰, 2 h; 5. 1%, 2 h; (b) pET32a-MaOct4 protein expression in BL21 under different induction time, 1. pET32a as control; 2~5. expression of protein induced in 2, 4, 6, 8 h; (c) the type and purification of pET32a-MaOct4 fusion protein, 1. total protein; 2. precipitate; 3. supernatant; 4-6. elution buffer with 40, 80, 150 mmol/L imidazole; M. prestained protein marker, the arrow indicates the interested bands |
所得兔抗团头鲂Oct4多克隆抗体经ELISA检测效价为1:81 000(表 1),可以进行抗原的特异性识别。

|
表 1 ELISA检测Oct4抗体效价 Tab.1 ELISA analysis of Oct4 antibody |
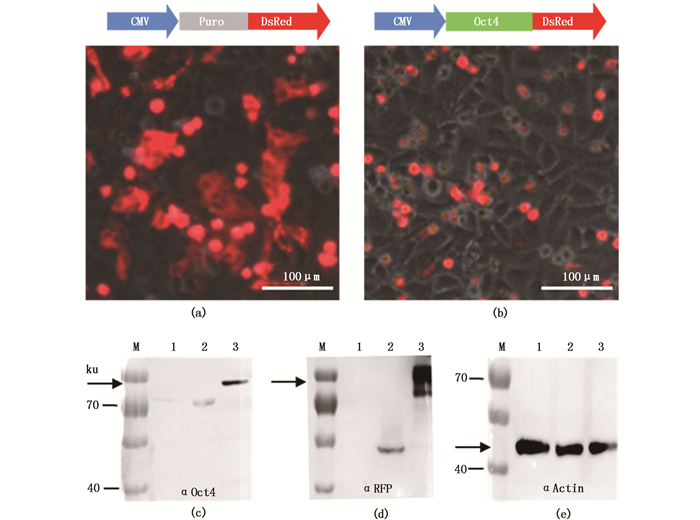
实验进一步采用Western blot方法检测抗体特异性。首先,所制备多克隆抗体可有效识别Oct4纯化重组蛋白,在49 ku处有预期条带且条带随蛋白浓度降低而逐渐减弱,最低检出量约为4.5 ng(图 3a)。其次,该多抗能有效识别pET32a-MaOct4菌体裂解液中的目的蛋白,在约49 ku处检测到预期大小的特异条带(图 3b)。再次,该抗体能有效识别团头鲂早期胚胎中的内源Oct4蛋白(分子量预计为52 ku),Western blot结果显示的条带与该内源蛋白大小一致(图 3c,3d),而使用免疫前阴性血清作为抗体检测不到预期条带(图 3e)。最后将pCVpr和pCMV-MaOct4-Red质粒分别转染HepG2(图 4a,4b)。细胞蛋白用Oct4多克隆抗体的杂交结果显示,转染pCMV-MaOct4-Red的蛋白有预期为78 ku的目的条带,而转染pCVpr及未转染质粒的蛋白提取液中仅有偏小而微弱的非特异性条带(图 4c);用RFP抗体检测相同的蛋白提取液,转染pCMV-MaOct4-Red组出现与Oct4多抗检测时大小一致的78 ku条带;转染pCVpr组有pr (puro-rfp)融合表达的48 ku蛋白条带,而未转染组无条带(图 4d);Actin作内参均能检测出目的条带(图 4e)。因此,以上结果均证明制备的兔抗团头鲂Oct4多克隆抗体能够有效识别以上几种形式的Oct4蛋白,可以用于后续实验。

|
图 3 多克隆抗体特异性检测
Fig. 3 Specificity detection of the polyclonal antibody
(a)纯化Oct4重组蛋白检测,1~5.纯化蛋白上样量分别为450、45、4.5、0.45、0 ng;6.H2O作阴性对照;(b)原核诱导表达菌体蛋白检测,1.Ma-Oct4多克隆抗体识别pET32a-MaOct4原核表达菌体蛋白;(c)团头鲂胚胎内源Oct4蛋白检测,1.1-cell;2.32-cell;(d) Actin抗体作内参;(e)免疫前血清作阴性对照;M.预染蛋白marker,箭头表示目的条带 (a) the purified fusion Oct4 protein, 1-5. the loading amount was 450, 45, 4.5, 0.45, 0 ng, respectively; 6. H2O; (b) the prokaryotic expression of protein, 1. detection of pET32a-MaOct4 protein expressed in BL21 with the Ma-Oct4 antibody; (c) the endogenous Oct4 protein, 1. 1-cell; 2. 32-cell; (d) the Actin antibody as the internal control; (e) the pre-immune serum as the negative control; M. prestained protein marker, the arrow indicates the interested bands |
|
图 4 多克隆抗体应用于转染细胞蛋白检测
Fig. 4 Detection of protein from transfected cells using the polyclonal antibody
(a) pCVpr质粒转染HepG2细胞后表达红色荧光图像;(b) pCMV-MaOct4-Red质粒转染HepG2细胞后表达红色荧光图像,标尺=100 μm;(c) Oct4多克隆抗体检测; 1.未转染阴性对照;2.pCVpr;3. pCMV-MaOct4-Red;(d) RFP抗体检测;(e) Actin抗体作内参;M.预染蛋白marker,箭头表示目的条带 (a) the merge image of HepG2 after transfected with pCVpr; (b) the merge image of HepG2 after transfected with pCMV-MaOct4-Red, scale bars=100 μm; (c) HepG2 protein detection using the Ma-Oct4 polyclonal antibody; 1. Negative control; 2. pCVpr; 3. pCMV-MaOct4-Red; (d) RFP antibody detection; (e) Actin antibody as the internal control; M. prestained protein marker, the arrow indicates the interested bands |
Oct4是迄今发现最早也是最重要的维持胚胎干细胞多潜能性和自我更新的关键基因之一[12],在人和鼠的研究较为深入[3-4],但是在低等脊椎动物中的作用有明显的分歧[6, 16-17]。鉴于不同物种的Oct4序列保守性偏低[14, 18],本研究通过克隆团头鲂的Oct4基因,表达了原核蛋白并制备了特异性抗体。
团头鲂Oct4蛋白全长472个氨基酸残基,包括保守的POU结构域,选用了包含该结构域的片段(233 aa)作抗原。ARAKAWA等[20]报道的小鼠Oct4单克隆抗体制备选用的肽段靠近C端,HUANG等[18]则选用位于2个POU亚结构域之间的肽段ENSENPQDMYKIERVF制备了尼罗罗非鱼Oct4抗体,但有报道人工合成多肽作为免疫物质在动物体内易降解和自身免疫原性差[26]。高金宁[23]将Po-Oct4基因编码区片段连入pET32a载体,得到了包涵体形式的Oct4重组蛋白,并制备了可用于后续免疫组化分析的兔抗牙鲆Oct4(Po-Oct4)多克隆抗体。本研究用团头鲂Oct4包含POU结构域的片段构建了原核表达载体,诱导的Ma-Oct4重组蛋白主要存在于包涵体中,制备的兔抗团头鲂Oct4多克隆抗体可识别不同来源的Ma-Oct4蛋白。这些抗体均为进一步分析鱼类Oct4基因的功能奠定了基础。不同的是,Po-Oct4蛋白的最佳诱导条件为:Transetta(DE3)菌株,25 ℃,1 mmol/L IPTG诱导8 h或更长时间,而Ma-Oct4蛋白的最佳诱导条件为:BL21(DE3)pLysS菌株,37 ℃,0.5 mmol/L IPTG诱导4 h。造成这种蛋白诱导条件差异的原因较多,影响外源基因在大肠杆菌中表达的因素主要有载体类型、目的基因的量、宿主菌特征、营养状况和培养条件等[27];使用相同的原核表达体系也需要摸索不同的蛋白诱导条件,而优化的诱导条件能显著提高外源蛋白的表达[28-29]。
实验结果表明制备的团头鲂Oct4抗体能够有效识别纯化的Ma-Oct4蛋白、原核表达的Ma-Oct4蛋白、团头鲂胚胎内源表达的Ma-Oct4蛋白以及HepG2细胞中融合表达的Ma-Oct4蛋白。用团头鲂早期胚胎的蛋白提取液进行实验时能检测到约52 ku理论大小的条带,与用RT-PCR证明的团头鲂Oct4转录本在早期胚胎中表达的结果一致,这也说明了Oct4的RNA和蛋白都存在于早期胚胎中;在目的条带上方还出现了非特异性条带,可能是抗体识别Oct4异构体或假基因所致[30-31],或者是提取液中含有免疫原区段类似的其他蛋白。本研究中通过建立融合表达Ma-Oct4: DsRed的细胞系来验证抗体的特异性,证实用Oct4抗体检测到的目的条带与RFP抗体识别的条带位置一致,这说明制备的抗体能特异地识别Oct4融合蛋白。
综上所述,本研究成功构建了团头鲂Oct4基因原核表达载体,优化了蛋白原核表达条件,获得了纯化的原核表达重组蛋白,制备了蛋白的多克隆抗体,并应用该抗体对不同来源Oct4蛋白进行了有效识别,这些工作为进一步研究团头鲂转录因子Oct4的功能奠定了基础。
| [1] | EVANS M J, KAUFMAN M H. Establishment in culture of pluripotential cells from mouse embryos[J]. Nature, 1981, 292(5819): 154–156. DOI:10.1038/292154a0 |
| [2] | NIKOLSKII N N, GABAI I A, SOMOVA N V. Human embryonic stem cells:Problems and perspectives[J]. Cell and Tissue Biology, 2007, 1(5): 375–383. DOI:10.1134/S1990519X0705001X |
| [3] | PARDO M, LANG B, YU L, et al. An expanded Oct4 interaction network:implications for stem cell biology, development, and disease[J]. Cell Stem Cell, 2010, 6(4): 382–395. DOI:10.1016/j.stem.2010.03.004 |
| [4] | PESCE M, SCHÖLER H R. Oct-4:Gatekeeper in the beginnings of mammalian development[J]. Stem Cells, 2001, 19(4): 271–278. DOI:10.1634/stemcells.19-4-271 |
| [5] | REIM G, BRAND M. Spiel-ohne-grenzen/pou2mediates regional competence to respond to Fgf8 during zebrafish early neural development[J]. Development, 2002, 129(4): 917–933. |
| [6] | PARVIN M S, OKUYAMA N, INOUE F, et al. Autoregulatory loop and retinoic acid repression regulate pou2/pou5f1gene expression in the zebrafish embryonic brain[J]. Developmental Dynamics, 2008, 237(5): 1373–1388. DOI:10.1002/(ISSN)1097-0177 |
| [7] | KOTKAMP K, MÖSSNER R, ALLEN A, et al. A Pou5f1/Oct4 dependent Klf2a, Klf2b, and Klf17 regulatory sub-network contributes to EVL and ectoderm development during zebrafish embryogenesis[J]. Developmental Biology, 2014, 385(2): 433–447. DOI:10.1016/j.ydbio.2013.10.025 |
| [8] | BELTING H G, WENDIK B, LUNDE K, et al. Pou5f1 contributes to dorsoventral patterning by positive regulation of vox and modulation of fgf8a expression[J]. Developmental Biology, 2011, 356(2): 323–336. DOI:10.1016/j.ydbio.2011.05.660 |
| [9] | KIM J B, ZAEHRES H, WU G M, et al. Pluripotent stem cells induced from adult neural stem cells by reprogramming with two factors[J]. Nature, 2008, 454(7204): 646–650. DOI:10.1038/nature07061 |
| [10] | SCHÖLER H R, HATZOPOULOS A K, BALLING R, et al. A family of octamer-specific proteins present during mouse embryogenesis:evidence for germline-specific expression of an Oct factor[J]. The EMBO Journal, 1989, 8(9): 2543–2550. |
| [11] | OKAMOTO K, OKAZAWA H, OKUDA A, et al. A novel octamer binding transcription factor is differentially expressed in mouse embryonic cells[J]. Cell, 1990, 60(3): 461–472. DOI:10.1016/0092-8674(90)90597-8 |
| [12] | TAKEDA J, SEINO S, BELL G I. Human Oct3 gene family:cDNA sequences, alternative splicing, gene organization, chromosomal location, and expression at low levels in adult tissues[J]. Nucleic Acids Research, 1992, 20(17): 4613–4620. DOI:10.1093/nar/20.17.4613 |
| [13] | MITALIPOV S M, KUO H C, HENNEBOLD J D, et al. Oct-4 expression in pluripotent cells of the rhesus monkey[J]. Biology of Reproduction, 2003, 69(6): 1785–1792. DOI:10.1095/biolreprod.103.019455 |
| [14] | NORDHOFF V, HVBNER K, BAUER A, et al. Com-parative analysis of human, bovine, and murine Oct-4 upstream promoter sequences[J]. Mammalian Genome, 2001, 12(4): 309–317. DOI:10.1007/s003350010279 |
| [15] | TAKEDA H, MATSUZAKI T, OKI T, et al. A novel POU domain gene, zebrafish pou2:expression and roles of two alternatively spliced twin products in early development[J]. Genes & Development, 1994, 8(1): 45–59. |
| [16] | YE H, DU H, CHEN X H, et al. Identification of a pou2ortholog in Chinese sturgeon, Acipenser sinensis and its expression patterns in tissues, immature individuals and during embryogenesis[J]. Fish Physiology and Biochemistry, 2012, 38(4): 929–942. DOI:10.1007/s10695-011-9579-8 |
| [17] | LIU R, LI M Y, LI Z D, et al. Medaka Oct4 is essential for pluripotency in blastula formation and ES cell derivation[J]. Stem Cell Reviews and Reports, 2015, 11(1): 11–23. DOI:10.1007/s12015-014-9523-2 |
| [18] | HUANG X H, ZHAO Y, LIU L Y, et al. Characterization of the POU5F1 homologue in Nile tilapia:from expression pattern to biological activity[J]. Stem Cells and Development, 2016, 25(18): 1386–1395. DOI:10.1089/scd.2016.0143 |
| [19] |
刘善荣. 人胚胎生殖系细胞的分离与体外培养[D]. 上海: 第二军医大学, 2003.
LIU S R. Isolation and in vitro cultivation of human embryonic germ cell[D]. Shanghai: The Second Military Medical University, 2003. |
| [20] | ARAKAWA T, YOSHIMI T, AZUMA M, et al. Production of a monoclonal antibody specific for Pou5f1/Oct4[J]. Monoclonal Antibodies in Immunodiagnosis and Immunotherapy, 2013, 32(3): 229–231. DOI:10.1089/mab.2013.0004 |
| [21] | LIPPOK B, SONG S, DRIEVER W. Pou5f1 protein expression and posttranslational modification during early zebrafish development[J]. Developmental Dynamics, 2014, 243(3): 468–477. DOI:10.1002/dvdy.24079 |
| [22] | SÁNCHEZ-SÁNCHEZ A V, CAMP E, GARCÍA-ESPAИA A, et al. Medaka Oct4 is expressed during early embryo development, and in primordial germ cells and adult gonads[J]. Developmental Dynamics, 2010, 239(2): 672–679. DOI:10.1002/dvdy.22198 |
| [23] |
高金宁. 牙鲆(Paralichthys olivaceus)干细胞多能性相关转录因子Oct4、Nanog和Sox2的克隆与分析[D]. 青岛: 中国海洋大学, 2014.
GAO J N. Isolation and characterization of the transcriptional factors in maintaining pluripotency of stem cells in Japanese flounder Paralichthys olivaceus[D]. Qingdao: Ocean University of China, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D548382 |
| [24] |
李玲玉, 方健, 于淼, 等. 青鳉prdm14的原核表达、多克隆抗体制备及其应用[J].
水生生物学报, 2017, 41(4): 748–754.
DOI:10.7541/2017.93 LI L Y, FANG J, YU M, et al. Prokaryotic expression, preparation and application of anti-prdm14 polyclonal antibody of medaka (Oryzias latipes) prdm14[J]. Acta Hydrobiologica Sinica, 2017, 41(4): 748–754. DOI:10.7541/2017.93 |
| [25] |
朱芳, 邓思, 罗立新. 分选酶A在pET32a(+)原核表达载体中的表达和鉴定[J].
生物技术通报, 2011: 218–222.
ZHU F, DENG S, LUO L X. Expression and identification of sortase A in pET32a(+) expression vector[J]. Biotechnology Bulletin, 2011: 218–222. |
| [26] |
杨洁, 黄迎春, 刘军锋, 等. 一种适用于短肽制备抗体的亲和纯化方法[J].
中华预防医学杂志, 2007, 41(6): 499–501.
YANG J, HUANG Y C, LIU J F, et al. An affinity purification method suitable for preparing short peptide antibody[J]. Chinese Journal of Preventive Medicine, 2007, 41(6): 499–501. |
| [27] |
高慧, 孙建义, 刘明启. 影响大肠杆菌中外源基因表达的因素[J].
上海畜牧兽医通讯, 2006: 64–65.
GAO H, SUN J Y, LIU M Q. Factors affecting the expression of exogenous genes in Escherichia coli[J]. Shanghai Journal of Animal Husbandry and Veterinary Medicine, 2006: 64–65. |
| [28] |
吴任, 谢数涛, 孙勇, 等. 凡纳滨对虾热休克蛋白70的原核高效表达[J].
中国水产科学, 2006, 13(2): 305–309.
WU R, XIE S T, SUN Y, et al. High level prokaryotic expression of heat shock protein 70 in Litopenaeus vannamei[J]. Journal of Fishery Sciences of China, 2006, 13(2): 305–309. |
| [29] |
毛明光, 温施慧, 姜志强, 等. 太平洋鳕神经坏死病毒衣壳蛋白(CP)的原核表达及条件优化[J].
大连海洋大学学报, 2016, 31(2): 117–123.
MAO M G, WEN S H, JIANG Z Q, et al. Prokaryotic expression and condition optimization of nervous necrosis virus capsid protein(CP) in Pacific cod Gadus macrocephalus[J]. Journal of Dalian Ocean University, 2016, 31(2): 117–123. |
| [30] | PAPAMICHOS S I, KOTOULA V, TARLATZIS B C, et al. OCT4B1isoform:the novel OCT4 alternative spliced variant as a putative marker of stemness[J]. Molecular Human Reproduction, 2009, 15(5): 269–270. DOI:10.1093/molehr/gap018 |
| [31] | WANG X, DAI J W. Concise review:isoforms of OCT4 contribute to the confusing diversity in stem cell biology[J]. Stem Cells, 2010, 28(5): 885–893. |
2. College of Fishery, Engineering Technology Research Center of Henan Province for Aquatic Animal Cultivation, Henan Normal University, Xinxiang 453007, China;
3. Collaborative Innovation Center for Efficient and Health Production of Fisheries in Hunan Province, Changde 415000, China
 2018,
Vol. 27
2018,
Vol. 27


