2. 浙江省淡水水产研究 浙江省鱼类健康与营养重点实验室, 浙江 湖州 313001
缬氨酸作为鱼类的10种必需氨基酸之一[1],对鱼类的生长性能和蛋白利用有重要的影响,其在鱼体内除直接为蛋白质合成提供原料外,还具有维持球状蛋白的三维结构和参与包裹在神经外的髓磷脂的合成等功能,为维持神经系统正常机能所必需。目前,国内外鱼类缬氨酸营养需求的研究已有不少报道,近年来确定了印度鲮(Cirrhinus mrigala)[2]、印度野鲮(Labeo rohita)[3]、异育银鲫(Carassius auratus gibelio)[4]、真鲷(Pagrus major)[5]、建鲤(Cyprinus carpio var. Jian)[6]、牙鲆(Paralichthy olivaceus)[7]、团头鲂(Megalobrama amblycephala Yih)[8]等多种养殖鱼类的缬氨酸需求量。
草鱼(Ctenopharyngodon idella Valenciennes)是我国养殖量最大的淡水鱼,早期对其营养需求的研究主要集中在蛋白质、脂肪和碳水化合物等方面[9-12],其研究成果对草鱼配合饲料的开发和应用起到了极大的推进作用。近些年对其必需氨基酸需求的研究已有报道,但并不完善,目前仅见对精氨酸[13]、赖氨酸[14]、苏氨酸[15]、异亮氨酸[16]和苯丙氨酸[17]等需求量的报道。本实验是通过调节饲料中缬氨酸水平探讨缬氨酸对草鱼鱼种生长和饲料利用等指标的影响,从而得出其最佳的缬氨酸需求量,为完善草鱼氨基酸平衡的高效配合饲料提供科学依据。
1 材料与方法 1.1 实验鱼实验鱼为本所实验基地同塘培育的当年夏花鱼种。选取体质健硕、规格相仿的1 050尾实验鱼,放入已经编号的玻璃缸中,随机分成7组,每组3个重复,每个重复放50尾鱼。用实验基础饲料驯养一周,使其适应养殖系统和实验饲料后,进行正式实验。每组实验鱼的初始体质量无差异, 均为1.35 g。
1.2 实验饲料实验饲料以鱼粉和晶体氨基酸混合物为蛋白源,氨基酸模式参照测定的实验草鱼全鱼40%粗蛋白中氨基酸含量(缬氨酸除外),饲料缬氨酸水平以晶体缬氨酸调节,用天冬氨酸和谷氨酸(1:1)调整百分比。实验饲料缬氨酸实测值为6.3、7.2、8.9、11.0、12.6、14.1、15.8 g/(kg干饲料),实验饲料设计配方的原料组成见表 1。实验饲料制作时,先将原料粉碎,并过60目筛,再按比例混合并搅拌均匀后,用绞肉机挤压成型,制成直径1 mm左右的硬颗粒。于烘箱50 ℃烘干,冷却后放入塑料袋,保存于4 ℃冰箱中。

|
表 1 实验饲料组成及营养水平(干物质基础) Tab.1 Composition and nutrient levels of the experimental diet (DM basis) |
实验于2014年8月15号至10月28号在本单位实验基地进行。养殖系统为室内玻璃缸循环水养殖系统,缸内配有生物过滤装置和气石,每缸养殖水体0.8 m×0.5 m×0.4 m,实验用水为经过充分曝气的自来水,日换水量为总水体的一倍,连续充气。采用饱食投喂,投饲时间为上午8:00、中午12:00和下午4:00。实验期间,水温为自然水温:25~30 ℃;水质:pH为7.4~8.0;溶氧大于5.0 mg/L;氨氮0.14~0.20 mg/L;亚硝酸盐0.02~0.05 mg/L。实验期间每天记录投饲量。
1.4 取样及分析实验开始时随机取鱼30尾作为初始鱼样。实验结束时,将实验鱼停饲24 h后称终末体质量。每缸随机取鱼10尾为一混合样,用于测定鱼体成分及氨基酸组成;另取5尾鱼称量全长和体质量,于冰盘上解剖取内脏和肝脏称重,用于计算肥满度、脏体指数和肝体指数,肝脏分装于2个冷冻管,先放入液氮罐中速冻,再保存到-20 ℃冰箱中用于测定肝脏谷丙转氨酶(ALT)和谷草转氨酶(AST)活性。
水分、粗蛋白、粗脂肪和粗灰分的测定参照AOAC的方法[18]:水分测定采用105 ℃烘干恒重法;粗蛋白测定采用凯氏定氮法;粗脂肪测定采用以乙醚为抽提液的索氏抽提法;粗灰分采用马福炉550 ℃焚烧法测定;样品氨基酸组成测定采用酸水解法,通过6 mol/L的浓盐酸110 ℃真空水解24 h的预处理后,用氨基酸分析仪测定;肝脏ALT、AST活性的测定按照南京建成生物工程研究所提供的测试盒说明书采用赖氏法进行测定。
1.5 计算公式实验鱼的增重率(Weight gain rate, WGR)、饲料效率(Feed efficiency, FE)、成活率(Survival rate, SR)、蛋白质累积率(Protein retention efficiency, PRE)、脏体比(Viscera index, VSI)、肝体比(Hepatosomatic index, HSI)和肥满度(Condition factor, CF)计算公式如下:
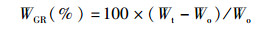 (1)
(1)
式中:WGR为增重率;Wt为草鱼终末体质量(g);Wo为草鱼初始体质量(g)。
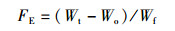 (2)
(2)
式中:FE为饲料效率;Wt为草鱼终末体质量(g);Wo为草鱼初始体质量(g);Wf为摄食饲料干质量(g)。
 (3)
(3)
式中:SR为成活率;Nt为每缸鱼剩余条数;No为每缸鱼最初条数。
 (4)
(4)
式中:PRE为蛋白质累积率;Pr为鱼体蛋白质累积量(g);Pf为蛋白质摄取量(g)。
 (5)
(5)
式中:VSI为脏体比;Wv为内脏质量(g);Wb为鱼体质量(g)。
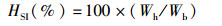 (6)
(6)
式中:HSI为肝体比;Wh为肝脏质量(g);Wb为鱼体质量(g)。
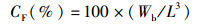 (7)
(7)
式中:CF为肥满度;Wb为鱼体质量(g);L为体长(cm)。
1.6 数据处理及统计分析实验数据以平均数加总标准误表示,用SPSS16.0 for Windows分析软件(One-way ANOVA)对所得实验数据进行单因素方差分析,若差异显著再做SNK多重比较。显著水平P采用0.05,P < 0.05为差异显著。采用抛物线回归分析模型分别拟合鱼体增重率、蛋白质累积率和饲料效率与饲料缬氨酸水平之间的关系,求得草鱼鱼种对缬氨酸的最佳需求量。
2 结果 2.1 草鱼鱼种生长情况由表 2可知,饲料缬氨酸水平对草鱼鱼种终末体质量、增重率、饲料效率和蛋白质累积率均有显著影响(P < 0.05)。草鱼鱼种终末体质量、增重率、蛋白质累积率随饲料缬氨酸水平的升高而显著增加,当饲料缬氨酸水平达12.6 g/(kg干饲料)时达最大值,继续增加饲料缬氨酸水平,草鱼鱼种终末体质量、增重率、蛋白质累积率显著下降。草鱼鱼种饲料效率随饲料缬氨酸水平的提高显著升高,在饲料缬氨酸水平为12.6和14.1 g/(kg干饲料)时达最大值(P < 0.05),继续增加饲料缬氨酸水平,饲料效率无显著变化。

|
表 2 饲料缬氨酸水平对鱼体生长及体形指标的影响 Tab.2 Effects of dietary valine level on growth performance of grass carp |
从表 3可知,饲料缬氨酸水平对草鱼鱼种鱼体必需氨基酸、支链氨基酸和总氨基酸无显著影响(P>0.05)。
|
表 3 饲料缬氨酸水平对鱼体必需氨基酸、支链氨基酸和总氨基酸含量的影响 Tab.3 Essential amino acids, branched-chain amino acids and total amino acids content of grass carp |
采用抛物线模型拟合草鱼鱼种的增重率数据和饲料缬氨酸水平之间的关系,得二次多项式:

式中:Y表示草鱼鱼种增重率;X表示饲料中的缬氨酸水平。图 1所示曲线最高处对应的缬氨酸水平为13.68 g/(kg干饲料),约占饲料蛋白的4.02%。

|
图 1 饲料中缬氨酸水平对草鱼鱼种增重率的影响
Fig. 1 ffect of dietary valine on WGR of juvenile grass carp
|
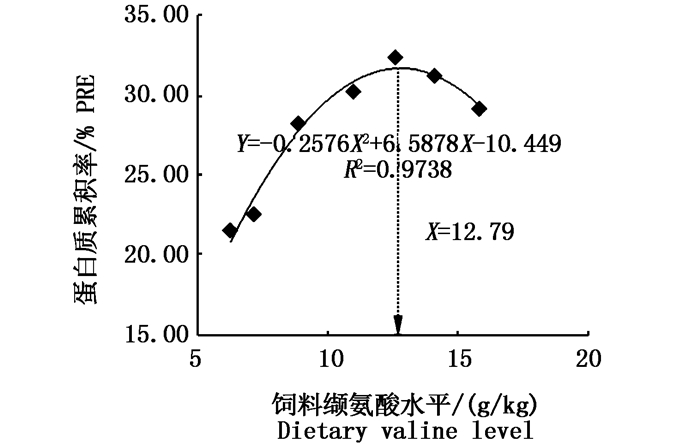
采用抛物线模型拟合草鱼鱼种的蛋白质累积率和饲料缬氨酸水平之间的关系,得二次多项式:

式中:Y表示草鱼鱼种蛋白质累积率;X表示饲料中的缬氨酸水平。图 2所示曲线最高处对应的缬氨酸水平为12.79 g/(kg干饲料),约占饲料蛋白的3.76%。
|
图 2 饲料中缬氨酸水平对草鱼鱼种蛋白质累积率的影响
Fig. 2 Effect of dietary valine on PRE of juvenile grass carp
|
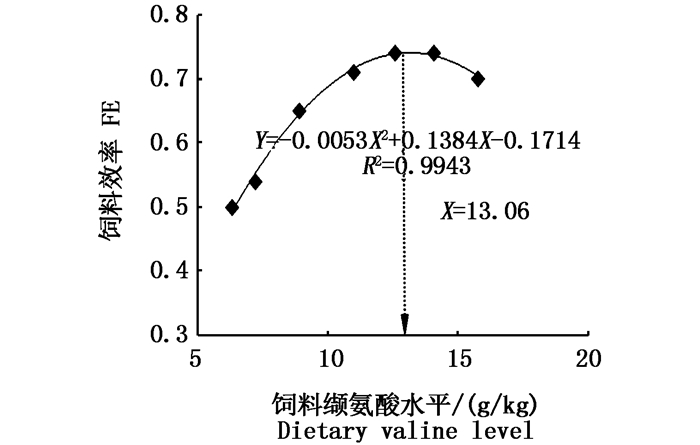
采用抛物线模型拟合草鱼鱼种的饲料效率和饲料缬氨酸水平之间的关系,得二次多项式:

式中:Y表示草鱼鱼种饲料效率;X表示饲料中的缬氨酸水平。图 3所示曲线最高处对应的缬氨酸水平为13.06 g/(kg干饲料),约占饲料蛋白的3.84%。
2.4 草鱼鱼种全鱼体组成
|
图 3 饲料中缬氨酸水平对草鱼鱼种饲料效率的影响
Fig. 3 Effect of dietary valine on FE of juvenile grass carp
|
从表 4可知,饲料缬氨酸水平对草鱼全鱼水分、粗蛋白、粗脂肪和粗灰分无显著影响(P>0.05)。

|
表 4 草鱼鱼种全鱼组成(鲜重) Tab.4 Whole fish composition of grass carp (Wet matter basis) |
从表 5可知,草鱼鱼种肝脏谷丙转氨酶活性在饲料缬氨酸水平11.0 g/(kg干饲料)时达最大值,但各处理组之间并未表现出明显规律性(P < 0.05)。饲料缬氨酸水平对草鱼鱼种肝脏谷草转氨酶无显著影响(P>0.05)。

|
表 5 草鱼鱼种肝脏谷丙转氨酶和谷草转氨酶活性 Tab.5 ALT and AST activity in hepatopancreas of grass carp |
研究表明,缬氨酸是鱼类的必需氨基酸[19]。在本实验中,饲料中缬氨酸含量不足时,草鱼鱼种的鱼体生长减缓,饲料效率和鱼体蛋白质累积率下降。其原因可能是当草鱼鱼种摄食缬氨酸含量不足的饲料后,因必需氨基酸不平衡,一方面限制了利用氨基酸合成体蛋白,另一方面造成体内有过多的其他氨基酸被分解,使鱼体因排出多余的氨而额外消耗能量,从而影响了草鱼的生长和饲料的利用。本实验中,当饲料缬氨酸含量超过12.6 g/(kg干饲料)时,随着饲料中缬氨酸含量的升高,草鱼鱼种生长减缓,鱼体蛋白质累积率显著降低,其原因可能是缬氨酸过量引起新的氨基酸不平衡,或者是机体因代谢过量的缬氨酸而消耗能量,加重机体代谢负担,从而造成鱼体生长减慢及饲料的浪费[20]。该结果与对印度鲮(Cirrhinus mrigala Hamilton)[2]、南亚野鲮(Labeo rohita Hamilton)[3]和喀拉鲃(Catla catla Hamilton)[21]等研究结果相似。但对异育银鲫(Carassius auratus gibelio)[4]、真鲷(Pagrus major)[5]和团头鲂(Megalobrama amblycephala Yih)[8]的研究结果则表明,饲料中缬氨酸过量时,鱼体增重趋于平稳,并未显著降低。造成这种差异的原因可能是实验鱼的种类、实验剂量和饲养条件的不同。
3.2 草鱼鱼种缬氨酸需求量鱼类缬氨酸需求量主要通过生长实验根据剂量-效应曲线测定,如折线模型和抛物线模型等。以往研究中常用指标主要有:特定生长率、增重率、饲料转化率、全鱼蛋白质沉积率、肌肉氨基酸沉积率等。本实验中,分别以鱼体增重率、蛋白质累积率和饲料效率为指标,经抛物线回归模型分析,求得草鱼鱼种对饲料缬氨酸的需求量为12.79~13.68g/(kg干饲料),占饲料蛋白的3.76%~4.02%。此需求量高于真鲷(Pagrus major)[5]的2%,莫桑比克罗非鱼(Oreochromis mossambicus)[22]的2.20%,喀拉鲃(Catla catla Hamilton)[21]的3.6%,与团头鲂(Megalobrama amblycephala Yih)[8]的3.71%~3.88%,印度鲮(Cirrhinus mrigala Hamilton)[2]的3.8%,南亚野鲮(Labeo rohita Hamilton)[3]的3.8%,大西洋鲑(Salmo salar)[23]的3.9%,建鲤(Cyprinus carpio var. Jian)[6]的4.0%和日本鳗鲡(Anguilla japonicas)[24]的4.0%接近,低于异育银鲫(Carassius auratus gibelio)[4]的4.53%。以上鱼类缬氨酸需求量的差异可能受鱼的种类、实验条件和分析方法的影响。此外,有研究称支链氨基酸间的拮抗作用也会影响某种支链氨基酸的需求量[25-26],但在鱼类中拮抗作用机理并未完全清楚,而不同鱼类之间表现也不尽相同[27-30]。有研究表明,当饲料中其他支链氨基酸含量满足其最低需求时,则拮抗作用的影响较小[31-32]。本实验中,氨基酸模式设计均参照草鱼全鱼氨基酸模式,使其满足其他支链氨基酸的需求,以期减小支链氨基酸间的拮抗作用对缬氨酸需求量的影响。
3.3 饲料中缬氨酸水平对草鱼鱼种全鱼体组成的影响国内外关于饲料缬氨酸水平对鱼体组成的影响已有报道,且不同研究者得到的结论不完全一致。李桂梅等[4]用缬氨酸水平范围为0.54%~2.29%干物质的饲料饲喂异育银鲫[Carassius auratus gibelio, (3.17±0.01) g]65 d后发现饲料缬氨酸水平仅对鱼体粗灰分有显著影响。RAHIMNEJAD和LEE[5]用含不同水平缬氨酸(0.27%~2.38%干饲料)的饲料饲养真鲷[Pagrus major,(32.04±0.2) g]12周后发现饲料缬氨酸水平对鱼体水分、粗蛋白和粗脂肪均有显著影响。DONG等[6]研究发现饲料缬氨酸水平对幼建鲤(9.67 g)全鱼粗蛋白、粗脂肪和灰分影响显著。周歧存等[33]研究发现饲料缬氨酸水平仅对凡纳滨对虾(Litopenaeus vannamei)幼虾(0.3 g)全虾及肌肉粗蛋白有显著影响。但也有研究者认为饲料缬氨酸水平不影响鱼体组成,HAN等[7]发现饲料缬氨酸水平对牙鲆(0.43 g±0.01 g)鱼体组成影响不显著。李燕[34]发现饲料缬氨酸水平对鲈鱼(8.0 g)和大黄鱼(Pesudosciaena crocea R., 6.0 g)鱼体组成均无显著影响。窦秀丽[35]研究表明饲料缬氨酸水平对鲈鱼(183.28 g±1.42 g)鱼体组成影响不显著。本实验条件下,饲料缬氨酸水平对草鱼鱼种全鱼体组成也无显著影响。造成这种差异的原因可能是鱼的种类、生长阶段及实验剂量范围不同等。
鱼类的生长实际上是对饲料中蛋白质的沉积,蛋白质的沉积则通过氨基酸的合成来实现。目前,关于饲料缬氨酸水平对鱼体氨基酸含量的影响研究较少。窦秀丽[35]研究表明饲料缬氨酸水平对鲈鱼(Lateolabrax japonicus)肌肉必需氨基酸组成无显著影响。本实验结果与之相同,饲料缬氨酸水平对草鱼鱼种鱼体各必需氨基酸及其总量、各支链氨基酸及其总量均无显著影响(P>0.05)。出现该结果的原因可能是由于肌肉的氨基酸组成相对保守,不容易受饲料中营养水平的影响[36]。
3.4 饲料中缬氨酸水平对草鱼肝脏谷丙转氨酶和谷草转氨酶活性的影响ALT和AST广泛分布于鱼体各组织器官中,通常存在于细胞膜、细胞质和线粒体中,是鱼类最重要的两种转氨酶,在氨基酸代谢中起重要作用,其活力与氨基酸代谢强弱有关[4]。鱼类进行各项生命活动的酶活反应场所是肝脏,故ALT和AST在肝脏中活力较高。DONG等[6]研究发现缬氨酸显著增加幼建鲤肝脏谷丙转氨酶和谷草转氨酶活力,李桂梅等[4]研究发现饲料缬氨酸水平对异育银鲫肝脏谷丙转氨酶和谷草转氨酶活力均无显著影响,而本实验中,肝脏中AST活力不受饲料中缬氨酸含量的显著影响,ALT活力在饲料缬氨酸水平为11.0 g/kg时达最高值(P < 0.05),但各组之间并未表现出明显规律性,饲料缬氨酸水平与鱼类肝脏ALT和AST活力的关系有待进一步探讨。
| [1] | National Research Council, Division on Earth and Life Studies, Board on Agriculture and Natural Resources, et al. Nutrient requirements of fish and Shrimp[M]. Washington, DC, USA: National Academies Press, 2011. |
| [2] | AHMED I, KHAN M A. Dietary branched-chain amino acid valine, isoleucine and leucine requirements of fingerling Indian major carp, Cirrhinus mrigala (Hamilton)[J]. The British Journal of Nutrition, 2006, 96(3): 450–460. |
| [3] | ABIDI S F, KHAN M A. Dietary valine requirement of Indian major carp, Labeo rohita (Hamilton) fry[J]. Journal of Applied Ichthyology, 2004, 20(2): 118–122. DOI:10.1046/j.1439-0426.2003.00526.x |
| [4] |
李桂梅, 解绶启, 雷武, 等. 异育银鲫幼鱼对饲料中缬氨酸需求量的研究[J].
水生生物学报, 2010, 34(6): 1157–1165.
LI G M, XIE S Q, LEI W, et al. Dietary valine requirement for juvenile gibel carp (Carassius auratus gibelio)[J]. Acta Hydrobiologica Sinica, 2010, 34(6): 1157–1165. |
| [5] | RAHIMNEJAD S, LEE K J. Dietary valine requirement of juvenile red sea bream Pagrus major[J]. Aquaculture, 2013, 416-417: 212–218. DOI:10.1016/j.aquaculture.2013.09.026 |
| [6] | DONG M, FENG L, KUANG S Y, et al. Growth, body composition, intestinal enzyme activities and microflora of juvenile Jian carp (Cyprinus carpio var. Jian) fed graded levels of dietary valine[J]. Aquaculture Nutrition, 2013, 19(1): 1–14. DOI:10.1111/j.1365-2095.2011.00926.x |
| [7] | HAN Y Z, HAN R Z, KOSHIO S, et al. Interactive effects of dietary valine and leucine on two sizes of Japanese flounder Paralichthys olivaceus[J]. Aquaculture, 2014, 432: 130–138. DOI:10.1016/j.aquaculture.2014.05.004 |
| [8] | REN M C, HABTE-TSION H M, LIU B, et al. Dietary valine requirement of juvenile blunt snout bream (Megalobrama amblycephala Yih, 1955)[J]. Journal of Applied Ichthyology, 2015, 31(6): 1086–1092. DOI:10.1111/jai.12911 |
| [9] |
廖朝兴, 黄忠志. 草鱼种在不同生长阶段对饲料蛋白质需要的研究[J].
淡水渔业, 1987: 1–5.
LIAO C X, HUANG Z Z. Protein requirements of grass fry at different growth stages[J]. Freshwater Fisheries, 1987: 1–5. |
| [10] |
赵库, 杨春富. 饲料蛋白质含量及颗粒大小对草鱼种生长的影响[J].
淡水渔业, 2000, 30(6): 31–33.
ZHAO K, YANG C F. Effect of protein content and grain size of feed on growth of grass crap fingerling[J]. Freshwater Fisheries, 2000, 30(6): 31–33. |
| [11] |
曹俊明, 关国强, 刘永坚, 等. 饲料蛋白质、脂肪、碳水化合物水平对草鱼生长和组织营养成分组成的影响[J].
水产科技情报, 1997, 24(2): 56–60.
CAO J M, GUAN G Q, LIU Y J, et al. Effects of different dietary levels of protein, fat and carbohydrate on growth rate and tissue nutritional composition in grass carp[J]. Fisheries Science & Technology Information, 1997, 24(2): 56–60. |
| [12] |
曹俊明, 田丽霞, 陈竹, 等. 饲料中不同脂肪酸对草鱼生长和组织营养成分组成的影响[J].
华南理工大学学报(自然科学版), 1996, 24(s): 149–154.
CAO J M, TIAN L X, CHEN Z, et al. Effect of dietary fatty acids on growth and tissue chemical composition of grass carp, Ctenopharyngodon idellus[J]. Journal of South China University of Technology (Natural Science), 1996, 24(s): 149–154. |
| [13] | GAO Y J, YANG H J, GUO D Q, et al. Dietary arginine requirement of juvenile grass carp Ctenopharyngodon idella (Valenciennes in Cuvier & Valenciennes, 1844)[J]. Aquaculture Research, 2015, 46(12): 3070–3078. DOI:10.1111/are.2015.46.issue-12 |
| [14] | WANG S, LIU Y J, TIAN L X, et al. Quantitative dietary lysine requirement of juvenile grass carp Ctenopharyngodon idella[J]. Aquaculture, 2005, 249(1/4): 419–429. |
| [15] |
文华, 高文, 罗莉, 等. 草鱼幼鱼的饲料苏氨酸需要量[J].
中国水产科学, 2009, 16(2): 238–247.
WEN H, GAO W, LUO L, et al. Determination of dietary threonine requirement for juvenile grass carp, Ctenopharyngodon idella[J]. Journal of Fishery Sciences of China, 2009, 16(2): 238–247. |
| [16] |
尚晓迪, 罗莉, 文华, 等. 草鱼幼鱼对异亮氨酸的需要量[J].
水产学报, 2009, 33(5): 813–822.
SHANG X D, LUO L, WEN H, et al. Study on isoleucine requirement for juvenile grass carp, Cenopharyngodon idellus[J]. Journal of Fisheries of China, 2009, 33(5): 813–822. |
| [17] |
孙丽慧, 陈建明, 潘茜, 等. 草鱼鱼种对饲料中苯丙氨酸需求量的研究[J].
上海海洋大学学报, 2016, 25(3): 388–395.
DOI:10.12024/jsou.20150901545 SUN L H, CHEN J M, PAN Q, et al. Dietary phenylalanine requirement for fingerling grass carp (Ctenopharyngodon idella)[J]. Journal of Shanghai Ocean University, 2016, 25(3): 388–395. DOI:10.12024/jsou.20150901545 |
| [18] | AO AC. Official methods of analysis[M]. Arlington: Association of Official Agricultural Chemists, 1990: 98, 450, 606, 589. |
| [19] | WILSON R P. Amino acids and proteins[M]//HALVER J E, HARDY R W. Fish Nutrition. 3rd ed. New York:Academic Press, 2002:145-175. |
| [20] | WALTON M J. Aspects of amino acid metabolism in teleost fish[M]//COWEY C B, MACKIE A M, BELL J G. Nutrition and Feeding in Fish. London:Academic Press, 1985:47-68. |
| [21] | RAVI J, DEVARAJ K V. Quantitative essential amino acid requirements for growth of catla, Catla catla (Hamilton)[J]. Aquaculture, 1991, 96(3/4): 281–291. |
| [22] | JAUNCEY K, TACON A G J, JACKSON A J. The quantitative essential amino acid requirements of Oreochromis (sarotherodon) mossambicus[C]//FISHELSON L, YARON Z. Proceedings of the First International Symposium on Tilapia in Aquaculture. Nazareth, Israel:Tel Aviv University, 1983:328-337. |
| [23] | ROLLIN X. Critical study of indispensable amino acids requirements of Atlantic salmon (Salmo salar L.) fry[D]. Belgium:Université Catholique de Louvain, 1999. |
| [24] | Committee on Animal Nutrition, Board on Agriculture, National Research Council. Nutrient requirements of fish[M]. Washington, DC: National Academy Press, 1993. |
| [25] | D'MELLO J P F, LEWIS D. Amino acid interactions in chick nutrition:2. Interrelationships between leucine, isoleucine and valine[J]. British Poultry Science, 1970, 11(3): 313–323. DOI:10.1080/00071667008415821 |
| [26] | D'MELLO J P F, LEWIS D. Amino acid interactions in chick nutrition:4. Growth, food intake and plasma amino acid patterns[J]. British Poultry Science, 1971, 12(3): 345–358. DOI:10.1080/00071667108415890 |
| [27] | CHANCE R E, MERTZ E T, HALVER J E. Nutrition of salmonoid fishes. XⅡ. Isoleucine, leucine, valine and phenylalanine requirements of Chinook salmon and inter-relations between isoleucine and leucine for growth[J]. The Journal of Nutrition, 1964, 83: 177–185. |
| [28] | HUGHES S G, RUMSEY G L, NESHEIM M C. Dietary requirements for essential branched-chain amino acids by lake trout[J]. Transactions of the American Fisheries Society, 1983, 112(6): 812–817. DOI:10.1577/1548-8659(1983)112<812:DRFEBA>2.0.CO;2 |
| [29] | YAMAMOTO T, SHIMA T, FURUITA H. Antagonistic effects of branched-chain amino acids induced by excess protein-bound leucine in diets for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 2004, 232(1/4): 539–550. |
| [30] | CHOO P S, SMITH T K, CHO C Y, et al. Dietary excesses of leucine influence growth and body composition of rainbow trout[J]. The Journal of Nutrition, 1991, 121(12): 1932–1939. |
| [31] | BARBOUR G, LATSHAW J D. Isoleucine requirement of broiler chicks as affected by the concentrations of leucine and valine in practical diets[J]. British Poultry Science, 1992, 33(3): 561–568. DOI:10.1080/00071669208417495 |
| [32] | BURNHAM D, EMMANS G C, GOUS R M. Isoleucine requirements of the chicken:the effect of excess leucine and valine on the response to isoleucine[J]. British Poultry Science, 1992, 33(1): 71–87. DOI:10.1080/00071669208417445 |
| [33] |
周歧存, 王用黎, 黄文文, 等. 凡纳滨对虾幼虾的缬氨酸需要量[J].
动物营养学报, 2015, 27(2): 459–468.
ZHOU Q C, WANG Y L, HUANG W W, et al. Valine requirement of juvenile Pacific white shrimp, Litopenaeus vanname[J]. Chinese Journal of Animal Nutrition, 2015, 27(2): 459–468. |
| [34] |
李燕. 鲈鱼和大黄鱼支链氨基酸与组氨酸营养生理的研究[D]. 青岛: 中国海洋大学, 2010.
LI Y. Optimal requirements of branch chain amino acids and histidine in diets of Japanese seabass, Lateolabrax japonicus and large yellow croaker Pesudosciaena crocea R.[D]. Qingdao:Ocean University of China, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011030173.htm |
| [35] |
窦秀丽. 鲈鱼(Lateolabrax japonicus)生长中后期缬氨酸、组氨酸和苏氨酸营养需求的研究[D]. 大连: 大连海洋大学, 2014.
DOU X L. The study on the optimum requirement of dietary valine, histidine and threonine of Japanese seabass (Lateolabrax japonicus) in the middle and late growing stage[D]. Dalian:Dalian Ocean University, 2014. https://www.cnki.com.cn/qikan-HYSC201406007.html |
| [36] |
路凯. 花鲈对亮氨酸、异亮氨酸和色氨酸需求量的研究[D]. 青岛: 中国海洋大学, 2015.
LU K. Studies on requirements of leucine, isoleucine and tryptophan in diets of Japanese seabass, Lateolabrax maculatus[D]. Qingdao:Ocean University of China, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10423-1015717386.htm |
2. Key Laboratory of Fish Health and Nutrition of Zhejiang Province, Zhejiang Institute of Freshwater Fisheries, Huzhou 313001, Zhejiang, China
 2017,
Vol. 26
2017,
Vol. 26


