2. 南京农业大学 无锡渔业学院, 江苏 无锡 214081
中国是世界池塘养殖大国,池塘养殖业在国民经济中占有重要地位[1]。但是,目前我国的池塘养殖面临着水环境污染严重[2-3]和机械化程度低[4]两大瓶颈问题,从而限制了池塘养殖业的健康可持续发展。因此创新养殖模式,提升池塘养殖的现代化程度,减少池塘养殖对内、外环境的污染已经成为现代池塘养殖业亟待解决的关键问题。为此,国内学者在借鉴国外分区养殖系统的基础上,提出了池塘工业化生态养殖系统,利用占池塘面积2%~5%的水面建设具有气提推水充气和集排污装备的系列水槽作为养殖区进行类似于“工厂化”的高密度养殖,实施工业化管理,并对其余95%~98%的水面进行适当改造后作为净化区对残留在池塘的养殖尾水进行生物净化处理,实现养殖周期内养殖尾水的零排放或达标排放[5]。这样,通过将养殖单元和水质净化单元分离,仅用小面积养殖了原有甚至超过原有总水域面积的产量,彻底革新了传统池塘养鱼模式。
池塘工业化生态养殖系统作为一种新型池塘生态养殖模式,虽然目前已经在部分地区得到了推广应用,但其基础研究十分薄弱,有关池塘工业化生态养殖系统中浮游植物群落结构的研究目前未见报道。浮游植物是水生态系统中的初级生产者,浮游植物也是监测、评价水质状况的重要生态学指标[6]。浮游植物对水体营养状态的变化能迅速做出响应[7],其种群结构与水质状况密切相关,能够综合、真实地反映出水体的生态条件和营养状况[7-9]。因此,研究养殖水体中浮游植物群落结构,不仅能够了解池塘水体的初级生产力,而且能够判别水体的环境状况。为此,本试验研究了团头鲂池塘工业化生态养殖系统中浮游植物群落结构的变化,为阐明池塘工业化生态养殖系统的生态学机理提供科学依据。
1 材料与方法 1.1 试验设计本试验在位于江苏省建湖县的盐城正荣生态渔业有限公司开展。池塘工业化生态养殖系统包括养殖区(Aquaculture area, AA)、进水区(Inlet area, IA)、排水区(Outlet area, OA)、净化区(Purification area, PA)、循环区(Recirculation area, RA)、循回区(Back area, BA)等6个试验分区(图 1),其中养殖区根据试验需要被划分为高密度养殖区和低密度养殖区。进水区、排水区、净化区、循环区、循回区的面积分别为3 000 m2、900 m2、15 000 m2、170 000 m2、55 000 m2,水深分别为4.0 m、2.0 m、1.2 m、1.5 m、2.0 m。养殖区面积为5 720 m2,由52个面积为110 m2的水泥池组成,池深2.5 m、水深2.0 m。

|
图 1 池塘工业化生态养殖系统示意图
Fig. 1 Schematic diagram of industrial eco-aquaculture system
图中黑色圆点代表采样点 The black dots in the figure mean the sampling sites |
试验于2016年7月13日开始,包括2种不同的养殖密度,分别是低密度组(Low stocking density aquaculture area, LA)和高密度组(High stocking density aquaculture area, HA)。养殖品种为团头鲂(Megalobrama amblycephala),初始平均体质量为(3.33±0.52) g,平均体长为(56.13±3.45) mm;低密度组和高密度组的放养密度分别为200尾/m2和300尾/m2。
1.2 养殖试验养殖期间的日投喂量约为鱼体质量的3%~5%,分3次投喂,投喂时间分别为9:00、12:30、16:00。养殖期间保持微流水,推水前端水流速度为12 cm/s。配置微管增氧系统,以作为备用;微管增氧系统在平常不开,只在水体溶解氧低于3 mg/L时开启。
1.3 浮游植物采集、鉴定和计数于2016年7月开始采集浮游植物样品,夏秋季每月采样1次,冬春季每两月采样1次。试验区共设置23个采样点,其中高密度养殖区3个、低密度养殖区3个、进水区3个、排水区3个、净化区5个、循环区3个、循回区3个,各试验分区的采样点位置如图 1所示。浮游植物样品采集方法参照文献[10]。浮游植物鉴定参照文献[11-13]。
1.4 评价方法采用Pielou均匀度指数(J,Pielou)和香农-威纳多样性指数(D,Shannon-Wiener index)对水体浮游植物的生态学特征进行分析评价。上述各项指数的计算方法参照文献[10, 14-15]。
2 结果与分析 2.1 浮游植物种类组成及丰度试验期间,所有分区循回区共鉴定出绿藻门、硅藻门、蓝藻门、裸藻门、隐藻门、甲藻门5门92种(包括变种和变型)藻类;其中绿藻种数最多,共46种,占浮游植物总种数的50.0%;蓝藻和裸藻次之,均为15种,占浮游植物总种数的16.3%;硅藻10种,占浮游植物总种数的10.9%;隐藻5种,占浮游植物总种数的5.4%;甲藻1种,占浮游植物总种数的1.1%。试验期间浮游植物种类组成如表 1所示。从各养殖分区的游植物种类组成看,试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区和循回区分别鉴定出浮游植物6门57种、5门55种、5门64种、5门51种、5门64种、6门63种和6门63种。低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的浮游植物种类数分别为40~52种、40~53种、45~62种、33~51种、45~55种、46~58种、45~59种(图 2),各试验分区的浮游植物种类数表现为进水区、净化区、循环区、循回区 > 低密度养殖区 > 高密度养殖区 > 排水区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的种类数总体表现为夏季 > 秋季 > 冬季。

|
表 1 各分区的浮游植物组成及种类数 Tab.1 The composition and number of species of phytoplankton in every partition |

|
图 2 浮游植物丰度和种类数变化
Fig. 2 Biomass and species of phytoplankton
|
2016年7月—2017年4月,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的浮游植物总丰度分别为5.25×107~13.42×107、5.74×107~16.54×107、5.08×107~10.36×107、6.01×107~17.82×107、5.46×107~11.31×107、4.84×107~11.96×107、4.84×107~10.75×107 cells/L(图 2)。浮游植物总丰度表现为排水区 > 高密度养殖区 > 低密度养殖区 > 进水区、净化区、循环区、循回区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的总丰度总体表现为夏季 > 秋季 > 冬季。
2.2 蓝、绿藻丰度及其所占比例试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的蓝藻丰度分别为3.28×107~10.08×107、4.07×107~13.04×107、2.54×107~7.25×107、4.78×107~15.63×107、3.08×107~7.94×107、2.52×107~8.66×107、2.62×107~6.91×107 cells/L(图 3)。蓝藻丰度和蓝藻占总藻类的百分比均表现为排水区 > 高密度养殖区 > 低密度养殖区 > 进水区、净化区、循环区、循回区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的蓝藻丰度总体表现为夏季 > 秋季 > 冬季,而蓝藻占总藻类的百分比各季节没有明显差异。
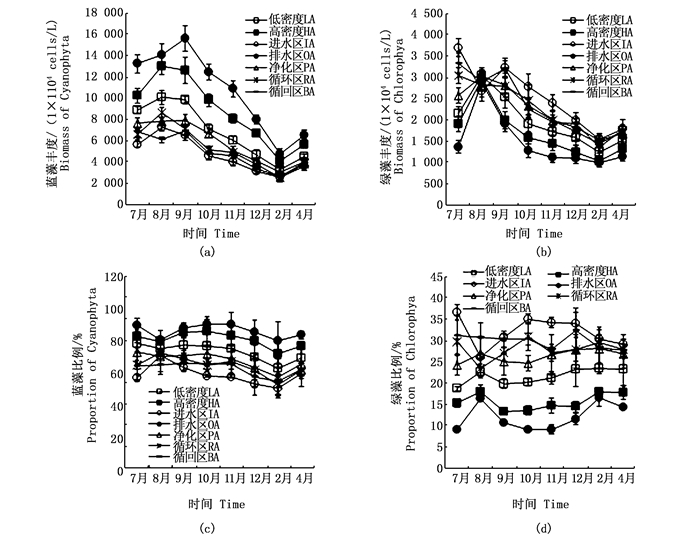
|
图 3 蓝、绿藻丰度及其所占比例变化
Fig. 3 Cyanophyta and chlorophyta biomass and their proportions of the total phytoplankton
|
试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的绿藻丰度分别为1.23×107~3.04×107、1.03×107~2.96×107、1.53×107~3.69×107、0.99×107~2.87×107、1.52×107~3.01×107、1.43×107~3.03×107、1.36×107~3.33×107 cells/L(图 3);绿藻丰度和绿藻占总藻类的百分比均表现为进水区、净化区、循环区、循回区 > 低密度养殖区 > 高密度养殖区 > 排水区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的绿藻丰度总体表现为夏季 > 秋季 > 冬季,而绿藻占总藻类的百分比各季节没有明显差异。
2.3 多样性和均匀度试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的多样性指数分别为2.65~3.84、2.12~3.65、3.28~4.01、1.96~3.53、2.78~4.09、3.06~3.95、3.11~4.05,平均值分别为3.02、2.61、3.70、2.22、3.32、3.39、3.44(表 2);多样性指数表现为排水区 < 高密度养殖区 < 低密度养殖区 < 进水区、净化区、循环区、循回区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的多样性指数没有表现出一定的规律性。
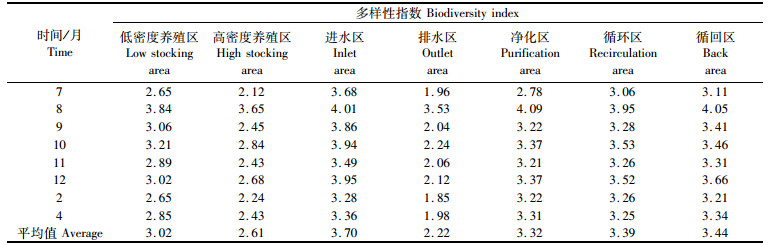
|
表 2 浮游植物多样性指数 Tab.2 Biodiversity of phytoplankton |
试验期间,低密度养殖区、高密度养殖区、进水区、排水区、净化区、循环区、循回区的均匀度指数分别为0.47~0.70、0.39~0.64、0.60~0.70、0.35~0.64、0.49~0.72、0.53~0.70、0.53~0.71,平均值分别为0.55、0.48、0.64、0.41、0.59、0.60、0.61(表 3);均匀度指数表现为排水区 < 高密度养殖区 < 低密度养殖区 < 进水区、净化区、循环区、循回区;进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。从季节变化上看,各试验分区的均匀度指数没有表现出一定的规律性。
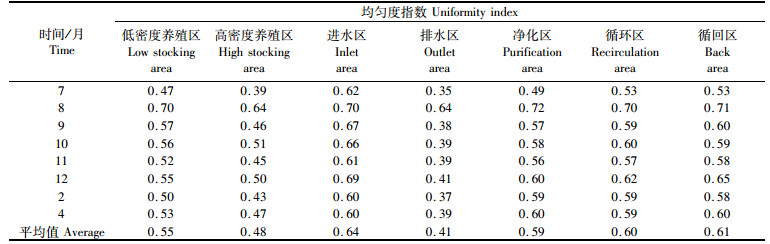
|
表 3 浮游植物均匀度指数 Tab.3 Uniformity of phytoplankton |
浮游植物是水生态系统中重要的初级生产者[16-17]和水生食物链的关键环节,能通过光合作用固定无机碳和释放氧气[18],并能吸收水体中的氮、磷等营养盐使之转化为有机物[19]。因此,养殖水体中的藻类在改善水质的同时,也为经济水生动物提供了优质饵料资源[20]。然而,并非所有藻类都能被经济水生动物利用,某些有害藻类,如微囊藻等,由于不能被鱼类等水生生物利用,在特定条件下会爆发性增殖而形成水华,使水质恶化、变臭、鱼虾大量死亡[21-22],给水生经济动物生长带来了严重危害[23]。因此,如何在促进有益藻类生长、繁殖的同时又抑制有害藻类的生长、繁殖,从而实现利用藻类调节改善养殖生态环境,大大提高水体初级生产力[21],是亟需解决的问题。
浮游植物数量和丰度主要受水体营养盐、水温、光照等因素的影响[24-25],在营养水平较高的水体中(TN > 0.2 mg/L,TP > 0.02 mg/L),营养盐对藻类的限制作用会下降,其他因素会影响藻类对营养盐的利用[10]。本研究的同步水质监测结果表明,各试验分区的总氮、总磷都远远高于上述限量水平,氮磷等营养盐已不是藻类生长的限制性因子。因此本研究中浮游植物丰度与水温关系密切,呈现出随水温升高而升高、随水温降低而降低的月度变化趋势。然而,本研究显示,蓝藻丰度依然受营养盐影响较大,在营养盐浓度较高的排水区和养殖区,蓝藻丰度及其所占比例明显较高,并导致藻类总丰度也较高。同时,从本试验的蓝、绿藻比例研究结果看,蓝藻丰度及其占藻类总丰度的百分比表现为排水区 > 高密度养殖区 > 低密度养殖区 > 进水区、净化区、循环区、循回区,而绿藻丰度及其占藻类总丰度的百分比表现为排水区 < 高密度养殖区 < 低密度养殖区 < 进水区、净化区、循环区、循回区;表明进水区、净化区、循环区、循回区的蓝藻丰度、蓝藻比例、绿藻丰度、绿藻比例都优于养殖区和排水区,显示出净化植物在一定程度上抑制了蓝藻生长、促进了绿藻生长;同时也表明高密度养殖区更易于滋生蓝藻。汤佩武[26]认为,在养殖池塘中浮床栽培水蕹菜能够显著降低浮游植物丰度和生物量;潘利平[27]研究表明,有生态浮床的水体中浮游植物丰度较低,且蓝藻丰度也一直维持在极低的水平,而无生态浮床的试验池中,浮游植物和蓝藻的丰度较高;赵巧玲[28]在研究植物浮床对精养池塘浮游藻类群落结构的影响时发现,浮床塘的植物以绿藻为主,而对照塘以蓝藻为主;刘娅琴等[29]在研究生态浮床对富营养水体浮游植物群落结构的影响时也得出上述结论,这与本研究结果类似。生态浮床系统对浮游植物的影响可能是通过系统对营养物质的去除而产生的上行效应来实现的[29-30],而且对磷的高效去除也可能是浮床系统抑制蓝藻水华的因素之一[29]。此外,生态浮床对浮游植物的控制可能还通过浮游动物的下行效应得以实现[30]。浮游动物对浮游植物的牧食压力能显著降低浮游植物的生物量并改变其群落结构[31-32],尽管浮游动物对某些浮游植物的选择性牧食可能使其他与之有营养竞争的浮游植物种类的生物量上升,但浮游动物能降低浮游植物的总生物量[33],使其处于降低的水平。本试验对浮游动物的同步监测表明,进水区、净化区、循环区、循回区的浮游动物丰度明显高于养殖区和排水区,这可能也是导致进水区、净化区、循环区、循回区的浮游植物丰度明显低于养殖区和排水区的因素。
3.2 多样性和均匀度物种多样性是衡量一定区域生物资源丰富程度的客观指标,用于评价群落中种类组成的稳定程度及其数量分布均匀程度和群落组织结构特征,并常作为描述群落演替方向、速度和稳定程度的指标[10]。同时,除多样性指数外,群落的均匀度也是表征群落结构特征的一个重要指标,能够反映出物种个体数目分配的均匀程度[10]。本研究中,进水区、净化区、循环区、循回区的浮游植物多样性指数和均匀度指数高于同期养殖区和排水区,表明进水区、净化区、循环区、循回区的浮游植物多样性和均匀度优于养殖区和排水区,显示出净化植物在一定程度上能够改善浮游植物群落结构,提高群落结构的稳定性。汤佩武[26]认为,在养殖池塘中浮床栽培水蕹菜能够显著提高浮游植物的Shannon-Wiener多样性指数和Pielou均匀度指数;刘娅琴等[30]研究显示,在富营养化水体中设置生态浮床能够提高浮游植物的Shannon-Wiener多样性指数和水生态系统的健康稳定性;赵巧玲[28]在研究植物浮床对精养池塘浮游藻类群落结构的影响时发现,浮床塘的Shannon-Wiener多样性指数和Pielou均匀度指数均明显高于对照塘,这与本研究结果类似。生态浮床对浮游植物群落的改善可能是通过光照、营养盐的上行效应与浮游动物的下行效应等因素得以实现的[30]。水生植物与藻类在对营养和光能的利用上形成竞争关系;因浮床植物的存在,藻类生长繁殖所需的营养物质和光照受到一定程度的限制,影响藻类群落结构和优势种[26]。此外,附着在植物根系上的以藻类为食的小型动物也可通过抑制藻类大量繁殖而改变其群落结构[26]。
同时,Shannon-Wiener多样性指数也是通过生物监测评价水质状况的重要指标,当Shannon-Wiener多样性指数在3以上时为清洁水体,2~3为轻度污染,1~2为中度污染,小于1为重污染,且多样性指数越大水质越好[34]。本研究显示,进水区、净化区、循环区、循回区的浮游植物多样性指数高于同期养殖区和排水区,表明进水区、净化区、循环区、循回区的水质较养殖区和排水区好。同时,从本研究中多样性指数指示的水质污染状况看,排水区接近中度污染,高密度养殖区为轻度污染,其余各试验区为清洁水体;表明除排水区外,其余各试验分区的水质都较好,系统运行良好。
4 结论浮游植物总丰度、蓝藻丰度及蓝藻比例均表现为排水区 > 高密度养殖区 > 低密度养殖区 > 进水区、净化区、循环区、循回区;绿藻丰度及其比例均表现为进水区、净化区、循环区、循回区 > 低密度养殖区 > 高密度养殖区 > 排水区;上述参数在进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。
浮游植物种类数、多样性指数和均匀度指数均表现为进水区、净化区、循环区、循回区 > 低密度养殖区 > 高密度养殖区 > 排水区;上述参数在进水区、净化区、循环区、循回区之间没有表现出明显差异和变化的规律性。
排水区接近中度污染,高密度养殖区为轻度污染,其余各试验区为清洁水体;表明除排水区外,其余各试验分区的水质都较好,系统运行良好。
| [1] |
吴珊. 水产养殖池塘蓝藻水华的生物防治[D]. 扬州: 扬州大学, 2016.
WU S. Biological control against cyanbacterial bloom in aquaculture pond[D]. Yangzhou: Yangzhou University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-11117-1016290442.htm |
| [2] |
李敏, 段登选, 许国晶, 等. 大薸微生态制剂协同净化养殖池塘富营养化水体的效果[J].
生态与农村环境学报, 2015, 31(1): 94–99.
DOI:10.11934/j.issn.1673-4831.2015.01.014 LI M, DUAN D X, XU G C, et al. Effects of Pistia stratiotes-probiotics purifying eutrophied pond water[J]. Journal of Ecology and Rural Environment, 2015, 31(1): 94–99. DOI:10.11934/j.issn.1673-4831.2015.01.014 |
| [3] |
沈明明. 影响对虾工厂化养殖水体微藻群落演替的主要因子及其与疾病发生的关系[D]. 上海: 上海海洋大学, 2016.
SHEN M M. Studies on the affecting factors to microalgae community succession and its' relevance to shrimp diseases in industrial aquaculture of Litopenaeus vannamei[D]. Shanghai: Shanghai Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912333.htm |
| [4] |
郑志营. 自动投饵机器船的轨迹优化方法研究[D]. 镇江: 江苏大学, 2015.
ZHENG Z Y. Research on the trajectory optimization method of automatic feeding ship[D]. Zhenjiang: Jiangsu University, 2015. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2800179 |
| [5] |
张茂友, 诸葛燕, 徐雪英, 等. 池塘工业化生态养殖系统鱼虾共养模式试验[J].
水产养殖, 2017, 38(3): 20–22.
ZHANG M Y, ZHUGE Y, XU X Y, et al. Co-culture of fish and shrimp in pond industrial eco-aquaculture system[J]. Journal of Aquaculture, 2017, 38(3): 20–22. |
| [6] |
陈家长, 孟顺龙, 尤洋, 等. 太湖五里湖浮游植物群落结构特征分析[J].
生态环境学报, 2009, 18(4): 1358–1367.
CHEN J Z, MENG S L, You Y, et al. Characteristic of phytoplankton community in Lake Wuli, Lake Taihu[J]. Ecology and Environmental Sciences, 2009, 18(4): 1358–1367. |
| [7] | SIDIK M J, RASHED-UN-NABI M, AZHARUL HOQUE M. Distribution of phytoplankton community in relation to environmental parameters in cage culture area of Sepanggar Bay, Sabah, Malaysia[J]. Estuarine, Coastal and Shelf Science, 2008, 80(2): 251–260. DOI:10.1016/j.ecss.2008.08.004 |
| [8] |
陈家长, 孟顺龙, 胡庚东, 等. 长江下游江段秋季浮游植物生态指标与理化指标评价[J].
长江流域资源与环境, 2010, 19(s2): 34–39.
CHEN J Z, MENG S L, HU G D, et al. Water quality evaluation by phytoplankton community structure indices and physical-chemical indices in the lower reach of the Yangtze river in autumn[J]. Resources and Environment in the Yangtze Basin, 2010, 19(s2): 34–39. |
| [9] |
刘守海, 张海景, 项凌云, 等. 杭州湾富营养化水域春季浮游生物生态群落特征研究[J].
上海海洋大学学报, 2015, 24(2): 265–271.
LIU S H, ZHANG H J, XIANG L Y, et al. Study on the plankton ecological community characteristics in eutrophication areas of Hangzhou Bay in spring[J]. Journal of Shanghai Ocean University, 2015, 24(2): 265–271. |
| [10] |
孟顺龙, 陈家长, 胡庚东, 等. 2008年太湖梅梁湾浮游植物群落周年变化[J].
湖泊科学, 2010, 22(4): 577–584.
MENG S L, CHEN J Z, HU G D, et al. Annual dynamics of phytoplankton community in Meiliang Bay, Lake Taihu, 2008[J]. Journal of Lake Sciences, 2010, 22(4): 577–584. |
| [11] |
郑洪萍. 福建省大中型水库常见淡水藻类图集[M]. 北京: 中国环境科学出版社, 2012.
ZHEN H P. Common freshwater algae in large and medium-scaled reservoirs in Fujian province[M]. Beijing: China Environmental Science Press, 2012. |
| [12] |
韩茂森, 束蕴芳. 中国淡水生物图谱[M]. 北京: 海洋出版社, 1995.
HAN M S, SHU Y F. Chinese freshwater organism map[M]. Beijing: Ocean Press, 1995. |
| [13] |
胡鸿钧, 魏印心. 中国淡水藻类[M]. 北京: 科学出版社, 2006.
HU H J, WEI Y X. The freshwater algae of China[M]. Beijing: Sciences Press, 2006. |
| [14] |
孟顺龙, 肖代, 陈小丽, 等. 里下河腹地典型水体秋季浮游植物生态学特征[J].
浙江农业学报, 2015, 27(11): 1998–2005.
DOI:10.3969/j.issn.1004-1524.2015.11.22 MENG S L, XIAO D, CHEN X L, et al. Phytoplankton ecological characteristics in the typical water bodies of Lixia River hinterland in autumn[J]. Acta Agriculturae Zhejiangensis, 2015, 27(11): 1998–2005. DOI:10.3969/j.issn.1004-1524.2015.11.22 |
| [15] |
刘娅琴, 刘福兴, 宋祥甫, 等. 农村污染河道生态修复中浮游植物的群落特征[J].
农业环境科学学报, 2015, 34(1): 162–169.
DOI:10.11654/jaes.2015.01.023 LIU Y Q, LIU F X, SONG X F, et al. Characteristics of phytoplankton community in country contaminated ditches during ecological restoration[J]. Journal of Agro-Environment Science, 2015, 34(1): 162–169. DOI:10.11654/jaes.2015.01.023 |
| [16] |
丁娜, 周彦锋, 宋江腾, 等. 阳澄湖浮游植物群落结构特征及其与水环境因子的关系[J].
上海海洋大学学报, 2015, 24(5): 702–711.
DING N, ZHOU Y F, SONG J T, et al. Community characteristics of phytoplankton in Yangcheng Lake and relationships with water environmental factors[J]. Journal of Shanghai Ocean University, 2015, 24(5): 702–711. |
| [17] |
张永红, 刘其根, 孔优佳, 等. 滆湖控藻网围内、外及工程示范区浮游植物群落结构周年变化特征对比研究[J].
上海海洋大学学报, 2016, 25(3): 422–430.
DOI:10.12024/jsou.20150301368 ZHANG Y H, LIU Q G, KONG Y J, et al. A comparative study of annual dynamics of community structure of phytoplankton between inside and outside of bio-manipulation pen and demonstration project area in Gehu Lake[J]. Journal of Shanghai Ocean University, 2016, 25(3): 422–430. DOI:10.12024/jsou.20150301368 |
| [18] |
李兴, 李建茹, 徐效清, 等. 乌梁素海浮游植物功能群季节演替规律及影响因子[J].
生态环境学报, 2015, 24(10): 1668–1675.
LI X, LI J R, XU X Q, et al. Seasonal succession of phytoplankton functional groups and their relationship with environmental factors in Wuliangsuhai Lake[J]. Ecology and Environment Sciences, 2015, 24(10): 1668–1675. |
| [19] |
何宝南, 何江涛, 王健, 等. 顺义潮白河再生水受水区反硝化作用初探[J].
农业环境科学学报, 2016, 35(8): 1565–1572.
DOI:10.11654/jaes.2016-0268 HE B N, HE J T, WANG J, et al. Preliminary investigation on the denitrification of reclaimed water intake area of the Chaobai River[J]. Journal of Agro-Environment Science, 2016, 35(8): 1565–1572. DOI:10.11654/jaes.2016-0268 |
| [20] |
汤江武, 吴逸飞, 薛智勇, 等. 肥料在水产养殖中的应用及前景[J].
淡水渔业, 2003, 33(4): 62–63.
TANG J W, WU Y F, XU Z Y, et al. Outlook to fertilizer utilization in aquaculture[J]. Freshwater Fisheries, 2003, 33(4): 62–63. |
| [21] |
金丽娜, 徐小清. 微囊藻毒素对鱼类毒性影响的研究进展[J].
水生生物学报, 2003, 27(6): 644–647.
JIN L N, XU X Q. A review of the toxic effect of microcystin on fish[J]. Acta Hydrobiologica Sinica, 2003, 27(6): 644–647. |
| [22] |
葛虹, 张扬. 水体富营养化及对鱼类的毒性[J].
水利渔业, 2006, 26(6): 79–81.
GE H, ZHANG Y. Water eutrophication and its toxicity to fishes[J]. Reservoir Fisheries, 2006, 26(6): 79–81. |
| [23] |
戴国飞, 张伟, 彭宁彦, 等. 枯水期鄱阳湖及其滨湖水体氮磷等污染物分布与藻华风险研究[J].
生态环境学报, 2015, 24(5): 838–844.
DAI G F, ZHANG W, PENG N Y, et al. Study on distribution of n and p pollutants and risk of cyanobacteria bloom in Poyang lake and waters around the lake during drought periods[J]. Ecology and Environment Sciences, 2015, 24(5): 838–844. |
| [24] |
滕益莉, 王沛芳, 任凌霄, 等. 锌和铁对浅水湖泊中浮游植物复苏影响研究以玄武湖为例[J].
农业环境科学学报, 2016, 35(3): 540–547.
DOI:10.11654/jaes.2016.03.018 TENG Y L, WANG P F, REN L X, et al. Impact of zinc and iron on phytoplankton community structure during recruitment:A case study in Lake Xuanwu, Nanjing[J]. Journal of Agro-Environment Science, 2016, 35(3): 540–547. DOI:10.11654/jaes.2016.03.018 |
| [25] |
严文逸, 王绍祥, 顾静, 等. 青草沙水库浮游藻类群落组成及其与环境因子的关系[J].
上海海洋大学学报, 2017, 26(1): 75–84.
DOI:10.12024/jsou.20160501776 YAN W Y, WANG S X, GU J, et al. Composition of planktonic algae community and its relationship with environmental factors in Qingcaosha Reservoir[J]. Journal of Shanghai Ocean University, 2017, 26(1): 75–84. DOI:10.12024/jsou.20160501776 |
| [26] |
汤佩武. 鱼-菜共生与生物絮团水质调控技术在西北盐碱池塘的应用研究[D]. 兰州: 甘肃农业大学, 2014.
TANG P W. Research on the fish-vegetable co-exiting and Bio-Floc water purification technology application in saline-alkaline ponds in the northwest China[D]. Lanzhou: Gansu Agricultural University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10733-1015021456.htm |
| [27] |
潘利平. 水源地生态净化模拟实验对浮游植物群落结构的影响[D]. 上海: 上海师范大学, 2016.
PAN L P. Effects of ecological purification simulation experiment in water sources on phytoplankton community structure[D]. Shanghai: Shanghai Normal University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10270-1016126310.htm |
| [28] |
赵巧玲. 植物浮床对精养池塘水质及浮游藻类群落结构的效应[D]. 武汉: 华中农业大学, 2010.
ZHAO Q L. Effects of plant floating beds on water quality and phytoplankton community structure in intensive culture ponds[D]. Wuhan: Huazhong Agricultural University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010609.htm |
| [29] |
刘娅琴, 邹国燕, 宋祥甫, 等. 框式复合型生态浮床对富营养水体浮游植物群落结构的影响[J].
水生生物学报, 2010, 34(1): 196–203.
LIU Y Q, ZOU G Y, SONG X F, et al. Effect of a new ecological floating bed system (EFBS) on phytoplankton community in eutrophicated water[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 196–203. |
| [30] |
刘娅琴, 邹国燕, 宋祥甫, 等. 富营养水体浮游植物群落对新型生态浮床的响应[J].
环境科学研究, 2011, 24(11): 1233–1241.
LIU Y Q, ZOU G Y, SONG X F, et al. Response of phytoplankton community to a new ecological floating bed system (EFBS) in enclosures with eutrophicated water[J]. Research of Environmental Sciences, 2011, 24(11): 1233–1241. |
| [31] | GLIWICZ Z M. On the different nature of top-down and bottom-up effects in pelagic food webs[J]. Freshwater Biology, 2002, 47(12): 2296–2312. DOI:10.1046/j.1365-2427.2002.00990.x |
| [32] | SCHNETZER A, CARON D A. Copepod grazing impact on the trophic structure of the microbial assemblage of the San Pedro Channel, California[J]. Journal of Plankton Research, 2005, 27(10): 959–971. DOI:10.1093/plankt/fbi049 |
| [33] | QUEIMALIOS C P, MODENUTTI B E, BALSEIRO E G. Phytoplankton responses to experimental enhancement of grazing pressure and nutrient recycling in a small Andean lake[J]. Freshwater Biology, 1998, 40(1): 41–49. DOI:10.1046/j.1365-2427.1998.00326.x |
| [34] |
孟顺龙, 陈家长, 胡庚东, 等. 太湖蠡湖浮游植物群落特征及其对水质的评价[J].
长江流域资源与环境, 2010, 19(1): 30–36.
MENG S L, CHEN J Z, HU G D, et al. Phytoplankton community characteristics and its eco-assessment on water quality in Lihu Lake, Taihu Lake[J]. Resources and Environment in the Yangtze Basin, 2010, 19(1): 30–36. |
2. Wuxi Fishery College, Nanjing Agricultural University, Wuxi 214081, Jiangsu, China
 2018,
Vol. 27
2018,
Vol. 27


