2. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306;
3. 上海海洋大学 水产科学国家级实验教学示范中心, 上海 201306
草鱼(Ctenopharyngodon idella)为我国主要淡水养殖品种,占全国鱼类养殖产量首位。草鱼出血病自20世纪70年代至今仍在长江中下游暴发流行,波及全国,年死亡损失超过30%,严重危害草鱼养殖业的发展[1-4]。草鱼呼肠孤病毒(Grass carp reovirus, GCRV)是草鱼出血病的主要病原。草鱼来源的呼肠孤病毒为双链RNA病毒,隶属水生呼肠孤病毒属,呼肠孤病毒科。病毒由核酸基因组和蛋白质衣壳组成。与其他无囊膜病毒类似,核酸基因组为病毒增殖和遗传变异提供信息,衣壳则保护核酸免受外界因素影响和破坏,并负责介导病毒侵染靶组织和协助病毒进入细胞内部。草鱼呼肠孤病毒毒株较复杂,至今还没在血清学上对其进行分类,但通过对现有流行毒株的分离及序列信息分析,目前存在Ⅰ型、Ⅱ型和Ⅲ型3个基因型[5]。其中,Ⅰ型主要有GCRV873,096,875,876,991株等,之间同源性约为72.5%至99.7%[5],Ⅱ型主要有HZ08,GD108,JX02,9014,106等,Ⅲ型主要有104,HB1007等。但草鱼Ⅱ型GCRV作为主要流行毒株[6],其致病机制仍不清楚,并且Ⅱ型GCRV与Ⅰ、Ⅲ型在基因组序列、鱼体致病力、细胞病变等方面差异较大[7-11]。当前已完成Ⅱ型GCRV部分毒株的基因组测序工作[10-11],但其编码蛋白质的功能研究尚为空白。JX02是本实验室保存的一株Ⅱ型GCRV病毒,与Ⅱ型代表株HZ08有着极高的同源性[12]。
Ⅱ型GCRV共编码12种蛋白,包括2种非结构蛋白和9种结构蛋白。对于其基因编码蛋白的功能和作用只能根据分子生物信息学分析及与其他已知基因或蛋白的比较来推测[10]。S7编码的VP56与Ⅲ型GCRV-104 VP55蛋白同源性达到15.1%,且与VP55的分子质量非常接近,亲水性相似,据推测其为参与细胞吸附作用的外纤维蛋白,参与病毒和细胞的吸附过程[13]。
本实验室运用酵母双杂交技术筛选了与VP56蛋白相互作用的宿主蛋白,并且验证了VP56蛋白与GCJAM-A蛋白无相互作用[14]。Fibulin蛋白是筛选出的唯一一个胞外基质蛋白,而且与Ⅰ型GCRV的VP7,Ⅲ型GCRV的VP55均能相互作用[15]。有研究发现,杆状病毒表达Ⅰ型GCRV的VP6与VP7感染蚕蛹所制备的冻干粉作为草鱼口服疫苗,可能会对GCRV有良好的免疫效果[16]。然而还没有对Ⅱ型GCRV蛋白进行真核表达等相关研究。本研究计划克隆位于病毒S7基因组片段上的VP56基因编码序列,构建原核表达质粒pGEX-4T-3-VP56与真核表达质粒pFastBacHTA-VP56,分别在大肠杆菌及昆虫细胞中研究相应重组蛋白的表达情况,为进一步研究VP56蛋白的功能及在体内体外验证病毒与草鱼细胞的相互作用奠定基础。
1 材料与方法 1.1 试验材料GCRV-JX02W毒株由本实验室分离保存,CIK细胞、pGEX-4T-3 Vector由本实验室保存,DH5α,BL21(DE3)购自天根生物有限公司,大肠杆菌DH10Bac感受态(自己制备),Trizol Reagent、Cellfectin® Ⅱ Reagent、pFastBacHTA Vector、昆虫细胞SF9及其培养基Sf-900TM Ⅲ SFM,转染培养基Grace′s Insect Medium(unsupplemented)均购自Invitrogen。Pyrobest Polymerase、PrimeScriptTM Ⅱ1st Strand cDNA Synthesis Kit、PrimeSTAR® Max DNA Polymerase、His60 Ni Superflow Resin、限制性内切酶,T4连接酶均购自TaKaRa公司。6周龄ICR小鼠购自上海实验动物研究中心。卡那霉素,庆大霉素,四环素,X-gal均购自上海生工有限公司。IPTG,HRP标记的羊抗鼠IgG等蛋白相关试剂购自上海威奥生物科技有限公司;Anti-His Tag Mouse Monoclonal Antibody购自Proteintech。
1.2 试验方法 1.2.1 引物设计与合成使用Primer Premier 5.0软件设计引物(表 1),送至上海生物工程有限公司合成。

|
表 1 引物序列 Tab.1 Primers used in the present study |
用TrizoL法提取感染JX02W毒株的CIK总RNA,用PrimeScriptTM Ⅱ1st Strand cDNA Synthesis Kit试剂盒将所提取的总RNA反转录成cDNA以此为模板,分别以pGEX-4T-3-VP56F与pGEX-4T-3-VP56R为引物,以pFastBacHTA-VP56F与pFastBacHTA-VP56R为引物扩增,PCR条件如下:94 ℃预变性3 min,(94 ℃ 30 s,61.1 ℃ 30 s,72 ℃ 2 min)35 cycles,72 ℃ 10 min,用Wizard@ SV Gel and PCR Clean-Up System试剂盒对PCR产物目的片段纯化回收。
用BamH Ⅰ和XhoⅠ限制性内切酶将pGEX-4T-3(pFastBacHTA)和回收的S7片段进行双酶切处理,用T4 DNA连接酶将纯化的目的片段分别与酶切好的pGEX-4T-3(pFastBacHTA)空质粒进行连接,体系为16 ℃,连接12 h,T4 Liqase 1 μL,T4 Liqase buffer 2.5 μL,空质粒100 ng,目的片段300 ng(400 ng),加灭菌水到25 μL。取连接产物各10 μL分别转化DH5α,各挑取10个单菌落进行PCR验证并测序,取阳性单菌落扩增并提取质粒,标记为pGEX-4T-3-VP56及pFastBacHTA-VP56。
1.2.3 重组质粒pGEX-4T-3-VP56的诱导表达、优化及目的蛋白的纯化将测序正确的pGEX-4T-3-VP56质粒转化BL21(DE3),挑取平板上菌落接种到含Amp+LB培养基37 ℃过夜活化。将活化的过夜培养物转移到新鲜的含Amp+ LB培养基,37 ℃,190 r/min,恒温振荡培养3 h。加入IPTG进行诱导,设置0、0.1、0.3、0.5、0.7 mmol/L 5个梯度,诱导4 h后收集表达细菌,4 ℃,8 000 r/min离心20 min;沉淀用蒸馏水洗涤两次,用1×PBS重悬沉淀,超声波破碎至溶液澄清。4 ℃,8 500 r/min离心20 min后收集上清和沉淀,利用SDS-PAGE分析原核表达GST-VP56蛋白的可溶性。
在优化条件下大量诱导表达GST-VP56,用尿素溶液重悬沉淀(4 ℃摇床20 min),配制2,4,6 mol/L尿素洗去杂蛋白,各洗两次,每次洗涤完后4 ℃ 8 500 r/min离心20 min,收集沉淀,最后用8 mol/L尿素重悬沉淀,洗脱液采用Bradford法测其浓度,蛋白分装后放在-80 ℃保存。
1.2.4 VP56的多克隆抗体制备及特异性分析从-80 ℃冰箱取出纯化的蛋白。用纯化的蛋白免疫小鼠,200 μg/只,共免疫4次。第1次采用腹腔内注射,rVP56与弗氏完全佐剂按1: 1混匀呈乳化状态后注射。2周后的第2次注射仍采用腹腔注射,与弗氏不完全佐剂充分1: 1混匀后注射。第3次免疫在第2次免疫一周后进行,皮下注射不加佐剂的纯抗原。1周后可以采取第4次免疫,注射条件同第3次。在第4次免疫一周后,眼角取血,血液放置37 ℃1 h,4 ℃过夜。第二天5 000 r/min离心10 min收集血清,分装每管50 μL,-80 ℃保存,一管4 ℃备用。检验多抗血清的效果,用纯化的rVP56上样,Western blot检测VP56多抗血清的特异性。将转好的PVDF膜在含5%牛奶的PBST溶液室温震荡孵育2 h,用制备的VP56多抗血清作为一抗(1: 3 000)室温震荡孵育1 h后4 ℃过夜,PBST洗3次,每次5 min。再用羊抗鼠的IgG作二抗(1: 3 000)室温震荡孵育3 h,PBST洗3次,每次5 min,最后将PVDF膜置于DAB溶液里显色,用ddH2O终止反应。
1.2.5 重组质粒pFastBacHTA-VP56的转座及杆粒的提取、鉴定复苏实验室冻存的DH10Bac菌,制备DH10Bac感受态。将pFastBacHTA-VP56质粒转化DH10Bac感受态,涂布于50 μg/mL卡那霉素,7 μg/mL庆大霉素,10 μg/mL四环素,100 μg/mL X-gal,40 μg/mL IPTG的LB琼脂板,于37 ℃,培养48 h。之后挑取白斑在以上平板上划线纯化,24 h后挑取白斑放入含50 μg/mL卡那霉素,7 μg/mL庆大霉素,10 μg/mL四环素的LB液体培养基中过夜培养,使用PureLinkTM Hipure提取杆粒DNA。使用引物pUC/M13 F(5′-CCCAGTCACGACGTTGTAAAACG-3′)、R(5′-AGCGGATAACAATTTCACACAGG-3′),对杆粒DNA进行扩增,PCR反应体系:模板1 μL,引物各1 μL,PrimeSTAR Max Premix(2×)25 μL,无菌水22 μL。反应条件为93 ℃预变性3 min,(94 ℃ 45 s,55 ℃ 45 s,72 ℃ 5 min) 35 cycles,72 ℃ 7 min。
1.2.6 杆粒DNA转染昆虫细胞及Western Blot检测重组蛋白使用转染试剂Cellfectin® Ⅱ Reagent,于六孔板转染昆虫细胞,细胞存活率大于95%,密度为1.5×106~2.5×106,转染条件为每孔细胞数量8×105个,杆粒DNA 1 μg和Cellfectin® Ⅱ Reagent 8 μL。取8 μL Cellfectin® Ⅱ Reagent稀释于100 μL不含抗生素的Grace培养基混匀,放置10 min,取1 μL杆粒DNA稀释于100 μL不含添加剂的Grace培养基混匀,将稀释的Cellfectin® Ⅱ Reagent与稀释的DNA混匀,室温孵育30 min,逐滴加入六孔板。27 ℃孵育3~5 h,吸出转染混合物,换以新鲜2 mL Sf-900TM Ⅲ SFM培养基。27 ℃孵育72 h后,每天观察细胞。
运用His60 Ni Superflow Resin纯化His-VP56蛋白,纯化后的蛋白溶液采用Bradford法测其浓度,蛋白分装-80 ℃保存。用Anti-His单抗作为一抗,HRP标记的羊抗鼠的IgG作二抗进行Western blot分析。
2 结果 2.1 S7基因ORF的扩增及pGEX-4T-3-S7和pFastBacHTA-S7的构建提取感染JX02W毒株的CIK总RNA,用PrimeScriptTM Ⅱ1st Strand cDNA Synthesis Kit试剂盒将所提取的总RNA反转录成cDNA,以此cDNA作为模板,克隆进pGEX-4T-3与pFastBacHTA载体上。PCR扩增出约1 539 bp条带,大小和VP56基因大小相同(图 1)。质粒测序结果表明pGEX-4T-3-S7与pFastBacHTA-S7均构建成功。
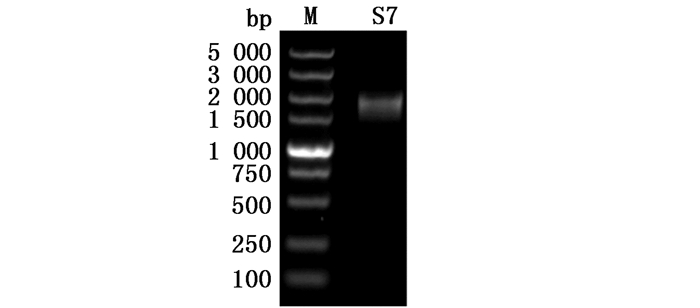
|
图 1 S7基因PCR扩增电泳图
Fig. 1 Electrophoretic profile of PCR products of S7 gene
M.marker 5 000 |
SDS-PAGE结果显示,经IPTG诱导的菌体沉淀相比未经IPTG诱导的对照菌在83 ku有一条明显的目的条带(图 2)。目的蛋白几乎全部存在于沉淀中。SDS-PAGE结果对比发现,使用IPTG 0.1~0.7 mmol/L诱导,目的条带均比较明显,且IPTG浓度的提高对目的蛋白的表达没有明显变化,所以将IPTG诱导浓度定为0.1 mmol/L(图 3)。纯化后的重组蛋白rVP56,80%溶解在8 mol/L的尿素里,用Bradford蛋白质定量法测定其浓度约2.4 mg/mL。rVP56纯化后几乎没有了杂带(图 4)。
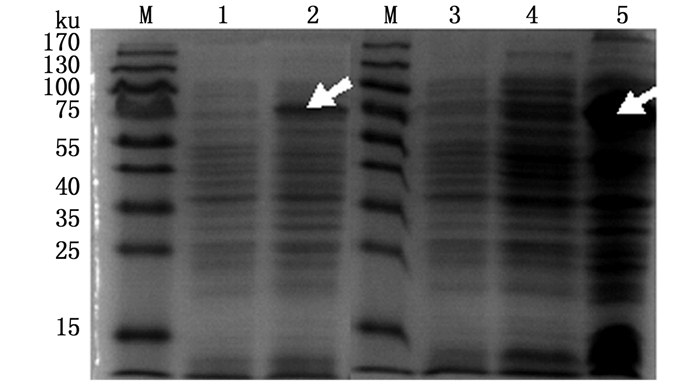
|
图 2 重组蛋白rVP56的诱导表达及可溶性分析
Fig. 2 Induced expression and solubility analysis of rVP56 protein
M.蛋白质标准物质;1, 3.未诱导细菌沉淀;2.诱导细菌沉淀;4.诱导细菌超声破碎后的上清;5.诱导细菌超声破碎后的沉淀 M. protein marker; 1, 3. the precipitate of uninduced bacterial control; 2. the precipitate of induced bacterial control; 4. the supernatant of induced bacteria after ultrasonic; 5. the precipitate of induced bacteria after ultrasonic |
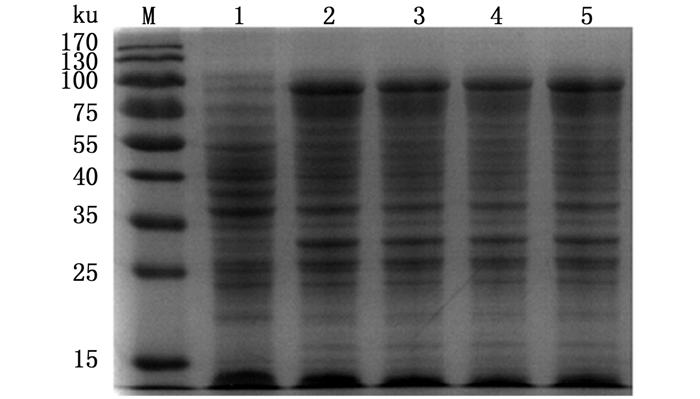
|
图 3 不同浓度IPTG对rVP56的诱导效果
Fig. 3 Effect of IPTG concentration on the expression of rVP56
M.蛋白质标准物质;1.未诱导菌体的沉淀;2. 0.1 mmol/L浓度诱导的菌体沉淀;3. 0.3 mmol/L浓度诱导的菌体沉淀;4. 0.5 mmol/L浓度诱导的菌体沉淀;5. 0.7 mmol/L浓度诱导的菌体沉淀 M. protein marker; 1. the precipitate of uninduced bacteria; 2. the precipitate of bacteria induced by 0.1 mmol/L IPTG; 3. the precipitate of bacteria induced by 0.3 mmol/L IPTG; 4. the precipitate of bacteria induced by 0.5 mmol/L IPTG; 5. the precipitate of bacteria induced by 0.7 mmol/L IPTG |
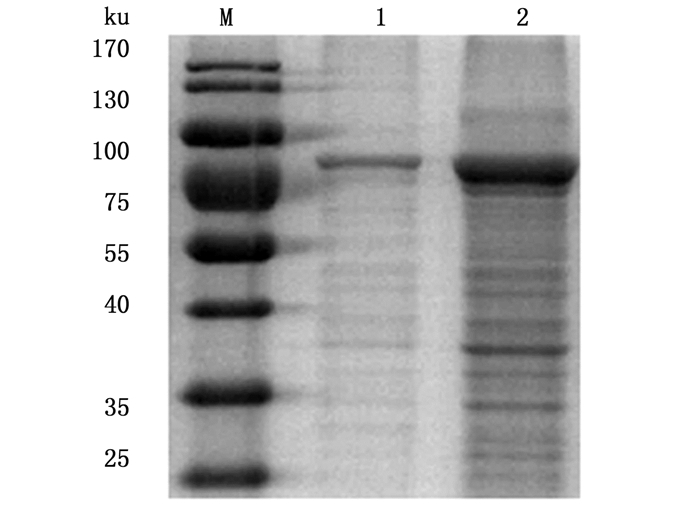
|
图 4 rVP56纯化产物的SDS-PAGE分析
Fig. 4 SDS-PAGE of purified rVP56
M.蛋白标准物质;1.纯化后的样品;2. 0.1 mmol/L浓度诱导的沉淀 M. protein marker; 1. purified sample; 2. the precipitate of bacteria induced with 0.1 mmol/L |
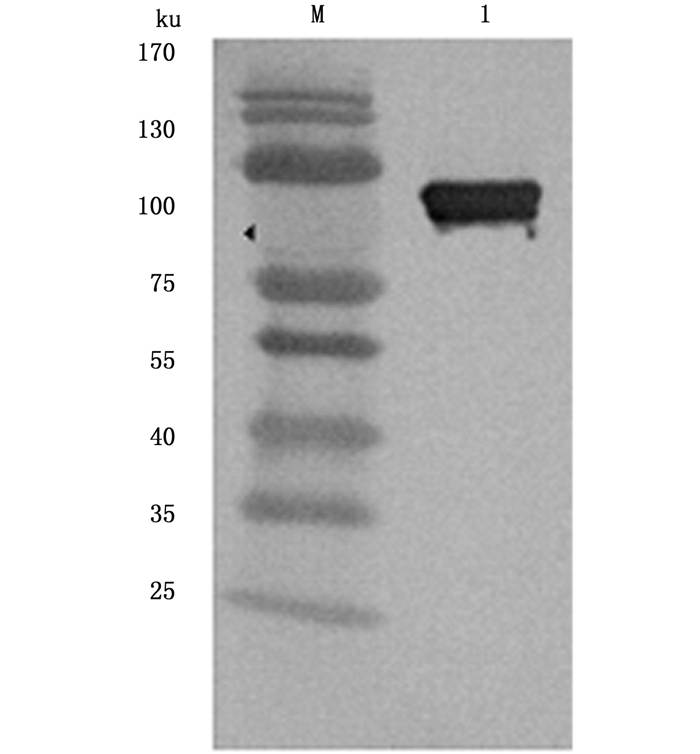
Western blot结果显示,rVP56样品中出现了大小约为83 ku的目的条带(图 5);制备的anti-VP56多克隆抗体与重组蛋白rVP56产生特异性免疫反应。
|
图 5 Western-blot检测rVP56重组蛋白
Fig. 5 Western-blot detection of rVP56
M.Marker;1. rVP56重组蛋白 M.protein marker; 1.recombinant protein rVP56 |
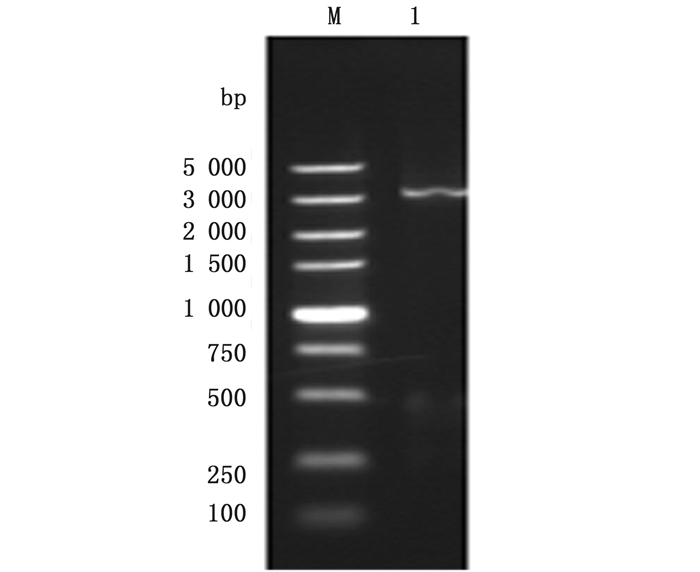
以PureLinkTM Hipure试剂盒提取杆粒DNA为模板,对杆粒DNA进行扩增,PCR反应体系:模板1 μL,引物各1 μL,PrimeSTAR Max Premix(2×)25 μL,无菌水22 μL。反应条件为93 ℃预变性3 min,(94 ℃ 45 s,55 ℃ 45 s,72 ℃ 5 min)35 cycles,72 ℃ 7 min。PCR产物经过电泳显现为约4 000 bp特异性条带,大小和预期相同(图 6)。
|
图 6 杆粒DNA扩增电泳图
Fig. 6 Electrophoretic profile of PCR products of recombinant bacmid DNA
M.标准物质5 000 M.marker 5 000 |
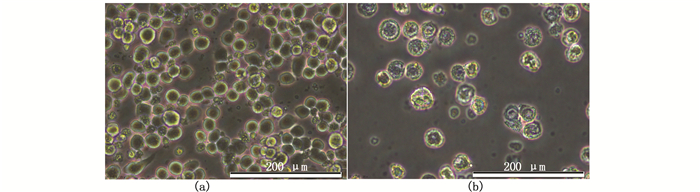
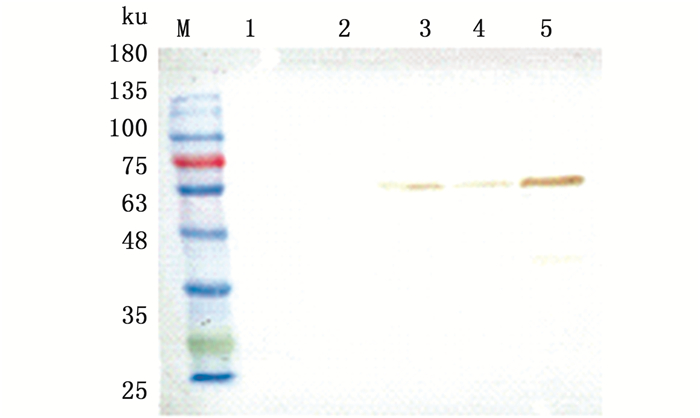
按照Bac-to-bac杆状病毒表达系统用户手册于六孔板转染昆虫细胞,设置一个未转染的对照,27 ℃下孵育细胞72 h,每天观察细胞。自转染后96 h,发现细胞核体积比对照组稍变大,细胞生长停滞,呈囊泡状(图 7)。将六孔板每孔细胞刮下于离心管,1 000 r/min离心5 min,采用0.22 μm滤膜过滤病毒上清液。细胞沉淀加入2×SDS loading buffer 30 μL,100 ℃煮沸5 min,12 000 r/min离心10 min,取上清制样,取少量病毒上清反复冻融后制样,Western结果显示,表达了重组蛋白VP56,大小约为62 ku,为可溶蛋白。大量表达His-VP56,使用His60 Ni Superflow Resin纯化His-VP56蛋白制样(图 8)。
|
图 7 昆虫细胞的感染现象
Fig. 7 Signs of infection
a.正常SF9细胞;b.杆粒转染的SF9细胞(转染后96h)
a. Normal SF9 cell; b. SF9 cell transfected by bacmid(96 h after transfection) |
|
图 8 His-VP56的Western Blot分析
Fig. 8 Western Blot Analysis of His-VP56
M.蛋白标准物质;1.正常SF9细胞;2-3.不同杆粒转染的SF9细胞;4.病毒上清;5.纯化后的VP56 M. protein marker; 1. Normal SF9 cell; 2-3. SF9 cell transfected by different bacmids; 4.Virus supernatant; 5.VP56 after purification |
Ⅰ型GCRV被最早发现,长期以来国内将其视为模式毒株并开展深入研究[17]。和永杏等对Ⅰ型GCRV-JX01外衣壳蛋白VP5和VP7作为亚单位疫苗的疫苗蛋白原的免疫保护性进行了研究,表明VP7与VP5抗血清均能特异性中和GCRV病毒粒子,能有效阻止病毒的感染[18-19]。有研究表明,使用杆状病毒表达系统在蚕体表达的VP7蛋白可作为草鱼口服蛋白疫苗,重组的病毒可作为VP6核酸疫苗[16]。而Ⅱ型GCRV毒株(HZ08、GD108、106、109、918和HuNan794)等最近几年才被陆续报道,王杭军等对GD108株VP5蛋白进行了原核表达及免疫原性研究,首次发现其VP5蛋白可诱导草鱼产生高滴度的抗体,但不能为草鱼提供抗GCRV感染下免疫保护[20-21]。本实验室宗乾坤等[22]对GCRV-JX02株外衣壳蛋白VP4、VP35蛋白进行了研究,为GCRV主要流行株血清学检测方法的建立奠定了基础。苏岚等[23]对Ⅲ型GCRV104株VP6蛋白进行了毕赤酵母表达,使表达的蛋白免受蛋白酶的降解。
本研究对Ⅱ型GCRV的S7基因编码的VP56蛋白进行了体外表达。首先采用了最经典的大肠杆菌原核表达系统,构建了pGEX-4T-3-VP56原核表达载体,表达GST-VP56融合蛋白。遗憾的是表达的蛋白质形成了不溶的包涵体,于是使用尿素梯度重悬混匀处理的方法,获得了浓度为2.4 mg/mL的GST-VP56融合蛋白,大小约为83 ku。并用纯化的蛋白免疫小鼠获得了抗VP56的多克隆抗体。于是采用本实验室常规的Bac-to-Bac重组杆状病毒构建技术,尝试运用杆状病毒表达系统在昆虫细胞内表达VP56蛋白。把VP56基因克隆至pFastBacHTA载体上,用自己制备的大肠杆菌DH10Bac感受态转化,涂布卡那,庆大霉素,四环素的三抗LB平板,提取重组杆粒,转染昆虫细胞。待细胞出现明显病变现象时,收集细胞及分离病毒上清,Western blot结果显示,转染杆粒的细胞与其P1病毒上清均成功表达了His-VP56蛋白,大小与预计相同,约为62 ku,为可溶蛋白,并运用His60 Ni Superflow Resin纯化试剂盒纯化His-VP56蛋白,浓度约为1.5 mg/mL。
本实验体外表达了Ⅱ型GCRV外层衣壳上的突起蛋白VP56,运用大肠杆菌原核表达系统和杆状病毒真核表达系统获得了不同形式纯化的蛋白,其中大肠杆菌表达的蛋白制作了抗VP56多克隆抗体为其免疫原性研究提供了实验材料,昆虫细胞表达的可溶性蛋白为研究其自身生物功能和进一步研究病毒与草鱼宿主细胞蛋白相互作用以及研究基于杆状病毒表达载体的GCRV新型基因工程疫苗奠定了基础。
| [1] |
张超, 王庆, 石存斌, 等. 草鱼呼肠孤病毒HZ08株的分离与鉴定[J]. 中国水产科学, 2010, 17(6): 1257-1263. ZHANG C, WANG Q, SHI C B, et al. Isolation and identification of a grass carp reovirus isolate GCRV HZ08[J]. Journal of Fishery Sciences of China, 2010, 17(6): 1257-1263. |
| [2] |
王方华, 李安兴. 草鱼病毒性出血病研究进展[J]. 南方水产科学, 2006, 2(3): 66-71. WANG F H, LI A X. Advances in research of hemorrhage of grass carp[J]. South China Fisheries Science, 2006, 2(3): 66-71. |
| [3] |
马贵华, 陈道印, 刘六英, 等. 草鱼出血病的免疫学研究进展[J]. 渔业现代化, 2008, 35(1): 45-49. MA G H, CHEN D Y, LIU L Y, et al. The study situation of the immunology of Grass carp's Toxic Bleeding Disease[J]. Fishery Modernization, 2008, 35(1): 45-49. |
| [4] |
ZHANG Q Y, RUAN H M, LI Z Q, et al. Detection of Grass Carp Hemorrhage Virus (GCHV) from Vietnam and comparison with GCHV strain from China[J]. High Technology Letters, 2003, 9(2): 7-13. |
| [5] |
WANG Q, ZENG W W, LIU C, et al. Complete genome sequence of a reovirus isolated from grass carp, indicating different genotypes of GCRV in China[J]. Journal of Virology, 2012, 86(22): 12466. DOI:10.1128/JVI.02333-12 |
| [6] |
曾伟伟, 王庆, 王英英, 等. 草鱼呼肠孤病毒三重PCR检测方法的建立及其应用[J]. 中国水产科学, 2013, 20(2): 419-426. ZENG W W, WANG Q, WANG Y Y, et al. Establishment of multiplex PCR for detection of grass carp reovirus and its application[J]. Journal of Fishery Sciences of China, 2013, 20(2): 419-426. |
| [7] |
RAO Y L, SU J G. Insights into the antiviral immunity against grass carp (Ctenopharyngodon idella) reovirus (GCRV) in grass carp[J]. Journal of Immunology Research, 2015(2): 670437. |
| [8] |
徐洋, 郝贵杰, 沈锦玉, 等. 两株草鱼呼肠孤病毒江西株的分离与鉴定[J]. 淡水渔业, 2010, 40(3): 44-49. XU Y, HAO G J, SHEN J Y, et al. Isolation and identification of two grass carp reovrius strains in Jiangxi province[J]. Freshwater Fisheries, 2010, 40(3): 44-49. |
| [9] |
曾伟伟, 王庆, 刘永奎, 等. 一株草鱼呼肠孤病毒弱毒株的分离、鉴定及免疫原性初步分析[J]. 水生生物学报, 2011, 35(5): 790-795. ZENG W W, WANG Q, LIU Y K, et al. Isolation and identification of new GCRV strain and primary study on its immunogenicity[J]. Acta Hydrobiologica Sinica, 2011, 35(5): 790-795. |
| [10] |
张超. 草鱼呼肠孤病毒HZ08株的分离鉴定与全基因组分子特征分析[D]. 上海: 上海海洋大学, 2010. ZHANG C. Isolation, identification of grass carp reovirus HZ08 and molecular characteristics of its complete genome[D]. Shanghai: Shanghai Ocean University, 2010. |
| [11] |
ZHANG C, WANG Q, SHI C B, et al. Molecular analysis of grass carp reovirus HZ08 genome segments 1-3 and 5-6[J]. Virus Genes, 2010, 41(1): 102-104. DOI:10.1007/s11262-010-0489-0 |
| [12] |
王土, 许丹, 吕利群. 应用dsRNA测序技术检测草鱼呼肠孤病毒的混合感染[J]. 上海海洋大学学报, 2012, 21(5): 756-762. WANG T, XU D, LÜ L Q. Detection of the co-infection of different grass carp reovirus strains using dsRNA sequencing technology[J]. Journal of Shanghai Ocean University, 2012, 21(5): 756-762. |
| [13] |
NIBERT M L, DUNCAN R. Bioinformatics of recent aqua-and orthoreovirus isolates from fish:evolutionary gain or loss of FAST and fiber proteins and taxonomic implications[J]. PLoS One, 2013, 8(7): e68607. DOI:10.1371/journal.pone.0068607 |
| [14] |
喻飞, 王浩, 宗乾坤, 等. 草鱼呼肠孤病毒GCRV VP56相互作用蛋白的鉴定[J]. 水产学报, 2016, 40(3): 371-378. YU F, WANG H, ZONG Q K, et al. Screening of potential host proteins interacting with VP56 of type Ⅱ grass carp reovirus by yeast two-hybrid system[J]. Journal of Fisheries of China, 2016, 40(3): 371-378. |
| [15] |
YU F, WANG H, LIU W S, et al. Grass carp Ctenopharyngodon idella Fibulin-4 as a potential interacting partner for grass carp reovirus outer capsid proteins[J]. Fish & Shellfish Immunology, 2015, 48: 169-174. |
| [16] |
LIU B, GONG Y C, LI Z, et al. Baculovirus-mediated GCRV vp7 and vp6 genes expression in silkworm and grass carp[J]. Molecular Biology Reports, 2016, 43(6): 509-515. DOI:10.1007/s11033-016-3984-0 |
| [17] |
ATTOUI H, FANG Q, JAARAR M F, et al. Common evolutionary origin of aquareoviruses and orthoreoviruses revealed by genome characterization of Golden shiner reovirus, Grass carp reovirus, Striped bass reovirus and golden ide reovirus (genus Aquareovirus, family Reoviridae)[J]. Journal of General Virology, 2002, 83(8): 1941-1951. DOI:10.1099/0022-1317-83-8-1941 |
| [18] |
HE Y X, XU H X, YANG Q, et al. The use of an in vitro microneutralization assay to evaluate the potential of recombinant VP5 protein as an antigen for vaccinating against Grass carp reovirus[J]. Virology Journal, 2011, 8: 132. DOI:10.1186/1743-422X-8-132 |
| [19] |
HE Y X, YANG Q, XU H X, et al. Prokaryotic expression and purification of grass carp reovirus capsid protein VP7 and its vaccine potential[J]. African Journal of Microbiology Research, 2011, 5(13): 1643-1648. |
| [20] |
王杭军, 叶星, 田园园, 等. 草鱼呼肠孤病毒GCRV-GD108株VP5蛋白的原核表达[J]. 华中农业大学学报, 2013, 32(2): 97-102. WANG H J, YE X, TIAN Y Y, et al. Prokaryotic expression of GCRV-GD108 VP5 protein[J]. Journal of Huazhong Agricultural University, 2013, 32(2): 97-102. |
| [21] |
王杭军, 叶星, 田园园, 等. 草鱼呼肠孤病毒GCRV-GD108株VP5蛋白功能及免疫原性分析[J]. 水产学报, 2013, 37(1): 109-116. WANG H J, YE X, TIAN Y Y, et al. Analysis of function and immunogenicity of GCRV-GD108 VP5[J]. Journal of Fisheries of China, 2013, 37(1): 109-116. |
| [22] |
宗乾坤, 张也, 吕利群. Ⅱ型草鱼呼肠孤病毒VP4、VP35蛋白多克隆抗体制备及其免疫原性分析[J]. 水产学报, 2016, 40(3): 355-362. ZONG Q K, ZHANG Y, LÜ L Q. Preparation and immunogenicity of polyclonal antibodies against VP4, VP35 protein of type Ⅱ grass carp reovirus[J]. Journal of Fisheries of China, 2016, 40(3): 355-362. |
| [23] |
苏岚, 曾令兵, 周勇, 等. 草鱼呼肠孤病毒VP6蛋白在毕赤酵母中表达的初步研究[J]. 淡水渔业, 2012, 42(6): 38-42. SU L, ZENG L B, ZHOU Y, et al. Preliminary study on the expression of Grass carp reovirus VP6 protein in Pichia pastoris[J]. Freshwater Fisheries, 2012, 42(6): 38-42. |
2. Key Laboratory of Agriculture Ministry for Freshwater Aquatic Genetic Resources, Shanghai Ocean University, Shanghai 201306, China;
3. National Experimental Teaching Demonstration Center for Fishery Sciences, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


