2. 上海申漕特种水产开发公司, 上海 201516
罗氏沼虾(Macrobrachium rosenbergii)具有个体大、肉质好、生长快、易于养殖等优点,是目前我国重要的养殖虾类[1]。经过多年累代人工繁育与养殖,病害增多、个体小型化、生长缓慢、性成熟时间提前、抗病能力下降等可称之为种质退化的现象日渐突出[2-6],尤其是近几年池养罗氏沼虾生长缓慢现象连续多年大面积发生,严重影响了沼虾的养殖生产。引起虾类生长缓慢的原因很多,已有较多文献报道过种质、水质、密度、病害等影响虾类生长:黎东[7]认为水中重金属离子抑制罗氏沼虾的生长;戴习林等[8]认为罗氏沼虾生长与养殖密度密切相关;刘珍等[9]认为EHP引起对虾生长缓慢;朱凝瑜等[10]认为IHHNV造成对虾慢性矮小残缺综合症;刘宝彬等[11]认为EHP、IHHNV能导致对虾生长缓慢。众多虾类疾病中,由白斑综合征病毒(WSSV)、虾肝肠胞虫(EHP)、传染性皮下及造血组织坏死病毒(IHHNV)、诺达病毒(MrNV)和桃拉病毒(TSV)病原引起的疾病不仅影响存活,也影响生长,严重地制约着对虾养殖业的进一步发展, 也可能影响罗氏沼虾的养殖[12-19]。另外,CHAREONTAWEE等[20]采用SSR标记分析了泰国养殖和野生群体遗传多样性,认为养殖群体和野生群体具有相似的相对较高的遗传变异,池养罗氏沼虾的生长表现不应归于遗传变异和近亲繁殖。本文通过调查分析池养罗氏沼虾的生长状况、主要病原感染情况、遗传多样性、水质以及感染WSSV对罗氏沼虾生长存活试验,探讨池养罗氏沼虾生长缓慢的原因,为防止池养罗氏沼虾生长缓慢与健康养殖和繁育提供对策和参考依据。
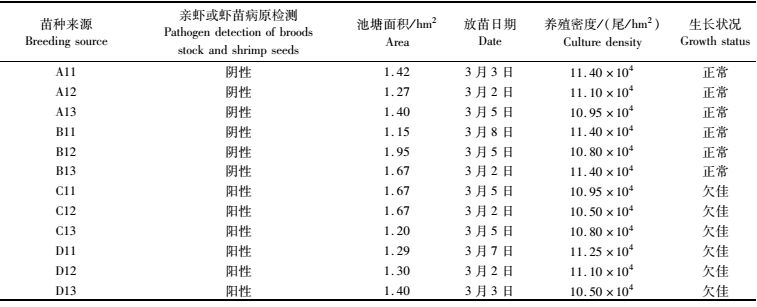
1 材料与方法 1.1 样品采集2016年3月,依据亲虾苗种检测情况在江苏高邮选取虾苗,虾苗分别来源于4家育苗场的12口塘(表 1),在养殖50、100、150 d以及220 d后,撒网或者拉网随机采集沼虾样30~60尾,采水器采集表层底层混合水为该池塘水样,其中部分塘养至200 d左右干塘收虾,虾样品为干塘虾。所有池塘均在养殖至120~130 d期间开始捕大留小销售,后每隔10 d左右轮捕一次,直至9月末10月初干塘收虾,最后依据生长状况和产量将采样塘分为生长正常池塘和生长欠佳池塘两种类型。2014年7月至2015年10月期间,依据养殖期间的生长表现分别对上海、江苏两地养殖中期或干塘收虾前5天的生长正常和生长欠佳池塘采集虾样和水样用于调查分析。沼虾体长采用直尺(0.1 cm)测量,电子天平(225 D, 0.01 g)逐尾称量体质量,现场按常用实验动物解剖病理取材标准[21]解剖获取鳃、肝胰腺、肌肉分别保存于RNAlater保存液和无水乙醇中,实验室-80 ℃保存。
|
表 1 2016年生长状况调查塘概况 Tab.1 The general situation of survey of ponds in growth in 2016 |
感染用罗氏沼虾来源于经两次检疫WSSV、IHHNV、EHP、TSV、MrNV为阴性结果的上海申漕水产开发公司的池塘养殖虾,暂养于室内水泥池7 d,剔除极大极小个体,作为实验用虾,体长(6.76±0.28)cm,体质量(9.63±0.43)g。
1.2.2 实验用水槽试验用水槽为78 cm×58 cm×47 cm的蓝色塑料箱。
1.2.3 WSSV病毒精提液稀释WSSV病毒精提液病毒粒子来源于上海海洋大学食品学院,原浓度1×107 copy/μL,-80 ℃保存,感染前将病毒原液在冰上解冻,用预冷的无菌生理盐水将浓度分别稀释为5×104 copy/μL,1×104 copy/μL,5×103 copy/μL,1×103 copy/μL,5×102 copy/μL和1×102 copy/μL。
1.2.4 感染实验实验组为6个注射浓度组,按设定浓度分别在腹部第二腹节基部肌肉注射病毒液0.2 mL感染WSSV,对照组虾同法注射0.2 mL的生理盐水,不注射为空白组,每组均设4个重复,每个水槽10尾虾。期间每天投配合饲料4次,占体质量的6%~8%,每天排污并换水10%,水温(26.0±1.0)℃,pH为8.0±0.2,连续充气增氧。每天检查记录实验虾存活状况,分别于养殖实验15 d、30 d和45 d,测量体长和体质量,45 d采集虾样品。
1.3 提取DNA和RNADNA提取:取保存于无水乙醇中的肝胰腺和肌肉组织约20 mg,依据海洋动物组织基因组DNA提取试剂盒(天根生化科技有限公司)操作方法提取样品肝胰腺和肌肉组织总DNA,用1%琼脂糖凝胶电泳检测DNA条带完整性,-20 ℃保存。
RNA提取:取保存于RNAlater保存液中的鳃组织约20 mg,依据RNA提取试剂盒(天根生化科技有限公司)提取样品鳃组织总RNA,用1%琼脂糖凝胶电泳检测RNA条带完整性,核酸蛋白测定仪检测RNA吸光度,-80 ℃保存。
1.4 病原检测EHP、IHHNV采用巢氏PCR扩增,WSSV采用荧光定量PCR扩增,TSV、MrNV采用普通PCR扩增。EHP引物来源于东海水产研究所[22],其余引物均为本实验室开发设计,均由上海生物工程技术有限公司合成。用1%的琼脂糖凝胶对PCR扩增产物电泳分离,逐尾检测病原。
1.5 遗传多样性分析参照文献[23]选取25对微卫星引物,分别对不同生长表现类型的池塘样品进行PCR扩增,每口池塘样本数30尾,用8%的聚丙烯酰胺凝胶对PCR扩增产物电泳分离,经银染后, 用扫描仪扫描成像。
1.6 水质分析参考国家环境保护总局水和废水监测分析方法[24]测定DO、pH、总氨氮(TAN)、硝基氮(NO3--N)、亚硝基氮(NO2--N)、活性磷(PO43--P)和化学需氧量(COD)等水质指标。
1.7 数据处理采用Excel 2010、SPSS 17.0对实验数据进行整理,t检验、方差分析处理数据,Duncan氏法均值多重比较,P<0.05表示存在显著性差异,数据以平均值±标准差(Mean±SE)表示。利用Gelpro analyzer 4.5对微卫星标记数据进行读取校正,采用PopGene 3.2、Cervus进行遗传参数分析。特定生长率、肥满度、多态信息含量、有效等位基因数、期望杂合度的计算公式如下:
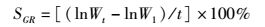 (1)
(1)
式中:SGR为特定生长率(%);t为养殖时间(d);Wt和W1分别为第t天罗氏沼虾体质量和初始体质量(g)。
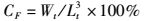 (2)
(2)
式中:CF为肥满度(g/cm3);Wt为第t天罗氏沼虾体质量(g);Lt为第t天罗氏沼虾的平均体长(cm)。
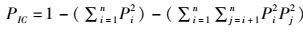 (3)
(3)
式中:PIC为多态信息含量;Pi、Pj分别为第i个和第j个等位基因在群体中的频率;n为某一位点上等位基因数。
 (4)
(4)
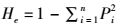 (5)
(5)
式中:Ne为有效等位基因;He为期望杂合度;Pi为第i个等位基因在群体中的频率;n为某一位点上等位基因数。
2 结果 2.1 池养罗氏沼虾生长状况调查塘养殖效果表 2与表 3分别是2016年罗氏沼虾生长状况调查塘养殖期间的部分水质指标和养殖结果。6口生长正常池塘和6口生长欠佳池塘样本数均为180尾。表 2水质数据表明,两类生长状况养殖塘水质指标间均不存在显著性差异(P>0.05)。由表 3知养殖50 d、100 d和150 d时,生长正常罗氏沼虾体长、体质量和肥满度均值均显著高于生长欠佳池塘(P<0.05),体长变异系数显著低于生长欠佳池塘的罗氏沼虾(P<0.05);而养殖220 d左右,两种池塘罗氏沼虾各项生长状况指标间不存在显著性差异(P>0.05),但统计发现生长正常池塘的平均产量显著高于生长欠佳池塘(P<0.05)。

|
表 2 2016年罗氏沼虾生长状况调查塘部分水质指标 Tab.2 The part of water quality of survey of ponds in growth of M. rosenbergii in 2016 |
|
表 3 2016年两类池塘罗氏沼虾的养殖效果 Tab.3 The culture results of M. rosenbergii of two types of ponds in 2016 |
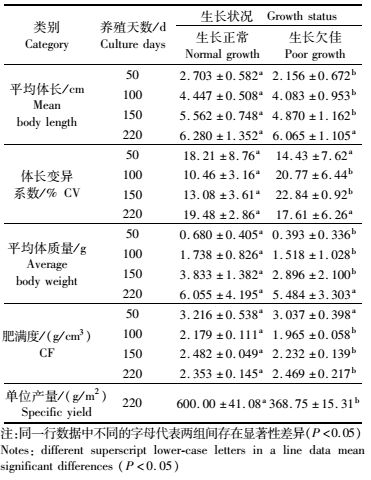
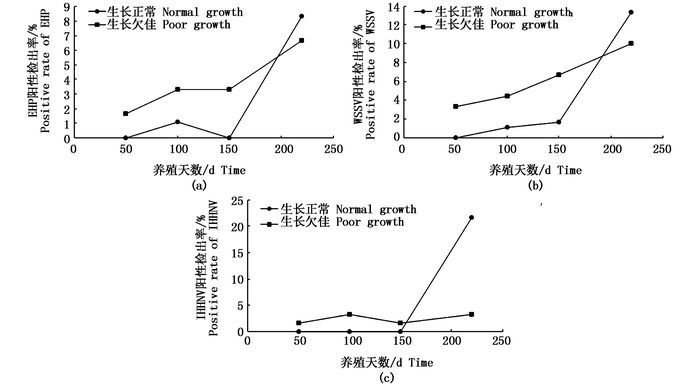
2015年与2016年所有生长状况调查塘中沼虾TSV、MrNV检疫结果均为阴性,而部分虾EHP、WSSV以及IHHNV检疫结果为阳性。经显著性检验,2016年沼虾分别养殖50 d、100 d以及150 d时,6口生长正常池塘180尾罗氏沼虾携带EHP、WSSV以及IHHNV 3种病原阳性检出率均显著低于6口生长欠佳池塘180尾罗氏沼虾(P<0.05),而220 d左右时,两类池塘沼虾携带上述病原的阳性检出率显著高于前3次检疫结果(P<0.05),同时生长正常池塘阳性检出率更高(图 1)。2015年调查塘干塘起捕前病原检测结果(图 2)类似,20口生长正常池塘(样本数200尾)EHP阳性检出率为14%,WSSV阳性检出率为13%,IHHNV阳性检出率为1.5%,均分别高于8口生长欠佳池塘(样本数80尾)的10%、12.5%、1.25%(P>0.05)。另外,生长正常池塘携带1种病原、2种病原沼虾比例均高于生长欠佳池塘(P>0.05,表 4)。
|
图 1 2016年罗氏沼虾生长状况调查塘养殖期间3种病原阳性检出率
Fig. 1 The curve of positive rate of three pathogens of M. rosenbergii in survey of ponds in growth in 2016
|
|
图 2 2015年起捕前罗氏沼虾生长状况调查塘3种病原阳性检出率
Fig. 2 The curve of positive rate of three pathogens of M. rosenbergii in survey of ponds in growth in 2015 before catching
|
|
表 4 2015年调查塘起捕前罗氏沼虾携带病原情况 Tab.4 Results of detection of pathogens of M. rosenbergii in survey of ponds in 2015 before catching |
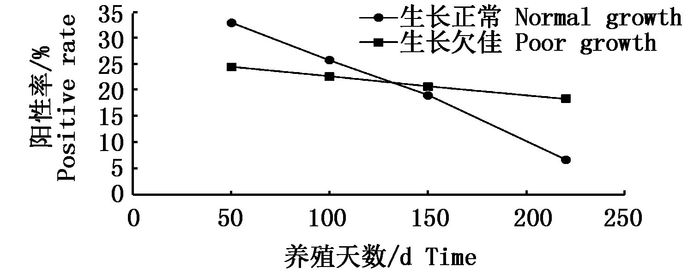
随着养殖天数增加,2016年抽检的两种生长类型池塘罗氏沼虾样品中雄性率均逐步降低,但生长正常池塘雄雌比下降速率高于生长欠佳池塘,在50 d、100 d时生长正常池塘雄雌比高于生长欠佳池塘,150 d后,生长正常池塘雄雌比低于生长欠佳池塘(图 3)。同时表 5数据也表明2015年干塘起捕前,生长正常池塘雄雌性比率均值为1:6.34,同样低于生长欠佳池塘的1:4.32,也即养殖后期生长正常池塘雄虾数量更少,且两种类型池塘中雄虾的3种病原阳性检出率均高于雌虾。
|
图 3 2016年罗氏沼虾生长状况调查塘养殖期间罗氏沼虾雄性率
Fig. 3 The male rate of M. rosenbergii in survey of ponds in growth in 2016
|

|
表 5 2015年调查塘起捕前罗氏沼虾雄雌比率 Tab.5 The sex ratio of M. rosenbergii in survey of ponds in 2015 before catching |
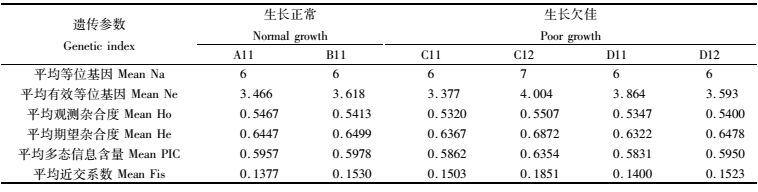
如表 6所示,两种生长类型池塘各遗传参数指标差异不显著(P>0.05),两种生长类型池塘25个微卫星位点平均等位基因介于6~7个之间,平均期望杂合度介于0.632 2~0.687 2之间,平均多态信息含量介于0.583 1~0.635 4之间,多态性较高。
|
表 6 2016年两种生长类型池塘沼虾遗传多样性分析结果 Tab.6 The results of analysis of genetic diversity of M. rosenbergii of two types of ponds in 2016 |
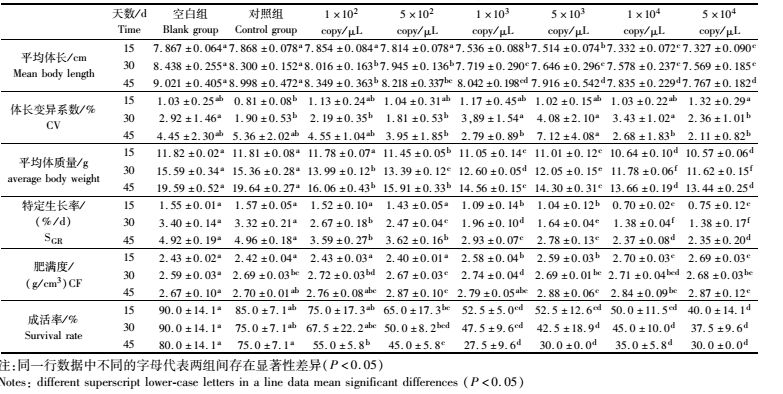
荧光定量检测结果显示感染WSSV 45 d,随着感染浓度的上升,不同组别罗氏沼虾体内WSSV的拷贝数也逐步增加(图 4),说明罗氏沼虾较易感染WSSV。感染15 d、30 d以及45 d,各浓度组(10尾罗氏沼虾)平均体长、平均体质量、成活率、特定生长率和肥满度均存在显著性差异(P<0.05),各项生长状况指标均随着感染浓度的上升逐步降低(表 7)。

|
图 4 人工感染45 d各组罗氏沼虾WSSV拷贝数检测结果
Fig. 4 The detection results of the number of copies of WSSV in different groups of Macrobrachium rosenbergii with artificial infection for 45 days
图中各浓度组均×102copy/μL Each concentration group is multiplied by 102 copy/μL |
|
表 7 不同感染天数各组罗氏沼虾的养殖效果 Tab.7 The culture results of M. rosenbergii of each group for different infection days |
影响虾类生长缓慢的因素很多,如杨世平[25]等认为盐度、饵料影响罗氏沼虾的生长,周梦颖[26]认为温度、盐度对罗氏沼虾生长有显著影响,朱春华等[27]认为环境激素(NP)影响罗氏沼虾的生长。
本文微卫星标记分析得出两种生长类型池塘中沼虾的PIC介于0.583 1~0.635 4之间,按BOTSTEIN[28]提出的标准,PIC>0.5属于高度多态性;许益铵等[29]认为Mean He应该介于0.3~0.8之间才有选育的潜力,本实验两类池塘Mean He介于0.632 2~0.687 2之间,与CHAREONTAWEE等[20]研究的泰国野生和养殖罗氏沼虾Mean He 0.64~0.73相似,说明两类池塘的罗氏沼虾杂合度相对较高,遗传变异较大;结合Fis 0.137 7~0.185 1分析,近交程度较弱,两类池塘种质差异不显著,说明种质差异或退化引起池塘罗氏沼虾生长缓慢的可能性很小。
对比2016年两类池塘中沼虾的3种病原(EHP、IHHNV、WSSV)阳性检出率得出:养殖前150 d生长正常池塘沼虾的阳性检出率显著低于生长欠佳池塘,养殖150 d后两类池塘沼虾的3种病原阳性检出率差异不显著,且生长正常池塘雄虾数量更少。2015年调查塘干塘起捕前结果类似,造成此类结果的原因是初次轮捕时间在130 d左右,后每隔10 d轮捕一次,轮捕时采取捕大留小的生产工艺,罗氏沼虾具有雄性生长速度大于雌性生长速度的生物学特性,因此导致生长正常池塘雄虾数量在150 d后迅速减少,且轮捕后剩余的罗氏沼虾个体小,病原阳性检出率高,由此得出150 d后生长正常池塘沼虾的病原阳性检出率高与捕大留小的生产工艺有关。本实验还证明感染WSSV影响罗氏沼虾的成活率,也影响罗氏沼虾的生长,且感染WSSV达到较高浓度会引起罗氏沼虾的死亡,李晶晶等[30]认为感染WSSV浓度103 copy/μL引起对虾的大量死亡; 刘宝彬[11]人工感染IHHNV认为IHHNV影响对虾的生长存活; 刘珍等[9]认为EHP引起对虾生长缓慢,IHHNV与罗氏沼虾生长缓慢的关系已有相关文献报道[12]。两类池塘的水质指标不存在显著性差异,且两类池塘的水质指标均符合罗氏沼虾养殖的水质需求[31]。据此结合养殖中后期每隔10 d左右捕大留小的生产工艺,认为感染特定病原引起池塘罗氏沼虾生长缓慢的可能性较大,且感染特定病原对雄虾生长的影响大于雌虾。
但本实验仅检测池养罗氏沼虾5种常见病原,其他病原是否影响罗氏沼虾生长尚无文献记载,由此认为池养罗氏沼虾生长欠佳可能与WSSV、IHHNV及EHP 3种病原有关,也可能与其他病原有关,尚需进一步实验证明。本实验于2016年亲虾或虾苗中检测出病原,罗氏沼虾养殖期间也检测出病原,因此养殖的商品虾不宜作为生产虾苗的亲本,需在较高生物安保条件下培育亲本。
| [1] |
杨大伟. 罗氏沼虾养殖存在的问题及关键措施[J].
齐鲁渔业, 2015: 28–29.
YANG D W. Problems and key measures in culture Macrobrachium rosenbergii[J]. Shandong Fisheries, 2015: 28–29. |
| [2] |
张瑞祺. 工厂化循环水处理技术在罗氏沼虾苗种繁育中的应用[D]. 上海: 上海海洋大学, 2015.
ZHANG R Q. Application of recirculating water treatment technology in the breeding of Macrobrachium rosenbergii[D]. Shanghai:Shanghai Ocean University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10264-1015974994.htm |
| [3] |
徐洋, 沈锦玉, 姚嘉赟, 等. 罗氏沼虾主要病害研究概况[J].
生物学杂志, 2012, 29(6): 74–76.
XU Y, SHEN J Y, YAO J Y, et al. Main diseases of the giant fresh water prawn Macrobrachium rosenbergii:a review[J]. Journal of Biology, 2012, 29(6): 74–76. |
| [4] |
刘杰. 患病罗氏沼虾幼体可疑病原核酸随机克隆技术的探索[D]. 上海: 上海海洋大学, 2012.
LIU J. The exploration of random cloning technology for suspicious pathogen nucleic acid in suffering Macrobrachium rosenbergii larvae[D]. Shanghai:Shanghai Ocean University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000351.htm |
| [5] |
董学洪, 陈正兴. 罗氏沼虾养殖中常见病害及防治[J].
水产养殖, 2015, 36(11): 46–48.
DOI:10.3969/j.issn.1004-2091.2015.11.017 DONG X H, CHEN Z X. Common diseases and prevention inculture Macrobrachium rosenbergii[J]. Journal of Aquaculture, 2015, 36(11): 46–48. DOI:10.3969/j.issn.1004-2091.2015.11.017 |
| [6] |
李新伦. 罗氏沼虾螺原体病原微生物的分离和生物学特性研究[D]. 南京: 南京师范大学, 2012.
LI X L. The separation of Macrobrachium rosenbergii spiroplasma pathogen and biology research[D]. Nanjing:Nanjing Normal University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10319-1015569822.htm |
| [7] |
黎东. Cu2+、Zn2+对罗氏沼虾生长以及卵巢发育的影响[D]. 湛江: 广东海洋大学, 2013.
LI D. Effects of growth and ovarian development on Macrobrachium rosenbergii by Cu2+ and Zn2+[D]. Zhanjiang:Guangdong Ocean University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10566-1013225173.htm |
| [8] |
戴习林, 周梦颖, 鞠波, 等. 养殖密度对罗氏沼虾生长、性别分化与性腺发育的影响[J].
水产学报, 2016, 40(12): 1874–1882.
DAI X L, ZHOU M Y, JU B, et al. Effects of stocking density on growth, sexual differentiation and gonad development of Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 2016, 40(12): 1874–1882. |
| [9] |
刘珍, 张庆利, 万晓媛, 等. 虾肝肠胞虫(Enterocytozoon hepatopenaei)实时荧光定量PCR检测方法的建立及对虾样品的检测[J].
渔业科学进展, 2016, 37(2): 119–126.
DOI:10.11758/yykxjz.20150512003 LIU Z, ZHANG Q L, WAN X Y, et al. Development of real-time PCR assay for detecting microsporidian Enterocytozoon hepatopenaei and the application in shrimp samples with different growth rates[J]. Progress in Fishery Sciences, 2016, 37(2): 119–126. DOI:10.11758/yykxjz.20150512003 |
| [10] |
朱凝瑜, 孔蕾, 郑天伦. 2013年浙江省南美白对虾虾苗病毒携带情况分析[J].
浙江农业学报, 2015, 27(5): 756–760.
ZHU N Y, KONG L, ZHENG T L. Analysis on presence of virus in Penaeus vannamei shrimp larvae in Zhejiang Province in 2013[J]. Acta Agriculturae Zhejiangensis, 2015, 27(5): 756–760. |
| [11] |
刘宝彬. 传染性皮下及造血组织坏死病毒(IHHNV)对凡纳滨对虾生长影响及其致病力分析[D]. 上海: 上海海洋大学, 2016.
LIU B B. Infectious hypodermal and hematopoietic necrosis virus and its pathogenicity analysis effect of growth of Litopenaeus vannamei[D]. Shanghai:Shanghai Ocean University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912447.htm |
| [12] | HAZREEN NITA M K, KUA B C, BHASSU S, et al. Detection and genetic profiling of infectious hypodermal and haematopoietic necrosis virus (IHHNV) infections in wild berried freshwater prawn, Macrobrachium rosenbergii collected for hatchery production[J]. Molecular Biology Reports, 2012, 39(4): 3785–3790. DOI:10.1007/s11033-011-1155-x |
| [13] | ARANGUREN L F, HAN J E, TANG K F J. Enterocytozoon hepatopenaei(EHP) is a risk factor for acute hepatopancreatic necrosis disease (AHPND) and septic hepatopancreatic necrosis (SHPN) in the Pacific white shrimp Penaeusvannamei[J]. Aquaculture, 2017, 471: 37–42. DOI:10.1016/j.aquaculture.2016.12.038 |
| [14] | TANG K F J, HAN J E, ARANGUREN L F, et al. Dense populations of the microsporidian Enterocytozoon hepatopenaei(EHP) in feces of Penaeusvannameiexhibiting white feces syndrome and pathways of their transmission to healthy shrimp[J]. Journal of Invertebrate Pathology, 2016, 140: 1–7. DOI:10.1016/j.jip.2016.08.004 |
| [15] | JAROENLAK P, SANGUANRUT P, WILLIAMS B A P, et al. A nested PCR assay to avoid false positive detection of the microsporidian Enterocytozoon hepatopenaei (EHP) in environmental samples in shrimp farms[J]. PLoS One, 2016, 11(11): e0166320. DOI:10.1371/journal.pone.0166320 |
| [16] |
胡文娟, 房文红, 江敏, 等. 淡水养殖凡纳滨对虾IHHNV-WSSV共感染率调查分析及其对免疫相关酶活性的影响[J].
上海海洋大学学报, 2015, 24(5): 685–693.
HU W J, FANG W H, JIANG M, et al. Investigation and analyses of IHHNV-WSSV co-infection in Penaeus vannamei cultured in freshwater and its effects on immune-related enzymes[J]. Journal of Shanghai Ocean University, 2015, 24(5): 685–693. |
| [17] |
夏小明. 对虾WSSV和IHHNV病毒重组酶聚合酶扩增(RPA)快速检测方法的研究[D]. 上海: 上海海洋大学, 2015.
XIA X M. Recombinase polymerase amplification assays for rapid detection of shrimp WSSV and IHHNV[D]. Shanghai:Shanghai Ocean University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10264-1015975057.htm |
| [18] | CAVALLI L S, BATISTA C R, NORNBERG B F S, et al. Natural occurrence of White spot syndrome virusand Infectious hypodermal and hematopoietic necrosis virusin Neohelice granulatacrab[J]. Journal of Invertebrate Pathology, 2013, 114(1): 86–88. DOI:10.1016/j.jip.2013.06.002 |
| [19] | PAZIR M K, AFSHARNASAB M, JAFARI B J, et al. Detection and identification of white spot syndrome virus (WSSV) and infectious hypodermal and hematopoietic necrosis virus (IHHNV) of Litopenaus vannamei from Bushehr and Sistan and Baloochestan provinces (Iran), during 2009-2010[J]. Iranian Journal of Fisheries Sciences, 2011, 10(4): 708–726. |
| [20] | CHAREONTAWEE K, POOMPUANG S, NA-NAKORN U, et al. Genetic diversity of hatchery stocks of giant freshwater prawn (Macrobrachium rosenbergii) in Thailand[J]. Aquaculture, 2007, 271(1/4): 121–129. |
| [21] |
孙祖越. 常用实验动物解剖病理取材图谱[M]. 上海: 上海科学技术出版社, 2007: 5-127.
SUN Z Y. Atlas of anatomy and pathologically removing organ blocks of common laboratory animals[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2007: 5-127. |
| [22] |
周俊芳, 房文红, 周红霞, 等. 一种用于我国养殖对虾虾肝肠胞虫感染早期预警的套式引物及其应用: 中国, CN104928288A[P]. 2015-09-23.
ZHOU J F, FANG W H, ZHOU H X, et al. Nested primer used for early warning of Enterocytozoon hepatopenaei of Chinese cultured shrimps and application of nested primer:China, CN104928288A[P]. 2015-09-23. |
| [23] |
刘洁. 微卫星标记在罗氏沼虾世代和群体间遗传多样性分析的应用[D]. 上海: 上海海洋大学, 2015.
LIU J. The application of diversity analysis of microsatellite markers in genetic generations and populations of Macrobrachium rosenbergii[D]. Shanghai:Shanghai Ocean University, 2015. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=nfsc201502003&dbname=CJFD&dbcode=CJFQ |
| [24] |
国家环保总局. 水和废水监测分析方法[M]. 4版. 北京: 中国环境科学出版社, 2002: 200-284.
State Environmental Protection Administration. Water and wastewater monitoring analysis methods[M]. 4th ed. Beijing: Chinese Environment Science Press, 2002: 200-284. |
| [25] |
杨世平, 丁树军, 孙成波, 等. 饵料和盐度对罗氏沼虾幼虾生长和存活率的影响[J].
热带生物学报, 2014, 5(2): 101–106.
YANG S P, DING S J, SUN C B, et al. Effect of diet and salinity on the growth and survival rate of juvenile shrimps of Macrobrachium rosenbergii[J]. Journal of Tropical Biology, 2014, 5(2): 101–106. |
| [26] |
周梦颖. 养殖密度、盐度和温度对罗氏沼虾性别分化和早期性腺发育的影响[D]. 上海: 上海海洋大学, 2014.
ZHOU M Y. Effect of stocking density, salinity and temperature on sex differentiation and early gonadal development on Macrobrachium rosenbergii[D]. Shanghai:Shanghai Ocean University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014051890.htm |
| [27] |
朱春华, 薛海波, 李郁娇, 等. 壬基酚(NP)对罗氏沼虾幼虾生长和性别分化的影响[J].
水产学报, 2011, 35(3): 365–371.
ZHU C H, XUE H B, LI Y J, et al. Effects of 4-nonylphenol on growth and sex differentiation in Macrobrachium rosenbergii[J]. Journal of Fisheries of China, 2011, 35(3): 365–371. |
| [28] | BOTSTEIN D, WHITE R L, SKOLNICK M, et al. Cons-truction of a genetic linkage map in man using restriction fragment length polymorphisms[J]. American Journal of Human Genetics, 1980, 32(3): 314–331. |
| [29] |
许益铵, 柳敏海, 油九菊, 等. 舟山附近海域3个大黄鱼养殖群体遗传多样性的微卫星分析[J].
浙江海洋学院学报(自然科学版), 2014, 33(2): 140–146.
XU Y A, LIU M H, YOU J J, et al. Genetic analysis of three cultured populations large yellow croaker(Pseudoseiaena crocea Richardson) using microsatellite DNA[J]. Journal of Zhejiang Ocean University (Natural Science), 2014, 33(2): 140–146. |
| [30] |
李晶晶, 李云, 刘红, 等. 感染溶藻弧菌及白斑综合征病毒后凡纳滨对虾不同组织的Toll样受体基因表达变化研究[J].
海洋与湖沼, 2016, 47(2): 476–483.
LI J J, LI Y, LIU H, et al. The expression of toll-like receptors in different tissues of Litopenaeus vannamei after challenges with white spot syndrome virus and Vibrio alginolyticus[J]. Oceanologia et Limnologia Sinica, 2016, 47(2): 476–483. |
| [31] |
刘海春, 董学洪, 刘志国. 罗氏沼虾健康养殖水质调控技术[J].
江苏农业科学, 2011, 39(5): 338–341.
LIU H C, DONG X H, LIU Z G. The healthy aquaculture water quality control technology in Macrobrachium rosenbergii[J]. Jiangsu Agricultural Sciences, 2011, 39(5): 338–341. |
2. Shanghai Shencao Special Fisheries Development Co., Shanghai 201516, China
 2017,
Vol. 26
2017,
Vol. 26


