钝吻黄盖鲽(Pleuronectes yokohama)隶属于鲽形目(Pleuronectiformes),鲽科(Pleruonectidae),黄盖鲽属(Pleuronectes)[1],又名沙盖、沙板等,主要分布在西北太平洋近海岸,为北温带浅海冷水底栖鱼类[2]。其适应的温度范围为2~28 ℃,最适宜的生长温度为16~26 ℃,是一种广温性鱼类。钝吻黄盖鲽属于底栖肉食性鱼类,性情温顺,活动量少且缓慢,喜好集群,具潜沙习性,在光线弱、水质清的海草丛中活动[3]。钝吻黄盖鲽是我国黄、渤海地区拖网作业的重要对象,但近年来由于环境恶化和捕捞过度,其资源正迅速衰减。
呼吸与排泄是鱼类新陈代谢的基本生理活动,也是研究鱼类能量学、鱼类养殖容量和评价鱼类对其所在的生态系统影响的重要内容之一[4]。研究鱼类的排氨和耗氧能力可直接或者间接地反映其生长代谢规律和特点及生理状况[5]。鱼类的耗氧和排氨能力除了受自身的状况影响外,还受体质量、pH、盐度、水温等外部因素的影响[5-9]。目前国内外对于钝吻黄盖鲽的研究较少,主要集中在遗传育种[10],核型分析[11],组织形态学比较[12],抗冻蛋白的提取、分析和测定[13],不同种群的形态学比较[14]等方面。在盐度、温度和体质量对其幼鱼耗氧率及排氨率的影响未见报道。
本文通过研究盐度、温度和质量对钝吻黄盖鲽幼鱼耗氧和排氨能力的影响,旨在探讨这些生境因子改变下钝吻黄盖鲽的生理活动代谢水平变化状况,为工厂化养殖参数的优化提供数据支持。另外,确定代谢强度最低时的生境因子可有助于在钝吻黄盖鲽运输过程中适当增加装运密度或延长运输时间,降低运输成本。
1 材料和方法 1.1 实验材料实验用鱼来自大连海洋大学农业部北方海水增养殖重点实验室自行繁育的钝吻黄盖鲽幼鱼,实验选取健康、无损伤、无病害、活力强的幼鱼作为实验用鱼。实验用水为二级沙滤海水,实验用鱼暂养于长方形水槽(2.0 m×1.2 m×0.8 m)中,养殖过程中每天保证溶氧、饵料充足,每天正常管理吸底、排水、投饵、加水,并观察幼鱼状态做好实验记录,实验用水水温为(13.20±0.50) ℃,溶解氧为8.55±0.35,pH为8.43±0.20,盐度为31.47±0.05。
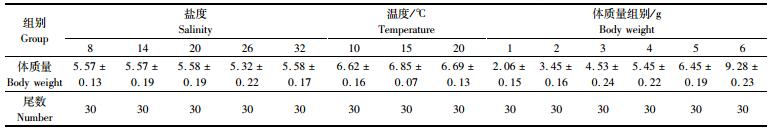
1.2 实验设计实验在方形聚乙烯水槽(30 cm×45 cm×30 cm)中进行,体积约为40 L,盐度分为8、14、20、26和自然海水(盐度约为32)5个盐度梯度组别;温度按照单位区组设计法分为10、15和20 ℃共3个温度梯度组别;不同规格的钝吻黄盖鲽幼鱼分为1、2、3、4、5、6共6个组。分组情况如表 1所示。采用加热棒控制水温。盐度梯度用水来自自然海水和经过24 h充分暴气后的自来水进行调配而成。每个组别设置3个平行组和1个空白对照组,每组放置实验用鱼30尾,实验期间每天每个水槽投日本林兼产业株式会社生产的配合饵料2次(3.94±0.12) g,吸底2次,换水1次。每个组别在处理7 d后测定其耗氧率和排氨率,测定前1 d停止投饵。实验期间做好记录。
|
表 1 钝吻黄盖鲽幼鱼盐度、温度和体质量分组 Tab.1 Classification of Pleuronectes yokohama juvenile by salinity, temperature and body weight |
采用静水密闭式呼吸实验方法,实验每组设置1个呼吸瓶作为空白对照,同时设置3个呼吸瓶作为实验组,每个呼吸瓶体积为500 mL,实验组中每个呼吸瓶放入2尾,经过1.5 h处理后取水样。分别用Winkle碘量法和次溴酸钠氧化法测定耗氧率和排氨率。
1.4 数据计算与处理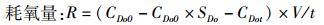 (1)
(1)
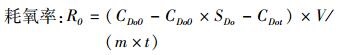 (2)
(2)
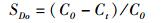 (3)
(3)
式中:R表示耗氧量(mg/h), R0是单位体质量耗氧率[mg/(g·h)];CDo0、CDot表示实验组起始溶氧和经过时间t之后的溶氧量(mg/L);SDo表示空白对照的溶氧浓度变化系数; C0、Ct分别表示空白对照组实验开始和结束时候的溶氧量;V表示呼吸瓶的体积(L);m表示鱼的体质量(g);t表示实验的时间。
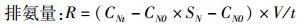 (4)
(4)
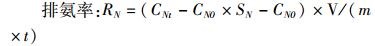 (5)
(5)
 (6)
(6)
式中:R表示排氨量(mg/h),RN是单位体质量排氨率[mg/(g·h)];CNt、CN0表示实验组起始和经过时间t之后的氨氮量(mg/L);SN表示空白对照的氨氮变化系数, C0、Ct分别表示空白对照组实验开始和结束时候的氨氮量;V表示呼吸瓶的体积(L);m表示鱼的体质量(g);t表示实验的时间。
氧氮比:O:N=Ro/RN,幼鱼耗氧与排氨的克原子比值。
温度系数Q10:lg Q10=10×(lg R2-lg R1)/(θ2-θ1),温度系数Q10, 温度每升高10 ℃水生生物呼吸和排泄变化比率。
能量代谢率:Rm=k×Ro, k为氧卡系数(13.56 J/mg, O2)
实验得到的数据用SPSS 20.0软件进行统计与分析。运用单因素方差分析,不满足方差齐性时,对数据进行自然对数或平方根转换,然后采用t检验进行多重比较,P<0.05为有显著性差异,数据以平均数±标准差(Mean±SD)表示。实验结果用Excel 2007绘制成图表。
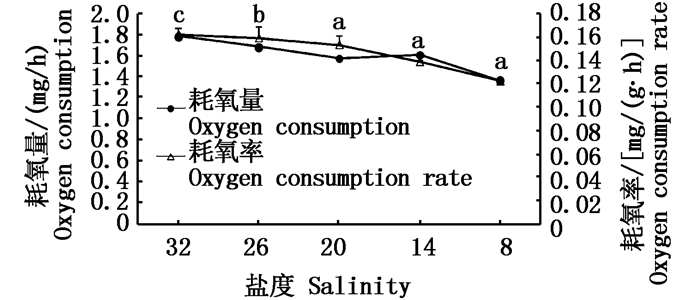
2 结果与分析 2.1 盐度对钝吻黄盖鲽幼鱼耗氧率和排氨率的影响盐度对钝吻黄盖鲽幼鱼耗氧率和耗氧量的影响如图 1所示。随着盐度的降低,耗氧率和耗氧量数值出现递减的变化。由生物统计分析可得出,盐度在32、26和20时,三者之间随着盐度降低耗氧率下降且差异显著(P<0.05),盐度为20、14和8时随着盐度继续下降耗氧率数值呈现继续下降趋势,但差异不显著。
|
图 1 盐度对钝吻黄盖鲽幼鱼耗氧量和耗氧率的影响
Fig. 1 The influence of salinity on oxygen consumption and oxygen consumption rate in P. yokohama juvenile
不同字母表示组间耗氧率差异显著(P<0.05) Different letters showed significant difference among oxygen consumption rate groups |
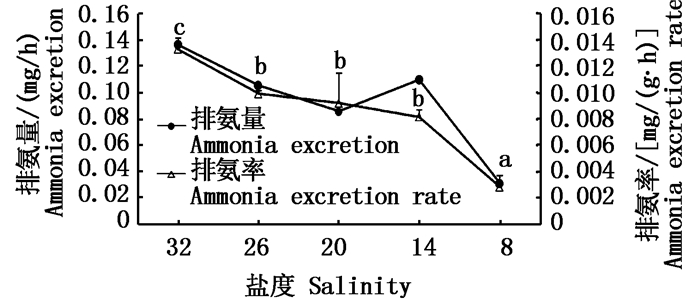
盐度对钝吻黄盖鲽幼鱼排氨率和排氨量的影响如图 2所示。随着盐度的降低,排氨率出现递减变化,排氨量数值上出现一定波动但总体趋势递减。由生物统计分析对排氨率数据处理可得出,盐度为32时和盐度为26、20、14时差异显著(P<0.05),盐度为26、20、14时无显著差异(P>0.05),盐度为8时排氨率与其他各盐度值时差异显著且数值最小(P<0.05)。
|
图 2 盐度对钝吻黄盖鲽幼鱼排氨量和排氨率的影响
Fig. 2 The influence of salinity on ammonia excretion and ammonia excretion rate in P. yokohama juvenile
不同字母表示组间排氨率差异显著(P<0.05) Different letters showed significant difference among ammonia excretion rate groups |
温度对钝吻黄盖鲽幼鱼耗氧率和耗氧量的影响如图 3所示。在该实验条件下,钝吻黄盖鲽幼鱼的耗氧量和耗氧率随温度的增加而呈现递增趋势。由生物统计分析可得到,温度为20 ℃时耗氧率最大,与10 ℃和15 ℃时差异极显著(P<0.01)。10 ℃和15 ℃之间差异显著(P<0.05),温度为10 ℃时数值上更低一些。温度和耗氧率二者之间的关系可以用函数Y= 0.022 5X0.720 1表示,X表示温度,Y表示耗氧率,R2=0.986 5。
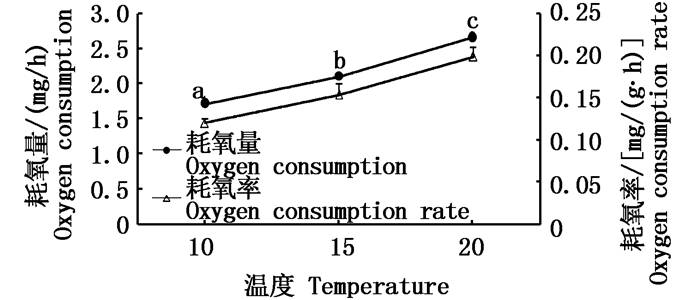
|
图 3 温度对钝吻黄盖鲽幼鱼耗氧量和耗氧率的影响
Fig. 3 The influence of temperature on oxygen consumption and oxygen consumption rate in P. yokohama juvenile
不同字母表示组间耗氧率差异显著(P<0.05) Different letters showed significant difference among oxygen consumption rate groups |
温度对钝吻黄盖鲽幼鱼排氨率和排氨量的影响如图 4所示。在该实验条件下,钝吻黄盖鲽幼鱼排氨量和排氨率同样随温度的递增而增加。温度为20 ℃时排氨率最大,与10 ℃和15 ℃之间差异显著(P<0.05),温度为10 ℃时排氨率最小。15 ℃和20 ℃之间同样差显著(P<0.05)。温度和排氨率二者之间的关系可以用函数Y=0.000 7X1.005 1表示,X表示温度,Y表示排氨率,R2=0.994 2。
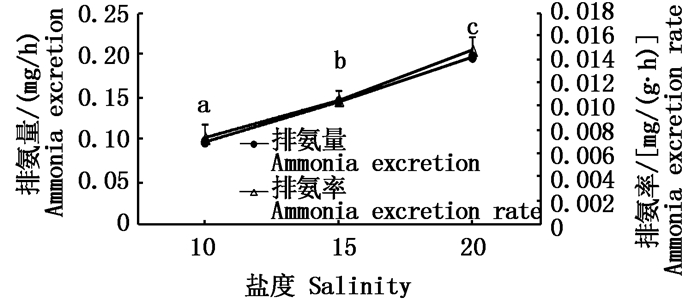
|
图 4 温度对钝吻黄盖鲽幼鱼排氨量和排氨率的影响
Fig. 4 The influence of temperature on ammonia excretion and ammonia excretion rate in P. yokohama juvenile
不同字母表示组间排氨率差异显著(P<0.05) Different letters showed significant difference among ammonia excretion rate groups |
钝吻黄盖鲽幼鱼自身体质量对耗氧率和耗氧量的影响如图 5所示,随着体质量的增加耗氧量在上升,耗氧率则在下降。1组别的幼鱼体质量在(2.06±0.15) g,此时耗氧率最大,但与其他组别间差异极显著(P<0.01)。2与3组别之间无显著差异(P>0.05),但2和3组与4、5、6组之间差异显著(P<0.05)。4与5之间无显著差异(P>0.05)。6组别的耗氧率最低,与其他组别之间差异显著(P<0.05)。体质量和耗氧率二者之间的关系可用函数Y=0.276 9X-0.404表示,X代表自身体质量,Y代表耗氧率,R2=0.955 6。
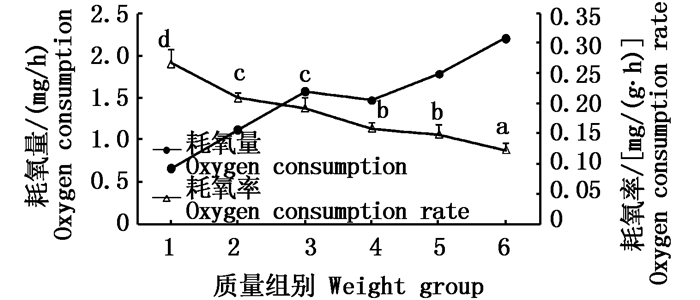
|
图 5 体质量对钝吻黄盖鲽幼鱼耗氧量和耗氧率的影响
Fig. 5 The influence of body weight on oxygen consumption and oxygen consumption rate in P. yokohama juvenile
不同字母表示组间耗氧率差异显著(P<0.05) Different letters showed significant difference among oxygen consumption rate groups |
钝吻黄盖鲽幼鱼自身体质量对排氨率和排氨量的影响如图 6所示,随着体质量增加排氨率递减,排氨量在增加。1组别的幼鱼排氨率最高,与其他组别之间差异极显著(P<0.01)。钝吻黄盖鲽幼鱼各组别之间的排氨率值差异显著(P<0.05)。6组别的排氨率最低。体质量和排氨率二者之间的关系可用函数Y=0.022 3X-0.402表示,X代表体质量,Y代表排氨率,R2=0.950 8。

|
图 6 体质量对钝吻黄盖鲽幼鱼排氨量和排氨率的影响
Fig. 6 The influence of weight on ammonia excretion and ammonia excretion rate in P. yokohama juvenile
不同字母表示组间排氨率差异显著(P<0.05) Different letters showed significant difference among ammonia excretion rate groups |
盐度对钝吻黄盖鲽幼鱼代谢的影响如表 2所示,盐度范围为8~32时,氧氮比的变化范围是44.441~12.278,随着盐度升高其氧氮比在降低,盐度为8时氧氮比为44.441,明显高于其他盐度时的数值。盐度对其能量代谢率的影响与氧氮比的变化有着相反趋势。
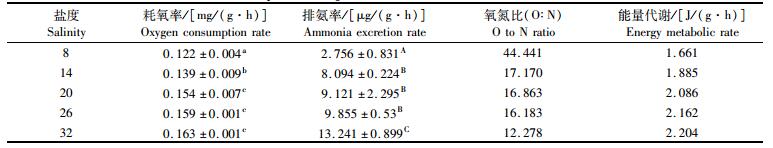
|
表 2 不同盐度下钝吻黄盖鲽幼鱼耗氧率、排氨率、氧氮比(O:N)和能量代谢效率 Tab.2 Energy metabolic rate, oxygen consumption rate, ammonia excretion rate and their ratio(O/N) of P. yokohama juvenile at different salinities |
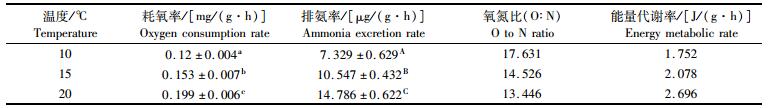
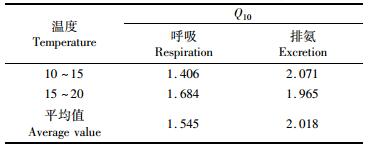
温度对钝吻黄盖鲽幼鱼代谢的影响如表 3和4所示,温度10~20 ℃时,氧氮比的变化范围为13.446~17.631,各温度时氨氮值变化差异不大。钝吻黄盖鲽幼鱼呼吸的Q10范围为1.406~1.684,平均值为1.545;排泄的Q10范围为1.965~2.071,平均值为2.018。温度对其能量代谢率的影响随着温度升高增加,相互之间差异比较显著。
|
表 3 不同温度下钝吻黄盖鲽幼鱼耗氧率、排氨率及氧氮比(O:N)和能量代谢效率 Tab.3 Energy metabolic rate, oxygen consumption rate, ammonia excretion rate and their ratio(O/N) of P. yokohama juvenile at different temperature |
|
表 4 不同温度下钝吻黄盖鲽幼鱼呼吸和排泄的Q10值 Tab.4 The Q10 values of respiration and excretion of P. yokohama juvenile at different temperature |
体质量对钝吻黄盖鲽幼鱼代谢的影响如表 5所示,体质量分布从(2.06±0.15) g到(9.28±0.23) g之间,各组别的氨氮比差异不大,能量代谢率随着体质量的增加而减小,体质量为(2.06±0.15) g组别的能量代谢率显著高于其他组别。

|
表 5 不同体质量钝吻黄盖鲽幼鱼耗氧率、排氨率及氧氮比(O:N)和能量代谢效率 Tab.5 Energy metabolic rate, oxygen consumption rate, ammonia excretion rate and their ratio(O/N) of P. yokohama juvenile with different body weight |
盐度是重要的生态因子,它的改变对海水鱼类生理水平具有明显的影响[15]。目前国内外许多学者对盐度胁迫下水生生物的呼吸排泄的变化状况进行过研究,一些学者普遍认为,对于一些鱼类当外界水环境的渗透压与鱼类机体自身的渗透压相同即达到等渗点时,耗氧率最低[16]。本文研究结果显示,其耗氧率随着盐度的下降也在不断下降,盐度在8和14时候耗氧率达到较低水平,且它们之间也无显著性差异。这与上述观点有相符之处。这一结果可能是因为在盐度为8~14时,钝吻黄盖鲽机体的内环境与外界水体环境渗透压相近,不需要消耗大量的能量去维持渗透压,故也不会消耗大量的氧气去产生能量,所以在此时鱼的耗氧率最低。在其他盐度时由于为了维持体内渗透压的平衡需要消耗大量的能量,这时耗氧率会增加。同时钝吻黄盖鲽作为一种鲆鲽鱼类,它具有鲆鲽类共有的典型特征,即它们属于近岸底栖型鱼类,在它长期的进化过程中,对瞬息万变的外界渗透压环境具有较强的适应能力,因此其体内具有发达的渗透压调节系统,所以造成了鲆鲽类既不同于狭盐性鱼类,也不同于广盐类鱼,它对一定程度的盐度变化有着很好的适应机制。已有研究表明,与钝吻黄盖鲽近缘的褐牙鲆幼鱼的等渗点盐度为14.97[17]。本文结果显示,盐度为8~14时耗氧率低,这与上述的研究结果相一致。
鱼类的氮排泄物包括氨氮、尿酸和尿素,其中氨氮是最主要的排泄物[18-19]S。氨主要通过脱氨基和转氨基作用形成,该过程产能。氨主要通过鳃排出体外,而肾脏排出氨仅占一小部分,以离子形式通过简单扩散和离子交换作用排泄[20]。由于水产动物对糖类的利用率较低,主要依靠蛋白质提供能量,故排氨率反映蛋白质代谢和能量代谢的水平[21]。当前一些对其他鱼类的研究发现,盐度应激下鱼类的排氨率和耗氧率有着一定的一致性[22]。本文研究结果显示,耗氧率和排氨率都随着盐度的增加而增大,这与上述研究结果相同。
3.2 温度对钝吻黄盖鲽幼鱼呼吸排泄的影响温度对生物的正常生长、发育及代谢都有着重要影响。目前国内外许多学者已经证实,一定范围内,温度越高,其生理代谢水平越高,耗氧率和排氨率也随着增大。对牙鲆(Paralichthys olivaceus)[23]、石斑鱼(Epinephelus awoara)[24]、美国红鱼(Scsiaenops ocellatus)[22]等的研究都证明了这一点。鱼是变温动物,鱼的体温会随着外界水温的变化而改变,水温升高会使维持鱼生命基本活动的各种器官中酶的活性提高,从而造成耗氧率和排氨率代谢的强度增加[25]。本文研究结果显示在10 ℃到20 ℃范围内,随着温度的增加,耗氧率和排氨率也有相应地增强,且相互之间差异显著。这与上述的理论和研究相符,也充分证明了这一点。Q10表示温度变化对代谢强度的影响,研究表明大眼梭鲈(Stizostedion vitreum)在20 ℃到25 ℃的排氨率Q10值为2.57[26];条石鲷(Oplegnathus fasciatus)在10 ℃到15 ℃和20 ℃到25 ℃两个温度区间,呼吸Q10值分别为1.423和1.221,排泄Q10值为2.505和2.603[27]。本实验结果显示10 ℃到15 ℃和20 ℃到25 ℃两个温度区间,呼吸Q10值分别为1.406和1.684,排泄Q10值分别为2.071和1.965,表明随温度的升高,其对代谢的强度影响也在增强,这可能与该种鱼最适宜的生长温度为16~26 ℃有关,在10 ℃到20 ℃范围内,代谢强度增强。
3.3 体质量对钝吻黄盖鲽幼鱼呼吸排泄的影响鱼类的耗氧率和排氨率与其自身的体质量在一定范围内呈现负相关的关系,这一点在一些学者的研究中已经得到证实。例如对金枪鱼(Horse mackel)[28],黄姑鱼(Nibea coibor)[29]黑鲷(Sparus macrocephalus)[30]等的研究都说明了这一点。对此现象理论上认为,鱼体内的内脏器官是维持生命的根本,各组织器官正常运行需要发生许多生理生化过程中的酶促反应,从而消耗大量的能量,而肌肉、表皮这些非维持基本生命活动的组织耗能较少。随着幼鱼的生长,肌肉、骨骼等组织占据的质量比越来越大,这样单位体质量耗氧量就会减少,造成耗氧率、排氨率的下降[31-32]。本实验结果显示,随着鱼体质量的增加,耗氧率和排氨率在不断下降,与上述实验理论和结果相符合。
3.4 能源物质分析氧氮比(O/N)代表着鱼类呼吸底物的组分,是一种重要的参数,它反映机体是利用蛋白质代谢还是利用糖类和碳水化合物代谢数量上的比值。O/N的大小表示着机体以何种物质作为能量来源。MAYZAUD认为,若机体完全依靠蛋白质提供能量,那么O/N比值约为7[33]。IKEDA提出,若机体依靠蛋白质和脂肪一起供能,则O/N比值约为24[34]。IKEDA还认为,若是机体完全依靠脂肪和糖类作为能源物质,那么O/N比值将无限大[35]。本实验结果显示,盐度为8到32时,O/N的范围从44.441到12.278呈现逐渐降低趋势,表明盐度为8时该鱼的能量物质是脂肪和糖类,这可能由于此时盐度较低,对鱼的应激较强,需要消耗大量能量,这时作为主要供能物质的脂肪和糖类需要大量分解供能。其他盐度下鱼类能量来源为脂肪和蛋白质。由结果还可以看出,其他条件相同时不同体质量的O/N比值相差不大, 约为12.5,说明不同体质量下能量来源相同,都是蛋白质和脂肪的混合物。当温度从10 ℃到20 ℃时,O/N比值从17.631下降到13.446, 说明在低温条件下能量来源物质中脂肪占的比例较高温时大,这是由于低温时要生成一定的热量来维持温度的缘故。
| [1] |
李思忠, 王惠民. 中国动物志:硬骨鱼纲鲽形目[M]. 北京: 科学出版社, 1995: 214-216.
LI S Z, WANG H M. Fauna of China:osteichthyes pleuronectiformes[M]. Beijing: Science Press, 1995: 214-216. |
| [2] |
张岩, 肖永双, 高天翔, 等. 钝吻黄盖鲽野生群体遗传多样性分析[J].
水产学报, 2008, 32(3): 492–496.
ZHANG Y, XIAO Y S, GAO T X, et al. Analysis of genetic diversity of natural population in Pleuronectes yokohamae[J]. Journal of Fisheries of China, 2008, 32(3): 492–496. |
| [3] |
潘婷. 钝吻黄盖鲽微卫星位点的开发及群体遗传多样性分析[D]. 上海: 上海海洋大学, 2014.
PAN T. Development of microsatellite markers and genetic diversity in Pleuronectes yokohamae[D]. Shanghai: Shanghai Ocean University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014051816.htm |
| [4] |
栗志民, 刘志刚, 谢丽, 等. 体重和温度对华贵栉孔扇贝(Chlamys nobilis)耗氧率和排氨率的影响[J].
海洋与湖沼, 2010, 41(1): 99–105.
DOI:10.11693/hyhz201001014014 LI Z M, LIU Z G, XIE L, et al. Effect of body weight and temperature on oxygen consumption and ammonia excretion rates of Chlamys nobilis[J]. Oceanologia et Limnologia Sinica, 2010, 41(1): 99–105. DOI:10.11693/hyhz201001014014 |
| [5] |
李加儿, 曹守花, 区又君, 等. 温度、盐度和pH对鲻幼鱼耗氧率、排氨率以及窒息点的影响[J].
中国水产科学, 2014, 21(5): 954–962.
LI J E, CAO S H, OU Y J, et al. Influence of temperature, salinity, and pH on oxygen consumption rate, ammonia excretion rate, and suffocation point in juvenile Mugil cephalus[J]. Journal of Fishery Sciences of China, 2014, 21(5): 954–962. |
| [6] |
闫茂仓, 单乐州, 邵鑫斌, 等. 温度及体重对鮸鱼幼鱼耗氧率和排氨率的影响[J].
热带海洋学报, 2007, 26(1): 44–49.
YAN M C, SHAN L Z, SHAO X B, et al. Influences of temperature and weight on respiration and excretion of Miichthy miiuy juvenile[J]. Journal of Tropical Oceanography, 2007, 26(1): 44–49. |
| [7] | CUI Y, WOOTTON R J. The metabolic rate of the minnow, Phoxinus phoxinus (L.) (Pisces:Cyprinidae), in relation to ration, body size and temperature[J]. Functional Ecology, 1988, 2(2): 157–161. DOI:10.2307/2389690 |
| [8] |
雷思佳. 盐度与体重对台湾红罗非鱼耗氧率的影响[J].
应用生态学报, 2002, 13(6): 739–742.
LEI S J. Effect of salinity and body weight on the oxygen consumption of Oreochromis niloticus×O. mossambicus[J]. Chinese Journal of Applied Ecology, 2002, 13(6): 739–742. |
| [9] |
廖志洪, 林小涛, 王春, 等. 黄颡鱼仔、稚、幼鱼耗氧率及氨氮排泄率的初步研究[J].
生态科学, 2004, 23(3): 223–226.
LIAO Z H, LIN X T, WANG C, et al. Primary study on oxygen consumption and NH3-N excretion rate of larvae, juvenile and young Pelteobogrus fulvidraco[J]. Ecology Science, 2004, 23(3): 223–226. |
| [10] |
宋宗诚, 林占德, 陈四清, 等. 钝吻黄盖鲽的工厂化人工育苗[J].
渔业现代化, 2003: 19–20.
SONG Z C, LIN Z D, CHEN S Q, et al. Artificial seeding rearing technique for Pseudopleuronectes yokohamae[J]. Fishery Modernization, 2003: 19–20. |
| [11] |
喻子牛, 孔晓瑜, 谢宗墉. 山东近海21种经济鱼类的核型研究[J].
中国水产科学, 1995, 2(2): 1–6.
YU Z N, KONG X Y, XIE Z Y. Studies on karyotypes of fishes of economic importance in coastal waters of Shandong peninsula[J]. Journal of Fishery Sciences of China, 1995, 2(2): 1–6. |
| [12] | SYASINA I G, SOKOLOVSKII A S. Assessment of the state of flounders from Sivuch'ya Bight (Peter the Great Bay, Sea of Japan) based on histopathological parameters[J]. Russian Journal of Marine Biology, 2001, 27(2): 80–86. DOI:10.1023/A:1016691129620 |
| [13] |
陈雄风, 蒋耀青. 鱼类抗冻蛋白的研究Ⅰ.黄盖鲽血清抗冻蛋白的特性及分离[J].
遗传学报, 1989, 16(5): 367–373.
CHEN X F, JIANG Y Q. Studies on antifreeze proteins of fishes Ⅰ. Isolation and characterization of antifreeze protein from the fish Pseudopleuronectes yokohamae[J]. Acta Genetica Sinica, 1989, 16(5): 367–373. |
| [14] |
张岩, 肖永双, 高天翔, 等. 钝吻黄盖鲽不同群体形态学比较研究[J].
渔业科学进展, 2010, 31(5): 15–21.
ZHANG Y, XIAO Y S, GAO T X, et al. Comparisons of morphological characteristics of different populations of marbled sole Pleuronectes yokohamae[J]. Process in Fishery Sciences, 2010, 31(5): 15–21. |
| [15] |
陈松波, 陈伟兴, 范兆廷. 鱼类呼吸代谢研究进展[J].
水产学杂志, 2004, 17(1): 82–89.
CHEN S B, CHEN W X, FAN Z T. Advancement of the study on respiratory metabolism of fishes[J]. Chinese Journal of Fisheries, 2004, 17(1): 82–89. |
| [16] | WOO N Y S, KELLY S P. Effects of salinity and nutritional status on growth and metabolism of Spams sarba in a closed seawater system[J]. Aquaculture, 1995, 135(1/3): 229–238. |
| [17] |
潘鲁青, 唐贤明, 刘泓宇, 等. 盐度对褐牙鲆(Paralichthys olivaceus)幼鱼血浆渗透压和鳃丝Na+-K+-ATPase活力的影响[J].
海洋与湖沼, 2006, 37(1): 1–6.
PAN L Q, TANG X M, LIU H Y, et al. Effects of salinity on plasma osmolality and gill Na+-K+-ATPase activity of juvinile Japanese flounder Paralichthys olivaceus[J]. Oceanologia et Limnologia Sinica, 2006, 37(1): 1–6. |
| [18] | HANDY R D, POXTON M G. Nitrogen pollution in mari-culture:toxicity and excretion of nitrogenous compounds by marine fish[J]. Reviews in Fish Biology and Fisheries, 1993, 3(3): 205–241. DOI:10.1007/BF00043929 |
| [19] | DOSDAT A, SERVAIS F, MÉTAILLER R, et al. Compa-rison of nitrogenous losses in five teleost fish species[J]. Aquaculture, 1996, 141(1/2): 107–127. |
| [20] |
江丽华, 朱爱意. 温度和盐度对美国红鱼耗氧率和排氨率的影响[J].
水产养殖, 2009, 30(10): 27–30.
DOI:10.3969/j.issn.1004-2091.2009.10.007 JIANG L H, ZHU A Y. Effect of temperature on oxygen consumption rate and ammonia excretion of Sciaenops ocellatus[J]. Journal of Aquaculture, 2009, 30(10): 27–30. DOI:10.3969/j.issn.1004-2091.2009.10.007 |
| [21] |
吕富, 潘鲁青, 王爱民, 等. 盐度对异育银鲫呼吸和氨氮排泄生理的影响[J].
水生生物学报, 2010, 34(1): 184–189.
LV F, PAN L Q, WANG A M, et al. Effects of salinity on oxygen consumption rate and ammonia excretion rate of Allogynogemetic crucian carp[J]. Acta Hydrobiologica Sinica, 2010, 34(1): 184–189. |
| [22] |
柴学军, 胡则辉, 徐君卓, 等. 盐度和pH对日本黄姑鱼幼鱼耗氧率和排氨率的影响[J].
浙江海洋学院学报(自然科学版), 2009, 28(2): 146–150.
CHAI X J, HU Z H, XU J Z, et al. Effect of salinity and pH on oxygen consumption rate and ammonia excretion rate in juvenile Nibea japonica[J]. Journal of Zhejiang Ocean University (Natural Science), 2009, 28(2): 146–150. |
| [23] |
张兆琪, 张美昭, 李吉清, 等. 牙鲆鱼耗氧率、氮排泄率与体重及温度的关系[J].
青岛海洋大学学报, 1997, 27(4): 483–489.
ZHANG Z Q, ZHANG M Z, LI J Q, et al. Oxygen consumption and nitrogen excretion of Paralichthys olivaceus with different body weights at different water temperature[J]. Journal of Ocean University of Qingdao, 1997, 27(4): 483–489. |
| [24] |
戴庆年, 赵莉莉. 青石斑鱼耗氧率研究[J].
水产科学, 1994, 13(3): 6–9.
DAI Q N, ZHAO L L. Research of oxygen consumption rate of Epinephelus awoara[J]. Fisheries Science, 1994, 13(3): 6–9. |
| [25] |
王艺磊, 张子平, 张殷鹏, 等. 真鲷耗氧率的初步研究[J].
集美大学学报(自然科学版), 2002, 7(3): 193–197.
WANG Y L, ZHANG Z P, ZHANG Y P, et al. Preliminary studies on oxygen consumption rate of red sea bream Pagrosomus major[J]. Journal of Jimei University (Natural Science), 2002, 7(3): 193–197. |
| [26] | FORSBERG J A, SUMMERFELT R C. Effect of temperature on diel ammonia excretion of fingerling walleye[J]. Aquaculture, 1992, 102(1/2): 115–126. |
| [27] |
闫茂仓, 单乐州, 谢起浪, 等. 温度、盐度及体重对条石鲷幼鱼耗氧率和排氨率的影响[J].
海洋科学进展, 2008, 26(4): 486–496.
YAN M C, SHAN L Z, XIE Q L, et al. Influence of temperature, salinity and body weight on oxygen consumption and ammonia excretion of Oplegnathus fasciatus juvenile[J]. Advances in Marine Science, 2008, 26(4): 486–496. |
| [28] | HERRMANN J P, ENDERS E C. Effect of body size on the standard metabolism of horse mackerel[J]. Journal of Fish Biology, 2000, 57(3): 746–760. DOI:10.1111/jfb.2000.57.issue-3 |
| [29] |
李加儿, 刘士瑞, 区又君, 等. 浅色黄姑鱼幼鱼耗氧率、排氨率及窒息点的初步研究[J].
海洋学报, 2008, 30(5): 165–170.
LI J E, LIU S R, OU Y J, et al. A preliminary study on oxygen consumption rate, ammonia excretion rate and asphyxiation point of fry of chu's croaker Nibea coibor[J]. Acta Oceanologica Sinica, 2008, 30(5): 165–170. |
| [30] |
朱爱意, 谢佳彦, 章韶兵. 黑鲷耗氧率昼夜变化及与体重、水温的关系研究[J].
南方水产科学, 2007, 3(6): 63–66.
ZHU A Y, XIE J Y, ZHANG S B. Diurnal rhythm of oxygen consumption and effects of body weight and water temperature on oxygen consumption rate of Sparus macrocephalus[J]. South China Fisheries Science, 2007, 3(6): 63–66. |
| [31] |
张中英, 胡玫, 吴福煌. 尼罗罗非鱼耗氧率的初步研究[J].
水产学报, 1982, 6(4): 369–378.
ZHANG Z Y, HU M, WU F H. Preliminary study on the oxygen consumption of Tilapia nilotica[J]. Journal of Fisheries of China, 1982, 6(4): 369–378. |
| [32] |
谢刚, 许淑英, 祁宝崙, 等. 卷口鱼耗氧规律的研究[J].
大连水产学院学报, 2002, 17(2): 89–94.
XIE G, XU S Y, QI B L, et al. Oxygen consumption performance of Ptychidio jordani[J]. Journal of Dalian Fisheries University, 2002, 17(2): 89–94. |
| [33] | MAYZAUD P. Respiration and nitrogen excretion of zoopl-ankton. Ⅳ. The influence of starvation on the metabolism and the biochemical composition of some species[J]. Marine Biology, 1976, 37(1): 47–58. DOI:10.1007/BF00386778 |
| [34] | IKEDA T. Nutritional ecology of marine zooplankton[J]. Memoirs of the Faculty of Fisheries Hokkaido University, 1974, 22(1): 1–97. |
| [35] | IKEDA T. Respiration and ammonia excretion of euphausiid crustaceans:synthesis toward a global-bathymetric model[J]. Marine Biology, 2013, 160(2): 251–262. DOI:10.1007/s00227-012-2150-z |
 2018,
Vol. 27
2018,
Vol. 27


