2. 宁波市检验检疫科学技术研究院, 浙江 宁波 315012
类固醇激素(Steroid hormones)又称甾体激素,该类激素对增强鱼体机体发育和改善生产性能具有重要的作用。鱼类性腺发育过程中,往往伴随着多种类固醇激素含量的变化,激素水平与性腺发育关系密切。DUFOUR等[1]研究发现,性类固醇激素雌二醇(E2)、睾酮(T)等对未注射激素的欧洲鳗鲡(Anguilla anguilla)的性腺发育存在反馈调节作用;17α-20β-二羟基-4-孕烯-3-酮是诱导卵巢最后成熟与排卵的诱导激素[2]。这些研究表明,在鱼类的人工繁殖阶段,激素含量的变化是决定其发育末期是否可以自然产卵的关键因素。因此,运用快速、精准的检测方法来监测鱼体内类固醇激素的变化,有助于深入了解鱼体性腺的发育规律和生殖细胞的发育情况。
目前类固醇激素的检测方法主要有放射性免疫测定法[3]、酶联免疫吸附法(ELISA)[4]、气相色谱-质谱法(GC-MS)[5]和液相色谱-串联质谱法(LC-MS/MS)[6]等。其中,酶联免疫法灵敏度较高、快速简便,但存在交叉反应及假阳性问题;液相色谱法选择性差,灵敏度也达不到要求;放射性免疫法重复性相对较差,交叉反应复杂;气质联用法样品前处理过程比较复杂,而且对不易挥发激素的检测效果较差。应用UPLC-MS/MS方法检测,无需进行衍生化,将超高效液相色谱和质谱两者的优点结合在一起,操作简单、省时,能够在保证灵敏度的情况下达到在目标范围内筛选未知化合物的目的,具有灵敏度高,抗干扰能力强等优势,已经广泛应用于食品安全检测及临床药物监测[7-10]。
近年来,超高效液相色谱串联质谱法(UPLC-MS/MS)在类固醇激素检测中得到较广泛的应用[11],林静等[12]首次将UPLC-MS/MS方法用于检测花鳗鲡(Anguilla marmorata)卵巢中性类固醇激素的变化,并对该方法进行了优化,与湛嘉等[13]使用气质联用仪测定黄鳝肌肉中性激素结果做了比较,检测限提高了47%,与LI等[10]采用超高效液相色谱串联质谱方法测定人血浆中表阿霉素结果相比,检测限提高了78%,回收率也高于蔡勤仁等[14]使用液质联用仪检测猪组织中的类固醇激素结果。因此,在该研究方法的基础上,本研究对日本鳗鲡发育成熟过程进行追踪采样,对其血清及性腺内激素含量的变化进行研究,以期为日本鳗鲡的人工繁殖和鱼类生殖内分泌学提供参考资料。
1 材料与方法 1.1 仪器与试剂仪器包括超高效液相色谱-串联三重四极杆质谱仪(Waters公司,USA)和Supertech QR15(A、B)萃取净化管(30/pk,宁波海曙恒隆实验器材有限公司)。
6种标准品购自Sigma-Aldrich公司(纯度>98%,USA);甲醇和乙腈购自Teida公司(HPLC级,USA)。根据各自的溶解性和纯度,用甲醇配制成20.0 μg/mL的标准品储备液。
1.2 亲鱼60尾雌性降海日本鳗鲡于2014年11月购买于江苏沿海地区,经聚维酮碘对鱼体消毒,所有鲡亲鱼尾部注入生物标签。雌鳗体质量为650~1 500 g,体长为45.0~74.8 cm;置于盐度为22,水温为16~23 ℃的水泥池养殖系统,并逐步提升其盐度(后期30~33);整个实验周期内均不投饵。
1.3 样品收集亲鱼随机分组,对照组日本鳗鲡不做处理,实验组日本鳗鲡处理方法是:CPE[鲤鱼脑垂体,2 mg/(kg·次)]+hCG[人绒毛膜促性腺激素,300 IU/(kg·次)]。分别在第3, 7, 11次注射激素后(每次取样4尾)以及对产卵组(10尾)、难产组(10尾)、不响应组(4尾)取样,对照组取4尾,MS-222麻醉,断尾取血法收集血清样品,解剖,取全部性腺,在样品前处理之前所有样品均保存于-80 ℃条件下。
1.4 样品前处理称取5.0 g的离体日本鳗鲡卵巢组织样品(量取1 mL日本鳗鲡血清样品)置于50 mL D-SPE净化管(A)(Supertech Q R1A,中国),样品前处理方法参考林静等[12]。
1.5 混合标准品睾酮、雌二醇、雌三醇、17α,20β-二羟基-4-孕烯-3-酮、17α-羟基孕酮、雌酮这6种标准品均用甲醇配制成1 mg/mL的标准贮备液,置于-18 ℃下保存备用。
1.6 数据处理实验所得数据采用Excel处理,用平均数±标准差(Mean±SD)表示,统计分析采用SPSS软件统计包中的Duncan′s T3检验,以P<0.05作为显著性标准。
2 结果 2.1 方法的检出限、回收率、重复性及标曲方程通过比较发现6种类固醇激素在12.5~250 ng/mL的线性范围内有良好的线性关系,相关系数r>0.99;在25、50、125和250 ng/mL 4个添加水平下的平均回收率为73.6%~88.1%,相对标准偏差(RSD)为1.9%~9.7%;在12.5、25、62.5和125 ng/mL 4个添加水平下的平均回收率为86.9%~98%,相对标准偏差(RSD)为1.7%~9.5%;本方法的信噪比S/N>10。
2.2 实际样品测定 2.2.1 血清内激素含量变化图 1为注射外源激素后,日本鳗鲡血清中6种类固醇激素的含量变化情况。结果显示,随着注射次数的增加(产卵之前),实验组日本鳗鲡血清内6种类固醇激素的浓度均呈现逐步增加的趋势,实验组6种类固醇激素在日本鳗鲡血清中的浓度均高于对照组(对照组E1、E3未检测到),实验组T、17α-羟基孕酮、DHP、E1、E2均在产卵期最高,E3在难产期最高。对照组日本鳗鲡血清中T、17α-羟孕酮、DHP、E2的含量均处于一个较低水平,平均浓度分别为(3.65±0.63)、(2.53±0.49)、(2.27±0.24)、(2.46±0.47)ng/mL。
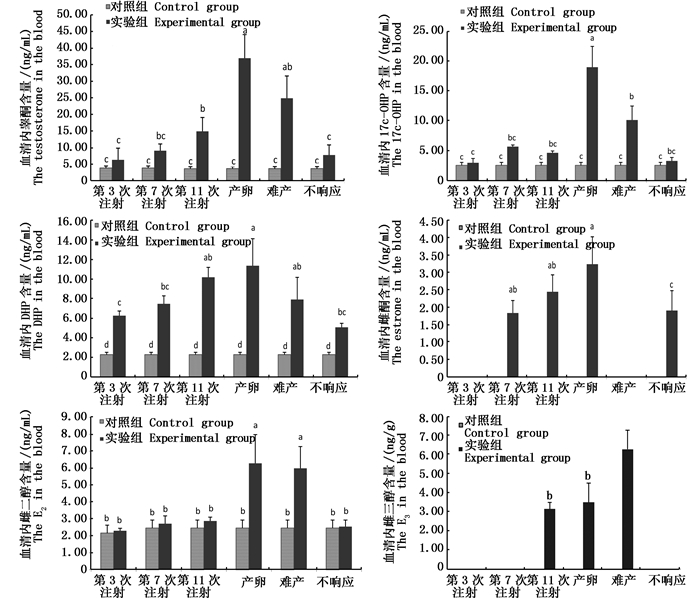
|
图 1 日本鳗鲡人工繁殖过程中血清内不同性类固醇激素的变化
Fig. 1 The steroid hormone changes in blood of Anguilla japonica during artificial induced maturation
|
图 2为注射外源激素后,日本鳗鲡性腺中4种类固醇激素的含量变化情况。结果显示,随着注射次数的增加,实验组日本鳗鲡性腺内4种类固醇激素均呈现增加的趋势,其浓度均高于对照组(对照组E2、E3未检测到,对照组与实验组T、DHP浓度在第11次注射、产卵及难产时期有显著差异)。对照组日本鳗鲡性腺中T、DHP的含量均处于一个较低水平,且整个周期中未检测到E2和E3。实验组日本鳗鲡性腺中T含量的增加趋势较缓慢,在产卵时浓度最高[(7.25±1.88)ng/g],显著高于对照组(P<0.05)。实验组DHP含量总体呈升高的趋势,在难产的日本鳗鲡中DHP含量达最高[(17.79±4.69)ng/g]。实验组E2在第11次激素注射、产卵以及难产组检测到;而E3的含量在第11次激素注射时最高,产卵时期E3的含量略有降低,难产时期未检测到,E3在整个发育过程呈无规则变化(图 2)。
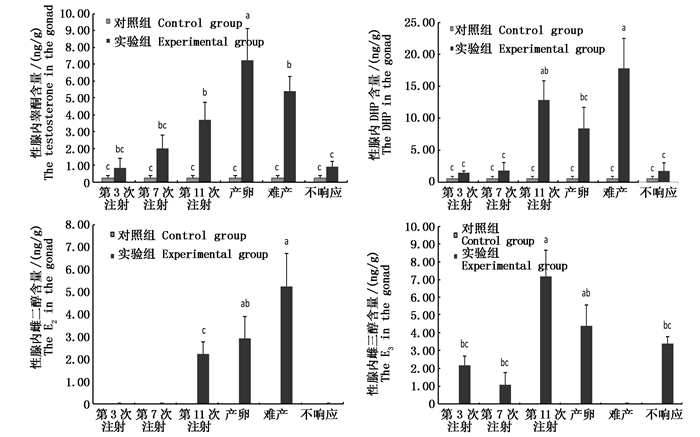
|
图 2 日本鳗鲡人工繁殖过程中性腺内不同性类固醇激素变化
Fig. 2 The steroid hormone changes in gonad of Anguilla japonica during artificial induced maturation
|
本研究采用UPLC-MS/MS方法测定分析了日本鳗鲡血清中6种、性腺中4种类固醇激素的含量变化,检测方法参考了林静等[12]建立的超高效液相色谱-串联质谱联用技术测定分析花日本鳗鲡卵巢中6种类固醇激素的方法。为了使组织中类固醇激素能够最大限度地提取出来,对样品前处理的方法进行了优化。结果表明,应用本方法对日本鳗鲡血清及性腺内类固醇激素进行定性及定量分析,具有灵敏、高回收率、准确、稳定等特点。
类固醇激素为脂溶性激素,鱼体性腺内含有大量油脂、蛋白质及一些杂质,类固醇激素的极性与油脂的极性极为相似,样品前处理的方法显得尤为重要。目前,较为常用的样品前处理方法有液液萃取(Liquid liquid extraction,LLE)、固相萃取(Solid phase extraction,SPE)、固相微萃取(Solid phase microextraction,SPME)、基质固相分散(Matrix solid-phase dispersion,MSPD)、加速溶剂萃取(Accelerated solvent extraction, ASE)和液相微萃取(Liquid phase microextraction, LPME)等[15-16]。液液萃取、基质固相分散和加速溶剂萃取需要使用大量的有机溶剂,而固相微萃取和液相微萃取的萃取容量很低。另外,上述前处理方法并不具有选择萃取性能,在萃取目标化合物的同时,也对大量非目标化合物进行萃取,对随后的分析检测结果造成了影响。由于日本鳗鲡体内(血清、性腺)类固醇激素保持在很低的浓度水平,对激素检测方法的选择就显得格外重要,必须确保兼备灵敏、准确、精密和稳定等要求。同时,样品中包含有各种脂类杂质,对样品前处理也有很高的要求。本研究在样品前处理中,选用固相分散萃取法(D-SPE),与固相萃取、基质固相萃取等方法相比,具有简单快捷,灵敏度高,分离效果好的优势。样品前处理采用Supertech QR15萃取净化管,此净化管将萃取和净化二合一,结合低温冷冻去脂,当温度降低到一定程度时甘油三酯类脂肪等杂质会从极性溶剂中凝固析出,再用石墨化碳吸附,之后通过离心沉淀脂肪或快速过滤,一般可以除去水产品乙腈提取液90%以上的脂肪[17-19],回收率和净化效果符合检测要求。
3.2 类固醇激素的含量变化与性腺发育关系对于大多数硬骨鱼类,通常是脑垂体分泌的促性腺激素作用于卵巢,卵母细胞外的膜细胞和颗粒细胞分泌性类固醇激素促进卵母细胞发育成熟[20]。本研究通过多次注射CPE及HCG诱导日本鳗鲡性腺发育,研究表明,随着日本鳗鲡的不断发育成熟,血清及性腺内类固醇激素的含量均有不同程度的升高。SOHN等[21]研究发现,斑马鱼体内性类固醇激素平衡受邻苯二甲酸二乙酯(DEP)、邻苯二甲酸丁苄酯(BBzP)、邻苯二甲酸二异丁酯(DBP)以及它们的水解代谢产物的影响。
DHP是性腺发育成熟的重要激素,是由卵母细胞滤泡膜的双层细胞分泌后和卵膜的特异性受体相结合产生的,主要功能是促进卵细胞内细胞核偏移与融合,促进胚泡破裂和排卵[3],因此在性腺中会大量积累,这与本研究中日本鳗鲡性腺及血清中DHP含量在产卵、难产时很高的结果相似,并且性腺中DHP含量在难产时高于正常产卵时,这说明日本鳗鲡之所以会难产,是因为体内DHP没有及时使卵细胞发生胚泡破裂而影响了产卵,大量积累在体内。
17α-OHP是孕酮在羟化酶作用下的产物,ADACHI等[22]研究表明,日本鳗鲡体内17α-OHP含量在卵母细胞发育后期活性最高,本研究中只在日本鳗鲡血清中检测到17α-OHP,性腺中未检测到17α-OHP,产卵前血清中17α-OHP含量维持在较低水平,产卵时含量明显升高,难产时17α-OHP含量低于产卵组,这说明17α-OHP可能对日本鳗鲡的顺利产卵也有一定的影响。
林浩然等[23]研究发现,雌性花鳗鲡成熟时期T含量较高,T水平会随着花鳗鲡卵巢发育不断增加;RAND-WEAVER等[24]研究发现T在雌鱼血清中的含量有时比雄鱼还要高,尤其是在卵黄生成末期,排卵期会出现峰值。本研究发现,日本鳗鲡血清及性腺中T含量均在产卵时最高,而对照组日本鳗鲡维持在低水平,这与前人研究结果相符。WANG等[25]在对照组七鳃鳗血清及性腺中未检测到T,这也证明,虽然T是雄激素,但在日本鳗鲡性腺发育末期同样会被大量生成。
雌酮通过17β-HSD水解酶的作用变为雌二醇和雌三醇[26],MATSUBARA等[11]实验周期内在日本鳗鲡血清中几乎检测不到雌酮含量。本研究在对照组日本鳗鲡性腺中未检测到雌酮,但在实验组日本鳗鲡血清中检测到雌酮,并且在产卵时含量[(3.24±0.79)ng/mL]较高,难产组中未检测到,可能是因为这个时期雌酮通过某种途径转为其他物质。最近研究表明[27-28],注射脑垂体的日本鳗鲡,达到最后成熟阶段之前,E2的水平会突然升高。本研究显示,日本鳗鲡血清中E2水平在产卵时显著升高。MATSUBARA等[11]研究表明在鱼类卵巢生长阶段,GtH刺激卵母细胞滤泡的膜细胞和颗粒细胞共同合成E2,诱导卵母细胞生成卵黄,进而诱导肝脏合成卵黄蛋白原。
一方面,类固醇激素通过裂解酶和水解酶的作用而相互影响,在鱼类人工繁殖过程中对生殖细胞的发育起不同的作用,进而使其达到自然产卵的目的;另一方面,类固醇激素也是调节促性腺激素循环进而反馈于下丘脑和脑垂体的重要因子。本研究中不响应组日本鳗鲡血清中6种类固醇激素、性腺中4种类固醇激素含量均显著低于产卵组和难产组,这可能是因为日本鳗鲡发育成熟过程中脑垂体分泌的促性腺激素未能达到阈值,致使血清和性腺中类固醇类激素的合成或水解途径受到抑制,从而影响了性腺发育,这有待于进一步的研究来证实。
| [1] | DUFOUR S, BURZAWA-GERARD E, LE BELLE N, et al. Re-productive endocrinology of the European eel, Anguilla anguilla[M]//AIDAK, TSUKAMOTO K, YAMAUCHI K. Eel Biology. Tokyo: Springer-Verlag, 2003: 373-383. |
| [2] | BRAUN AM, THOMAS P. Biochemical characterization of a membrane androgen receptor in the ovary of the Atlantic croaker (Micropogoni asundulatus)[J]. Biology of Reproduction, 2004, 71(1): 146–155. DOI:10.1095/biolreprod.103.025825 |
| [3] | KAZETO Y, TOSAKA R, MATSUBARA H, et al. Ovarian steroidogenesis and the role of sex steroid hormones onovarian growth and maturation of the Japanese eel[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2011, 127(3/5): 149–154. |
| [4] | ROSENFELD H, MYLONAS C C, BRIDGES C R, et al. GnRHa-mediated stimulation of the reproductive endocrine axis in captive Atlantic bluefin tuna, Thunnus thynnus[J]. General and Comparative Endocrinology, 2012, 175(1): 55–64. DOI:10.1016/j.ygcen.2011.09.013 |
| [5] |
丁雅韵, 徐晓云, 谢孟峡, 等. 动物组织中己烯雌酚残留的基体固相扩散-气相色谱-质谱分析方法研究[J].
分析化学, 2003, 31(11): 1356–1359.
DOI:10.3321/j.issn:0253-3820.2003.11.018 DING Y Y, XU X Y, XIE M X, et al. Matrix solid-phase dispersion coupled with gas chromatography-mass spectrometry for the analysis of trace residue of diethylstilboestrol in animal tissue[J]. Chinese Journal of Analytical Chemistry, 2003, 31(11): 1356–1359. DOI:10.3321/j.issn:0253-3820.2003.11.018 |
| [6] |
秦燕, 陈捷, 张美金. 动物肌肉组织中甾类同化激素多组分残留的液相色谱-质谱检测方法[J].
分析化学, 2006, 34(3): 298–302.
QIN Y, CHEN J, ZHANG M J. Determination of anabolic hormones Multi-residues in animal muscle tissues using liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2006, 34(3): 298–302. |
| [7] | KAUFMANN A, BUTCHER P, MADEN K, et al. Ultra-performance liquid chromatography coupled to time of flight mass spectrometry(UPLC-TOF):a novel tool for multi-residue screening of veterinary drugs in urine[J]. Analytica Chimica Acta, 2007, 586(1/2): 13–21. |
| [8] | BARBERO G F, PALMA M, BARROSO C G. Pressurized liquid extraction of capsaicinoids frompeppers[J]. Agricultural and Food Chemistry, 2006, 54(9): 3231–3236. DOI:10.1021/jf060021y |
| [9] |
张新忠, 罗逢健, 陈宗懋, 等. 超高效液相色谱串联质谱法测定茶叶、茶汤和土壤中氟环唑、茚虫威和苯醚甲环唑残留[J].
分析化学, 2013, 41(2): 215–222.
ZHANG X Z, LUO F J, CHEN Z M, et al. Residue determination of epoxiconazole, indoxacarb and difenoconazole in tea, tea infusion and soil using ultra high performance liquid chromatography coupled with tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2013, 41(2): 215–222. |
| [10] | LI R P, DONG L L, HUANG J X. Ultra performance liquid chromatography-tandem mass spectrometryfor the determina-tion of epirubicin in human plasma[J]. Analytica Chimica Acta, 2005, 546: 167–173. DOI:10.1016/j.aca.2005.04.073 |
| [11] | MATSUBARA H, LOKMAN P M, KAZETO Y, et al. Serum steroid profiles in artificially maturing female Japanese eel, Anguilla japonica[J]. Aquaculture, 2005, 243(1/4): 393–402. |
| [12] |
林静, 湛嘉, 帅滇, 等. 人工诱导花鳗鲡成熟过程中卵巢内6种性类固醇激素的含量及变化[J].
水产学报, 2015, 39(9): 1341–1349.
LIN J, ZHAN J, SHUAI D, et al. Quantification of 6 sexual steroid hormones in the ovary of marbled eel Anguilla marmorata during artificial induced maturation[J]. Journal of Fishes of China, 2015, 39(9): 1341–1349. |
| [13] |
湛嘉, 俞雪钧, 李佐卿, 等. 黄鳝肌肉中的20种性激素同时测定的气质联用检测方法[J].
食品科学, 2008, 29(6): 298–303.
ZHAN J, YU X J, LI Z Q, et al. Stimultaneous determination of residue of sex hormones in Eelmuscle by Gas Chromatography-Mass Spectrometry[J]. Chinese Journal of Food Science, 2008, 29(6): 298–303. |
| [14] |
蔡勤仁, 冯家望, 张毅, 等. 液相色谱-串联质谱结合谱库检索法同时测定猪组织中12种类固醇激素[J].
色谱, 2011, 29(8): 712–717.
CAI Q R, FENG J W, ZHANG Y, et al. Determination of 12 steroid hormone residues in pig tissues by liquid chromatography-tandem mass spectrometry combining with library search[J]. Chinese Journal of Chromatography, 2011, 29(8): 712–717. |
| [15] | SANTOS L S, ROSSOG B, PILLI R A, et al. The mechanism of the Stille reaction investigated by electrospray ionization mass spectrometry[J]. Journal of Organic Chemistry, 2007, 72(15): 5809–5812. DOI:10.1021/jo062512n |
| [16] | FENN J B. Ion formation from charged droplets:roles of geo-metry, energy, and time[J]. Journal of the American Society for Mass Spectrometry, 1993, 4(7): 524–535. DOI:10.1016/1044-0305(93)85014-O |
| [17] | CHEN S B, YU X J, HE X Y, et al. Simplified pesticide multiresidues analysis in fish by low-temperaturecleanup and solid-phase extraction coupled with gas chromatography/mass spectrometry[J]. Food Chemistry, 2009, 113(4): 1297–1300. DOI:10.1016/j.foodchem.2008.08.045 |
| [18] | LOPES R P, AUGUSTI D V, OLIVEIRA A G, et al. De-velopment and validation of a methodology to qualitatively screening veterinary drugs in porcine muscle via an innovative extraction/clean-up procedure and LC-MS/MS analysis[J]. Food Additives & Contaminants:Part A, 2011, 28(12): 1667–1676. |
| [19] | GENTILI A, CARETTI F, BELLANTE S, et al. Development and validation of two multiresidue liquid chromatography tandem mass spectrometry methods based on a versatile extraction procedure for isolating non-steroidal anti-inflammatory drugs from bovine milk and muscle tissue[J]. Analytical and Bioanalytical Chemistry, 2012, 404(5): 1375–1388. DOI:10.1007/s00216-012-6231-0 |
| [20] | FOSTIER A, JALABERT B, BILLARD R, et al. The gonadal steroids[J]. Fish Physiology, 1983, 9: 277–372. DOI:10.1016/S1546-5098(08)60291-5 |
| [21] | SOHN J, KIM S, KOSCHORRECK J, et al. Alteration of sex hormone levels and steroidogenic pathway by several low molecular weight phthalates and their metabolites in male zebrafish (Danio rerio) and/or human adrenal cell (H295R) line[J]. Journal of Hazardous Materials, 2016, 320: 45–54. DOI:10.1016/j.jhazmat.2016.08.008 |
| [22] | ADACHI S, IJIRI S, KAZETO Y, et al. Ogenesis in the Japanese eel, Anguilla japonica[M]//AIDA K, TSUKAMOTO K, YAMAUCHI K. Eel Biology. Tokyo: Springer-Verlag, 2003: 301-317. |
| [23] |
林浩然, 齐鑫, 周雯伊, 等. 人工诱导花鳗鲡卵巢发育成熟及相关激素和组织的作用[J].
水产学报, 2010, 34(7): 989–998.
LIN H R, QI X, ZHOU W Y, et al. Artificial induction maturation of marbled eel(Anguilla marmorata) andfunctions of related hormones and tissues[J]. Journal of Fisheries of China, 2010, 34(7): 989–998. |
| [24] | RAND-WEAVER M, NOSO T, MURAMOTO K, et al. Isolation and characterization of somatolactin, a new protein related to growth hormone and prolactin from Atlantic cod (Gadus morhua) pituitary glands[J]. Biochemistry, 1991, 30(6): 1509–1515. DOI:10.1021/bi00220a010 |
| [25] | WANG H Y, BUSSY U, CHUNG-DAVIDSON Y W, et al. Ultra-performance liquid chromatography tandem mass spectrometry for simultaneous determination of natural steroid hormones in sea lamprey (Petromyzon marinus)plasma and tissues[J]. Journal of Chromatography B, 2016, 1009-1010: 170–178. DOI:10.1016/j.jchromb.2015.12.030 |
| [26] | KAZETO Y. Molecular biological studies on ovarian steroid hormone biosynthesis in Japanese eel, Anguilla japonica[D]. Hokkaido: Hokkaido University, 1999: 13-27. http://hdl.handle.net/2115/51605 |
| [27] | KAYABA T, SASAKI N, ADACHI S, et al. Effects of pituitary glycoprotein hormones and thyroid hormones on in-vitro vitellogenin incorporation into organ-cultured oocytes in the Japanese eel, Anguilla japonica[J]. Zoological Science, 2008, 25(3): 334–343. DOI:10.2108/zsj.25.334 |
| [28] | LOKMAN P M, GEORGE K A N, DIVERS S L, et al. 11-Ketotestosterone and IGF-I increase the size of previtellogenic oocytes from shortfinned eel, Anguilla australis, in vitro[J]. Reproduction, 2007, 133(5): 955–967. DOI:10.1530/REP-06-0229 |
2. Ningbo Academy of Inspection and Quarantine, Ningbo 315012, Zhejiang, China
 2018,
Vol. 27
2018,
Vol. 27


