2. 中国水产科学研究院珠江水产研究所 农业部热带亚热带水产资源利用与养殖重点实验室, 广东 广州 510380;
3. 广东省水产养殖污染修复生态工程技术研究中心, 广东 广州 510380
池塘混养是目前我国淡水养殖业的主要方式之一,其养殖密度大、投饵率高,导致养殖池塘中氮磷含量日益增高,引发水质恶化、病害频发[1]。然而目前主要的处理方法是大量换水,由此产生的养殖废水会直接排放到临近水域。在我国淡水资源短缺的现状下,这就迫切需要强化水体及养殖区域环境的修复能力,营造稳定、可控的健康养殖环境,实现养殖生境自我修复。
生物膜法是一种能耗低、成本低、简单方便、不会对环境产生二次污染的养殖废水处理方法[2],近年来,备受广大科研工作者的关注。目前国内外学者对生物膜做了大量研究,主要集中在生物膜的形成过程、生物膜的运行机理、生物膜的信号因子等方面。生物膜的形成需要具备载体、氮、磷及微量元素等条件,经过养殖,污水在载体表面流动一段时间后,微生物在载体表面黏附、生长和增殖,最终达到成熟,形成生物膜;成熟的生物膜具有良好的好氧、兼性、厌氧微生物生存环境[3],可以实现同步硝化-反硝化作用,将氨氮和有机质最终转化为氮气[4],从而达到净化水质的目的;还有研究表明通过人工手段,利用细菌的群体感应(quorum-sensing,QS)改变周围环境的信号分子浓度来调控种群密度以及细菌的生理功能,也可以影响生物膜的形成[5]。然而实际应用中更加关注生物膜的代谢活性和功能特征,因为代谢活性的高低可以影响水体中氮、磷的含量。
Biolog技术是目前研究微生物代谢活性的常用方法,该方法简单、快速,获取信息量大,被广泛用于水体、土壤微生物群落代谢特征研究[6],是通过测定微生物对不同碳源的利用情况来表现其生理特性的不同,在时间和空间上能较好地表现微生物的动态变化,其原理是通过在微平板中直接培养微生物,并实时监测其引起的光吸收变化来表现其生理特征[7]。本研究以生态基为载体材料,探讨混养池塘生物膜微生物在形成过程中对碳源的代谢情况以及水体中总氮和总磷的变化,为生物膜微生物对碳源的选择性和功能多样性提供数据参考,为后续生物膜法在水产养殖中运用提供一定的指导意义。
1 材料与方法 1.1 实验材料载体材料为无纺布生态基,其具有不易分解、不污染环境的优点。材料厚度0.2 cm,比重240 g/m2,比面积20 m2/m2,生态基每块长5 m,宽1 m,长边的一端保持完整,另一端剪成0.05 m×0.8 m的长条状。
实验在惠州市振华渔业有限公司的池塘进行,本实验选取该公司罗非鱼(Oreochromis mossambicus)和草鱼(Ctenopharyngodon idellus)高产混养殖池塘作为生物膜的培养环境。养殖水源为东江水,经过滤沉淀后注入池塘,池塘面积20 hm2,有效水深为2.5 m,养殖容量为25 000 kg/hm2,(罗非鱼占60%,草鱼占40%),配合少量鲢鳙,每日投喂罗非鱼和草鱼膨化饲料(粗蛋白分别为≥30%和≥26%)。
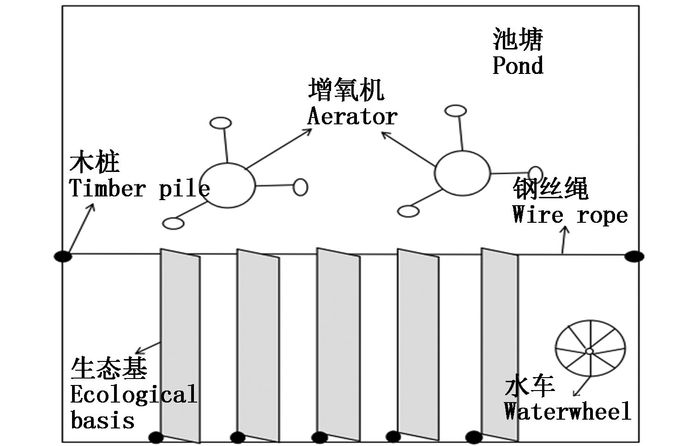
生态基布局如图 1所示:池塘左右两端打两个木桩固定钢丝绳,平行于钢丝绳的岸边打一排木桩,间隔2 m,生态基垂直于钢丝绳固定,然后将生态基悬挂于养殖池塘中,并保持其垂直悬浮的状态。同时池塘安装2台增氧机和一台车轮式水车,水车固定于池塘右下侧,搅动方向向右,使池塘形成逆时针的水流,可使池塘中悬浮物充分流经悬挂的生态基,有利于悬浮物的附着。在整个实验周期内,池塘内未使用任何药物,也不换水。
|
图 1 生态基布局简图
Fig. 1 The diagram of ecological basis layout
|
实验是在2015年8月5日至10月9日期间进行,平均气温23~35 ℃。每隔7天同步测定水质指标,pH、水温、溶氧、电导率、总溶解固体的测定采用便携式多参数水质分析仪(YSI Professional Plus,美国)现场测定。氨态氮采用纳氏试剂比色法(GB 7479—1987)测定;亚硝态氮采用萘乙二胺分光光度法(GB 7493—1987)测定;硝态氮采用酚二磺酸分光光度法(GB 7480—1987)测定;总氮采用碱性过硫酸钾消解紫外分光光度法(GB 11894—1989)测定;总磷采用钼酸铵分光光度法(GB 11893—1989)测定。
1.3 微生物样品采集与Biolog分析生态基放置后每隔7天采样一次,共采样10次(0 w、1 w、2 w、3 w、4 w、5 w……9 w),采样用于生物膜微生物代谢活性、结构和功能分析。采样时随机选取同一水层(约水面下0.5 m)不同位置的生态基材料(每处5 g左右,需6处以上),混样装入50 mL灭菌离心管中,低温带回实验室,立即进行微生物群落功能性分析。
BiologTM的ECO测试板(ECO MicroPl,美国Matrix Technologies Corporation)含有31种不同碳源和空白对照,每块板有3个重复。Biolog-ECO微平法操作:在无菌条件下称取上述混样的生态基3 g放入盛有150 mL 0.9%的灭菌生理盐水的锥形瓶中,充分振荡后,与0.9%的生理盐水按比例混合制成均匀的微生物悬液,加入Biolog-ECO微平板中。将加好样的Biolog-ECO微平板放入25 ℃恒温培养箱中,每隔24 h读取各孔在590 nm波长下的光吸收值,连续测定8 d。后续的多样性指数、对碳源的利用特征等数据处理根据TIQUIA[8]的测定方法,选取平均颜色变化率(Average well color development,AWCD)变化曲线最大斜率处的培养时间(本研究为48 h),分析结果相对稳定。
1.4 计算方法平均颜色变化率(AWCD)表示生物膜微生物对碳源的利用情况,是表现微生物活性的重要指标[9]。丰富度指数、Simpson指数(又称优势度指数)、Shannon-Wiener指数、Pielou均匀度指数、McIntosh指数用于表示微生物的多样性。计算方法参考高晓奇等[10]的计算方法。
1.5 统计分析方法数据统计和绘图采用Microsoft Office进行,主成分分析(Principal omponent Analysis,PCA)采用Canoco 4.5进行,热图(Heatmap)采用GPS heml 1.0软件进行绘图,统计分析采用SPASS 18.0进行,实验所得数据为“算数平均值±标准差”(Mean±SD),用单因素方差分析(One-way ANOVA),选用Duncan多重比较法,比较均值之间的差异显著性,显著性水平为P<0.05。
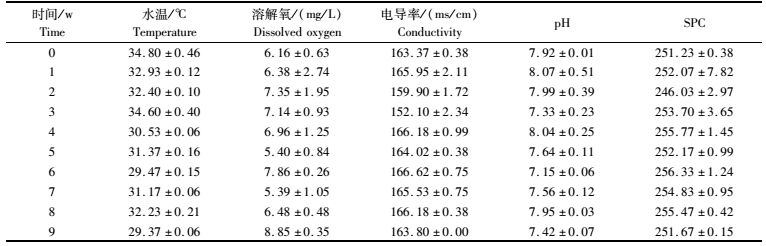
2 结果与分析 2.1 池塘水质的基本情况及理化指标的变化在实验期间,水温维持在30 ℃左右,pH维持在7~8,DO均保持在5 mg/L以上,电导率在152~166 ms/cm之间小幅度波动,SPC基本稳定在250左右,如表 1所示。
|
表 1 池塘水质的基本情况 Tab.1 The characteristics of the water in fish pond |
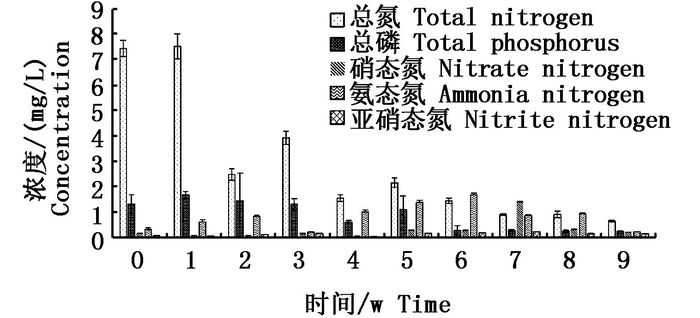
实验期间水体中总氮、总磷等结果如图 2所示。从图 2可以看出,实验开始到结束,总氮和总磷的浓度分别由7.45 mg/L和1.69 mg/L降低到0.66 mg/L和0.25 mg/L,去除率分别达到了91.14%和85.21%,具有较好的去除效果;硝态氮一直处于较低浓度,均在2 mg/L以下;亚硝态氮浓度一直处于0.2 mg/L以下,适合鱼类生长;氨态氮浓度在实验期间保持较低水平,仅第7周出现了波动。结果显示在高产混养池塘中挂生态基对总氮和总磷的去除及对氨态氮、硝态氮和亚硝态氮等水质指标的维持有一定贡献作用。
|
图 2 实验期间总氮、总磷、硝态氮、氨态氮和亚硝态氮的浓度变化情况
Fig. 2 Concentrations of total nitrogen, total phosphorus, Nitrate nitrogen, Ammonia nitrogen and Nitrite nitrogen in the pond water during the experiment
|
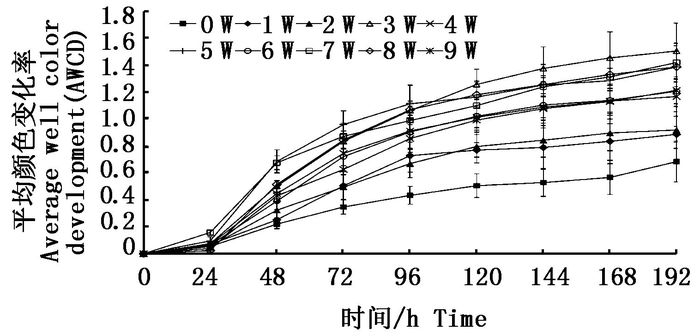
图 3可看出,在24 h内除了第8周AWCD值略高一点,其他周AWCD值无明显差异,在24 h后,AWCD值升高速度明显,直到96 h之后趋于平缓,到144 h之后AWCD值基本保持稳定。不同采样时间点生物膜微生物对碳源的代谢活性存在明显差异,表现为第3、5、7、8周生物膜代谢活性处于较高水平,第0、1、2周生物膜代谢活性最低,总体上看从第3周开始,固着微生物对碳源的利用率保持较高的状态。在生物膜形成过程中,生物膜微生物的代谢活性出现先升高后降低的趋势。
|
图 3 不同采样时间点固着微生物AWCD值变化
Fig. 3 Changes of microbial AWCD values at different sampling time points
|
从表 2中可以看出,不同采样点之间5种指数均存在显著差异(P<0.05)。Shannon指数第5、7周水平最高,第0、1、2、9周水平最低,存在显著差异(P<0.05);Simpson指数第1、3、4、5、7、8周显著高于其他周,差异显著(P<0.05);Pielou均匀度指数第0周最高,第1、2、4、6、9周次之,其他周水平较低;McIntosh指数差异较大,第3、5、7、8周水平远高于其他周;丰富度指数之间也存在着较大差异5w>7w>8w>3w≈4w>6w>9w>2w>1w>0w。总体表现第3、4、5、7、8周多样性指数处于较高水平。
|
表 2 生物膜微生物群落多样性指数 Tab.2 Biofilm microbial community diversity index |
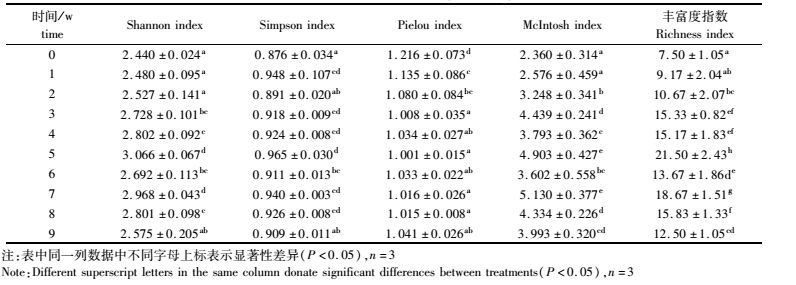
由图 4可看出,生物膜微生物对聚合物类和碳水化合物类的碳源利用率更高,对氨基酸类和胺类碳源的利用率次之,最低的是酚类和羧酸类。不同采样时间点6类碳源的利用率都在生物膜形成过程中出现先升高后降低的趋势,聚合物类和碳水化合物类提高幅度最大,氨基酸和胺类的提高幅度略小,而羧酸和胺类的提升幅度最小。生物膜微生物对羧酸类、聚合物类和碳水化合物类碳源的利用率均在第5周达到最高,对氨基酸和胺类碳源的利用率则在第7周达到最高,说明不同阶段形成的不同微生物种群对不同碳源的利用率是有差异的。总的来说,本次实验在生物膜形成过程中对聚合物类和碳水化合物类碳源的选择利用较大,可能与生物膜附着微生物的种类有关;在这两类碳源的相对利用率中可以看出,从第3周开始生物膜微生物对其利用开始大幅度升高,到第8周开始出现回落,可能与生态基上生物膜附着微生物的量有关。
|
图 4 不同采样时间点生物膜微生物对6类碳源的相对利用率
Fig. 4 Relative utilization rates of biofilm microorganisms for six carbon sources at different sampling time points
|
图 5是基于平均颜色变化率(AWCD)做出来的生物膜微生物对31种碳源的利用情况(即代谢能力),如图例所示,由蓝色到红色表示生物膜微生物的代谢能力逐渐增强。从图 5中可以看出生物膜微生物对31种碳源的代谢能力存在显著差异,对F1(肝糖)和E2(N-乙酰-D-葡萄糖氨)代谢能力最强,其次是A2(β-甲基-D-葡萄糖苷)和G2(α-D-葡萄糖-1-磷酸),对C1(吐温40)、D2(D-甘露醇)、G1(D-纤维二糖)、H2(D, L-α-磷酸甘油)、B3(D-半乳糖醛酸)、A3(D-半乳糖酸内脂)、D4(L-丝氨酸)的代谢能力更弱,而对G3(α-丁酮酸)、C4(L-苯丙氨酸)、C3(2-羟基苯甲酸)、F3(衣康酸)等碳源几乎不利用,以上结果提供了生物膜附着微生物碳源利用的强弱图谱,可以为碳源强化生物膜提供数据参考;由图 5可知,不同采样时间对碳源利用的聚类表现为,第0、1周的利用情况相似,第2、3、5、7周利用情况相似,第4、6、8、9周利用情况相似,第0、1周的利用情况较其他周差异较大。

|
图 5 生物膜微生物对31种碳源利用率的热图
Fig. 5 Thermal diagram of biofilm microbes for 31 carbon sources utilization
H4.腐胺(Putrescine);G4.苯乙胺(Phenylethylamine);B2.D-木糖(D-Xylose);E3.γ-羟丁酸(γ-Hydroxybutyric Acid);G3.α-丁酮酸(α-Ketobutyric Acid);F4.甘氨酰-L-谷氨酸(Glycyl-L-Glutamic Acid);C1.吐温40(Tween 40);D2.D-甘露醇(D-Mannitol);G1.D-纤维二糖(D-Cellobiose);H2.D, L-α-磷酸甘油(D, L-α-Glycerol Phosphate);A2.β-甲基-D-葡萄糖苷(β -Methyl-D-Glucoside);G2.α-D-葡萄糖-1-磷酸(α-D-Glucose -1-Phosphate);E2.N-乙酰-D-葡萄糖氨(N-Acetyl-D-Glucosamine);F1.肝糖(Glycogen);E4.L-苏氨酸(L-Threonine);B4.L-天门冬酰胺(L-Asparagine);H3.D-苹果酸(D-Malic Acid);E1.α-环式糊精(α-Cyclodextrin);F2.D-葡糖氨酸(D-Glucosaminic Acid);B3.D-半乳糖醛酸(D-Galacturonic Acid);A3.D-半乳糖酸内脂(D-Galactonic Acid Lactone);D4.L-丝氨酸(L-Serine);B1.丙酮酸甲酯(Pyruvic Acid Methyl Ester);C2.i-赤藓糖醇(i-Erythritol);H1.α-D-乳糖(α-D-Lactose);D1.吐温80(Tween 80);C4.L-苯丙氨酸(L-Phenylalanine);C3.2-羟基苯甲酸(2-Hydroxybenzoic Acid);D3.4-羟基苯甲酸(4-Hydroxybenzoic Acid);A4.L-精氨酸(L-Arginine);F3.衣康酸(Itaconic Acid) |
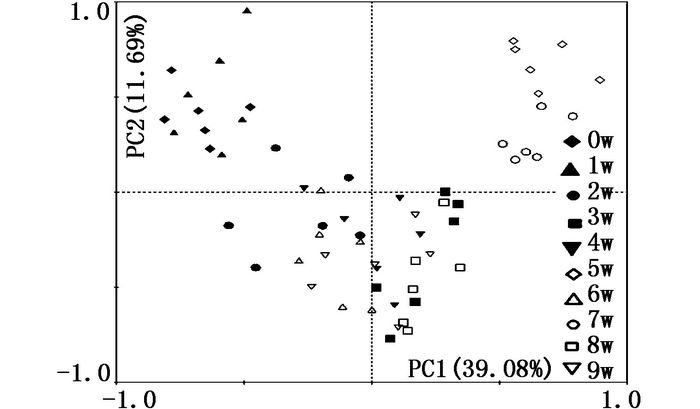
为研究不同采样时间生物膜微生物的碳源利用多样性的特点,选择Biolog培养时间为48 h获得的数据,并对其进行标准化变换后,应用Canoco for Windows 4.5实施主成分分析。获得了4个主成分分析,即PC1(39.08%)、PC2(11.69%)、PC3(6.4%)、PC4(5.68%)。PC1和PC2的贡献率达到了50.77%,将这两个主成分作图,得到不同采样时间生物膜微生物碳源代谢特征(图 6)。样本间的离散程度表明了它们之间的相似性,离得越近代表相似程度越高,反之则相反。第0、1周的样方聚集在一起位于第二象限与PC1和PC2呈负相关,对碳源利用情况较差,第3、4、6、8、9周的样方聚集在一起,位于第三、四象限,相比第0、1周对碳源的利用有所提高,第5、7周样方聚集在第一象限,与PC1和PC2呈正相关,对碳源利用情况较好,这可能与生物膜形成过程中生态基附着微生物的量和种类发生变化有关。
|
图 6 生物膜微生物对31种碳源主成分分析
Fig. 6 Principal component analysis of 31 kinds of carbon Sources by biofilm microorganisms
|
集约化养殖水体中的氮磷主要来源于养殖过程中饲料残剩物和粪便排泄物的分解。传统的养殖方式片面追求产量,过量地投饵,形成大量的有机代谢废物沉积,导致水体系统的分解环节受抑制,产生过多的氨氮等中间有害产物,进而影响养殖动物的健康。为了维持水质的稳定,目前主要的处理方法是大量换水[11]。在循环经济、节水控污的情况下,大量换水不符合持续发展的需求。因此,国内外学者也进行了大量的研究,其中采用生态基控制池塘水质就是其中之一。本研究实验结果显示在池塘中使用生态基后,养殖池塘中总氮和总磷在整个实验期间呈现下降趋势,去除率分别达到了91.14%和85.21%,去除效果明显。本实验室[12]前期研究了混养池塘生物膜附着微生物群落结构,发现生态基生物膜附着微生物群落中与脱氮除磷相关的细菌(Comamonadaceae、Neisseriaceae、Betaproteobacteria、Agitococcus lubricus、Vogesella、Aeromonas caviae、Chitinophagaceae)丰度是提高的,因此,本研究中总氮、总磷的去除效果良好可能与挂生态基后脱氮除磷相关的细菌提升有关。吴伟等[13]的研究表明在池塘中添加人工基质可以达到净化水质、降低氮磷含量的作用。另外添加人工基质对氨氮、亚硝酸态氮的去除也有研究,VIAU等[14-15]研究发现在巴西南美对虾虾苗和淡水小龙虾养殖中生物膜的使用显著降低氨氮、亚硝酸盐的含量。宋协法等[3]研究表明纳米生态基对养殖污水氨氮去除率达到了90%以上。本研究与上述研究都证明了人工基质应用在池塘中可以起到脱氮除磷的效果。
3.2 生物膜形成过程中附着微生物对碳源的代谢活性及功能多样性本研究选取主养罗非鱼和草鱼并配合少量鲢鳙的混养池塘进行试验,是因为池塘生态系统中引入鲢鳙可以改变微生物的群落结构,促进新的细菌的增殖,增加微生物群落丰度[16],微生物群落丰度会直接影响微生物的代谢活性。AWCD值反映了微生物对不同碳源总体的代谢能力,其变化速率越快,表示微生物代谢活性越高[17]。本研究结果显示,第3周生物膜微生物对Biolog-ECO板上31种碳源总体代谢能力最强,这可能与生物膜微生物群落结构成熟有关,冯志华等[18]和刘艳红等[19]研究也证实了养殖系统中生物膜形成周期为30~40 d。本研究中所用指数(丰富度指数、Shannon指数、Simpson指数、Pielou指数和McIntosh指数)均存在显著差异,总体表现为第3、4、5、7、8周处于较高水平,第0、1、2周处于低水平,说明生物膜成熟后较形成初期微生物群落多样性指数有较大提升,这与代谢活性呈现的规律基本一致。随着生物膜的形成,生态基上附着的微生物种类和数量的增加是导致生物膜代谢活性和多样性指数增加的直接原因。本研究采用的生态基具有巨大的表面积和致密的三维孔结构,吸附水体中的营养物质和氮磷等元素为细菌、真菌等微生物提供了生长繁殖的环境,利于生物膜的快速形成。梁益聪等[20]研究发现在黑水中添加生态基在10 d左右生物膜就达到成熟。夏耘等[21]研究发现在草鱼养殖池塘中添加生态基改变了菌种的分布,生态基上出现了优势菌群。上述研究表明添加生态基可能会导致生物膜微生物碳代谢活性和多样性指数增加。
3.3 对碳源的利用差异按化学性质的不同把31种碳源分为6类,其中氨基酸6种、碳水化合物10种、羧酸7种、聚合物4种、胺类2种和酚类2种。在实验期间,生物膜微生物对6类碳源的利用存在差异,对碳水化合物类和聚合物类的利用明显高于其他四类,对羧酸类和酚类的利用很低,宋景华等[22]在循环水养殖池塘中发现微生物群落对碳水化合物类的利用最好,优势明显,说明微生物在生长繁殖期间对碳源的种类是有选择性的。
在不同采样时间点,生物膜微生物对单一碳源的利用也存在显著差异,生物膜微生物偏好利用的碳源有肝糖、N-乙酰-D-葡萄糖氨、β-甲基-D-葡萄糖苷、α-D-葡萄糖-1-磷酸、吐温40、D-甘露醇、D-纤维二糖、D, L-α-磷酸甘油、D-半乳糖醛酸、D-半乳糖酸内脂、L-丝氨酸;几乎没有利用的碳源有2-羟基苯甲酸、L-苯丙氨酸、L-苏氨酸、α-丁酮酸和衣康酸。其中N-乙酰-D-葡萄糖氨是细菌和真菌细胞壁的组成成分[23],在生物膜形成过程中,提高了对此碳源的利用,可能是因为微生物的大量生长繁殖;β-甲基-D-葡萄糖苷是具有β-苷键的糖类衍生物,可由纤维素酶进行分解,产纤维素酶的生物种类广泛,主要集中在微生物的细菌、真菌和放线菌等[24],微生物生物膜对此碳源的利用说明生物膜上产纤维素酶的微生物较多;α-D-葡萄糖-1-磷酸是被磷酸化的葡萄糖,是糖酵解途径的中间产物,可能生物膜上的微生物参与葡萄糖发酵过程,因此对该碳源的利用较好。国内大量研究结果与本实验结果类似,朱云昊等[26]在Biolog-ECO解析循环水鳗鲡养殖系统中不同生物降解工艺下的滤料微生物群落功能多样性特征中也发现了微生物对N-乙酰-D-葡萄糖氨、吐温40的偏好,对2-羟基苯甲酸没有利用。曹煜成等[27]在罗非鱼主养池塘中对5—10月整个养殖季中的水体微生物群落动态变化中发现利用较好的碳源有D-甘露醇、N-乙酰-D-葡萄糖氨、D-纤维二糖和吐温40,对2-羟基苯甲酸的利用率很低。从上述研究中可看出2-羟基苯甲酸几乎不被养殖水体微生物利用,但刘颖等[28]的研究发现2-羟基苯甲酸在流化床A槽(添加滤料曝气充足)、微珠滤器中层、下层的微生物很好地利用,这可能与添加滤料、曝气充足、温度、地理位置等诸多因素有关。
生物膜微生物对31种碳源利用的主成分分析可以表明不同采样时间点对碳源利用的相似程度及差异,结果表明,第5、7周样方对碳源的利用最高,第3、4、6、8、9周的样方次之,第0、1周的样方最差,也就是生物膜成熟时较成熟前期和后期对碳源的利用是升高的,本团队[29]之前在草鱼养殖池塘中的主成分分析生物群落对碳源的利用时也发现了此现象,说明前期生态基上吸附的生物量少,随着时间的延长,附着生物量逐渐增多,直至生物膜达到成熟,成熟之后进入稳定期,定植种类减少,出现了优势菌群。
综上所述,在高产混养池塘中挂生态基达到了脱氮除磷的效果;同时寻找出生物膜微生物对Biolog-ECO板上31种碳源中利用较高的碳源,包括肝糖、D-甘露醇、N-乙酰-D-葡萄糖氨、D-纤维二糖、吐温40、D-甘露醇、D-纤维二糖、D, L-α-磷酸甘油、D-半乳糖醛酸、D-半乳糖酸内脂、L-丝氨酸等。研究结果为后续在生产实践中利用碳源强化生物膜形成提供参考。
| [1] |
邓来富, 江兴龙. 池塘养殖生物修复技术研究进展[J].
海洋与湖沼, 2013, 44(5): 1270–1275.
DENG L F, JIANG X L. The Application and research progress of bioremediation in pond aquaculture[J]. Oceanologia et Limnologia Sinica, 2013, 44(5): 1270–1275. |
| [2] | LIN Y F, JING S R, LEE D Y, et al. Nutrient removal from aquaculture wastewater using a constructed wetlands system[J]. Aquaculture, 2002, 209(1/4): 169–184. |
| [3] |
宋协法, 薛松松, 陈义明. 纳米生态基对水产养殖污水的处理效果[J].
环境工程学报, 2012, 6(7): 2231–2236.
SONG X F, XUE S S, CHEN Y M. Effect of nano-ecobase on treatment of aquaculture wastewater[J]. Chinese Journal of Environmental Engineering, 2012, 6(7): 2231–2236. |
| [4] | MATSUZAKA E, NOMURA N, NAKAJIMA-KAMBE T, et al. A simple screening procedure for heterotrophic nitrifying bacteria with oxygen-tolerant denitrification activity[J]. Journal of Bioscience and Bioengineering, 2003, 95(4): 409–411. DOI:10.1016/S1389-1723(03)80077-4 |
| [5] | WHITEHEAD N A, BARNARD A M L, SLATER H, et al. Quorum-sensing in gram-negative bacteria[J]. FEMS Microbiology Reviews, 2001, 25(4): 365–404. DOI:10.1111/j.1574-6976.2001.tb00583.x |
| [6] | TAKABE Y, KAMEDA I, SUZUKI R, et al. Changes of microbial substrate metabolic patterns through a wastewater reuse process, including WWTP and SAT concerning depth[J]. Water Research, 2014, 60: 105–117. DOI:10.1016/j.watres.2014.04.036 |
| [7] | GARLAND J L, MILLS A L. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351–2359. |
| [8] | TIQUIA S M. Metabolic diversity of the heterotrophic microorganisms and potential link to pollution of the Rouge River[J]. Environmental Pollution, 2010, 158(5): 1435–1443. DOI:10.1016/j.envpol.2009.12.035 |
| [9] | CHOI K H, DOBBS F C. Comparison of two kinds of Biolog microplates (GN and ECO) in their ability to distinguish among aquatic microbial communities[J]. Journal of Microbiological Methods, 1999, 36(3): 203–213. DOI:10.1016/S0167-7012(99)00034-2 |
| [10] |
高晓奇, 肖能文, 叶瑶, 等. 基于Biolog-ECO分析长庆油田土壤微生物群落功能多样性特征[J].
应用与环境生物学报, 2014, 20(5): 913–918.
GAO X Q, XIAO N W, YE Y, et al. Analysis of microbial community functional diversity in the Changqing Oilfield based on Biology-ECO method[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(5): 913–918. |
| [11] |
乔顺风, 刘恒义, 靳秀云, 等. 养殖水体氨氮积累危害与生物利用[J].
河北渔业, 2006: 20–22.
QIAN S F, LIU H Y, JIN X Y, et al. The accumulation and toxicity of ammonia nitrogen in aquaculture water[J]. Hebei Fisheries, 2006: 20–22. |
| [12] | LI Z F, CHE J F, XIE J, et al. Microbial succession in biofilms growing on artificial substratum in subtropical freshwater aquaculture ponds[J]. FEMS Microbiology Letters, 2017, 364(4). DOI:10.1093/femsle/fnx017 |
| [13] |
吴伟, 陈家长, 胡庚东, 等. 利用人工基质构建固定化微生物膜对池塘养殖水体的原位修复[J].
农业环境科学学报, 2008, 27(4): 1501–1507.
WU W, CHEN J Z, HU G D, et al. Research on the immobilized biofilm structure of the artificial substrates and in-site bioremediation of the pond aquaculture Water[J]. Journal of Agro-Environment Science, 2008, 27(4): 1501–1507. |
| [14] | VIAU V E, DE SOUZA D M, RODRíGUEZ E M, et al. Biofilm feeding by postlarvae of the pink shrimp Farfantepenaeus brasiliensis (Decapoda, Penaidae)[J]. Aquaculture Research, 2013, 44(5): 783–794. DOI:10.1111/are.2013.44.issue-5 |
| [15] | VIAU V E, OSTERA J M, TOLIVIA A, et al. Contribution of biofilm to water quality, survival and growth of juveniles of the freshwater crayfish Cherax quadricarinatus (Decapoda, Parastacidae)[J]. Aquaculture, 2012, 324-325: 70–78. DOI:10.1016/j.aquaculture.2011.10.009 |
| [16] |
唐永涛, 赵良杰, 杨洋, 等. 基于16S rDNA比较研究混养三角帆蚌和鲢鳙对池塘养殖水体微生物群落结构的影响[J].
淡水渔业, 2015, 45(3): 70–77.
TANG Y T, ZHAO L J, YANG Y, et al. Effects of Hyriopsis cumingii, Hypophthalmichthys molitrix and Aristichthys nobilis polycultured on microbial community structure in aquaculture ponds/enclosures:a comparative study-Based on 16S rDNA sequences[J]. Freshwater Fisheries, 2015, 45(3): 70–77. |
| [17] |
席劲瑛, 胡洪营, 姜健, 等. 生物过滤塔中微生物群落的代谢特性[J].
环境科学, 2005, 26(4): 165–170.
XI J Y, HU H Y, JIANG J, et al. Metabolic properties of the microbial community in the biofilters using Biolog microplates[J]. Environmental Science, 2005, 26(4): 165–170. |
| [18] |
冯志华, 徐军田, 李玉, 等. 封闭循环海水养殖生物滤池生物膜形成过程研究[J].
淮海工学院学报(自然科学版), 2010, 19(4): 79–82.
FENG Z H, XU J T, LI Y, et al. Study on the biofilm formation process of biofilter in a closed seawater recirculating aquaculture system[J]. Journal of Huaihai Institute of Technology (Natural Science Edition), 2010, 19(4): 79–82. |
| [19] |
刘艳红, 罗国芝, 朱学宝. 海水闭合循环系统生物滤器微生物特性研究[J].
农业环境科学学报, 2004, 23(3): 540–544.
LIU Y H, LUO G Z, ZHU X B. Microbial characteristics of biofilter in a closed marine System[J]. Journal of Agro-Environment Science, 2004, 23(3): 540–544. |
| [20] |
梁益聪, 胡湛波, 涂玮灵, 等. 碳素纤维生态基技术对城市黑臭水体的修复效果[J].
环境工程学报, 2015, 9(2): 603–608.
DOI:10.12030/j.cjee.20150216 LIANG Y C, HU Z B, TU W L, et al. Effectiveness of carbon fiber based biofilm carrier remediation technology on urban black-odorous water[J]. Chinese Journal of Environmental Engineering, 2015, 9(2): 603–608. DOI:10.12030/j.cjee.20150216 |
| [21] |
夏耘, 王一飞, 郁二蒙, 等. 生态基对草鱼生长性能、肠道及水体微生物的影响[J].
水产学报, 2014, 38(9): 1410–1420.
XIA Y, WANG Y F, YU E M, et al. Effects of eco-substrates on growth performance, intestine and water bacterial community composition of Ctenopharyngodon idella[J]. Journal of Fisheries of China, 2014, 38(9): 1410–1420. |
| [22] |
宋景华, 李谷, 张世羊, 等. 循环水养殖池塘微生物群落的碳源代谢特性和功能多样性[J].
江苏农业科学, 2013, 41(9): 305–309.
SONG J H, LI G, ZHANG S Y, et al. Carbon metabolic characteristics and functional diversity of microbial communities in recycling ponds[J]. Jiangsu Agricultural Sciences, 2013, 41(9): 305–309. |
| [23] | DAS M K, ROY S K, SARKAR D P. Characterization of anti-N-acetyl-D-glucosamine antibodies elicited through haptenated liposomes[J]. Carbohydrate research, 1984, 128(2): 335–340. DOI:10.1016/0008-6215(84)85340-9 |
| [24] | ZHOU X G, SMITH J A, OI F M, et al. Correlation of cellulase gene expression and cellulolytic activity throughout the gut of the termite Reticulitermes flavipes[J]. Gene, 2007, 395(1/2): 29–39. |
| [25] | HANES C S. The reversible formation of starch from glucose-1-phosphate catalysed by potato phosphorylase[J]. Proceedings of the Royal Society of London. Series B, Biological Sciences, 1940, 129(855): 174–208. DOI:10.1098/rspb.1940.0035 |
| [26] |
朱云昊, 谭洪新, 孙大川, 等. Biolog-ECO解析循环水鳗鲡养殖系统中不同生物降解工艺下的滤料微生物群落功能多样性特征[J].
上海海洋大学学报, 2017, 26(1): 64–74.
DOI:10.12024/jsou.20160401729 ZHU Y H, TAN H X, SUN D C, et al. Analysis of carbon metabolism diversity characters of moving bed biofilm reactor at different biodegradation process in recirculating aquaculture systems using Biolog-ECO method[J]. Journal of Shanghai Ocean University, 2017, 26(1): 64–74. DOI:10.12024/jsou.20160401729 |
| [27] |
曹煜成, 李卓佳, 文国樑, 等. 罗非鱼主养池塘水体微生物群落对碳源代谢的动态变化[J].
农业环境科学学报, 2014, 33(1): 172–177.
DOI:10.11654/jaes.2014.01.022 CAO Y C, LI Z J, WEN G L, et al. Dynamics of microbial community and its metabolisms of different carbon sources in tilapia ponds[J]. Journal of Agro-Environment Science, 2014, 33(1): 172–177. DOI:10.11654/jaes.2014.01.022 |
| [28] |
刘颖, 李丽, 孙大川, 等. 循环水养鳗系统生物过滤器中微生物群落的代谢特性[J].
水产学报, 2015, 39(10): 1539–1548.
LIU Y, LI L, SUN D C, et al. Carbon metabolism of microbial communities in biofilters of recirculating aquaculture system cultured with Anguilla marmorata[J]. Journal of Fisheries of China, 2015, 39(10): 1539–1548. |
| [29] |
李志斐, 王广军, 谢骏, 等. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析[J].
水产学报, 2016, 38(12): 1985–1995.
LI Z F, WANG G J, XIE J, et al. Microbial carbon metabolic characteristics of biofilm communities in the grass carp culture pond based on Biolog-ECO plates[J]. Journal of Fisheries of China, 2016, 38(12): 1985–1995. |
2. Key Laboratory of Tropical & Subtropical Fishery Resource Application and Cultivation, Ministry of Agriculture, Pearl River Fishery Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, Guangdong, China;
3. Guangdong Ecological Remediation of Aquaculture Pollution Research Center, Guangzhou 510380, Guangdong, China
 2017,
Vol. 26
2017,
Vol. 26


