美洲鲥(American shad,Alosa sapidissima),属鲱形目(Clupeiformes)、鲱科(Clupeidae)、鲥亚科(Alosinae)、西鲱属(Alosa),与长江鲥鱼属同一亚科,主要分布在北美洲大西洋西岸。因其在形态特征与营养价值方面与我国长江鲥鱼非常相似,在长江鲥鱼濒临灭绝的情况下,自20世纪90年代,美洲鲥被引入我国,其市场价格昂贵,市场前景广阔。
在近20年内,国内科研机构及诸多学者在引种[1]、苗种培育[2]、早期发育[3]及养殖技术[4-7]方面开展了大量的研究,直至近年,美洲鲥人工繁殖技术日趋成熟,开展适合美洲鲥大规模养殖模式的研究成为必然趋势。而目前关于美洲鲥的养殖技术主要集中在工厂化养殖[4, 7]和网箱养殖[8-9]方面,前者基础设施要求高,运营成本高,国内推广面积有限,后者自然环境要求高,适用于水库和长江河道。此外,虽然这些养殖模式的面积和数量在扩大,但养殖成功率不高,养殖技术未完全成熟;因此,充分利用美洲鲥海、淡水均适宜养殖的特性,结合我国广阔的池塘养殖空间,研发美洲鲥池塘养殖模式并提高养殖技术具有重要的现实意义和推广意义,也可为广大养殖户带来巨大的经济效益。本文开展了美洲鲥1+龄鱼种池塘养殖生长特性研究,以期为美洲鲥池塘养殖生产和池塘养殖全过程提供生长特性的理论基础数据。
1 材料与方法 1.1 材料 1.1.1 养殖池塘试验用池塘为2个相邻的0.17 hm2的池塘(编号:10#东,10#西),池塘为泥质塘底,深约2.0 m,注水深1.8 m,每个池塘具有独立进排水设施,并均配备1台1.5 kW的叶轮增氧机。
池塘使用前进行修整和清塘消毒。进水口套60目筛绢网,排水口设立两道拦网,第一道围网,第二道闸网。采用225 kg/hm2的漂白精消毒池塘后,进水至满池,1周后使用池塘开展养殖试验。
1.1.2 试验用鱼试验用鱼为美洲鲥1+龄鱼种,该鱼种为上海市水产研究所奉贤科研基地2015年5月通过人工繁殖并经室内培育和陆基水泥池养殖越冬培育而成。
1.2 方法 1.2.1 养殖方式试验于2016年5月至11月期间,在上海市奉贤区域内上海市水产研究所奉贤科研基地进行。美洲鲥1+龄鱼种采用池塘单养模式开展养殖。自2016年5月1日开始,将本科研基地陆基水泥池中的美洲鲥1+龄鱼种2 600尾转运至10#东进行养殖。另留存1 600余尾在陆基水泥池中暂养,陆基水泥池面积为200 m2,水深1.5 m,至5月30日,将此1 600尾鱼种转运至10#西进行养殖。
1.2.2 养殖管理6月30日,为降低水温,安全度夏,利用10#东、10#西越冬大棚遗留的底钢丝结构,全池塘覆盖遮荫膜,至9月1日,拆除所有遮荫膜。
1.2.3 投饲管理养殖期间投喂浮性海水膨化颗粒饲料,根据养殖阶段不同选择合适口径的颗粒,早期投喂2#颗粒饲料,1月后投喂3#颗粒饲料。未遮盖遮荫膜阶段饲料投放在饲料框内,饲料框尺寸为1.5 m× 2.0 m,木质结构,四周框围20 cm高的15目皮条网,遮盖遮荫膜阶段直接投放在池内。
1.2.4 水质管理养殖用水为当地河口水,盐度变化范围3~12,pH 7~9,DO保持在5 mg/L以上。水温低于28 ℃,每两周换水1次,每次换水量为1/3,水温高于28 ℃,适时换水,换水量为1/5,特别是盛夏期间,当外界水温相对较低时连续少量多次换水。
1.2.5 日常管理试验期间,每天上、下午各测量1次水温,定期检测池塘内常规水质指标。定时定点投喂饲料,每天清理未吃完的饲料。及时清理池塘内死鱼。
1.3 数据统计 1.3.1 数据采集定期测量美洲鲥生长数据,采集测量的美洲鲥采用拉网方式捕获,随机从拉网中抽取30尾美洲鲥进行体长、体质量测量。体长测量采用直尺(0.01 cm)、体质量测量采用电子秤(0.1 g)。
1.3.2 数据分析采用SPSS 19.0对测量数据进行统计分析,Excel进行图表绘制。数据分析中各项参数的计算公式如下:
 (1)
(1)
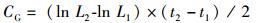 (2)
(2)
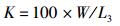 (3)
(3)
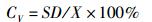 (4)
(4)
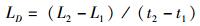 (5)
(5)
 (6)
(6)
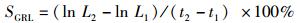 (7)
(7)
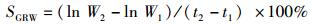 (8)
(8)
式中:W为体质量(g);L为体长(cm);CG为生长常数;K为肥满度;CV为变异系数(%);LD日均增长量(cm/d);WD为日均增重量(g/d);SGRL为特定增长率(%/d);SGRW为特定增重率(%/d):W1、W2和L1、L2分别为t1,t2时的体质量(g)和体长(cm);SD为标准差;X为平均值;a和b为常数。
2 结果与分析 2.1 生长情况美洲鲥1+龄鱼种的养殖,10#东初始养殖密度为15 600尾/hm2;经185 d养殖,体长增加49.8%、体质量增加300.8%,体质量增加明显;池塘养殖成活率为46.65%。10#西初始养殖密度约为10#东的61.5%,为9 600尾/ hm2;10#西投放鱼种时间比10#东晚30 d,经30 d陆基水泥池养殖,初始放入10#西的鱼种与经30 d池塘养殖的10#东鱼种体长、体质量的生长均无显著性差异(P>0.05);10#西池塘养殖成活率为42.7%。
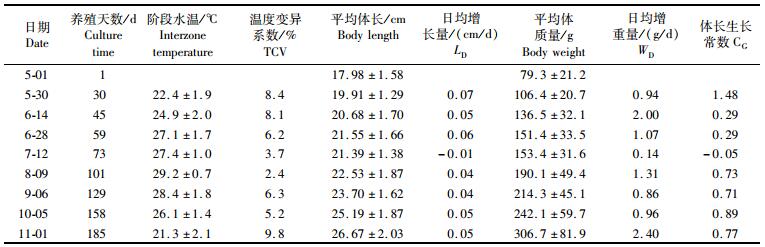
将两个池塘美洲鲥各阶段生长数据合并统计(P>0.01),分析美洲鲥1+龄鱼种池塘养殖的生长特性(表 1)。美洲鲥1+龄鱼种养殖周期为185 d,期间水温变化范围为16.4~30.8 ℃,各检测周期内的阶段平均水温、温度变异系数(Temperature Coefficient of Variation, TCV)随着养殖时间的增加均呈“U”型变化;养殖周期内体长增长48.3%,达到(26.67±2.03)cm,体质量增加286.8%,达到(306.7±81.9)g,体质量增加明显。日均增长量随着养殖时间的增加呈“U”型变化,最高出现在第1~30天(0.07 cm/d),日均增重量随着养殖时间的增加呈“W”型变化,其中养殖早期(第1~45天)出现持续增加并形成一个小高峰,养殖后期(第158~185天)达到最大值2.40 g/d;生长常数最大值(1.48)出现在养殖初期(第1~30天),且随着养殖天数的增加下降明显,至养殖中后期则维持在相对稳定的数值区间(0.71~0.89)。
|
表 1 池塘养殖美洲鲥生长特性 Tab.1 Growth characteristics of pond-reared Alosa sapidissima |
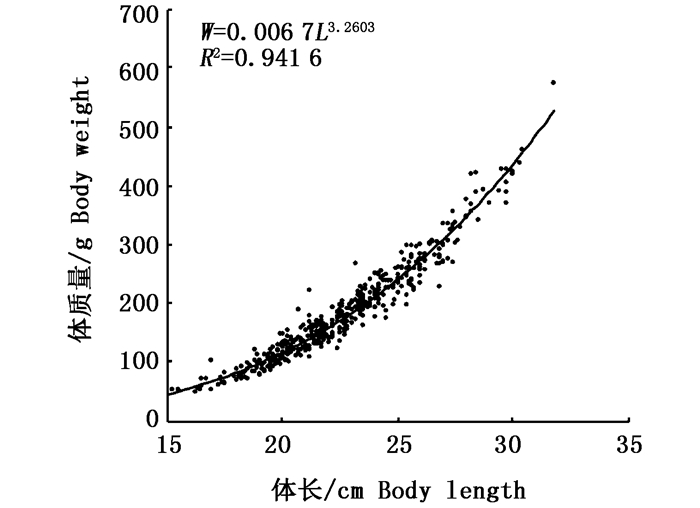
对测得的美洲鲥体长、体质量数据拟合体长和体质量生长方程关系式(W=aLb)得到体长和体质量的关系为:W=0.006 7L3.2603,R2=0.941 6(图 1)。拟合方程式中,b=3.260 3,b值接近3,表明此阶段美洲鲥的生长为匀速生长,体质量增长略快于体长增长。
|
图 1 体长与体质量的关系
Fig. 1 Relationship between body length and body weight of pond-reared Alosa sapidissima
|
对体长与养殖天数拟合方程,其生长曲线见图 2。体长与养殖天数关系为:L=0.000 002 T3-0.006 10T2+0.090 825T+17.574 103,R2=0.994 3。拟合方程,经计算可得,体长生长拐点出现在第100.8天,在此拐点前体长生长速度随养殖天数增加而下降,拐点后体长生长速度随养殖天数增加而增加。
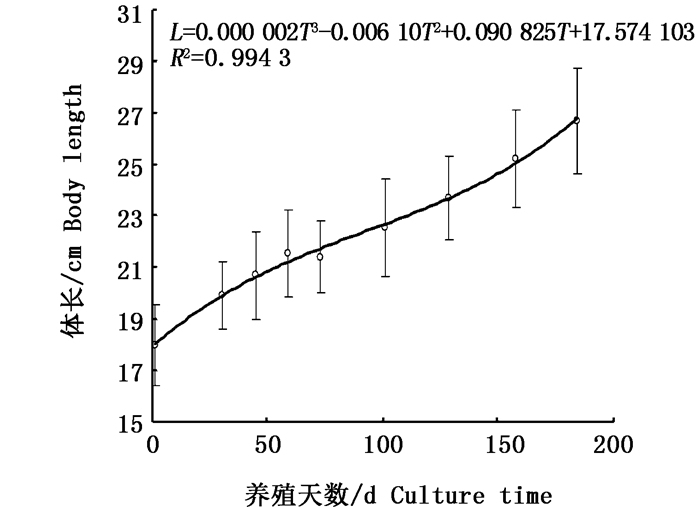
|
图 2 体长与养殖天数的关系
Fig. 2 Growth curve of body length of pond-reared Alosa sapidissima
|
对体质量与养殖天数拟合方程,其生长曲线见图 3。体质量与养殖天数关系为:W=0.000 04T3-0.010 13T2+1.680 14T+74.079 88,R2=0.991 6。拟合方程,经计算可得,体质量生长拐点出现在第96.5天,在此拐点前体质量生长速度随养殖天数增加而下降,拐点后体质量生长速度随养殖天数增加而增加,其变化规律与体长生长速度变化规律相同。
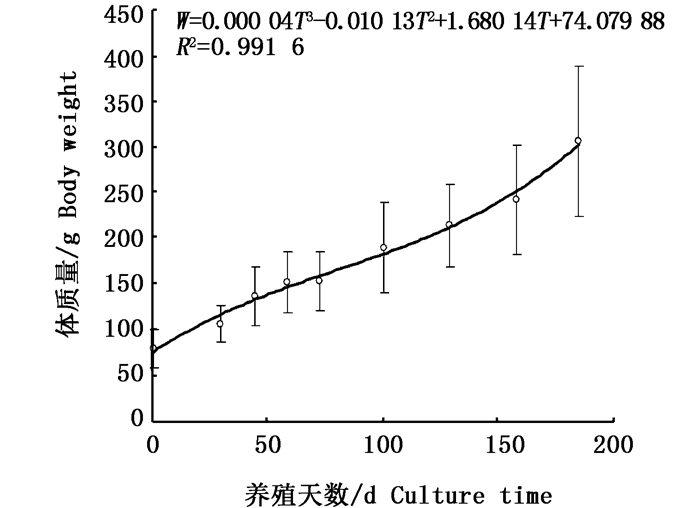
|
图 3 体质量与养殖天数的关系
Fig. 3 Growth curve of body weight of pond-reared Alosa sapidissima
|
由图 4可知,在养殖周期内,美洲鲥体长、体质量变异系数[Body Length (Weight) Coefficient of Variation, LCV(WCV)]变化趋势相同,均呈波浪形波动,体长、体质量变异系数最大值(8.77%,26.71%)为放养时生长初始值。养殖过程中,体长、体质量变异系数峰值均出现在45 d(6月14日)、101 d(8月9日)、185 d(11月1日),其中体长变异系数101 d(8月9日)最大(8.32%);体质量变异系数185 d(11月1日)最大(26.69%);体长变异系数的最低谷值(6.44%)出现在73 d(7月12日),体质量变异系数的最低谷值(19.41%)出现在30 d(5月30日)。肥满度在养殖早期(第1~30天,5月1日至5月30日)较低,1 d(5月1日)、30 d(5月30日)肥满度均为1.34,但肥满度变异系数明显变小(13.69%→7.51%);养殖中后期(第45~185天,6月14日至11月1日)在相对较高的范围内波动,其中在101 d(8月9日)达到峰值(1.63),之后虽有所下降,但在养殖后期出现上升趋势,肥满度变异系数在养殖中期(第73~129天,7月12日至9月6日)呈现连续增长(7.42%→10.41%),至养殖后期呈下降趋势。
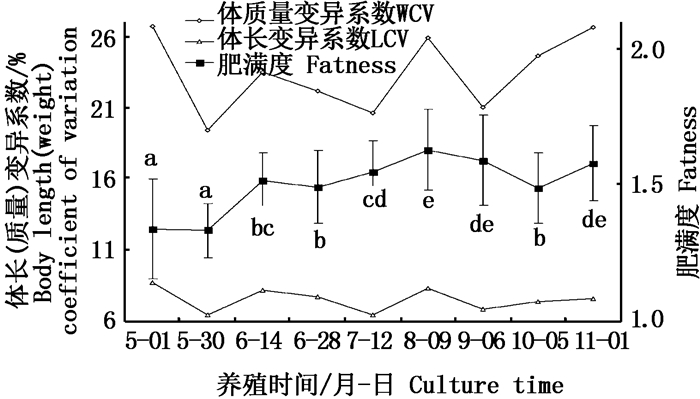
|
图 4 体长(质量)变异系数、肥满度与养殖时间的关系
Fig. 4 Correlation between LCV (WCV) and culturetime and correlation between fatness and culture time
|
由图 5可知,阶段平均水温符合季节变化规律,但其变异系数变化趋势与其明显背离,并且在第73~101天阶段(7月12日至8月9日)维持在较低范围内(2.41%~3.66%),其余阶段的阶段平均水温变异系数均大于6%。在养殖早期,特定增重率随着水温的上升而增加,第30~45天阶段(5月30日至6月14日)的特定增重率达到最大(1.66 %/d);第45~73天阶段(6月14日至7月12日),特定增重率随着水温的上升而降低,并在第59~73天阶段(6月28日至7月12日)达到最小(0.09 %/d);至养殖中后期,特定增重率随着水温的下降呈增长趋势。特定增长率变化幅度较小,随温度的变化趋势大致与特定增重率随温度的变化趋势相同。养殖早期,在第1~30天阶段(5月1日至5月30日)的特定增长率达到最大(0.35 %/d);养殖中期,在第59~73天阶段(6月28日至7月12日)达到最小(-0.05 %/d);此后,维持在窄幅范围内波动(0.18 %/d~0.21 %/d)。

|
图 5 特定增长(质量)率与水温的关系
Fig. 5 Correlation between water temperature and SGRL (SGRW) of pond-reared Alosa sapidissima
|
鱼类的体长、体质量作为重要的生物学特征,是判断鱼类种质质量和养殖效果的标准之一[10]。本试验中,拟合体长和体质量的关系为:W=0.006 7L3.260 3,其中b=3.260 3,b值接近3,表明池养美洲鲥1+龄鱼种在试验期间为匀速生长,体质量生长略快于体长生长,这与王汉平等[11]对池养同龄珠江鲥鱼生长特性的研究有所不同(b=2.991 2,< 3.260 3)。养殖环境和养殖密度是造成区别的主要因素,王汉平等[11]认为不同纬度的鲥鱼,不论养殖还是天然鲥鱼,其生长差异明显,如长江鲥鱼的生长明显快于珠江鲥鱼,庄平等[12]则发现养殖密度对施氏鲟生长有显著影响。
3.2 生长式型目前,主要用贝特朗菲(von Bertalanffy)方程和幂指数生长方程[13]研究鱼类生长规律。施永海等[4]对工厂化养殖美洲鲥开展周年生长特性研究,拟合出von Bertallanffy生长方程,雌为Lt=467.92[1-e-0.574 8(t+0.171 0)],Wt=1 637.72[1-e-0.574 8(t+0.171 0)]3.111 3;雄为Lt=389.21[1-e-0.737 4(t+0.197 5)],Wt=834.08[1-e-0.737 4(t+0.718 9)]3.057 4。而本试验体长、体质量数据与养殖时间拟合方程均显示三次函数方程优于前两者,R2分别为0.994 3和0.991 6。经计算得出体长、体质量生长拐点分别为100.8 d和96.5 d,两者相近,体质量生长拐点略早于体长生长拐点,且两个拐点分别出现在当年立秋(8月7日)前后,其中,体质量生长拐点(约1.3周年)与施永海等[4]对工厂化养殖美洲鲥周年生长特性研究拟合方程所得的拐点(雌鱼为1.52周年;雄鱼为1.22周年)在实际生长时间上相近,说明对于养殖的美洲鲥而言,不论工厂化还是池塘养殖,其体质量快速生长期主要在1+龄段。关于体长、体质量生长拐点不同的研究结果,罗钦等[14]对澳洲龙纹斑的研究中也曾报道。出现本文结果中所述的体长、体质量随养殖天数的变化规律,其主要原因为拐点之前,养殖初期的补偿生长以及适宜的水温环境使得体长、体质量在初期生长速度明显快,这与生长常数和日均增长(重)量的变化规律相符,随着养殖水温的升高,美洲鲥活动能耗增加,生长趋于平缓;拐点之后,随着养殖水温的逐渐降低,美洲鲥逐渐进入适宜生长环境,并且为越冬储备大量的能量,表现为体长、体质量生长速度加快。而体质量拐点早于体长拐点,这与生长阶段有关,随着养殖时间的增加,美洲鲥逐渐从幼鱼期过渡到成鱼期,成鱼期以体质量生长为主,为越冬后第二年的性腺繁殖发育提供能量基础,陈慧等[15]对网箱养殖大黄鱼的生长特性研究也有相同发现。
3.3 阶段生长生长常数用于划分鱼类的生长阶段,同一生长阶段生长常数比较接近[16],美洲鲥1+龄鱼种的体长生长常数表现出明显的季节特征,春末夏初处于快速生长期,体长生长明显;整个夏季体长生长常数维持较低水平(CG < 0.3),表明该阶段生长不明显,其中6月28日至7月12日期间,体长生长常数出现负值,则是由高温期间采样导致美洲鲥大量死亡而造成的采样误差所致;夏末入秋,体长生长常数在较高范围内窄幅波动(0.71~0.89),表明该阶段为平稳生长期。而在体长快速生长期阶段(第1~30天,5月1日至5月30日),日均增长量为试验期间最高,达0.07 cm/d,之后(第30~45天,5月30日至6月14日)呈现下降趋势,而在这期间(第1~45天,5月1日至6月14日)日均增重量则呈上升趋势,这说明美洲鲥1+龄鱼种在由陆基水泥池转入池塘养殖的初期,出现补偿生长现象。这种补偿生长先由体长开始,体质量的补偿生长则相对滞后,其原因可能是美洲鲥在陆基水泥池中养殖密度较大,小水体大密度的环境下越冬,其体长、体质量的生长均受到抑制,当放入池塘进行养殖后,优越的养殖环境和饵料环境,使得体长优先出现补偿现象,而初期由于美洲鲥急速游动的习性,池塘大环境条件下消耗更多的能量,这些能量的消耗减缓了体质量的补偿生长,随着环境的适应和摄食的增加,体质量补偿现象得以体现。
3.4 生长离散与肥满度美洲鲥1+龄鱼种池塘养殖的肥满度及其变化规律与同龄池塘养殖的珠江鲥鱼(1.43~1.57)[11]、尖吻鲈(1.39~1.64)和花鲈(1.34~1.53)[17]大致相同。根据生长离散和肥满度的变化规律以及肥满度各阶段显著差异,大致可将池塘养殖美洲鲥的肥满度变化分为三个阶段,第一阶段(第1~30天,5月1日至5月30日),此阶段肥满度最低,且与其他阶段存在显著性差异(P<0.05),经30 d的养殖,体质量变异系数明显降低(26.71%→19.41%),表明养殖环境的优化使得原本在陆基水泥池小环境中空间和资源趋于紧张的美洲鲥平均生长率提高,庄平等[12]研究也发现当鱼类生存水域空间趋于紧张时,劣势鱼生长影响较大,易造成生长离散加剧,当环境改善后,这种生长离散加剧自然会降低;而此阶段肥满度并未改变(1.34),则是由合并数据统计所致,10#西美洲鲥30 d从陆基放入池塘;第二阶段(第30~73天,5月1日至7月12日),此阶段生长离散呈下降趋势,体长、体质量变异系数均逐渐变小,肥满度呈上升趋势,与第一阶段差异显著(P<0.05),说明美洲鲥经过池塘养殖初期适应后,随着鱼体规格的不断变大,其对环境应激能力增强,抵抗力增强,生长离散逐渐变小,这与祖岫杰等[18]对二龄拉氏
鱼类在一定温度范围内随温度的升高生长速率加快,当超出其适宜生长温度范围时,生长速率明显减缓甚至死亡[18-20]。美洲鲥不耐高温,当水温连续高于30 ℃,即会出现大量死亡,我国大部分区域夏季池塘水温均高于30 ℃。因此,水温是目前开展美洲鲥池塘养殖技术研究较为滞后的因素之一,而通过对整个池塘覆盖遮荫膜的方式,解决了夏季高温造成美洲鲥大量死亡的技术问题。试验期间,利用遮荫膜的降温和适时换水,池塘水温维持在30.8 ℃以下,从阶段水温变异系数的变化趋势(表 1)亦可知,盖遮荫膜在夏季高温阶段将水温稳定地控制在窄幅范围内,避免极端高温和极端温差对养殖的影响。
本试验中,在第59~73天阶段,特定增长(重)率均出现最低值,对应阶段平均水温为(27.4±1.0) ℃,这主要是由于遮盖遮荫膜对环境的变化造成的,在此阶段美洲鲥摄食受影响,进而影响生长。如图 5所示,以73 d为对称轴线,特定增长(重)率、阶段平均水温变化规律大致呈对称变化,其中特定增长率较特定增重率变化更为平稳,主要是特定增重率受池塘适应阶段的补偿生长、养殖中期的雌雄分化等影响更大,因此以特定增长率与阶段平均水温的变化规律判断适宜美洲鲥生长水温更为客观。在养殖周期内,阶段平均水温与特定增长率变化趋势相反,根据两者对应变化趋势和峰谷值判断,第1~30天阶段特定增长率达到0.35 %/d,此时水温变化范围为18.2~27.6 ℃,阶段平均水温(20.4±1.9) ℃;第129~185天特定增长率维持在0.21%/d,此阶段水温变化范围为16.4~30.0 ℃,第158~185天的阶段平均水温为(21.3±2.1) ℃,就整个养殖周期而言,美洲鲥1+龄鱼种适宜生长水温范围为16~30 ℃,最适生长水温为19~24 ℃。此外,7~8月最高阶段平均水温期间,特定增长(重)率仍呈上升趋势,这一现象与谢永德等[21]对菊黄东方鲀池塘生长的研究有相似也有不同,其认为长江流域室外养殖,生长高峰出现在4—6月和9—11月,而7—8月特定增长(重)率出现上升趋势,这说明极端高温虽然容易引起美洲鲥死亡,但由于遮荫膜的存在,降低了池塘温度绝对值和温差,减小了温度变异系数,相对稳定的环境有利于美洲鲥生长,这也为肥满度在高温期间(7月12日至8月9日)达到最大值提供了数据和理论支撑。
3.6 养殖密度与生长10#东初始养殖密度(体长为17~20 cm,15 600尾/hm2)明显高于10#西(体长为17~20 cm,9 600尾/ hm2),这两个养殖密度又明显高于李兵[22]开展池塘养殖报道的同规格美洲鲥养殖密度(体长为15~20 cm,3 000~4 500尾/ hm2),在相对较高养殖密度状态下,10#东、10#西的美洲鲥体长、体质量生长均无极显著差异(P>0.01),结合10#东、10#西美洲鲥成活率相近可初步判断美洲鲥可适宜较高密度(15 600尾/hm2)池塘养殖。
而造成美洲鲥养殖成活率较低(10#东为46.65%;10#西为42.70%)的主要原因为水温和采样测量,生长数据样本的采集通过拉网获得,拉网时美洲鲥对表层较高的水温产生应激反应,造成热休克并导致后续死亡,同时拉网易造成机械损伤,美洲鲥冲撞网片造成擦伤并后续死亡,在实际操作过程中,虽采取半池塘拉网并及时开启增氧机的措施,但仍只是一种补救措施,因此建议在池塘养殖期间,避免拉网操作,同时在高温期间尽量少换水。此外,在使用遮盖遮荫膜期间,池塘光合作用较弱,而美洲鲥喜集群快速游动并消耗大量氧气[23],建议在此期间,早晨晚些关闭增氧机,临近天黑开启增氧机,连续阴雨天可在中午开启增氧机:以上措施可避免美洲鲥因缺氧而造成大量死亡,进而提高养殖成活率。
综上所述,美洲鲥1+龄鱼种在池塘养殖条件下,185 d的养殖周期内,其体长、体质量生长呈幂函数关系,属匀速生长型。体长、体质量与养殖天数均呈三次函数增长相关,体长和体质量生长拐点分别出现在第100.8天和第96.5天。最适生长水温为19~24 ℃。
建议在美洲鲥池塘养殖期间,加强对水温的控制和管理,根据水温情况适时适量换水,夏季高温时段可采用池塘遮盖遮荫膜的方式降低水温,减少拉网操作。
| [1] |
蔡惠凤, 戴海平, 袁思平, 等. 美国鲥鱼的引种与人工养殖试验[J].
中国水产, 2014: 59–60.
CAI H F, DAI H P, YUAN S P, et al. Introduction and artificial culture test of Alosa sapidissima[J]. China Fisheries, 2014: 59–60. |
| [2] |
潘庭双, 李海洋, 侯冠军. 美洲鲥鱼的生物学特性及大规格苗种培育技术[J].
水利渔业, 2006, 26(4): 33–34.
PAN T S, LI H Y, HOU G J. Biological characteristics and big-sized fingerling rearing of Alosa sapidissima[J]. Reservoir Fisheries, 2006, 26(4): 33–34. |
| [3] |
邓平平, 施永海, 徐嘉波, 等. 美洲鲥仔稚鱼脊柱及附肢骨骼系统的早期发育[J].
中国水产科学, 2017, 24(1): 73–81.
DENG P P, SHI Y H, XU J B, et al. Early development of the vertebral column and appendicular skeleton of Alosa sapidissima[J]. Journal of Fishery Sciences of China, 2017, 24(1): 73–81. |
| [4] |
施永海, 徐嘉波, 陆根海, 等. 养殖美洲鲥的生长特性[J].
动物学杂志, 2017, 52(4): 638–645.
SHI Y H, XU J B, LU G H, et al. Growth characteristics of cultured American shad Alosa sapidissima[J]. Chinese Journal of Zoology, 2017, 52(4): 638–645. |
| [5] |
张云龙, 邵辉, 袁娟, 等. 美国鲥鱼高产模式关键技术[J].
渔业致富指南, 2010: 35–36.
ZHANG Y L, SHAO H, YUAN J, et al. The key technology of Alosa sapidissima high yield mode[J]. Fishery Guide to be Rich, 2010: 35–36. |
| [6] |
高峰. 浅析美洲鲥鱼生态养殖关键技术[J].
水产养殖, 2015, 36(2): 39–41.
GAO F. The analysis on the key technology of Alosa sapidissima ecological culture[J]. Journal of Aquaculture, 2015, 36(2): 39–41. |
| [7] |
缪晓燕, 樊昌杰, 朱爱琴, 等. 美洲鲥工厂化养殖技术初探[J].
水产科技情报, 2014, 41(4): 176–179.
MIAO X Y, FAN C J, ZHU A Q, et al. A preliminary study on the technology of Alosa sapidissima industrial aquaculture[J]. Fisheries Science & Technology Information, 2014, 41(4): 176–179. |
| [8] |
郭礼中, 丁华东. 美洲鲥鱼长江网箱养殖初探[J].
科学养鱼, 2010: 30–31.
GUO L Z, DING H D. Preliminary study on cage culture of American shad in Yangtze River[J]. Scientific Fish Farming, 2010: 30–31. |
| [9] |
贾俊威. 美洲鲥鱼水库网箱养殖试验[J].
安徽农学通报, 2016, 22(14): 133–134.
DOI:10.3969/j.issn.1007-7731.2016.14.056 JIA J W. The trial of Alosa sapidissima cage culture in reservoir[J]. Anhui Agricultural Science Bulletin, 2016, 22(14): 133–134. DOI:10.3969/j.issn.1007-7731.2016.14.056 |
| [10] |
李思发. 中国淡水主要养殖鱼类种质研究[M]. 上海: 上海科学技术出版社, 1998.
LI S F. Genetical characterization of major freshwater culture fishes in China[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1998. |
| [11] |
王汉平, 钟鸣远, 陈大庆, 等. 鲥鱼的驯养与生物学研究Ⅱ.池养鲥鱼的生长特性及其与温度的关系[J].
应用生态学报, 1995, 6(3): 291–297.
WANG H P, ZHONG M Y, CHEN D Q, et al. Domestication of Tenualosa reevesii and its biology, Ⅱ. Growth characteristics of pondreared reeves shad and its relation to temperature[J]. Chinese Journal of Applied Ecology, 1995, 6(3): 291–297. |
| [12] |
庄平, 李大鹏, 王明学, 等. 养殖密度对史氏鲟稚鱼生长的影响[J].
应用生态学报, 2002, 13(6): 735–738.
ZHUANG P, LI D P, WANG M X, et al. Effect of stocking density on growth of juvenile Acipenser schrenckii[J]. Chinese Journal of Applied Ecology, 2002, 13(6): 735–738. |
| [13] |
陆小萏, 陆文杰, 郑光明, 等. 鱼类生长的幂指数生长方程[J].
水产学报, 2002, 26(3): 281–284.
LU X D, LU W J, ZHENG G M, et al. Power-exponential growth equation of fish growth[J]. Journal of Fisheries of China, 2002, 26(3): 281–284. |
| [14] |
罗钦, 罗土炎, 林旋, 等. 澳洲龙纹斑鱼种生长特性研究[J].
福建农业学报, 2016, 31(1): 7–11.
LUO Q, LUO T Y, LIN X, et al. Growth performance of juvenile Murray Cod, Maccullochella peelii peelii[J]. Fujian Journal of Agricultural Sciences, 2016, 31(1): 7–11. |
| [15] |
陈慧, 林国文, 刘招坤, 等. 网箱养殖大黄鱼生长特性的研究[J].
海洋科学, 2010, 34(11): 1–5.
CHEN H, LIN G W, LIU Z K, et al. Study on growth characters of cultured Pseudosciaena crocea originated from Eastern Fujian[J]. Marine Sciences, 2010, 34(11): 1–5. |
| [16] |
殷名称. 鱼类生态学[M]. 北京: 中国农业出版社, 1995.
YIN M C. Fish ecology[M]. Beijing: China Agriculture Press, 1995. |
| [17] |
张邦杰, 梁仁杰, 毛大宁, 等. 池养尖吻鲈和花鲈的生长特性[J].
水产科技情报, 1998, 25(2): 60–65.
ZHANG B J, LIANG R J, MAO D N, et al. Growth characteristics of pond reared Lates calcarifer and Lateolabrax japonicus[J]. Fisheries Science & Technology Information, 1998, 25(2): 60–65. |
| [18] |
祖岫杰, 刘艳辉, 李改娟, 等. 二龄拉氏鱥在池塘养殖条件下的生长特性[J].
渔业现代化, 2015, 42(4): 26–29.
ZU X J, LIU Y H, LI G J, et al. The pond culture and growth performances of two-year Phoxinus lagowskii Dybowskii[J]. Fishery Modernization, 2015, 42(4): 26–29. |
| [19] |
姜作发, 尹家胜, 徐伟, 等. 人工养殖条件下哲罗鱼生长的初步研究[J].
水产学报, 2003, 27(6): 590–594.
JIANG Z F, YIN J S, XU W, et al. A preliminary study on the growth of Hucho taimen under artificial rearing conditions[J]. Journal of Fisheries of China, 2003, 27(6): 590–594. |
| [20] |
姜作发, 贾锺贺, 白庆利, 等. 人工养殖山女鳟幼鱼的生长特性[J].
中国水产科学, 2007, 14(1): 160–164.
JIANG Z F, JIA Z H, BAI Q L, et al. Growth characters of cultured juvenile Oncorhynchus masou masou[J]. Journal of Fishery Sciences of China, 2007, 14(1): 160–164. |
| [21] |
谢永德, 施永海, 张海明, 等. 池养菊黄东方鲀一龄越冬鱼种的生长特性[J].
浙江海洋学院学报(自然科学版), 2012, 31(4): 340–344.
XIE Y D, SHI Y H, ZHANG H M, et al. Study on growth characteristics of one-year-old overwintering Takifugu flavidus under artificial culturing condition[J]. Journal of Zhejiang Ocean University (Natural Science), 2012, 31(4): 340–344. |
| [22] |
李兵. 美洲鲥的生物学特性及池塘养殖技术[J].
海洋与渔业, 2008: 35–36.
DOI:10.3969/j.issn.1672-4046.2008.10.013 LI B. The biological characteristics and pond farming technology of Alosa sapidissima[J]. Ocean & Fishery, 2008: 35–36. DOI:10.3969/j.issn.1672-4046.2008.10.013 |
| [23] |
刘青华, 贾艳菊, 高永利, 等. 美国鲥鱼的生物学特性与集约化养殖管理[J].
渔业现代化, 2006: 26–27, 34.
LIU Q H, JIA Y J, GAO Y L, et al. Biological characteristics and intensive culture management for American shad, Alosa sapidissima[J]. Fishery Modernization, 2006: 26–27, 34. |
 2018,
Vol. 27
2018,
Vol. 27


