2. 上海海洋大学 水域环境生态上海高校工程研究中心, 上海 201306;
3. 上海海洋大学 海洋科学研究院, 上海 201306
2007年IPCC的科学评估报告指出海洋是全球碳循环系统重要的“碳汇”,其固碳总量大约可以达到3.81Gt,海洋表面碳循环过程每年净收支的碳量约为1.6 Gt[1]。研究表明,大型海藻及浮游植物共同完成了地球上90%的光合作用,而大型海藻的固碳潜能比浮游植物大得多[2-3]。DUARTE和CHISCANO[4]在海藻固碳方面的研究显示,大型海藻每年固碳量高达120~329 Mt。而CHUNG等[5]对褐藻藻场的实验结果表明,褐藻规模养殖每年固碳量可达10 t。大型海藻光合固碳作用有利于缓解海洋酸化。研究发现,海洋酸化会严重危害海洋生物,干扰海洋中最重要的基础生物珊瑚虫以及其他浮游生物的骨骼钙化。另外对鱼类、海胆、头足类的毒性效应都已发生[6],所以利用大型海藻固碳效应缓解海洋酸化具有重要的研究意义。近年来,有关大型海藻生态修复作用已有大量报道,但修复效应评估多见于大型海藻对N、P营养盐及重金属等的吸收,而对于大型海藻固碳方面的研究仍较为有限。
瓦氏马尾藻(Sargassum vachellianum)是我国东南沿海的大型海藻种类,其研究价值和意义举足轻重[7]。据调查,浙江省枸杞岛瓦氏马尾藻野生资源受到严重破坏,目前,针对马尾藻海藻场已经开展了修复、重建和研究工作,研究主要集中在海藻生长及光合作用对环境因子的响应、海藻的人工增殖、藻场的重建及修复等方面[8-11],但瓦氏马尾藻光合无机碳吸收方面的研究尚未展开。因此,本文选择浙江省枸杞岛瓦氏马尾藻藻场生态系统修复作为背景,研究主要环境因子温度、光照强度及氮磷水平对中国特有大型海藻种类瓦氏马尾藻无机碳吸收及提升海水pH能力的影响。为藻场修复后的碳汇效应的评估提供理论依据,也为海洋“碳汇”对CO2减排和防止海洋酸化作用的评估方法提供数据支撑。
1 材料与方法 1.1 材料及预培养实验用瓦氏马尾藻取自浙江舟山枸杞岛,采集时间为2014年5月,低温保存带回,后在上海海洋大学藻类培养室进行预培养。预培养时,挑选健康的新鲜藻体切取顶端藻段[(2±0.1)cm]放入盛有VSE培养液的5 L锥形瓶中进行不同密度的预培养,海藻预培养条件:温度20 ℃,盐度30,光照强度60 μmol/(m2·s),光照周期12 L:12 D,连续充气,培养过程中每隔3 d需添加1次VSE培养液,并且每隔6 d换1次新鲜的消毒海水。实验前2周培养,供实验用。
1.2 实验设计实验时选择50 mL封闭的透明比色管,加入新鲜的消毒海水和实验前配制的VSE培养液,并分别称取(0.125±0.01)g(预培养结果表明,当培养密度低于2.5 g/L,生长率无明显变化)生长旺盛的健康藻体盛于比色管中,在以下条件下进行培养,适应性培养3 d后,更换新的比色管及培养液,并将藻体生物量减少到初始密度,测定72 h内培养液中DIC浓度及pH的变化情况,其测定方法参照冯子慧等[12]。
温度实验设置10、15、20、25、30 ℃共5个梯度,光照强度为60 μmol/(m2·s);光照强度实验设置20、60、100、200、300 μmol/(m2·s)共5个梯度,温度为20 ℃;氮、磷加富实验设置4个不同N、P水平组合,即向自然消毒海水(NaNO3浓度约19 μmol/L,NaH2PO4浓度约1.3 μmol/L)中添加不同浓度的氮磷溶液,使其呈现4种浓度,高氮磷(HNP):添加500 μmol/L NaNO3和30 μmol/L NaH2PO4;高氮低磷(HNLP):500 μmol/L NaNO3;低氮高磷(LNHP):30 μmol/L NaH2PO4;低氮磷(LNP):不加NaNO3和NaH2PO4,光照强度为60 μmol/(m2·s),温度为20 ℃,实验设计参照李少香等[13]的研究。每组设置3个重复实验,在连续培养6 h(L)、12 h(L)、24 h(12 L:12 D)、48 h(12 L:12 D)、72 h(12L:12D)后,分别测定培养液中DIC浓度及pH。
1.3 海水溶解无机碳(DIC)及pH测定各组实验过程中,培养液中DIC的浓度由TOC-VCPH总有机碳分析仪(Shimadzu公司,日本)测得,其pH用FE 20数显pH计(Mettler Toledo公司,瑞士)测定。
1.4 数据分析整理数据并用Excel 2007绘制图形,用OriginPro 8.0软件进行单因子方差分析(one-way ANOVA),利用SPSS 19软件进行Duncan’s多重比较分析重复实验结果均值的差异显著性,设显著性差异水平为P < 0.05,数据值以平均值±标准误(X±SE,n=3)表示。
2 结果 2.1 不同温度条件对瓦氏马尾藻无机碳吸收能力及提升海水pH的影响图 1a为不同温度梯度下瓦氏马尾藻培养液中DIC浓度的变化。0 ~ 12 h,DIC浓度显著降低,12 ~ 24 h DIC浓度重新上升,之后DIC浓度的下降幅度逐渐变小。其中,20 ℃实验组DIC浓度有显著下降,0 ~ 12 h的降幅达到0.48 mmol/L,而30 ℃实验组降幅最小(0.14 mmol/L),且72 h后回升至2.19 mmol/L,藻体变软且颜色变深,表明藻体不适应30 ℃高温条件。
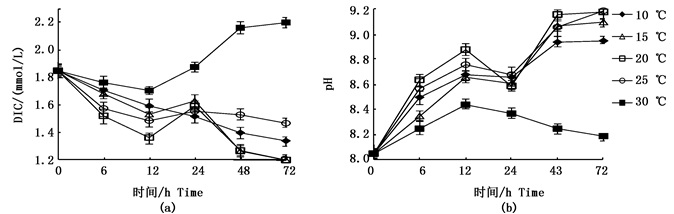
|
图 1 不同温度条件下瓦氏马尾藻培养液中DIC浓度的变化(a)及pH的变化(b)
Fig. 1 DIC concentration(a) and pH (b) changes in the culture medium of Sargassum vachellianum under different temperature conditions with time
各组实验均在60 μmol/(m2·s)光强条件下进行,分别在0、6、12、24和48 h后测定培养液中DIC的浓度和pH。图中误差线为SD值(n=3)
The light intensity was 60 μmol/(m2·s), DIC concentration and pH values were measured five times (0, 6, 12, 24 and 48 hours). Error bars=SD (n=3) |
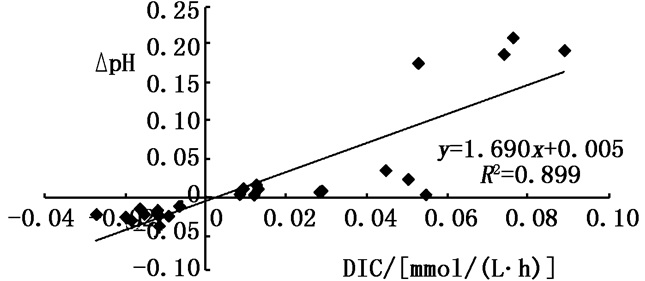
图 1b为不同温度梯度下瓦氏马尾藻培养液中pH的变化,可以看出,各实验组培养液pH的提升速率与DIC浓度的下降速率相对应,且存在正相关性(R2=0.899, n=25, P < 0.05),见图 2。其中,0 ~ 12 h,20 ℃实验组的pH上升最快,可达到8.88。12 ~ 24 h后,各实验组pH均有下降,在24 ~ 48 h内30 ℃实验组的pH仍为下降趋势,而其他实验组有明显升高,而48 h后,其他实验组仍有微小上升趋势,说明该30 ℃实验组藻体已不适应生存。
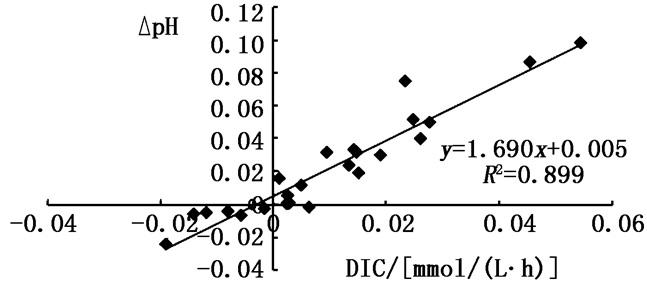
|
图 2 不同温度条件下pH与DIC变化速率相关性分析
Fig. 2 The correlation analysis of change rates of pH and DICunder different temperature conditions
|
瓦氏马尾藻无机碳吸收速率显示,0 ~ 12 h内,前6 h无机碳吸收速率最高,与其相比后6 h速率存在明显下降,其中20 ℃和25 ℃实验组藻体无机碳吸收速率下降幅度与其他实验组存在明显差异(P < 0.05),见表 1。另外,还存在第2 d瓦氏马尾藻净固碳速率与第1 d相比,明显下降(P < 0.05)的现象。25 ℃和30 ℃实验组DIC浓度均上升,其中30 ℃实验组上升明显,说明瓦氏马尾藻已对高温不适应(图 1a)。
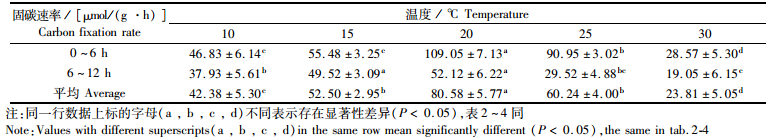
|
表 1 12 h内不同温度梯度对瓦氏马尾藻无机碳吸收速率的影响 Tab.1 Effects of different temperatures on dissolved inorganic carbon absorption rate over 12 hours |
0 ~ 12 h内,各实验组前6 h藻体培养液pH的提升速率均大于后6 h,其中后6 h下降幅度较大的是20 ℃和25 ℃实验组,与其他实验组存在显著性差异(P < 0.05),而10 ℃实验组降幅较小且与其他实验组均存在显著性差异(P < 0.05),该现象与DIC浓度降低速率相对应,且20 ℃实验组的pH提升速率显著高于其他实验组(P < 0.05),见表 2。另外,第2 d,各实验组培养液的pH提升速率与第1 d相比,有明显下降(P < 0.05),且除30 ℃实验组外,其他各组的pH上升差异不显著。
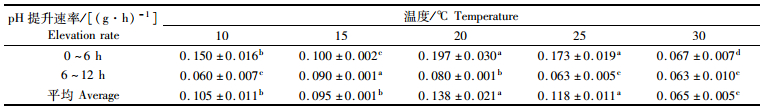
|
表 2 12 h内不同温度条件对瓦氏马尾藻提升海水pH速率的影响 Tab.2 Effects of different temperatures on the seawater pH elevation rate over 12 hours |
图 3a为不同光强实验组瓦氏马尾藻培养液中DIC浓度的变化。其中,0~12 h内,培养液中DIC的浓度明显降低。60 μmol/(m2·s)光照组DIC浓度下降速率最大,第1个光照期间(0 ~ 12 h)降幅为0.49 mmol/L。而24 ~ 48 h内,所有实验组培养液的DIC浓度均有所下降,但降幅已明显减小。而48 ~ 72 h内,除200和300 μmol/(m2·s)光照组出现上升外,其他实验组DIC浓度只有微小下降。
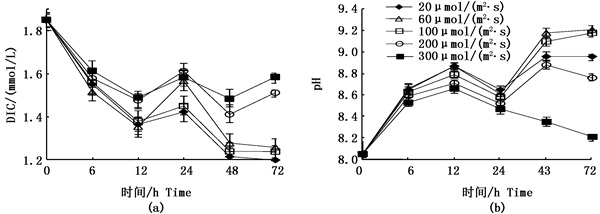
|
图 3 不同光照强度组瓦氏马尾藻培养液DIC浓度变化(a)及pH变化(b)
Fig. 3 DIC concentration(a) and pH(b) changes in different light intensity groups with time
各实验组均在20 ℃温度条件下进行,并分别在实验后0,6,12,24和48 h测定培养液中DIC浓度和pH。图中误差线为SD值(n=3)
The experimental temperature was 20 ℃. DIC concentration and pH values were measured over a 48-hour period as a function of five time-points (0, 6, 12, 24 and 48 hour). Error bars=SD (n=3) |
图 3b为不同光强条件对瓦氏马尾藻培养液pH变化的影响。其中,各实验组培养液的pH上升速率与DIC浓度下降速率表现出正相关性(R2=0.733, n=25, P < 0.05),见图 4。第1天光照期间(0 ~ 12 h),60 μmol/(m2·s)光照强度下pH上升最快,达到8.87。第2光照周期实验结束后,除300 μmol/(m2·s)光照组pH下降外,其余各组pH均上升。而第3光照周期实验结束后,除60 μmol/(m2·s)光强实验组pH有微小上升外,其余各组pH均下降至8.21~9.18之间。
|
图 4 不同光强度下pH与DIC变化速率相关性分析
Fig. 4 The correlation analysis of change rate of pH and DICunder different light intensity
|
表 3为不同光强条件对瓦氏马尾藻无机碳吸收速率的影响,其中,0 ~ 12 h内,20和60 μmol/(m2·s)实验组前6 h瓦氏马尾藻无机碳吸收速率显著高于其他实验组(P < 0.05),第1光照周期(0~12 h)无机碳平均吸收速率达80.48 μmol/(g·h)和82.14 μmol/(g·h),200和300 μmol/(m2·s)实验组无机碳平均吸收速率分别为61.91 μmol/(g·h)和59.76 μmol/(g·h),随着光照强度的增强,藻体在第1光照周期内无机碳平均吸收速率表现为先升高后降低。

|
表 3 12 h内不同光照强度对瓦氏马尾藻无机碳吸收速率的影响 Tab.3 Effects of different irradiance on dissolved inorganic carbon absorption rate over 12 hours |
表 4为12 h内5组不同光强条件下瓦氏马尾藻对海水pH提升速率的影响。第1天光照期间(0 ~ 12 h),60 μmol/(m2·s)实验组pH上升最快,其提升速率为0.137/(g·h),其次是20 μmol/(m2·s)实验组,提升速率达0.133/(g·h),显著高于其他组(P < 0.05)。200和300 μmol/(m2·s)实验组pH上升不显著(P < 0.05)。

|
表 4 12 h内不同光强条件对瓦氏马尾藻提升海水pH速率的影响 Tab.4 Effects of different light intensity on the seawater pH elevation rate in 12 hours |
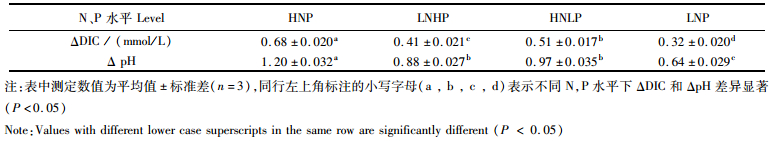
图 5为瓦氏马尾藻在4组不同N、P水平下培养12 h后,各实验组培养液DIC浓度及pH的变化。结果显示,培养12 h后,HNP组培养液中DIC浓度降幅最大,由1.83 mmol/L降低至1.15 mmol/L;其次是HDLP组,降低至1.32 mmol/L;LNHL组降低至1.42 mmol/L;LNP组DIC浓度降幅最小,为1.51 mmol/L。实验前后,不同N、P浓度的实验组间培养液的DIC浓度变化量存在显著差异(P < 0.05), 见表 5,其中LNP组DIC变化量最小,仅为0.32 mmol/L;其次是LNHP组(0.41 mmol/L)、HNLP组(0.51 mmol/L);HNP组DIC变化量最大为0.68 mmol/L,显著高于其他3个组合(P < 0.05)。说明N、P加富对瓦氏马尾藻无机碳吸收具有促进作用。

|
图 5 不同N、P水平对瓦氏马尾藻吸收海水中DIC及提升海水pH影响
Fig. 5 Effect of different nitrogen (N) and phosphorous (P) levels on dissolved inorganic carbon (DIC) uptake and seawater pH elevationof Sargassum vachellianum
图中的误差线为SD值(n=3),横坐标中的“C”表示实验前各培养液中的DIC浓度及pH Error bars represent standard deviation (n=3).C represents the DIC concentration and seawater pH before the experiment |
|
表 5 实验前后海水DIC及pH变化量 Tab.5 The change in the dissolved inorganic carbon (DIC) concentrations and pH levels in the culture solution over the experimental period |
图 5显示,实验前后培养液pH的变化与DIC浓度变化相对应,其中,HNP组pH为9.25,达到最高值;其次是HNLP (9.02)、LNHP (8.93);LNP组pH最低,为8.69。另外,4组不同N、P浓度组合实验前后其培养液的pH变化量差异显著(P < 0.05),HNP组pH变化量最大,为1.20,显著高于其他实验组(P < 0.05);其次是HNLP组(0.97)、LNHP组(0.88);LNP组pH变化量与其他实验组相比显著降低(P < 0.05),仅为0.64。说明N、P加富除了可以促进瓦氏马尾藻吸收海水中的DIC外,还相应地提升了海水的pH,且N、P的添加对增加藻体吸收DIC及提升海水pH的能力具有促进作用。
3 讨论 3.1 温度变化对瓦氏马尾藻无机碳吸收能力及提升海水pH的影响温度作为最普遍的气候因素影响着所有生物的生理过程,有研究表明,温度能控制植物光合作用利用无机碳的速率,并起到主要作用[14]。本文在不同温度条件对瓦氏马尾藻光合吸收无机碳及提高海水pH的能力进行了研究,结果表明,随着温度的升高,藻体的无机碳吸收速率和提升海水pH的速率均在20 ℃组出现最大值,且总体趋势为先增加后降低。0 ~ 12 h中,与前6 h相比较,后6 h藻体的无机碳吸收速率有所降低,且第2天藻体的吸收速率与第1天相比也有显著下降。这与DIC浓度的下降有关,海水中DIC的主要存在形式为HCO3-(≈40%)和CO32-(≈60%)[15],因海藻在短时间内快速吸收,使得HCO3-含量快速下降且比例降低,在没有外源CO2补充的情况下,如果延长实验的时间,海藻对无机碳的吸收能力将会受到影响[13]。24 h后,30 ℃实验组DIC浓度上升,pH明显下降,且培养48 h后藻体已开始出现变软和颜色变深的现象,该现象的出现表明藻体已经不能适应此时的培养温度,该温度已超过藻体的耐受范围。李少香[13]对浒苔的研究也表明,随着温度的升高,浒苔对无机碳的吸收速率和培养液中pH的提升速率表现出先升高后降低的趋势,其中35 ℃高温组浒苔出现近半数发白的现象,表明该温度已明显超过藻体的适应范围。研究表明,温度可以通过影响藻体内光合色素的含量间接影响藻体对无机碳的吸收速率,张建伟等[16]的研究中,随温度的升高,瓦氏马尾藻的多种光合色素均呈现下降趋势,这也可能就是引起其无机碳吸收速率及pH提升速率下降的原因,具体机理还需进一步研究。因此,在一定温度范围内,升高温度能够促进瓦氏马尾藻对DIC的吸收,当温度超过一定范围,瓦氏马尾藻无机碳吸收及提升海水pH的能力将受到抑制。
3.2 光强变化对瓦氏马尾藻无机碳吸收能力及提升海水pH的影响光照是海藻生长发育必不可少的因素,大型海藻通过光合作用实现C、N、P的吸收。张建伟等[16]研究表明,光照强度能显著影响瓦氏马尾藻的生长状况,该结论与杨彬等[17]对莫氏马尾藻的研究结果相似。本文开展了不同光强条件对瓦氏马尾藻光合无机碳吸收和提升海水pH能力的研究,结果表明光照60 μmol/(m2·s)实验组的无机碳吸收速率和pH提升速率均最快,但随光照强度的不断增加,瓦氏马尾藻的无机碳吸收速率也下降,尤其是光照200和300 μmol/(m2·s)实验组的吸收速率有显著下降,这主要因为随着培养液中DIC浓度的下降,高pH的环境使得CO2的含量急剧下降,且无外源CO2补充的情况下,CO2扩散速度很慢[18],故其代谢不能与光吸收同步,成为最主要的限制因子。该结果同样出现在李少香[13]对浒苔的研究中,光照强度在20~200 μmol/(m2·s)之间,藻体在第一光照期间内无机碳吸收速率先增加后下降,且各实验组之间存在明显差异。另外,王巧晗等[19]对孔石莼的研究中表明,其化学组成中C元素的含量会受到光强的显著影响,达到一定光强时,C元素含量会显著上升,后随光强的增强,C元素含量会明显下降。可见光照强度变化会显著影响藻体对无机碳的吸收。另外因为光能超过了藻体光合系统所能利用的光能值,发生了光抑制现象,进而使得藻体的光合功能下降,无机碳吸收速率下降[20]。这种现象在对其他藻类的研究中也已被证实,有研究表明,龙须菜(Gracilaria lemaneiformis)在自然生长环境条件下,随光照强度的增加,海水表面较强的太阳辐射使其产生了光抑制现象,进而导致藻体生长及光合速率的下降[21-23],从而影响藻类对海水中无机碳的吸收。因此,瓦氏马尾藻的营养吸收和生长过程受到光照强度的显著影响,在低光强时,随光强升高,瓦氏马尾藻营养吸收和生长速率加快,当光强超过一定阈值,进一步提高增强光强,藻体的生长和光合固碳作用均受到抑制。
3.3 N、P加富作用对瓦氏马尾藻无机碳吸收能力及提升海水pH的影响N、P作为大型海藻生长的主要营养盐成分,N是藻类光合器官的重要合成元素,藻体的光合固碳效应对N含量的供给反应敏感,P是藻细胞核酸和膜的主要成分,同时也是组成ATP的基本元素,所以N、P对海藻的生理生化过程有着至关重要的作用[13]。李枫等[24]对龙须菜的研究中表明,高N高P处理条件下,龙须菜的生长和光合固碳能力比高N低P、低N高P、低N低P均高。本文开展了瓦氏马尾藻无机碳吸收能力及提升海水pH对不同N、P加富处理的响应研究,结果显示,各实验组DIC浓度变化量和提升海水pH的变化量均存在显著性差异。此现象说明N、P加富均有利于促进瓦氏马尾藻的光合固碳能力的提高。藻类光合作用吸收CO2同时消耗营养盐,所以适当增加营养盐的浓度可促进藻体对CO2的吸收,进而影响海水中的无机碳体系[13]。韩婷婷[25]研究表明,N加富促进了海带生长率的提高和光合固碳能力的增强,使得其培养液中DIC的含量加速下降。这样的结果也出现在徐永健等[26]对圆扁江蓠的研究中,在N浓度较高的介质中,藻体的光合速率增加,生长速率也相应增加。且HNLP组相比LNHP组对海水DIC浓度和pH的影响更大,说明N加富比P加富对马尾藻光合吸收无机碳能力的影响更大。该研究结果与李少香[13]对浒苔的研究一致,N、P加富对促进浒苔的光合固碳吸收海水中的无机碳效果显著,且N加富的促进效果强于P加富。邹定辉等[27]对石莼的研究也证明藻体对P的需求小于N。有研究表明,相同条件下生长的坛紫菜,培养海水的营养盐浓度升高,会增大藻体的Chl.a含量[28]。PEDERSEN[29]对石莼和线性硬毛藻的研究也表明,N加富使藻体内的叶绿素含量增加,提高藻体的最大光合作用速率,从而增强藻体无机碳吸收能力。研究发现,在缺P的情况下,细基江蓠变种的藻胆蛋白和叶绿素含量都比平常环境中低[30]。因此,N、P营养盐影响瓦氏马尾藻的光合固碳能力可能是通过影响藻体的光合色素和体内蛋白等的正常代谢来发挥作用的,但具体机理仍需深入研究。氮、磷加富能够显著提高瓦氏马尾藻光合作用吸收无机碳的能力,从而降低了海水DIC的浓度,促进海洋不断吸取空气中的CO2。瓦氏马尾藻的光合及无机碳吸收作为复杂的生理过程,除温度、光照强度和N、P营养盐浓度外,其光合无机碳吸收及提升海水pH的能力必然还受到藻体密度和其他生态因子等的影响,今后还需对该过程进行深入的研究。
| [1] |
IPCC. Climate change 2007:the physical science basis, contribution of working group Ⅰ to the fourth assessment report of the intergovernmental panel on climate change[M]. Cambridge: Cambridge University Press, 2007.
|
| [2] |
PACKER M. Algal capture of carbon dioxide; biomass generation as a tool for greenhouse gas mitigation with reference to New Zealand energy strategy and policy[J]. Energy Policy, 2009, 37(9): 3428-3437. DOI:10.1016/j.enpol.2008.12.025 |
| [3] |
LI Y Q, HORSMON M, WU N, et al. Biofuels from microalgae[J]. Biotechnology Progress, 2008, 24(4): 815-820. |
| [4] |
DUARTE C M, CHISCANO C L. Seagrass biomass and production:a reassessment[J]. Aquatic Botany, 1999, 65(1/4): 159-174. |
| [5] |
CHUNG I K, OAK J H, LEE J A, et al. Installing kelp forests/seaweed beds for mitigation and adaptation against global warming:Korean Project Overview[J]. ICES Journal of Marine Science, 2013, 70(5): 1038-1044. DOI:10.1093/icesjms/fss206 |
| [6] |
陈清华, 彭海君. 海洋酸化的生态危害研究进展[J]. 科学导报, 2009, 27(19): 108-111. CHEN Q H, PENG H J. Ecological impact of ocean acidification[J]. Science & Technology Review, 2009, 27(19): 108-111. |
| [7] |
张建伟, 刘媛媛, 吴海龙, 等. 环境因子对瓦氏马尾藻生长及光合作用的影响[J]. 中国水产科学, 2014, 21(6): 1227-1235. ZHANG J W, LIU Y Y, WU H L, et al. Effects of different environmental factors on growth and photosynthesis of Sargassum vachellianum[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1227-1235. |
| [8] |
张婧. 瓦氏马尾藻与铜藻的室内人工培育[D]. 上海: 上海海洋大学, 2012. ZHANG J. Indoor cultivation of the brown alga Sargassum vachellianum and Sargassum horneri: morphological observation and techniques of artificial seeding[D]. Shanghai: Shanghai Ocean University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10264-1013000387.htm |
| [9] |
CHAI Z Y, HUO Y Z, HE Q, et al. Studies on breeding of Sargassum vachellianum on artificial reefs in Gouqi Island, China[J]. Aquaculture, 2014, 424-425: 189-193. DOI:10.1016/j.aquaculture.2013.12.038 |
| [10] |
徐金根, 陈素文, 张汉华, 等. 温度和光照对瓦氏马尾藻繁殖的影响[J]. 广东农业科学, 2013, 40(9): 121-123, 128. XU J G, CHEN S W, ZHANG H H, et al. Effect of light and temperature on reproduction of Sargassum vachellianum[J]. Guangdong Agricultural Sciences, 2013, 40(9): 121-123, 128. |
| [11] |
柴召阳, 霍元子, 于克锋, 等. 枸杞岛瓦氏马尾藻藻场生态系统健康评价[J]. 海洋环境科学, 2013, 32(3): 386-389. CHAI Z Y, HUO Y Z, YU K F, et al. Assessment of Sargassum vachellianum bed ecosystem health in Gouqi Island[J]. Marine Environmental Science, 2013, 32(3): 386-389. |
| [12] |
冯子慧, 孟阳, 陆巍, 等. 绿潮藻浒苔光合固碳与防治海水酸化的作用Ⅰ.光合固碳与海水pH值提高速率研究[J]. 海洋学报, 2012, 34(2): 162-168. FENG Z H, MENG Y, LU W, et al. Studies on photosynthesis carbon fixation and ocean acidification prevention in Ulva prolifera Ⅰ. Rate of photosynthesis carbon fixation and seawater pH increase[J]. Acta Oceanologica Sinica, 2012, 34(2): 162-168. |
| [13] |
李少香. 浒苔光合固碳影响因子及海区评估研究[D]. 上海: 上海海洋大学, 2014. LI S X. Studies on influencing factors of photosynthetic carbon fixtation and evaluation of sea area by Ulva prolifera[D]. Shanghai: Shanghai Ocean University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10264-1014051830.htm |
| [14] |
黄瑶, 毛玉泽, 周毅, 等. 添加氮磷对龙须菜光合固碳能力影响的现场研究[J]. 渔业科学进展, 2013, 34(1): 22-30. HUANG Y, MAO Y Z, ZHOU Y, et al. Field study on photosynthetic carbon acquisition of Gracilaria lemaneifomis after adding nitrogen and phosphorus[J]. Progress in Fishery Sciences, 2013, 34(1): 22-30. |
| [15] |
RIVERS J S, PECKOL R. Interactive effects of nitrogen and dissolved inorganic carbon on photosynthesis, growth, and ammonium up take of the macroalgae Cladophora vagabunda and Gracilaria tikvahiae[J]. Marine Biology, 1995, 121(4): 747-753. DOI:10.1007/BF00349311 |
| [16] |
张建伟, 刘媛媛, 吴海龙, 等. 环境因子对瓦氏马尾藻生长及光合作用的影响[J]. 中国水产科学, 2014, 21(6): 1227-1235. ZHANG J W, LIU Y Y, WU H L, et al. Effects of different environmental factors on growth and photosynthesis of Sargassum vachellianum[J]. Journal of Fishery Sciences of China, 2014, 21(6): 1227-1235. |
| [17] |
杨彬, 谢恩义, 曲元凯. 不同环境因子对莫氏马尾藻幼苗生长和光合色素的影响[J]. 南方水产科学, 2013, 9(4): 39-44. YANG B, XIE E Y, QU Y K. Effects of different environment factors on the growth and photosynthetic pigments of seedlings of Sargassum mcclurei[J]. South China Fisheries Science, 2013, 9(4): 39-44. |
| [18] |
程丽巍. 三种大型海藻对海水中营养盐供应变化的生理响应研究[D]. 南京: 南京农业大学, 2010. CHENG L W. Study on the physiological responses of three marine macroalgae to the change of nutrients supplies in seawater[D]. Nanjing: Nanjing Agricultural University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012270943.htm |
| [19] |
王巧晗, 董双林, 田相利, 等. 光照强度对孔石莼生长和藻体化学组成的影响[J]. 海洋科学, 2010, 34(8): 76-80. WANG Q H, DONG S L, TIAN X L, et al. The effects of light intensity on the growth and chemical constituents of Ulva pertusa[J]. Marine Sciences, 2010, 34(8): 76-80. |
| [20] |
潘瑞炽, 王小菁, 李娘辉. 植物生理学[M]. 7版. 北京: 高等教育出版社, 2012: 110-114. PAN R C, WANG X J, LI N H. Plant physiology[M]. 7th ed. Beijing: Higher Education Press, 2012: 110-114. |
| [21] |
XU J T, GAO K S. Growth, pigments, UV-absorbing compounds and agar yield of the economic red seaweed Gracilaria lemaneiformis (Rhodophyta) grown at different depths in the coastal waters of the South China Sea[J]. Journal of Applied Phycology, 2008, 20(5): 681-686. DOI:10.1007/s10811-007-9247-7 |
| [22] |
郑兵. 深澳湾环境因子的变化特征与龙须菜养殖的生态效应[D]. 汕头: 汕头大学, 2009. ZHENG B. Variation characteristics of environmental factors and ecological effects of Gracilaria lemaneiformis in Shen'ao Bay, Eastern Coast of Guangdong[D]. Shantou: Shantou University, 2009. http://cdmd.cnki.com.cn/article/cdmd-10560-2010042587.htm |
| [23] |
蒋雯雯. 环境因子对菊花江蓠和细基江蓠繁枝变型生理生态学影响的比较研究[D]. 青岛: 中国海洋大学, 2010. JIANG W W. A Comparative study on the effects of environmental conditions on the physiological ecology of Gracilaria lichenoides and G. tenuistipitata var. liui[D]. Qingdao: China Ocean University, 2010. |
| [24] |
李枫, 邹定辉, 刘兆普, 等. 氮磷水平对龙须菜生长和光合特性的影响[J]. 植物生态学报, 2009, 33(6): 1140-1147. LI F, ZOU D H, LIU Z P, et al. Effects of nitrogen and phosphorous levels on growth and photosynthetic traits of Gracilaria lemaneiformis (Rhodo-Phyta)[J]. Chinese Journal of Plant Ecology, 2009, 33(6): 1140-1147. |
| [25] |
韩婷婷. 大型海藻对不同CO2浓度的光合生理响应及其生态效应[D]. 青岛: 中国科学院研究生院(海洋研究所), 2013. HAN T T. Photosynthetic physiological responses of macroalgae to different CO2 concentrations and their ecological effects[D]. Qingdao: Institute of Oceanology, Chinese Academy of Sciences, 2013. http://cdmd.cnki.com.cn/Article/CDMD-80068-1013299949.htm |
| [26] |
徐永健, 钱鲁闽, 焦念志. 江蓠作为富营养化指示生物及修复生物的氮营养特性[J]. 中国水产科学, 2004, 11(3): 276-280. XU Y J, QIAN L M, JIAO N Z. Nitrogen nutritional character of Gracilaria as bioindicators and restoral plants of eutrophication[J]. Journal of Fishery Sciences of China, 2004, 11(3): 276-280. |
| [27] |
邹定辉, 高坤山, 阮祚禧. 高CO2浓度对石莼光合作用及营养盐吸收的影响[J]. 青岛海洋大学学报, 2001, 31(6): 877-882. ZOU D H, GAO K S, RUAN Z X. Effects of elevated CO2 concentration on photosynthesis and nutrients uptake of Ulva lactuca[J]. Journal of Ocean University of Qingdao, 2001, 31(6): 877-882. |
| [28] |
查毅. 基于生物修复的两种大型经济海藻营养盐吸收和光合作用研究[D]. 广州: 华南理工大学, 2013. ZHA Y. Study on nutrient uptake and photosynthesis of two large seaweeds based on bioremediation[D]. Guangzhou: South China University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1013318206.htm |
| [29] |
PEDERSEN M F. Nitrogen limitation of photosynthesis and growth:comparison across aquatic plant communities in a Danish estuary (Roskilde Fjord)[J]. Ophelia, 1995, 41(1): 261-272. DOI:10.1080/00785236.1995.10422047 |
| [30] |
许忠能, 林小涛, 林继辉, 等. 营养盐因子对细基江蓠繁枝变种氮、磷吸收速率的影响[J]. 生态学报, 2002, 22(3): 366-374. XU Z N, LIN X T, LIN J H, et al. The effects of nutrient availability on the uptake of nitrogen and phosphorus by Gracilaria tenuistipitata var. liui Zhang et Xia[J]. Journal of Ecology, 2002, 22(3): 366-374. |
2. Water Environment and Ecology Engineering Center of Shanghai Institute of Higher Education, Shanghai Ocean University, Shanghai 201306, China;
3. Marine Scientific Research Institute, Shanghai Ocean University, Shanghai 201306, China
 2018,
Vol. 27
2018,
Vol. 27


