河鲀毒素(Tetrodotoxin, TTX)是一种天然的生物碱类神经毒素,通过与肌肉、神经等组织的电压门控钠离子通道结合,抑制钠离子通过、阻止细胞动作电位形成而使组织无法行使其功能;人中毒的症状有口舌麻痹、头痛恶心并伴随呕吐、肌肉无力,严重者会陷入昏迷、呼吸衰竭甚至死亡[1]。河鲀毒素最初是从鲀科鱼中发现的, 河鲀毒素之名也是由河鲀鱼而来的,河鲀的多个器官或组织都含有河鲀毒素;根据调查,我国有35种具有不同程度毒性的河鲀,同种河鲀鱼各个器官的毒素水平会随着季节变化和地域不同而有所差异,一般来说卵巢的毒性最高,其次是肝脏和肠道,皮肤、肾脏、肌肉等组织也含有少量河鲀毒素[2-4]。
最初,许多研究者以为河鲀毒素是由河鲀鱼自身分泌的,随着研究的推进,关于河鲀体内TTX的起源产生了多种不同的假说,主要可分为内因说和外因说两类[5-6]。内因说认为河鲀体内的河鲀毒素来源于刺胞、毒腺中的蛋白质毒素,但尚缺乏证据;外因说认为河鲀体内河鲀毒素的来源一是通过食物链累积,河鲀摄入的饵料生物本身含有河鲀毒素,另一来源是共生细菌,在多种河鲀鱼的皮肤、肠道、肝脏和卵巢中都分离到可以产TTX的细菌[1, 6-10]。另外,海淡水环境沉积物、藻类、软体动物还有蟹类体内都分离到可以产TTX的细菌,其中弧菌属(Vibrio)、气单胞菌属(Aeromonas)、假单胞菌属(Pseudomonas)、芽孢杆菌属(Bacillus)、希瓦氏菌属(Shewanella)以及交替单孢菌属(Bacillus)占得比例最多[8]。
小鼠生物学检测法和酶联免疫法检测表明,星点东方鲀(Takifugu niphobles)是我国常见的野生河鲀鱼中毒性最高的鱼种之一[4, 11-14],有文献报道,从星点东方鲀肠道分离到的土生柔特勒菌(Raoultella terrigena)、腐败希瓦氏菌(Shewanella putrefaciens),从卵巢分离到的细小杆菌(Microbacterium arabinogalactanolyticum)具有产毒能力,根据小鼠生物学检测法,每升发酵液所含毒素水平分别为38.5 MU、60 MU、210.6 MU[15-17](1 MU表示在30 min内杀死一只20 g的小鼠的毒素量,1 MU=0.22 μg TTX),笔者推测星点东方鲀毒性如此之高可能与其体内的共生细菌有关。为了更准确地定量分析星点东方鲀各主要累毒组织之间的TTX含量差异,本研究采用液相色谱-串联质谱法对TTX进行定量分析,并通过筛选,从星点东方鲀中获得了新的产TTX细菌,为更好地理解河鲀累毒和其共生产TTX细菌的关系提供数据。
1 材料与方法星点东方鲀样本3尾于2016年3月7日采自福建省东山县附近海域,分离肌肉、卵巢、肝脏和肠道组织。
1.1 星点东方鲀组织TTX提取、纯化取星点东方鲀组织5 g至50 mL离心管中,用剪刀尽量剪碎,加入20~30 mL 0.1%乙酸溶液,煮沸10 min,冷却至室温后离心取上清液,40 ℃减压蒸馏浓缩至5 mL。取1 mL浓缩液加入超滤管(默克密理博有限公司)中,4 000 r/min离心30 min,取滤出液备用LC-MS/MS检测。
1.2 细菌分离鉴定 1.2.1 分离培养基TCBS琼脂培养基:酵母浸粉5.0 g/L,蛋白胨10.0 g/L,硫代硫酸钠10.0 g/L,枸缘酸钠10.0 g/L,牛胆粉5.0 g/L,牛胆酸钠3.0 g/L,蔗糖20.0 g/L,氯化钠10.0 g/L,柠檬酸铁1.0 g/L,溴麝香草酚蓝0.04 g/L,琼脂15.0 g/L,pH 8.6±0.2。
1.2.2 细菌分离用无菌水冲洗河鲀鱼体表,放在消毒的解剖盘中,用灭菌的剪刀和镊子解剖星点河鲀鱼,取肝脏、卵巢、肠道各2 g分别放入无菌的离心管中,用灭菌的剪刀将组织尽量剪碎并加入等体积无菌0.75% NaCl溶液,振荡混匀。静置后取上清100 μL均匀涂布在TCBS平板上。25 ℃倒置培养24~36 h直至长出菌落,挑取性状不同的菌团继续在TCBS板上纯化2~3次得到单菌落。将得到的单菌落接到LB培养基中,28 ℃培养后向菌液中加等体积无菌的80%甘油溶液保种留用。
1.2.3 细菌鉴定获得的菌株用16S rRNA引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′)扩增,反应体系(50 μL):2×Taq PCR Master Mix 25 μL,上下游引物各1 μL,ddH2O 22 μL,模板1 μL。PCR反应条件:95 ℃预变性5 min,94 ℃变性1 min,54 ℃退火30 s,72 ℃延伸2 min,共35个循环,72 ℃延伸10 min。扩增产物经过连接转化送至上海生工生物工程有限公司进行测序。
1.2.4 细菌系统发育进化树的构建将细菌测序序列通过BLAST N在GenBank比对后,在所有匹配的序列中选取序列匹配度最高的生物序列,作为系统树参考序列。在生物软件MEGA 6中选用NJ(Neighbor-joining)法构建系统发育树,设定bootstrap为1 000次重复。
1.3 细菌发酵及TTX提取纯化 1.3.1 细菌发酵和TTX提取纯化挑取单菌落至LB培养基(胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,氯化钠10.0 g/L,pH≈7)中,28 ℃,180 r/min培养48 h[18],发酵后的菌液10 000 r/min离心收集上清液,40 ℃减压蒸馏浓缩至20 mL左右,浓缩液经过C18小柱(上海安谱实验科技股份有限公司),纯化得到的洗脱液与流出液合并,再经过TTX免疫亲和柱(江苏美正生物科技有限公司)纯化得到洗脱液4 mL,洗脱液经氮吹仪吹干,加入1 mL 0.1%乙酸溶液复溶备用LC-MS/MS检测。
1.3.2 细菌CFU计数细菌发酵48 h后取5 mL菌液以空白培养基为对照检测600 nm处的吸光值,用空白培养基梯度稀释107倍,取100 μL稀释液均匀涂布在LB平板上,28 ℃倒置培养12 h计数并计算发酵液细菌CFU。
1.4 液相色谱-质谱法检测TTX 1.4.1 标准品的配制TTX标准品1 mg,加入1 mL 0.1%乙酸溶液震荡溶解,梯度稀释至100、50、25、10、5和1 ng/mL,作为标准工作液用于绘制标准曲线。
1.4.2 液相色谱-质谱检测条件色谱:Waters Atlantis HILIC Silica色谱柱(2.1×150 mm,3 μm);流动相:A为0.1%甲酸溶液,B为乙腈;洗脱梯度:0~8 min,68%A;流速:200 μL/min;柱温:30 ℃;进样体积:10 μL。
质谱:电喷雾离子源(ESI),多反应监测(MRM),离子源电压5 500 V,雾化气400 psi,辅助气40 psi,最优去簇电压60 V,最优碰撞能量为45 V,离子源温度500 ℃,定性、定量离子分别为m/z 320.1/162.0和m/z 320.1/302.0。
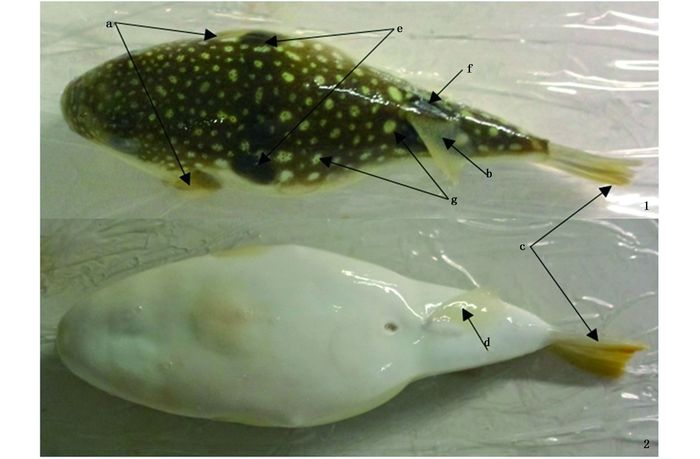
2 结果 2.1 星点东方鲀的鉴定经形态学鉴定,采样所得的河鲀鱼鱼体背腹面各具一群弱小的刺,体上半部呈褐色,并似星点状散布着许多白色小圆点,腹面白色,胸鳍后上方及背鳍基部各有一长圆形黑斑,尾鳍呈杏黄色,其他各鳍呈淡黄色[12],为星点东方鲀(图 1)。
|
图 1 星点河鲀鱼外观图
Fig. 1 The appearance of T. niphobles
1.背面观;2.腹面观;a.胸鳍;b.背鳍;c.尾鳍;d.臀鳍;e.胸鳍上方黑斑;f.背鳍基部黑斑;g.背部白色圆点 1. the back of T.niphobles; 2. the abdomen of T.niphobles; a. pectoral fin; b. dorsal fin; c. tail fin; d. anal fin; e. black spot over the pectoral fin; f. blacks pot at the dorsal fin; g. white dot on the back |
细菌16S rDNA扩增产物为1 280~1 400 bp,通过比对分析,在星点东方鲀肌肉、肝脏和卵巢组织中一共分离到5株细菌,分别是鳗利斯顿氏菌属(Listonella sp.)、不动杆菌属(Acinetobacter sp.)、洛菲不动杆菌(Acinetobacter lwoffii)、牡蛎弧菌(Vibrio crassostreae)、肠杆菌属(Enterobacter sp.),细菌分离结果见表 1,基于5株细菌和GenBank数据库其他细菌的16S rDNA的序列构建的系统进化关系,结果显示,L-1、C-2-2、R-1-2分别与牡蛎弧菌(Vibrio crassostreae)、鳗利斯顿氏菌属(Listonella sp.)、肠杆菌属(Enterobacter sp.)的亲缘关系最近,G-2-4和G-4-3与不动杆菌属(Acinetobacter sp.)的亲缘关系最近(图 2),其中鳗利斯顿氏菌属以及不动杆菌属是首次在河鲀类鱼中被分离到的。
|
表 1 星点东方鲀组织细菌分离结果 Tab.1 Symbiotic bacteria of T. niphobles |

|
图 2 基于C-2-2、G-4-3、G-2-4、L-1、R-1-2细菌和GenBank数据库其他细菌的16S rDNA的序列构建的系统进化树
Fig. 2 Phylogenetic tree constructed based on 16S rDNA sequence of bacteria C-2-2, G-4-3, G-2-4, L-1, R-1-2 and other bacteria in GeneBank database
|
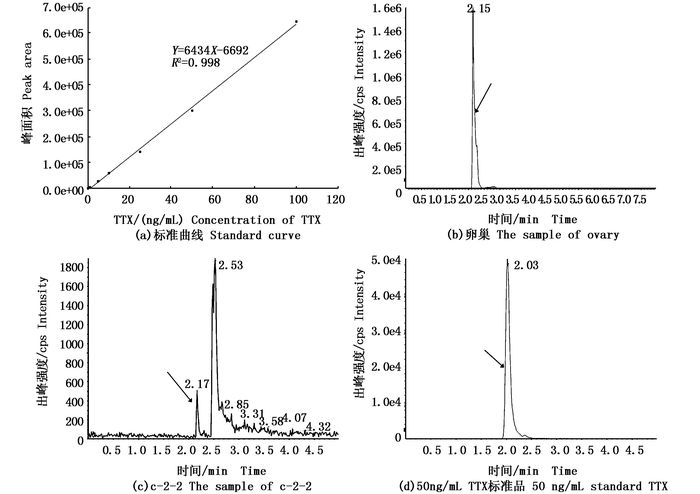
根据检测结果,星点东方鲀的卵巢每克组织TTX含量高达56.247 μg,分别是肝脏(0.380 μg/g)的约148.0倍,肌肉(0.118 μg/g)的约476.7倍(表 2)。对细菌的发酵物进行检测发现,除牡蛎弧菌和一株不动杆菌属细菌外其他细菌的发酵物中均检测到TTX。由标准品检测得到的标准曲线的线性方程为Y=6434X-6692,相关系数R2为0.998,说明TTX在0~100 ng/mL浓度范围内具有较好的线性关系,样品出峰时间在2~2.5 min内,与标准品出峰时间一致,说明在细菌发酵液提取物中含有TTX(图 3)。

|
表 2 组织和细菌的TTX含量 Tab.2 The TTX cotent of tissue/bacteria from T. niphobles |
|
图 3 部分组织和细菌的LC-MS/MS检测图谱
Fig. 3 LC-MS/MS chromatogram map
箭头所指为TTX出峰 The arrows mark the peak of TTX |
细菌发酵48 h后,菌液在600 nm处的紫外光吸收值范围为0.876~2.016 A,用梯度稀释涂板法进行活菌计数,每升发酵液的细菌数为(2.68~6.35)×1013个,有毒细菌的产毒量为0.298~0.855 ng/1013 CFU(表 2)。
3 讨论相比其他检测方法,液相色谱-质谱法检测TTX应用范围更广,结果可信度更高[19]。本研究中,星点东方鲀的肌肉、肝脏以及卵巢组织都含有TTX,其中卵巢组织的TTX含量极高,每克组织TTX含量高达56.247 μg,相当于255.6 MU,分别是肝脏(0.380 μg/g,1.72 MU)的约148.0倍,肌肉(0.118 μg/g,0.53MU)的约476.7倍。张风雷等对在深圳大鹏湾采集到的河鲀样本进行小鼠生物学法检测,发现星点东方鲀的肝脏和卵巢毒性最高,分别为(511.75±256.50) MU/g、(354.10±169.82) MU/g,弓斑东方鲀的肝脏和卵巢毒性也很高,分别为(186.25±76.48) MU/g、(260.02±132.15) MU/g[11]。ITOI等[20]用LC-MS/MS检测过的星点东方鲀组织河鲀毒素含量为(216±374)~(4139±6023) ng。萧哲等对珠海范围内渔市场和养殖场采集的各种河鲀进行小鼠生物学法检测河鲀毒素:韦氏兔鲀、暗纹东方鲀和六斑刺鲀全身河鲀毒素量低于10 MU/g,弓斑东方鲀只有肝脏具有弱毒(10~100 MU/g),菊黄东方鲀肝脏含有100 MU/g以上的毒素,肠脏含毒介于10~100 MU/g之间,其余器官含毒均低于10 MU/g;横纹东方鲀的卵巢、肝脏和皮肤均含有100 MU/g以上的毒素,肠道含毒在10~100 MU/g之间,鱼肉则含毒低于10 MU/g[12]。相比之下,本研究采集到的星点东方鲀样本的肌肉和肝脏组织毒性较低,可视为无毒,卵巢毒性较高,为强毒。
本研究星点东方鲀组织中分离到3株具有产TTX能力的细菌,分别是鳗利斯顿氏菌属(Listonella sp.)、肠杆菌属(Enterobacter sp.)和不动杆菌属(Acinetobacter sp.),根据CFU计数,每1 013个细菌可产生0.298~0.855 ng河鲀毒素,其中鳗利斯顿氏菌属(Listonella sp.)和不动杆菌属(Acinetobacter sp.)是首次在河鲀鱼中被分离到的,为TTX的微生物来源增添了新的证据。之前他人研究所分离的产TTX细菌,如土生柔特勒菌、腐败希瓦氏菌和细小杆菌等均没有在本研究中分离到,可能与所用的分离细菌培养基不同所致,文献中用ORI培养基作为分离培养基,本研究采用的是TCBS琼脂培养基,因此分离细菌的种类有限,不过本研究也表明,在星点东方鲀体内存在多种产TTX的细菌,文献报道的星点东方鲀样本来自日本伯方岛、中国香港附近海域,本研究中星点东方鲀样本采自福建东山县附近海域,可能生活在不同环境的星点东方鲀,其体内产TTX细菌的组成也不同。
有关细菌产TTX的产量的文献不是很多,已知从暗纹东方鲀(Fugu obscurus)中分离到一株纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis)200 mL发酵液最多可产生(23.9±0.4) MU的河鲀毒素,在凹鼻鲀(Chelonodon patoca )皮肤分离到的一株黏质沙雷氏菌(Serratia marcescens)、在铅点东方鲀(Takifugu alboplumbeus)肠道分离到的一株溶藻弧菌(Vibrio alginolyticus)每500 mL发酵液分别含有河鲀毒素100.1、78.3 MU[15]。从星点东方鲀组织分离到的土生柔特勒菌(Raoultella terrigena)、腐败希瓦氏菌(Shewanella putrefaciens)和细小杆菌(Microbacterium arabinogalactanolyticum),根据小鼠生物学检测法,每升发酵液所含毒素水平分别为38.5、60、210.6 MU [15-17]。本研究分离到的细菌每升发酵液TTX含量为1.608~2.292 ng,相当于0.007~0.010 MU。相比之下,本研究分离到的细菌的产毒能力很低,对星点东方鲀组织河鲀毒素的贡献很小。河鲀体内累积TTX多少,可能主要与河鲀本身的耐受能力高低有关,而与共生细菌产TTX能力关系不大。
| [1] | LAGO J, RODRÍGUEZ L P, BLANCO L, et al. Tetrodotoxin, an extremely potent marine neurotoxin:distribution, toxicity, origin and therapeutical uses[J]. Marine Drugs, 2015, 13(10): 6384–6406. DOI:10.3390/md13106384 |
| [2] |
杨桂梅, 鲍宝龙. 河鲀和河鲀毒素之间关系的研究进展[J].
上海水产大学学报, 2008, 17(6): 734–739.
YANG G M, BAO B L. Research progress on the tetrodotoxin in puffer fish[J]. Journal of Shanghai Fisheries University, 2008, 17(6): 734–739. |
| [3] |
黄致强, 潘心富. 我国的河鲀鱼及其毒素(TTX)研究的概述[J].
河北渔业, 1985: 37–47.
HUANG Z Q, PAN X F. A survey outline of the study on the China's puffer fish and tetrodotoxin (its toxin)[J]. Hebei Fisheries, 1985: 37–47. |
| [4] |
程苏云, 丛黎明, 蒋贤根, 等. 浙江省沿海河豚鱼生态分布和毒素检测[J].
浙江预防医学, 2003, 15(10): 1–2.
DOI:10.3969/j.issn.1007-0931.2003.10.001 CHENG S Y, CONG L M, JIANG X G, et al. The ecological distribution of tetraodon fish in coastland of Zhejiang Province and tetraodotoxin determination[J]. Zhejiang Journal of Preventive Medicine, 2003, 15(10): 1–2. DOI:10.3969/j.issn.1007-0931.2003.10.001 |
| [5] |
池珍, 郑莺, 毛宁. 产河豚毒素(TTX)菌株ZY-23的分离与鉴定[J].
微生物学通报, 2010, 37(2): 217–221.
CHI Z, ZHENG Y, MAO N. Isolation and identification of strain ZY-23 producing tetrodotoxin[J]. Microbiology China, 2010, 37(2): 217–221. |
| [6] |
吴韶菊, 崔建洲, 宫庆礼. 河豚毒素的微生物起源[J].
海洋科学, 2005, 29(10): 81–85.
DOI:10.3969/j.issn.1000-3096.2005.10.019 WU S J, CUI J Z, GONG Q L. The microbial origin of tetrodotoxin[J]. Marine Sciences, 2005, 29(10): 81–85. DOI:10.3969/j.issn.1000-3096.2005.10.019 |
| [7] |
李秋芬, 徐怀恕. 河豚毒素(TTX)及其微生物起源[J].
海洋通报, 1994, 13(4): 86–91.
LI Q F, XU H S. Tetrodotoxin and its miceoorganismic source[J]. Marine Science Bulletin, 1994, 13(4): 86–91. |
| [8] | JAL S, KHORA S S. An overview on the origin and production of tetrodotoxin, a potent neurotoxin[J]. Journal of Applied Microbiology, 2015, 119(4): 907–916. DOI:10.1111/jam.12896 |
| [9] | PRATHEEPA V, VASCONCELOS V. Microbial diversity associated with tetrodotoxin production in marine organisms[J]. Environmental Toxicology and Pharmacology, 2013, 36(3): 1046–1054. DOI:10.1016/j.etap.2013.08.013 |
| [10] |
陈永平, 张素青, 李春青, 等. 河鲀毒素的起源及检测技术研究进展[J].
现代渔业信息, 2011, 26(12): 16–19, 15.
DOI:10.3969/j.issn.1004-8340.2011.12.004 CHEN Y P, ZHANG S Q, LI C Q, et al. Progress in study of the methods in detecting and the origin on the tetrodotoxin[J]. Modern Fisheries Information, 2011, 26(12): 16–19, 15. DOI:10.3969/j.issn.1004-8340.2011.12.004 |
| [11] |
张风雷, 戴桂勋, 汤洵, 等. 大鹏湾海域河豚鱼毒性状况研究[J].
华南预防医学, 2004, 30(2): 7–9.
ZHANG F L, DAI G X, TANG X, et al. The study of tetrodotoxin of puffer fish in Dapeng bay[J]. South China Journal of Preventive Medicine, 2004, 30(2): 7–9. |
| [12] |
萧哲, 杨嘉辉, 罗淇, 等. 珠海河鲀的毒性研究[J].
中国农学通报, 2012, 28(23): 104–107.
XIAO Z, YANG J H, LUO Q, et al. A toxicological study of puffer fishes collected from Zhuhai, China[J]. Chinese Agricultural Science Bulletin, 2012, 28(23): 104–107. |
| [13] |
岳亚军, 张律, 游杰, 等. 免疫亲和柱净化-高效液相色谱-串联质谱法测定鱼肉和肝脏中河鲀毒素[J].
中国食品卫生杂志, 2016, 28(2): 214–218.
YUE Y J, ZHANG L, YOU J, et al. Immunoaffinity cartridge purification-determination of tetrodotoxin in fish organizations using liquid chromatography coupled with triple quadrupole mass spectrometry[J]. Chinese Journal of Food Hygiene, 2016, 28(2): 214–218. |
| [14] |
曹文卿, 林黎明, 吴振兴, 等. QuEChERS/液相色谱-串联质谱法测定红鳍东方鲀肉中河鲀毒素[J].
分析测试学报, 2014, 33(5): 588–593.
CAO W Q, LIN L M, WU Z X, et al. Determination of tetrodotoxin in flesh of Fugu rubripes by QuEChERS combined with liquid chromatography-tandem mass spectrometry[J]. Journal of Instrumental Analysis, 2014, 33(5): 588–593. |
| [15] | YU C F, YU P H F, CHAN P L, et al. Two novel species of tetrodotoxin-producing bacteria isolated from toxic marine puffer fishes[J]. Toxicon, 2004, 44(6): 641–647. DOI:10.1016/j.toxicon.2004.07.021 |
| [16] | MATSUI T, TAKETSUGU S, KODAMA K, et al. Production of tetrodotoxin by the intestinal bacteria of a puffer fish Takifugu niphobles[J]. Nippon Suisan Gakkaishi, 1989, 55(12): 2199–2203. DOI:10.2331/suisan.55.2199 |
| [17] | YU V C H, YU P H F, HO K C, et al. Isolation and identification of a new tetrodotoxin-producing bacterial species, Raoultella terrigena, from Hong Kong marine puffer fish Takifugu niphobles[J]. Marine Drugs, 2011, 9(12): 2384–2396. DOI:10.3390/md9112384 |
| [18] | WEI F, MA T L, GONG X L, et al. Identification of tetrodotoxin-producing bacteria from goby Yongeichthys criniger[J]. Toxicon, 2015, 104: 46–51. DOI:10.1016/j.toxicon.2015.07.335 |
| [19] |
黄清发. 河鲀毒素提取技术及检测方法的研究进展[J].
水产科技情报, 2010, 37(4): 169–171, 181.
HUANG Q F. Advance in extraction and detection of tetrodotoxin[J]. Fisheries Science & Technology Information, 2010, 37(4): 169–171, 181. |
| [20] | ITOI S, KOZAKI A, KOMORI K, et al. Toxic Takifugu pardalis eggs found in Takifugu niphobles gut:implications for TTX accumulation in the pufferfish[J]. Toxicon, 2015, 108: 141–146. DOI:10.1016/j.toxicon.2015.10.009 |
 2017,
Vol. 26
2017,
Vol. 26


